中国科学院微生物研究所、中国微生物学会主办
文章信息
- 金竹萍, 李澄, 王磊, 裴雁曦
- Jin Zhuping, Li Cheng, Wang Lei, Pei Yanxi
- 拟南芥表皮模式因子EPFs的表达纯化与功能鉴定
- Prokaryotic expression, purification and functional identification of epidermal pattern factors in Arabidopsis thaliana
- 生物工程学报, 2020, 36(4): 792-800
- Chinese Journal of Biotechnology, 2020, 36(4): 792-800
- 10.13345/j.cjb.190285
-
文章历史
- Received: June 27, 2019
- Accepted: August 8, 2019
- Published: September 4, 2019
气孔是由2个保卫细胞包围而成的开孔,多存在于叶片和茎,是植物表皮所特有的结构。气孔密度直接决定植物叶片进行光合作用的效率和作物产量,因此是农业生产中一个很重要的形态学指标。有资料表明,气孔的产生早于植物的维管、根、种子和花等其他组织器官,充分说明了气孔在植物的生长发育中的重要作用[1]。气孔的发育遵循“单细胞间隔”原则,由植物的原表皮细胞开始,以不均等间隔分裂的方式组成了叶片表皮细胞的关键部分[2-3]。研究发现,在模式植物拟南芥中表皮模式因子(Epidermal pattern factors,EPFs)家族基因编码细胞分泌型的、富集半胱氨酸的短肽,它们的生物功能大多被证明为调节气孔的发育及植物的生长[4-5]。其中已经明确功能的是,EPF1与EPF2在气孔发育调节中为负调控因子,EPFL9为正调控因子[6-8],即EPF1和EPF2抑制气孔发育,而EPFL9促进气孔的发育。气孔的发育在形态学上表现为气孔数目和保卫细胞大小两个方面,决定着植物体光合与呼吸时CO2和O2的进出速度,从而调节植物对逆境胁迫的响应,最终影响农作物产量[9]。
硫化氢(Hydrogen sulfide,H2S)是近年来备受瞩目的一种新型气体信号分子,参与动植物体内很多生理过程,执行非常重要的生理功能。我们的前期研究发现,H2S通过与其他植物激素相互作用,共同调节气孔运动,参与植物对干旱胁迫的响应[10-17]。在实验过程中,同时发现H2S处理对植物气孔的数目和大小也有影响。因此,H2S和EPFs在调控植物气孔发育中的作用有相似之处。本研究构建拟南芥表皮模式因子编码基因AtEPF1、AtEPF2和AtEPFL9的原核表达载体,经诱导表达纯化得到融合蛋白。将纯化到的蛋白分别处理拟南芥幼苗,测定其体内的H2S产率变化,为后续开展气体信号H2S和EPFs对拟南芥叶片气孔发育调节机制的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料拟南芥(Arabidopsis thaliana, Col-0)植株,原核表达载体pET28a (Kan抗性),大肠杆菌菌株DH5α及BL21(DE3)菌株,由实验室保存。
1.1.2 主要试剂实验过程中所用反转录试剂盒(5×All-In-One RT MasterMix(abm))、琼脂糖凝胶DNA回收试剂盒、提质粒试剂盒、限制性内切酶(BamHⅠ/ NheⅠ)、Ligation-Free Cloning System (abm)、甘油、胰蛋白胨、氯化钠、酵母提取物、琼脂粉、卡那霉素(Kan)、异丙基β-D-硫代半乳糖苷(IPTG)、引物合成等,均购自生工生物工程(上海)股份有限公司。
1.1.3 主要仪器与设备PCR基因扩增仪(杭州博日TC-96/G/H9(b))、凝胶成像系统仪(BIO-RAD 1708195)、高速离心机(安徽中科中佳HC-2062)、无菌操作工作台(北京京仪VS-1300L-U)、紫外分光光度计(上海尤尼柯UV-2100)、核酸电泳仪(北京六一仪器厂DYY-8C)、恒温振荡器(太华THZ-C)、压力蒸汽灭菌锅(上海博迅YXQ-LS-70A)、电热恒温水浴锅(恒字XMTD-8222)、超声破碎仪(宁波新芝JY88-IIN)等。
1.2 方法 1.2.1 AtEPF1、AtEPF2和AtEPFL9基因的克隆及pET28a载体的双酶切以4周龄的野生型拟南芥叶片为实验材料,采用异硫氰酸胍/苯酚法提取RNA,用反转录试剂盒得到cDNA。根据NCBI数据库提供的AtEPF1 (At2g20875)、AtEPF2 (At1g34245)和AtEPFL9 (At4g12970)序列,设计两端分别含有BamHⅠ和NheⅠ酶切位点的引物,引物序列见表 1。
| Primer name | Primer sequence (5′–3′) | Restriction enzyme |
| EPF1-F | CAGCCATATGGCTAGCAGGCATTTACCAACATCCTCC | NheⅠ |
| EPF1-R | GCTCGAATTCGGATCCTCAAGGGACAGGGTAGGACT | BamHⅠ |
| EPF2-F | CAGCCATATGGCTAGCATTCGCACGCCGCCACTAA | NheⅠ |
| EPF2-R | GCTCGAATTCGGATCCTCAAGGGACAGGGTAGGACT | BamHⅠ |
| EPFL9-F | CAGCCATATGGCTAGCTCAAGACCTCGTTCTATCGAAA | NheⅠ |
| EPFL9-R | GCTCGAATTCGGATCCTTATCTATGACAAACACATCTATAA | BamHⅠ |
| The single underlined sequences indicate restriction enzyme site. | ||
首先,以反转录得到的拟南芥cDNA为模板,克隆AtEPF1、AtEPF2和AtEPFL9基因。经琼脂糖凝胶电泳检测克隆产物,检测正确后切胶回收。同时,将pET28a载体质粒用限制性内切酶BamHⅠ和NheⅠ 37 ℃双酶切处理3 h,得到线性化载体产物。琼脂糖凝胶电泳检测正确后,切胶回收待用。
1.2.2 pET28a-AtEPF1、pET28a-AtEPF2和pET28a-AtEPFL9重组质粒表达载体的构建分别取目的基因(AtEPF1、AtEPF2和AtEPFL9) 2 μL、双酶切线性化载体片段(pET28a) 6 μL和无缝连接酶(5×ligation-free cloning master mix) 2 μL。再把目的基因(AtEPF1、AtEPF2和AtEPFL9)分别与双酶切线性化载体片段和无缝连接酶轻轻混匀,冰上放置30 min,得到连接产物。
把连接后的产物用热激法转化大肠杆菌DH5α,培养过夜,挑选菌落进行PCR鉴定,将大小正确的条带切胶回收,测序检测。
1.2.3 pET28a-AtEPF1、pET28a-AtEPF2和pET28a-AtEPFL9原核表达载体的诱导表达1) 提取重组质粒pET28a-AtEPF1、pET28a- AtEPF2和pET28a-AtEPFL9,分别转化于BL21感受态细胞中。37 ℃培养过夜后,分别挑选单菌落在LB液体培养基(Kan抗性)中,37 ℃、180 r/min振荡培养过夜。
2) 预诱导菌株摸索蛋白诱导表达条件:将培养的菌液按1%的比例接入含有Kan抗性的LB液体培养基中,于37 ℃、180 r/min条件下培养,约3–5 h后,紫外分光光度测得菌液的OD600在0.6–0.8之间,加IPTG至终浓度分别为0、0.05、0.1、0.3、0.5、1、1.5 mmol/L,分别在16 ℃诱导培养20 h、28 ℃诱导培养16 h、37 ℃诱导培养5 h后取样。
3) 处理样品:取不同温度和不同诱导浓度下BL21(DE3)/pET28a-AtEPF1、BL21(DE3)/pET28a- AtEPF2和BL21(DE3)/pET28a-AtEPFL9菌株的样品各5 mL,12 000 r/min离心1 min,弃上清,加入0.1 mol/L磷酸缓冲液(1×PBS) 500 μL重悬菌体沉淀,超声波(5 s/5 s)破碎菌体,12 000 r/min离心1 min,取上清,加入5×上样缓冲液(含有β-巯基乙醇)混匀,100 ℃煮沸8 min使蛋白质变性,12% SDS-PAGE检测。
4) 筛选EPF1、EPF2和EPFL9蛋白诱导表达条件:在0、0.05、0.1、0.3、0.5、1、1.5 mmol/L IPTG诱导浓度下,16 ℃、28 ℃和37 ℃三种不同诱导温度条件下进行蛋白的诱导表达,分别诱导16、16、20 h后取样品进行SDS-PAGE检测。最终筛选出诱导蛋白最适条件为:IPTG诱导浓度分别为0.5、0.3、0.05 mmol/L,最适诱导温度分别为28 ℃、28 ℃和16 ℃,最适诱导时间分别为16、16和20 h。
1.2.4 AtEPF1、AtEPF2和AtEPFL9蛋白的纯化取构建好的BL21(DE3)/pET28a-AtEPF1、BL21(DE3)/pET28a-AtEPF2和BL21(DE3)/pET28a- AtEPFL9菌株在固体LB平板(Kan抗性)上划线,37 ℃倒置培养过夜;挑取单菌落接种至1 mL Kan抗性LB液体培养基中,180 r/min、37 ℃振荡培养过夜;再取100 μL菌液接种至100 mL Kan抗性的液体LB培养基中,180 r/min、37 ℃振荡培养约3–5 h后,至OD600在0.6–0.8之间,分别加入IPTG至终浓度为0.5 mmol/L、0.3 mmol/L和0.05 mmol/L,诱导温度分别为28 ℃、28 ℃和16 ℃,诱导时间分别为16、16和20 h。同时分别在相同的温度和诱导时间下设置对照组,12 000 r/min离心1 min,倒弃培养液上清,留下菌体沉淀,冰上放置待用[18]。
将5 mL 20 mmol/L的咪唑加入到集菌管内,吹吸沉淀,直至成为均匀的乳白色液体。然后将其置于冰上超声破碎至透明状态;12 000 r/min、4 ℃离心10 min,弃掉沉淀;用注射器吸取上清,通过滤膜缓慢注入Ni琼脂糖凝胶柱,静置10 min,使蛋白与Ni柱充分结合,然后流出蛋白,以上过程重复3次;直至Ni琼脂糖凝胶柱中蛋白完全流出后,用含梯度浓度的咪唑洗脱液(浓度依次为20、50、100、200、250、300、500 mmol/L)洗脱蛋白。最终AtEPF1、AtEPF2和AtEPFL9蛋白能被洗脱下来的咪唑浓度为200、100和200 mmol/L。
1.2.5 AtEPF2和AtEPFL9蛋白对拟南芥H2S产率的影响野生型拟南芥种子消毒后播种于1/2MS培养基表面,直立培养2周后分别加入5 mL的AtEPF2和AtEPFL9蛋白(浓度为0.2 μg/μL),轻轻晃动以使拟南芥幼苗充分浸润在蛋白液体中。咪唑洗脱液为对照处理,分别在处理1、3、5、7、9、10、30 min时取样,测定幼苗的H2S产率,H2S产率测定方法参照文献[10]。
1.2.6 数据统计与分析所述试验均重复3次,利用WPS Office统计并汇总数据,结果用x±s表示。通过SPSS Statistics软件进行单因素比较,P < 0.05和P < 0.01分别为差异显著和差异极显著(不同字母代表统计结果不在相同水平)。利用SigmaPlot10.0软件作图。
2 结果与分析 2.1 目的基因AtEPF1、AtEPF2和AtEPFL9的克隆以4周苗龄的叶片为材料,提取总RNA,反转录为cDNA。按照表 1设计的引物进行PCR反应,克隆得到目的基因AtEPF1、AtEPF2和AtEPFL9。结果如图 1所示,AtEPF1、AtEPF2和AtEPFL9的大小分别为252 bp、285 bp、213 bp图 1A–1C)。

|
| 图 1 pET28a-AtEPF1、pET28a-AtEPF2和pET28a-AtEPFL9重组质粒的构建 Fig. 1 Construction of recombinant plasmids of pET28a-AtEPFs. (A-C) PCR amplification of AtEPF1, AtEPF2 and AtEPFL9 genes. 1: amplification of the gene AtEPF1, AtEPF2 and AtEPFL9 genes; 2: negative control; M: marker. (D-F) PCR amplification of DH5α/pET28a-AtEPFs. 1: PCR identification of DH5α/pET28a-AtEPFs; M: marker. (G-I) Double enzyme digestion of DH5α/pET28a-AtEPFs plasmids. 1: pET28a-AtEPFs recombinant plasmids; 2: pET28a-AtEPFs was double digested; M: marker. |
| |
将1.2.2方法中所得含有pET28a-AtEPF1、pET28a-AtEPF2和pET28a-AtEPFL9的DH5α菌株进行PCR鉴定,结果如图 1所示。成功克隆到目的基因AtEPF1、AtEPF2和AtEPFL9,分别与预期大小一致(图 1D–1F)。
2.3 pET28a-AtEPF1、pET28a-AtEPF2和pET28a-AtEPFL9重组质粒的双酶切检测按照提质粒试剂盒的使用说明,分别提取DH5α/pET28a-AtEPF1、DH5α/pET28a-AtEPF2和DH5α/pET28a-AtEPFL9菌株的重组质粒。将回收到的重组质粒用限制性内切酶BamHⅠ和NheⅠ在37 ℃条件下酶切3 h,结果如图 1所示。重组质粒经酶切得到目的片段的大小分别与AtEPF1、AtEPF2和AtEPFL9基因一致(图 1G–1I)。结合2.2的检测结果,说明重组载体pET28a- AtEPF1、pET28a-AtEPF2和pET28a-AtEPFL9构建成功。
2.4 AtEPF1、AtEPF2和AtEPFL9蛋白的纯化按照1.2.3中筛选到的最适诱导表达蛋白条件,诱导BL21(DE3)/pET28a-AtEPF1、BL21(DE3)/ pET28a-AtEPF2和BL21(DE3)/pET28a- AtEPFL9表达蛋白。按照1.2.4的纯化蛋白步骤,分别纯化到AtEPF1、AtEPF2和AtEPFL9蛋白。但大小与预期不一致(图 2A–2C),分别约为理论计算值的2倍。经Ni琼脂糖凝胶柱纯化获得融合蛋白,大小分别为18 kDa、19 kDa和14.5 kDa左右。

|
| 图 2 SDS-PAGE分析大肠杆菌中AtEPF1、AtEPF2和AtEPFL9蛋白的表达纯化 Fig. 2 SDS-PAGE analysis of the expression and purification of AtEPF1 (A), AtEPF2 (B) and AtEPFL9 (C) in E. coli. 1: the total protein without IPTG induction; 2: the total protein with IPTG induction; 3: the purified recombinant protein. |
| |
通过ProtScale在线软件分别对AtEPF1、AtEPF2和AtEPFL9蛋白亲疏水特性进行分析,得到其蛋白亲疏水性预测图(图 3A–3C),正值的氨基酸表明具有疏水性,负值的氨基酸表明具有亲水性。正值越大,则蛋白质的疏水性越强;负值越小,则蛋白质的亲水性越强。分析发现,AtEPF1和AtEPF2蛋白亲疏水特性趋势一致,AtEPFL9蛋白氨基酸负值数目远远多于正值数目,即AtEPFL9蛋白亲水性较强。这与在实验过程中纯化AtEPFL9蛋白时,菌体沉淀较易破碎,上清溶液中蛋白浓度较高相一致。
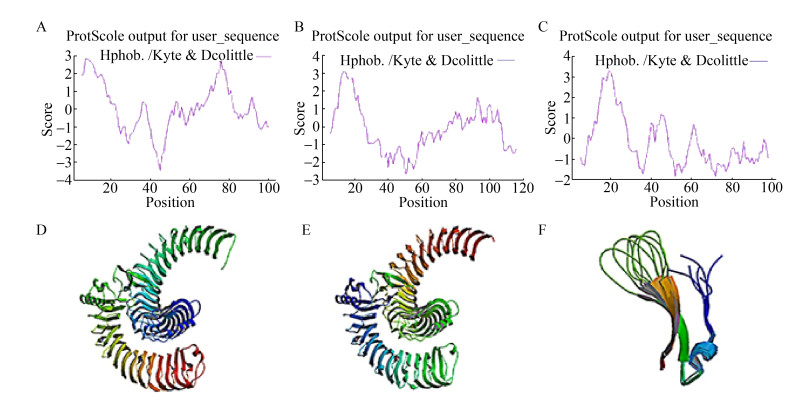
|
| 图 3 AtEPF1、AtEPF2和AtEPFL9蛋白的生物信息学分析 Fig. 3 Bioinformation analysis of AtEPF1, AtEPF2 and AtEPFL9. (A-C) The hydrophilic and hydrophobic plots of AtEPF1, AtEPF2 and AtEPFL9. (D-F) The tertiary structure of AtEPF1, AtEPF2 and AtEPFL9. |
| |
通过在线SWISS MODEL软件,对AtEPF1、AtEPF2和AtEPFL9蛋白三维结构进行模拟,同源建模预测结果100%,如图 3D–3F所示。分析发现,AtEPF1和AtEPF2的结构是类似的,这与AtEPF1和AtEPF2在植物气孔发育过程中的功能一致相吻合,进一步印证了蛋白质的“结构决定功能”的事实。
2.6 AtEPF2和AtEPFL9蛋白处理后拟南芥的H2S产率测定在用AtEPF2和AtEPFL9蛋白处理拟南芥后,测定了不同处理时间H2S的产率,结果如图 4所示。(1)以咪唑洗脱液为对照,用AtEPF2蛋白处理拟南芥后,在处理时间为1、3、5、7、10 min时,与对照相比,拟南芥的H2S产率均有不同程度的下降,且有显著性差异。而在处理时间为30 min时,与对照相比,拟南芥的H2S产率没有明显变化。(2)以咪唑洗脱液为对照,用AtEPFL9蛋白处理拟南芥后,在处理时间为1、3、5、7、10 min时,与对照相比,拟南芥的H2S产率均有不同程度的上升,且有显著性差异。而在处理时间为30 min时,与对照相比,拟南芥的H2S产率没有明显变化。
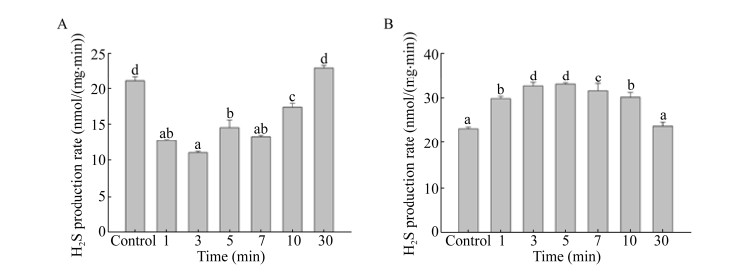
|
| 图 4 AtEPF2和AtEPFL9蛋白处理对拟南芥H2S产率的影响 Fig. 4 Effects of AtEPF2 (A) and AtEPFL9 (B) proteins on H2S production rate in Arabidopsis thaliana. Different letters indicated significant differences among treatments (one way ANOVA, P < 0.05). |
| |
气孔是地球上任何植物不可缺少的重要组成部分。在众多粮食作物中,如大麦、玉米、高粱等,它们通过气孔实现气体交换,进行光合作用来制造有机物。因此,气孔发育、气孔数目和气孔大小是提高农作物产量的一个重要的形态学指标。构建拟南芥气孔发育基因AtEPF1、AtEPF2和AtEPFL9原核表达载体及开展后续一系列研究,为进行基础农作物气孔发育的研究建立了良好的开端。同时,这也为H2S调控气孔发育增强农作物光合作用来提高产量提供了一种可能的途径。
在克隆得到目的基因时,AtEPF1和AtEPF2基因的大小与预期大致吻合,AtEPFL9基因的大小略大于理论值(图 1C)。分析发现,由于AtEPFL9片段较小,而琼脂糖凝胶电泳时所加的染料分子量较大,会对AtEPFL9基因的电泳结果略有影响。通过碱基数目换算氨基酸数目公式,理论上得到的AtEPF1、AtEPF2和AtEPFL9表达后的融合蛋白大小约为9.13 kDa、10.34 kDa、7.7 kDa。而SDS-PAGE显示表达后的融合蛋白大小约为18 kDa、19 kDa、14.5 kDa。虽然AtEPF1、AtEPF2和AtEPFL9蛋白与pET28a载体上的His标签蛋白进行融合表达,但His标签蛋白的大小约为0.6 kDa,理论上不足以影响SDS-PAGE结果。通过在线SWISS MODEL软件,对3种蛋白三维结构进行模拟,deepview分析了蛋白表面电荷分布情况,发现3个蛋白表面的正电荷和负电荷均分别集中分布在蛋白的两端,这意味着AtEPF1、AtEPF2和AtEPFL9蛋白在SDS-PAGE过程中,极易通过电荷之间“异性相吸”原理,形成二聚体或多聚体。因此,SDS-PAGE检测结果显示的蛋白大小与理论计算值相比,可能为多聚体形式。
EPFs家族属于多肽类激素[5],因此用纯化得到的AtEPF2和AtEPFL9融合蛋白处理拟南芥幼苗。在处理时间分别为1、3、5、7、10 min时,与对照相比,它们的H2S产率均有不同程度的变化,EPF2和EPFL9分别抑制和促进H2S的产生(图 4)。而处理时间延长至30 min时,H2S产率与对照组相比无显著变化。这说明AtEPF2和AtEPFL9蛋白作为多肽类激素,调节植物体内H2S的产生,且只在短时间内发挥作用,随着处理时间的延长作用逐渐消失。我们已经知道,EPF1和EPF2在调控气孔发育中均表现为抑制作用[5]且两种蛋白的三维结构(图 3D和3E)极其类似。但在实验过程中,与EPF2不同的是,EPF1蛋白的纯化遇到各种各样的困难,这可能与EPF1本身表达很少,且EPF1蛋白极易以包涵体的形式存在有关。但从理论上推测,EPF1的作用应当与EPF2类似,也可能抑制植物体内H2S的产生。
EPF1、EPF2和EPFL9蛋白是EPFs家族中功能较为明确的分泌型多肽激素,它们调节叶片气孔的生长与发育[5],然而其更深层次的作用机理尚不明确。本研究表达纯化这3种蛋白,为深入研究它们的生物学功能奠定了基础[19]。令人兴奋的是,初步研究结果表明,EPFs融合蛋白显著调控植物体内H2S信号的生物合成。因此,进一步深入研究EPFs和H2S对植物气孔发育的作用机制,对农业实践中增加作物产量、增强植物抗逆性有重要意义。
| [1] |
Chen L, Hou SW. Molecular genetic control of plant stomatal development. Sci Sin Vitae, 2017, 47(8): 798-807 (in Chinese). 陈亮, 侯岁稳. 植物气孔发育的分子遗传调控. 中国科学:生命科学, 2017, 47(8): 798-807. |
| [2] |
Lu JJ, He JJ, Zhou XS, et al. Homologous genes of epidermal patterning factor regulate stomatal development in rice. J Plant Physiol, 2019, 234-235: 18-27. DOI:10.1016/j.jplph.2019.01.010 |
| [3] |
Li Y, Xu SS, Wang GX. Advance in stomatal development mechanism and its regulation of external and internal cues. Chin Bull Life Sci, 2018, 30(5): 491-499 (in Chinese). 李岩, 徐珊珊, 王根轩. 气孔发育机制及其内外调控因子的研究进展. 生命科学, 2018, 30(5): 491-499. |
| [4] |
Hua C, Zhou F, Chen QZ, et al. Plant peptide signal and posttranslationally modified small-peptide signals. Hubei Agric Sci, 2015, 54(15): 3585-3589 (in Chinese). 华春, 周峰, 陈全战, 等. 植物多肽信号及翻译后修饰小肽. 湖北农业科学, 2015, 54(15): 3585-3589. |
| [5] |
Richardson LGL, Torii KU. Take a deep breath: peptide signalling in stomatal patterning and differentiation. J Exp Bot, 2013, 64(17): 5243-5251. DOI:10.1093/jxb/ert246 |
| [6] |
Hunt L, Bailey KJ, Gray JE. The signalling peptide EPFL9 is a positive regulator of stomatal development. New Phytol, 2010, 186(3): 609-614. DOI:10.1111/j.1469-8137.2010.03200.x |
| [7] |
Hunt L, Gray JE. BASL and EPF2 act independently to regulate asymmetric divisions during stomatal development. Plant Signal Behav, 2010, 5(3): 278-280. DOI:10.4161/psb.5.3.10704 |
| [8] |
Hepworth C, Caine RS, Harrison EL, et al. Stomatal development: focusing on the grasses. Curr Opin Plant Biol, 2018, 41: 1-7. DOI:10.1016/j.pbi.2017.07.009 |
| [9] |
Hughes J, Hepworth C, Dutton C, et al. Reducing stomatal density in barley improves drought tolerance without impacting on yield. Plant Physiol, 2017, 174(2): 776-787. DOI:10.1104/pp.16.01844 |
| [10] |
Jin ZP, Shen JJ, Qiao ZJ, et al. Hydrogen sulfide improves drought resistance in Arabidopsis thaliana. Biochem Biophys Res Commun, 2011, 414(3): 481-486. DOI:10.1016/j.bbrc.2011.09.090 |
| [11] |
Jin ZP, Pei YX. Research progress on hydrogen sulfide signaling in plants. Chin J Cell Biol, 2013, 35(6): 880-888 (in Chinese). 金竹萍, 裴雁曦. 植物H2S气体信号分子的生理功能研究进展. 中国细胞生物学学报, 2013, 35(6): 880-888. |
| [12] |
Pei YX. Gasotransmitter hydrogen sulfide in plants: stinking to high heaven, but refreshing to fine life. Chin J Biochem Mol Biol, 2016, 32(7): 721-733 (in Chinese). 裴雁曦. 植物中的气体信号分子硫化氢:无香而立, 其臭如兰. 中国生物化学与分子生物学报, 2016, 32(7): 721-733. |
| [13] |
Jin ZP, Xue SW, Luo YN, et al. Hydrogen sulfide interacting with abscisic acid in stomatal regulation responses to drought stress in Arabidopsis. Plant Physiol Biochem, 2013, 62: 41-46. DOI:10.1016/j.plaphy.2012.10.017 |
| [14] |
Jin ZP, Fang HH, Zhang LP, et al. Physiological effects of hydrogen sulfide under drought stress in Arabidopsis thaliana. J Shanxi Univ: Nat Sci Ed, 2013, 36(1): 113-117 (in Chinese). 金竹萍, 方慧慧, 张丽萍, 等. 硫化氢对拟南芥在干旱胁迫条件下的生理影响. 山西大学学报:自然科学版, 2013, 36(1): 113-117. |
| [15] |
Jin ZP, Pei YX. Physiological implications of hydrogen sulfide in plants: pleasant exploration behind its unpleasant odour. Oxid Med Cell Longev, 2015, 2015: 397502. |
| [16] |
Cui WT, Shen WB. Physiological function and its molecular mechanism of hydrogen sulfide in plants. Chem Life, 2012, 32(4): 385-389 (in Chinese). 崔为体, 沈文飚. 植物中硫化氢的生理功能及其分子机理. 生命的化学, 2012, 32(4): 385-389. |
| [17] |
Wang R. Physiological implications of hydrogen sulfide: a whiff exploration that blossomed. Physiol Rev, 2012, 92(4): 791-896. |
| [18] |
Chen DX, Li WW, Li SB, et al. Prokaryotic expression, purification of NteIF2α and preparation and application of polyclonal antibody in Nicotiana tabacum. J Agric Biotechnol, 2017, 25(1): 50-57 (in Chinese). 陈德鑫, 李雯雯, 李思斌, 等. 烟草NteIF2α的原核表达、纯化及多克隆抗体制备和应用. 农业生物技术学报, 2017, 25(1): 50-57. |
| [19] |
Matsubayashi Y, Sakagami Y. Peptide hormones in plants. Annu Rev Plant Biol, 2006, 57: 649-674. DOI:10.1146/annurev.arplant.56.032604.144204 |
 2020, Vol. 36
2020, Vol. 36




