中国科学院微生物研究所、中国微生物学会主办
文章信息
- 崔文文, 迟婧, 冯艳芳, 耿丽丽, 刘荣梅
- Cui Wenwen, Chi Jing, Feng Yanfang, Geng Lili, Liu Rongmei
- 人工合成根特异启动子SRSP的功能分析
- Construction and function of a root-specific promoter SRSP
- 生物工程学报, ${metaVo.year}, 36(4): 700-706
- Chinese Journal of Biotechnology, ${metaVo.year}, 36(4): 700-706
- 10.13345/j.cjb.190259
-
文章历史
- Received: June 17, 2019
- Accepted: September 23, 2019
- Published: November 7, 2019
2. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193
2. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing] 100193, China
随着植物启动子中顺式作用元件功能研究的逐渐深入,研究者可以根据生产需要,设计合成人工启动子,以便控制目的基因在特定时间和特定组织的精准表达,且可避免由于克隆自植物的启动子可能引起的基因沉默,这对于植物基因工程育种具有重要的意义[1]。
合成启动子主要通过核心启动子和上游顺式作用元件的组合设计而成[2];核心启动子可调节转录起始,并维持最基本的转录水平,合成启动子中最常用的核心启动子是mini CaMV 35S启动子[3-5]。上游顺式元件的多种组合可以设计合成具有不同表达特性的启动子,Dey等[6]总结了188种合成的启动子,详细描述了各启动子中各种顺式作用元件的选择和组合及它们的表达特性。顺式作用元件的排列方式影响启动子的表达特性,并不是所有的人工合成启动子都能达到预期的设计效果。王睿等[7]将4种顺式作用元件(促进基因在叶片表达的EGATFLK、LPSE1和LSE1元件与抑制基因在种子和茎秆中表达的LPRSE1元件)以单拷贝、双拷贝和3个拷贝的形式进行不同组合排布,以构建叶片特异表达的启动子,其中,Syn3启动子驱动的gus基因在种子、叶片和茎中都有表达。因此,对顺式作用元件的选择、组合及其排列方式,是人工合成启动子设计的关键。
植物的地下根系部分对植物的代谢及吸收起着不可或缺的作用,可对来自土壤中水分、无机盐进行吸收利用,为植物的生长发育和结实提供支持。但来自土壤的一些生物和非生物胁迫对植物的生长产生了较大的威胁,如土传病害和地下害虫,严重影响了一些重要粮食和经济作物的产量。为了增加植物抗逆性,提高作物产量,寻找并研究根部特异性表达的启动子,保证胁迫相关抗性基因在作物根部特异高效的表达具有重要意义。
本研究利用4种根特异性顺式作用元件OSE1ROOTNODULE、OSE2ROOTNODU-LE、SP8BFIBSP8AIB、ROOTMOTIFTAPOX1,以4个重复组合顺式排列的方式,与CaMV 35S启动子核心区及Omega序列连接构建了一个合成启动子,对其表达特性进行了分析。
1 材料与方法 1.1 材料大肠杆菌DH5α细胞,载体pMD19T,根癌农杆菌LBA4404,烟草Nicotiana benthamiana,植物表达载体pCAMBIA2300.1,以上材料均由本实验室保存。
1.2 启动子上游pro-SRS模块合成人工合成根特异启动子SRSP上游的根特异性元件由3个模块构成,分别为pro-SRS、CaMV 35S启动子核心区、Omega序列;模块pro-SRS长度299 bp,具有4种根特异的顺式作用元件,每种元件均为4拷贝数(表 1),该序列由金维智生物科技有限公司合成。对其上游模块进行扩增,引物对为proSRSFH和proSRSRcd (见表 2);PCR扩增条件如下:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。
| cis-acting elements | Sequence motif | Function | References |
| OSE2ROOTNODULE | CTCTT | Root-specific | Ishiguro S and Nakamura K(1992)[9] |
| SP8BFIBSP8AIB | ACTGTGTA | Root-specific | Elmayan T and Tepfer M (1995)[10] |
| OSE1ROOTNODULE | AAAGAT | Root-specific | Vieweg MF, et al. (2004)[11] |
| ROOTMOTIFTAPOX1 | ATATT | Root-specific | Zhang C, et al.(2004)[12] |
| Primer name | Sequence(5′–3′) | Size(bp) |
| proSRSFH | aagcttGATTATTTACTCTTGTAAAT | 313 |
| proSRSRcd | GAAGGATAGTGGGATTGCAAGAAGCATGCTT | |
| 35SminiFcd | AAGCATGCTTCTTGCAATCCCACTATCCTTC | 62 |
| 35SminiRcd | AATTGTTGTAAAAATTCCTCTCCAAATGAAATG | |
| OmegaFcd | CATTTCATTTGGAGAGGAATTTTTACAACAATT | 66 |
| OmegaRB | ggatccTGTAATTGTAAATAGTAATTG | |
| gusJDF | CCTCATCAACAACAAACC | 270 |
| gusJDR | CTGCCTTCGCCGAGTCCC | |
| EF1a | TGGTGTCCTCAAGCCTGGTAT | 106 |
| EF1b | ACGCTTGAGATCCTTAACCGC | |
| GF | GGAAAGGACTGGAAGAGAAGTG | 124 |
| GR | TCCGATATGGTTGCGGATTT | |
| Lower case bases indicate added restriction enzyme sites. | ||
转录核心区克隆:PCR法克隆CaMV 35S最小活性区与Omega序列,模板分别为载体pCMBIA2300.1和Ω序列,PCR引物对则分别为35SminiFcd/ 35SminiRcd和OmegaFcd/OmegaRB (表 2);PCR反应体系和反应条件同上。重叠PCR方法合成人工启动子SRSP:以proSRSPFH/OmegaRB为引物(表 2),3个序列产物为模板进行PCR扩增;PCR反应体系和反应条件同上。
1.3 重组植物表达载体的构建及对烟草的遗传转化将启动子及植物表达载体pCAMBIA2300.1用Hind Ⅲ和BamHⅠ双酶切后连接,重组载体通过电击法转化至农杆菌LBA4404中;农杆菌介导的对烟草遗传转化采用叶盘法[8]。
1.4 抗性苗的PCR鉴定及T1代植株的RT-PCR分析SDS法提取烟草基因组,利用gus基因引物gusJDF/gusJDR (表 2)进行PCR鉴定。收获PCR阳性植株种子进行RT-PCR分析,Trizol法分别提取转基因烟草根、茎与叶片的总RNA,反转录成cDNA,进行RT-PCR验证;烟草内参基因引物EF1a/EF1b,gus基因引物GF/GR序列详见表 2。
1.5 烟草GUS组织化学染色对转基因烟草T0和T1代植株GUS染液染色,37 ℃避光温育12 h,FAA固定液固定2 h,无水乙醇进行脱色24 h,超纯水清洗后用vhx-2000型超景深三维显微镜下观察GUS染色情况及拍照,并将染色的根进行横切与纵切,显微镜观察。
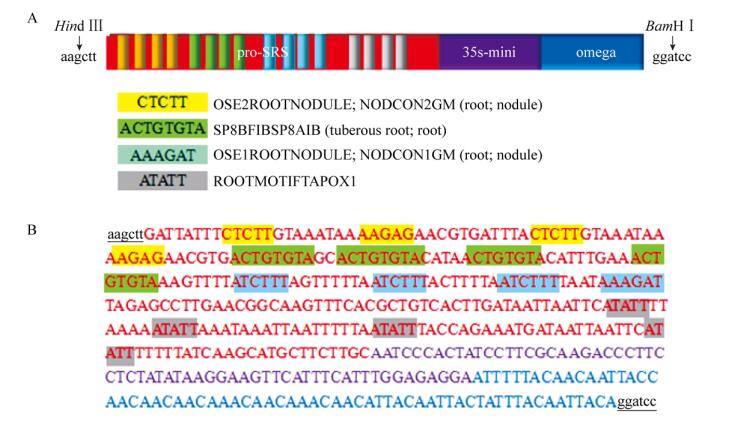
2 结果与分析 2.1 根特异启动子SRSP设计与合成为了分析顺式作用元件以多个重复紧密排列的方式,是否能够发挥预期的功能,设计合成的启动子含有OSE1ROOTNODULE、OSE2ROOTNODULE、SP8BFIBSP8AIB、ROOTMOTIFTAPOX1四个根特异元件,并以4个重复组合的方式顺序排列(图 2)。SRSP启动子除了含有上游的pro-SRS片段,还含有35S核心区和Ω序列(图 2)。对3个启动子模块进行克隆,模板分别为合成pro-SRS片段、植物表达载体pCAMBIA2300.1和Ω序列,进行PCR扩增后分别得到pro-SRS片段为313 bp、35S核心启动子片段62 bp和Ω序列片段66 bp (图 1,泳道1条带、泳道2条带、泳道3条带),重叠PCR扩增得到434 bp的人工启动子SRSP片段(图 1,泳道4条带)。为了与后续的载体连接,在合成启动子两端引入了Hind Ⅲ和BamHⅠ的双酶切位点,如图 2所示。

|
| 图 1 pro-SRS、35S-mini promoter、Ω模块及启动子SRSP序列PCR扩增结果 Fig. 1 PCR amplification results of pro-SRS, 35S-mini promoter, Ω module and promoter SRSP. M: DNA marker; 1: PCR amplification results of the pro-SRS module; 2: PCR amplification results of 35S-mini promoter; 3: PCR amplification results of the Ω module; 4: overlapping PCR amplification of the artificial promoter SRSP fragment; N: negative control. |
| |
|
| 图 2 人工合成根特异性启动子SRSP结构示意图 Fig. 2 Schematic diagram of artificially synthesized root-specific promoter SRSP. (A) Arrangement of cis-elements in the synthetic module. (B) Nucleotide sequence of the SRSP module. |
| |
将与pMD-19T载体连接得到的重组质粒pMD-SRSP与基础载体pCAMBIA.2300.1进行双酶切(BamH Ⅰ和Hind Ⅲ)并回收,将得到启动子片段与载体pCAMBIA.2300.1连接,获得表达载体p2300.1-SRSP (图 3A)。将表达质粒转化至农杆菌LBA4404,进行菌液PCR验证,扩增条带与预计启动子大小片段一致(图 3B)。

|
| 图 3 重组载体p2300.1-SRSP的构建和T1转基因烟草的RT-PCR分析 Fig. 3 Construction of recombinant vector p2300.1-SRSP and RT-PCR analysis of T1 transgenic tobaccos. (A) Double restriction enzymes digestion of p2300.1-SRSP. (B) PCR identification of transformed Agrobacterium. (C) PCR identification of T1 transgenic tobaccos. (D) RT-PCR results of T1 transgenic tobaccos. M: DNA marker; 1: SRSP promoter; 2: p2300.1-SRSP/BamH I+Hind III. 3–4: PCR analysis of Agrobacteirum tumefaciens strains transformed with vectors p2300.1-SRSP. 5–11: PCR identification of T1 transgenic tobaccos. N: negative control (ddH2O); P: positive control. |
| |
对获得的PCR阳性植株进行移栽,并收获种子。种植转p2300.1-SRSP烟草的T1代植株,提取基因组并进行PCR鉴定,结果7株抗性苗均能扩增出250 bp左右的gus基因(图 3C)。分别提取T1代转基因烟草根、茎与叶片的总RNA,反转录,RT-PCR结果表明,只有根部可以扩增出gus基因(图 3D),说明SRSP启动子驱动的gus基因只在根部进行转录表达。
2.4 转基因植株的GUS染色对其T0代和T1代烟草植株进行GUS化学组织分析,超景深显微镜下观察(图 4),染色结果显示转基因烟草根部全部染成蓝色,叶片未染成蓝色,说明SRSP启动子驱动gus基因在烟草根部的特异表达。根部切片结果表明,韧皮部染色较深,维管柱的其余结构如木质部也被染成蓝色(图 5),gus基因在韧皮部表达量高,髓部无表达;根部表皮几乎未被染成蓝色,gus基因在表皮中表达量很少,形成层也有基因的表达,纵切中根的皮层呈现弥散分布。

|
| 图 4 转SRSP的烟草的GUS组织染色 Fig. 4 GUS staining of transgenic plants of SRSP tobaccos. (A) Leaf of T0 generation tobaccos. (B) Root of T0 generation tobaccos. (C) T1 generation tobaccos. |
| |

|
| 图 5 转SRSP烟草GUS染色后的根部的横切图与纵切图 Fig. 5 Cross-cuttings and longitudinal sections of roots after transfection of SRSP tobaccos GUS. |
| |
植物基因工程中,启动子的选取和使用对基因的表达起着至关重要的作用,启动子作为调控基因转录表达的重要序列,其应用非常广泛[13-14]。组织特异性启动子可以调控外源基因在特定的组织或器官中表达,因而避免了因外源蛋白的组成型表达对植物造成的毒害及营养的浪费[15-16]。但天然的组织特异启动子数量有限,且具有一定局限性,随着转基因作物叠加基因策略的应用,可能会产生同源依赖性的基因沉默现象(Homology- dependent gene silencing,HDGS)和不良重组的产生[17]。因此,设计人工合成启动子,其可在特定时间和空间精准表达的特点,更易于满足研究者的需求。
启动子通过不同的顺式作用元件对下游基因起到调控作用,这些顺式作用元件的种类、数量及排列方式都可能影响下游基因的转录水平[18]。Liu等[19]的研究表明4个重复的诱导调控元件可在人工启动子中发挥功能,构建的启动子均可受相应的激素(乙烯、水杨酸、茉莉酸甲酯)诱导表达。顺式作用元件之间需要一定的间隔从而提高转录因子的附着率,有研究表明5 bp的间隔可使元件与转录因子进行正常的结合而调控基因表达,而4个拷贝数的顺式作用元件就可提高原基因表达水平的30倍[20]。Mohan等[21]构建了1个根特异性合成启动子模块SynR,此模块含7个顺式作用元件(1×MYB core、2×ROOT MOTIF、1×ELRECOREPC、1×MAR框、1×ARFAT元件、1×LEAFYATAG);每个元件间隔10 bp,间隔序列为TCATAACGCT。本研究的结果发现4个拷贝数的根特异性元件OSE1ROOTNODULE、OSE2ROOTNODULE、SP8BFIBSP8AIB、ROOTMOTIFTAPOX1进行组合,顺式作用元件的间隔序列在2–22 bp之间,能保证其发挥功能,构建的合成启动子能驱动报告基因在烟草根部的特异表达,为组织特异性启动子设计中顺式作用元件的选择和排列组合方式提供理论指导。
4 结论本研究构建了一个由4种根特异表达顺式作用元件重复排列构成的人工启动子SRSP,RT-PCR及GUS染色的结果表明,该启动子驱动gus报告基因在T0和T1代烟草根部的特异表达。为利用组织特异表达顺式作用元件构建高效、稳定和可控的组织特异性启动子奠定了基础。
| [1] |
Mehrotra R, Gupta G, Sethi R, et al. Designer promoter: an artwork of cis engineering. Plant Mol Biol, 2011, 75(6): 527-536. DOI:10.1007/s11103-011-9755-3 |
| [2] |
Biłas R, Szafran K, Hnatuszko-Konka K, et al. Cis-regulatory elements used to control gene expression in plants. Plant Cell, Tissue Organ Cult, 2016, 127(2): 269-287. DOI:10.1007/s11240-016-1057-7 |
| [3] |
Bhullar S, Chakravarthy S, Advani S, et al. Strategies for development of functionally equivalent promoters with minimum sequence homology for transgene expression in plants: cis-elements in a novel DNA context versus domain swapping. Plant Physiol, 2003, 132(2): 988-998. DOI:10.1104/pp.103.020602 |
| [4] |
Bhullar S, Datta S, Advani S, et al. Functional analysis of cauliflower mosaic virus 35S promoter: re-evaluation of the role of subdomains B5, B4 and B2 in promoter activity. Plant Biotechnol J, 2007, 5(6): 696-708. DOI:10.1111/j.1467-7652.2007.00274.x |
| [5] |
Bhullar S, Datta S, Burma PK. Delayed trans-inactivation of synthetic domain a 35S promoters by "tobacco 271 locus" due to reduced sequence homology. Plant Mol Biol Rep, 2011, 29(1): 1-11. DOI:10.1007/s11105-010-0202-4 |
| [6] |
Dey N, Sarkar S, Acharya S, et al. Synthetic promoters in planta. Planta, 2015, 242(5): 1077-1094. DOI:10.1007/s00425-015-2377-2 |
| [7] |
Wang R, Zhu ML, Gao FY, et al. Designing, construction and functional characterization of tissue-specific synthetic promoter in rice. Acta Agronom Sin, 2017, 43(6): 789-794 (in Chinese). 王睿, 朱梦琳, 高方远, 等. 水稻组织特异型人工合成启动子的设计、构建及功能鉴定. 作物学报, 2017, 43(6): 789-794. |
| [8] |
Feng YF. Cloning and fanction of peanut root-specific promoters[D]. Linfen: the Normal University of Shanxi, 2016 (in Chinese). 冯艳芳.花生根特异启动子的克隆及功能分析[D].临汾: 山西师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10118-1016100356.htm |
| [9] |
Ishiguro S, Nakamura K. The nuclear factor SP8BF binds to the 5′-upstream regions of three different genes coding for major proteins of sweet potato tuberous roots. Plant Mol Biol, 1992, 18(1): 97-108. DOI:10.1007/BF00018460 |
| [10] |
Elmayan T, Tepfer M. Evaluation in tobacco of the organ specificity and strength of the rolD promoter, domain A of the 35S promoter and the 35S2 promoter. Transgenic Res, 1995, 4(6): 388-396. DOI:10.1007/BF01973757 |
| [11] |
Vieweg MF, Frühling M, Quandt HJ, et al. The promoter of the Vicia faba L. Leghemoglobin gene VfLb29 is specifically activated in the infected cells of root nodules and in the arbuscule-containing cells of mycorrhizal roots from different legume and nonlegume plants. Mol Plant-Microbe Interact, 2004, 17(1): 62-69. DOI:10.1094/MPMI.2004.17.1.62 |
| [12] |
Zhang C, Pan SF, Chen H, et al. Characterization of NtREL1, a novel root-specific gene from tobacco, and upstream promoter activity analysis in homologous and heterologous hosts. Plant Cell Rep, 2016, 35(4): 757-769. |
| [13] |
Bisht NC, Jagannath A, Gupta V, et al. A two gene—two promoter system for enhanced expression of a restorer gene (barstar) and development of improved fertility restorer lines for hybrid seed production in crop plants. Molecular Breeding, 2004, 14(2): 129-144. DOI:10.1023/B:MOLB.0000038002.45312.08 |
| [14] |
Gurr SJ, Rushton PJ. Engineering plants with increased disease resistance: how are we going to express?. Trends Biotechnol, 2005, 23(6): 283-290. DOI:10.1016/j.tibtech.2005.04.009 |
| [15] |
Porto MS, Pinheiro MPN, Batista VG, et al. Plant promoters: an approach of structure and function. Mol Biotechnol, 2014, 56(1): 38-49. |
| [16] |
Stoger E, Williams S, Keen D, et al. Constitutive versus seed specific expression in transgenic wheat: temporal and spatial control. Transgenic Research, 1999, 8(2): 73-82. DOI:10.1023/A:1008801929494 |
| [17] |
Moshelion M, Altman A. Current challenges and future perspectives of plant and agricultural biotechnology. Trends Biotechnol, 2015, 33(6): 337-342. DOI:10.1016/j.tibtech.2015.03.001 |
| [18] |
Szabados L, Charrier B, Kondorosi A, et al. New plant promoter and enhancer testing vectors. Mol Breed, 1995, 1(4): 419-423. DOI:10.1007/BF01248419 |
| [19] |
Liu WS, Mazarei M, Rudis MR, et al. Rapid in vivo analysis of synthetic promoters for plant pathogen phytosensing. BMC Biotechnol, 2011, 11: 108. DOI:10.1186/1472-6750-11-108 |
| [20] |
Rushton PJ, Reinstädler A, Lipka V, et al. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound- induced signaling. Plant Cell, 2002, 14(4): 749-762. DOI:10.1105/tpc.010412 |
| [21] |
Mohan C, Jayanarayanan AN, Narayanan S. Construction of a novel synthetic root-specific promoter and its characterization in transgenic tobacco plants. 3 Biotech, 2017, 7: 234. |
 ${metaVo.year}, Vol. 36
${metaVo.year}, Vol. 36




