中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张丽, 宋馨宇, 陈磊, 张卫文
- Zhang Li, Song Xinyu, Chen Lei, Zhang Weiwen
- 光合微生物混菌体系的应用和研究进展
- Recent progress in photosynthetic microbial co-culture systems
- 生物工程学报, 2020, 36(4): 652-665
- Chinese Journal of Biotechnology, 2020, 36(4): 652-665
- 10.13345/j.cjb.190288
-
文章历史
- Received: June 29, 2019
- Accepted: September 19, 2019
- Published: October 25, 2019
2. 教育部合成生物学前沿研究中心,天津 300072;
3. 教育部系统生物工程重点实验室,天津 300072;
4. 天津大学 生物安全战略研究中心,天津 300072
2. Frontier Science Center for Synthetic Biology and Key Laboratory of Systems Bioengineering, Ministry of Education of China, Tianjin 300072, China;
3. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China;
4. Center for Biosafety Research and Strategy, Tianjin University, Tianjin 300072, China
光合微生物是一类能够利用太阳能和二氧化碳作为唯一能源和碳源,进行自养营养生长的生物。光合微生物与其他异养菌形成的混菌体系在自然界中普遍存在,例如人们熟悉的地衣,即为这一类体系的典型代表。在地衣中,光合微生物利用太阳光进行光合作用合成有机物,为真菌生长繁殖提供所需的碳源,而真菌能向光合微生物提供生长因子和运输无机营养,同时还能对光合微生物起到保护作用[1]。
光合微生物与异养菌之间相互关系的存在可增强混菌体系成员响应和适应环境的能力,从而更好地在自然界中生存下去[2-4]。仍旧以地衣为例,这种常见的自然混菌体系有着极强的适应能力与抗逆性,能够作为先锋生物在高山带、冻土带和南北极地区等极端条件下生存,且共存时间很长,有的寿命甚至可达千年[5-6]。除此之外,还有像缺乏维生素B12相关代谢途径的莱茵衣藻Chlamydomonas reinhardtii与可产维生素B12相关的异养菌共存、慢生根瘤菌Mesorhizobium与固氮螺菌Azospirillum的共存等[7-8]。更值得关注的是,光合微生物混菌体系还有改善生态环境的功能,比如污水的净化、水体污染物的降解以及促进农药降解等诸多生态学意义[9-11]。自然环境的污水中存在大量的异养微生物群落,藻类的光合作用和异养菌的代谢及呼吸作用能协同降解污水中的有机物,并能实现同步脱氮除磷及抗生素、重金属的去除。Loutseti等[12]利用菌藻混菌系统处理铜、钙污水,离子去除效率分别达到80%和100%;随后,Bai和Achary[13]采用菌藻混菌系统处理磺胺甲恶唑、三氯生污水,处理效率分别达到32%和74%。很多研究还证实,光合微生物和土壤中的异养细菌通过建立相互作用,能够显著增加农作物的微量元素与蛋白质的含量,这对植物的生长有着非常重要的作用[14-17]。Naind等[18]将变形杆菌中的普罗威登斯菌Providencia sp.与3种蓝细菌构建混菌体系混合添加到土壤中,发现培养的小麦与普通条件下相比在种质上有明显的改善。这些研究证明光合微生物混菌体系在工农业生产过程中有着重要的价值。因此,对天然存在光合微生物混菌体系的相关理论与应用的研究就显得尤为重要。
由于经过数亿年的进化已经适应了特定的生活环境,天然光合微生物混菌体系在稳定性上有一些优势,但是同时也使得其应用的灵活性与广泛性受到限制。近年来,合成生物学的发展给混菌系统的应用开辟了新的方向。合成生物学旨在以工程学思想作为指导,通过从头设计和构建,能够对现有的和天然的生物系统进行重新设计和改造[19]。美国科学家Ducat等[20]通过向聚球藻Synechococcus elongatus PCC 7942中引入蔗糖转运蛋白基因cscB并结合系统改造,获得蔗糖产率高达28 mg/(L·h)的蓝细菌菌株。这个产率足以支持一定的异养菌的生长,因此Ducat等尝试利用高产蔗糖的S. elongatus. PCC 7942菌株与玻利维亚盐单胞菌Halomonas boliviensis[21]、大肠杆菌Escherichia coli、枯草芽孢杆菌Bacillus subtilis等[22]构建人工混菌系统,最终实现了聚羟基丁酸脂(Polyhydroxybutyrate,PHB)、淀粉酶等多种高附加值物质的生产,这一工作也证明了合成生物学技术和策略在混菌系统应用中的价值。
文中将对光合微生物混菌体系的优势、光合微生物混菌体系的应用以及对光合微生物混菌体系机理的解析等方面进行系统的概述,同时还对现阶段光合微生物混菌体系存有的问题进行分析与总结,并对光合微生物混菌体系的应用前景作出展望。
1 光合微生物混菌体系的优势光合微生物混菌体系中不同菌株之间存在相互作用,这是与纯培养最本质的差别,这种关系的存在使得混菌体系表现出多方面的优势,以下将逐一介绍。
1.1 增加体系的稳定性与鲁棒性研究表明,过于剧烈的光波动会对光系统Ⅰ (PSⅠ)造成损伤[23],同时,由于不同的光强的变化使得光合微生物本身需要通过一系列的生理调整来适应生存环境,其中为了还原由光反应产生的过多氧气(O2),在化学还原O2的同时会生成过氧化氢(H2O2),这种活性氧物质会严重抑制光合微生物自身的生长[24-25]。Ducat等[22]通过将高产糖S. elongatus PCC 7942与Saccharomyces cerevisiae W303可利用蔗糖的突变株进行混合培养,该混菌体系在光-暗交替(16 h光照/8 h黑暗)条件下,双菌在数月内都可维持生物量的稳定。由于酵母的存在可以很好地清除培养基中的活性氧物质,因此这种培养模式与其各自菌株的纯培养相比,体系的稳定性大幅度提高。
1.2 提高生产过程中底物的利用效率含有淀粉和纤维素的废弃生物质如秸秆等,可用作生物氢(H2)生产的廉价原料[26]。通常,传统的生物氢生产是以含有淀粉的生物质作为基底,并利用经过热处理的活性厌氧污泥和梭菌属和肠杆菌属的纯培养物通过黑暗发酵进行[27],由于活性污泥和异养菌在发酵的过程中会产生挥发性脂肪酸(VFA)与二氧化碳(CO2),仍旧造成了部分碳源的损失。鉴于此,Kargi等将经过热处理的活性污泥(Anaerobic sludge,AS)与光合微生物红细菌Rhodobacter sphaeroides NRRL-B 1727进行混合培养[28-30]。通过在黑暗条件下活性污泥水解生物质中的淀粉生成葡萄糖供给污泥中的异养菌和R. sphaeroides NRRL-B 1727生成VFA,随后,在光照条件下R. sphaeroides NRRL-B 1727可利用的VFA进行H2的再生产。该混菌体系在96 h内可将底物中的淀粉完全分解成H2与VFA,H2转化效率为201 mL/g淀粉,最高产率达377 μmol/h,与纯异养菌发酵相比提高了12.9%[31]。
1.3 提升高附加值物质的生产能力莱茵衣藻Chlamydomonas reinhardtii是一种重要的模式藻类物种,它具有很高的氢化酶活性,加之易于遗传操作和易培养,已广泛用于光解介导的H2产生的研究[32-33]。但是氢化酶对氧气(O2)非常敏感,在高O2浓度下极易失活。Luo等[34]一项研究中证实,假单胞菌Pseudomonas sp. BS4可促进C. reinhardtii在光介导的条件下生产H2,在BS4-C. reinhardtii共培养的过程中,体系内的O2被异养菌迅速消耗,从而形成一个厌氧环境,这种环境被证明非常适合于藻类氢化酶的活化,使之发挥更好的作用。此外,该研究还证实,BS4的存在能够减缓微藻叶绿素的消耗,增强微藻的淀粉积累和维持蛋白质含量,使得微藻得到更好的生长与H2生产能力。
2 光合微生物混菌体系的应用由于光合微生物混菌体系具有诸多优势,已在环境工程、微生物细胞工厂等领域得到广泛的应用(表 1)。
| Application | Co-culture system | Highlight | Reference | |
| In environment engineering | Surface sewage treatment | Cladophora, Klebsormidium, and Bacillus, Pseudomonas | Efficient, clean, low cost, and thorough treatment | [39-41] |
| Soil remediation | Providencia sp., Anabaena sp. and Calothrix sp | Avoiding the reduction of soil fertility and can also act on deep soil | [18, 43] | |
| Biodegradation | S. obliquus GH2 and four heterotrophics | Simultaneously degrade various pollutants | [57-60] | |
| Microorganism cell factory | Lipid | Strains in activated sludge | Achieve continuous production and save costs | [66] |
| Polysaccharide | S. platensis, C. vulgaris and four fungi | For the production of new polysaccharides | [10] | |
| Hydrogen | C. reinhardtii MGA 161 and Pseudomonas sp. BS4 | Increasing hydrogen yield | [33, 69-72] |
大量的工业生产及人类活动使得地表水中的营养物质积累过剩,从而引起严重的地表水污染[35]。为避免自然水体的富营养化、保证健康的水生生态系统,水体中总氮量(TN)含量应低于0.3 mg/L,总磷量(TP)含量应低于0.02 mg/L[36-39]。传统的物理化学污水处理方式具有高耗能、高成本、污染物处理不彻底、易形成二次污染等缺陷,生物法处理废水是近几年来兴起的一种高效清洁的方式,主要利用光合微生物的混菌体系进行(图 1A–B)。光合微生物可以有效地利用废水中的氮、磷进行生长,同时产生异养菌所必需的氧气,体系中的异养菌由此去分解废水中的有机污染物。根据此特点,许多微藻和异养菌根据其对营养物质的吸收与分解能力在自然界中被分离出来[34, 37]。例如,Vyverman等[39]报道了丝状微囊藻中的刚毛藻Cladophora、克里藻Klebsormidium以及鱼腥藻Anabaena等对氮、磷物质具有很高的吸收能力。这些藻类在实验室条件下(23 ℃),氮物质的吸收率分别为55.9–70.6 mg NO3–-N/(g DW·d);磷物质的吸收率分别为12.7–27.5 mg PO43–-P/(g DW·d)。除此之外,这些藻类对环境还有着良好的适应性,在15 ℃至超过35 ℃的温度下和pH 3–9范围内都可以很好地生长,这极大增加了处理污水的适用性范围[40-41],在养殖废水、河湖水、城市废水等的净化中都有很好的应用[42]。
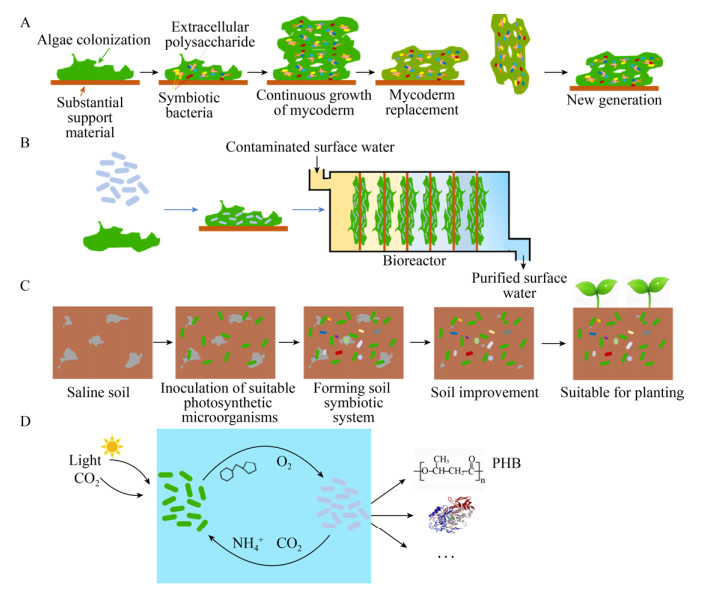
|
| 图 1 光合微生物混菌体系示意图 Fig. 1 Schematic representation of symbiotic system of photosynthetic microorganisms. (A) The formation process of symbiotic system in sewage treatment. (B) The process of sewage treatment by symbiotic system. (C) The process of soil remediation by symbiotic system. (D) Schematic representation of artificial symbiotic system. |
| |
自然和人类活动都有可能导致土壤肥力退化和盐渍化。目前,世界各地约有10亿hm2的盐渍化土地,若将这些盐碱化土地修复,将会得到极大的土壤资源[43]。传统的土壤脱盐方式主要有浸出、去除表面盐碱层、电场以及其他物理方法等[44]。一般来说,物理方法通常只作用于上层土壤,且在脱盐的过程中容易导致土壤肥力的降低[45]。一些光合微生物如念珠藻Nostoc、鱼腥藻Anabaena等在固氮、产生细胞外基质和相容溶质(通常为胞外多糖物质)上有着突出的能力,这种能力对土壤肥力恢复以及脱盐渍化有着极其重要的作用[43]。在脱盐的过程中,光合微生物通常与其他异养微生物共同作用以改善土壤盐度,这种过程是单一物种所无法完成的,图 1C展示了混菌体系作用于土壤修复的过程。混菌体系工作能力通常由生物量的生长与胞外多糖物质的生产能力来表征[43]。高盐度[46]、高蓝光[47]、氮饥饿[48]等条件有利于蓝细菌生产胞外多糖物质,而异养菌的存在还可以调节胞外多糖的分子量、支化度、取代基数以及超微分子结构等[10],进而影响胞外多糖的性质,使之适用于不同的盐渍土壤类型。此外,蓝细菌还可以与土壤中的细菌、真菌进行复杂的相互作用以此共同改善土壤环境,提高土壤肥力。Prasanna等[49]首次阐明了细菌和蓝细菌菌株之间的积极和动态相互作用及其在提升小麦等农作物产量上的应用前景。研究发现在额外添加了一种蓝藻和两种异养菌的土壤中所长出的小麦与接种在施加全剂量磷钾肥料的相比,麦穗重量增加了2倍。此外,土壤微生物学测定中还发现接种了混菌体系的土壤中脱氢酶、FDA水解酶、碱性磷酸酶的活性以及微生物生物量都有显著提高。在现场实验中还发现,混菌体系应用在土壤中还可以降低40–80 kg N/hm2的氮源成本。Naind等[18]将变形杆菌中的普罗威登斯菌Providencia sp.与两种鱼腥藻Anabaena sp.与眉藻Calothrix sp.混合添加到土壤,与普通肥料(N60P60K60)相比,接种了蓝细菌的混菌土壤中长出的小麦麦粒的蛋白质含量增加18.6%,Fe、Mn和Cu三种微量元素分别增加105.3%、36.7%和150.0%。
2.1.3 生物降解金属离子也会对藻类生物产生毒性,当在其生存环境中金属离子较高时,藻类会表现出系统的、特异性的应激反应[50-52]。实验证明,金属离子可以被主动摄取进入细胞内部进行代谢淬灭,或作为避免细胞中毒的防御工具,微藻在生长的过程中也会释放一些金属螯合剂,此外藻类生存环境的pH值普遍偏高,这也会导致相关重金属离子的沉淀[53-54]。但通常情况下,单一的光合微生物对金属离子的耐受性较差,在应用之前需要进行长期的驯化过程,且处理的金属种类较为单一[55]。有研究证实,许多光合微生物混菌体系可以络合重金属离子以及对有机污染物进行降解[56-57]。因此“藻类-细菌”混菌体系会在金属离子丰富的环境中相互排毒和同化金属,这种机制使得混菌体系在相同条件下可以比单培养体系处理更多种类的金属离子。此外,Subashchandrabose等报道了混菌体系可以有效降解久效磷、喹硫磷和甲基对硫磷等有机磷杀虫剂[58],还发现混菌体系具有降解多种农药包括DDT、阿特拉津、α-硫丹的功能[54]。Mahdavi与Muñoz等[53-54, 59]发现光合微生物对有包括黑油、乙腈、苯酚、萘、苯并芘、二苯并呋喃、偶氮化合物等在内的有机污染物的处理,利用混菌体系降解酚类物质的效率可达100%,然而单独使用四尾栅藻Scenedesmus quadricauda的降解率只有27%[60]。Tang等[57]报道了一项利用斜生栅藻Scenedesmus obliquus GH2与4种可以降解不同污染物的异养菌组成的人工混菌体系进行原油降解的研究,该研究可同时降解原油中的多种物质。利用该混菌体系进行原油降解时,直链烷烃几乎完全被降解。Ryu等[9]研究中还发现了光合微生物混菌体能够降解废水中的有毒物质硫氰酸盐。
2.2 微生物细胞工厂 2.2.1 脂质生产聚羟基脂肪酸酯(Polyhydroxyalkanoate,PHA)是目前发现的在细菌细胞内作为碳和能量储存化合物最丰富的中性脂质[61]。用混菌培养方式生产PHA的研究已经非常成熟,但研究最多仍为异养菌混菌体系[62-65]。菌藻共混合培养生产PHA由Fradinho等[66]首次提出,该体系对PHA进行生产主要由“富集PHA合成菌株”与“PHA批量合成”两个阶段组成[66]。第一阶段使用“饱足-饥饿”模式(Feast and famine regime)。PHA的积累需要以乙酸作为底物,因此首先使活性污泥中的异养菌在底物乙酸充足的阶段积累PHA,底物消耗殆尽之后部分异养菌会为了维持生存开始利用藻类产生的氧气消耗自身合成的PHA。通过上述模式的往复循环,能在藻类存在条件下生产PHA的异养菌菌株存活下来,从而达到富集PHA生产菌株的目的。第二阶段通过连续添加底物乙酸来使菌群连续不断地产生PHA而不被消耗,达到生产PHA的目的。研究中菌体最高PHA含量为20%,经过筛选后的体系,菌藻混菌体系与纯异养体系相比具有更高的PHA产量,并且利用菌藻间的相互关系使得体系在长时间内可以稳定存在,实现PHA的连续化生产。
2.2.2 多糖生产微生物的胞外多糖是一种具有广泛用途的高聚物,例如,β-D-葡聚糖具有免疫调节和肿瘤抑制的功能,细菌纤维素可以应用于声卡膜的制造以及透明质酸可以应用于化妆品中等[67]。据统计,已经发现可以产生胞外多糖的微生物约有49属76种[68]。Angelis等[10]报道了一种将微藻、蓝细菌和大型真菌共培养的混菌体系用于胞外多糖的生产。该项研究首先基于单一培养体系的生物量和胞外多糖的生产力,筛选出螺旋藻Spirulina platensis和小球藻Chlorella vulgaris两种光合微生物,以及灵芝Ganoderma、香菇Lentinus、栓菌Trametes、侧耳Pleurotus、落叶松蕈Agaricus 5种真菌,并在不同的共培养物中培养。通过13C NMR光谱和气质联用对来自单一和混菌体系的水溶性胞外多糖分进行表征与比较,发现混菌体系生产的胞外多糖的种类与纯培养相比有着很大的差别,从分子结构上鉴定出了很多新型多糖。在此基础上,为了实现多糖的最大生产,Angelis等[10]还对共培养条件,如温度、搅拌速度、真菌和微藻接种率、初始pH、光照强度和葡萄糖浓度等进行摸索,最终使多糖和生物质产量与单培养蓝细菌相比分别增加33%和61%。
2.2.3 生物产氢将混菌体系用于生物产氢已经有很多报道。例如,Miura等[69]将莱茵衣藻C. reinhardtii MGA 161与海洋光合细菌菌株W-1S共培养进行氢气生产。在此过程中,C. reinhardtii MGA 161可作为氢光解的电子供体,经优化后的该体系的氢气产量可达0.083 μmol/h。Kawaguchi等[70]通过将海红菌Rhodobium marinum A-501的培养物与淀粉乳杆菌Lactobacillus amylovorus和藻类生物质混合将藻类淀粉代谢为乳酸盐作为电子供体,改善了混菌体系使之更有利于产氢。在混合培养条件下,氢气的产率较单培养提高1.5倍,产量提高1.4倍,最高产率可达100.75 μmol/h。近年来,Wu等[71-72]将莱茵衣藻与慢生型大豆根瘤菌Bradyrhizobium japonicum或圆褐固氮菌Azotobacter chroococcum进行混合培养生产氢气,氢气产率分别达到0.42 μmol/h和0.36 μmol/h,最高已达到莱茵衣藻产氢速率的17倍。同时期,Luo等[33]发现受污染的C. reinhardtii菌液中有较高的氢气积累,并通过一系列的研究证实了受污染菌液中含有的假单胞菌Pseudomonas sp. BS4可以促进氢气的生产,经优化后的混菌体系氢气产率可达811 μmol/h。该异养菌除了可协助莱茵衣藻产氢之外,对小球藻属Chlorella、栅藻属Scenedesmus等光合微生物的产氢也有良好的促进作用。
3 光合微生物混菌系统的解析混菌体系成员之间存在某种相互关系,这种相互关系的存在是与纯培养最本质的差别,因此对混菌成员之间相互关系的解析也有助于我们进一步理解与应用混菌体系(表 2)。
| Microorganisms | Mechanism | Reference |
| S. elongatus PCC 7002, Mesorhizobium sp. TAIHU and P. stutzeri TAIHU | Compensate for metabolic defects | [73-74] |
| Synechococcus and Roseobacter | Compensate for metabolic defects | [75] |
| S. elongatus PCC 7002 and S. putrefaciens W3-18-1 | Removing environmental nutrition restrictions | [76] |
| T. elongatus BP-1 and M. ruber A | Removing environmental nutrition restrictions | [77] |
Li等[73]通过宏基因组分析探究了聚球藻Synechococcus elongatus PCC 7002与其他两种淡水异养微生物——假单胞菌Pseudomonas stutzeri TAIHU和根瘤菌Mesorhizobium sp. TAIHU在高盐度条件下所形成的稳定混菌体系间的相互关系。该研究发现,为了应对共培养中的高盐环境,S. elongatus PCC 7002会合成并分泌包括蔗糖和甘油葡萄糖在内的一些渗透相容性物质,这些物质除了为体系提供对抗渗透压、减轻细胞损伤的作用之外,也被认为作为异养细菌可利用的潜在碳源或氮源。而异养菌Mesorhizobium sp. TAIHU携带支持S. elongatus PCC 7002正常生长所需的所有涉及维生素B12的从头生物合成的基因,以合成维生素B12供蓝藻生长使用。同时,两种异养菌有着强大的脂肪分解能力可为蓝藻提供更多的可利用碳源与能量。
除此之外,P. stutzeri TAIHU在高盐度条件下也会分泌一种常见的渗透相容性物质——四氢嘧啶,而负责四氢嘧啶及其衍生物的分解代谢的基因仅存在于Mesorhizobium sp. TAIHU中,这在高盐度条件消失时去除水体多余的营养物质非常重要。同时期,Nelson等[74]也对一些聚生体中存在的无法从头合成必需的B族维生素相关酶辅助因子微生物的存活机制进行了解析,并发现混菌体系依赖辅助因子的同种异体代谢作为优化的生存策略。这种生存策略可以更好地发挥各个菌种的优势,使得混菌体系更加稳定。
Christie-Oleza等[75]使用天然存在于海洋中的“Synechococcus-Roseobacter”相互作用作为光合自养-异养生物模型的研究。研究发现,虽然Synechococcus在体系中充分发挥着生产者的作用为异养生物提供赖以生存的有机碳源。但除了阳光和CO2,Synechococcus的生存同样也依赖异养生物对海洋中一些有机物分解与矿化所产生的含氮、磷等物质。这种代谢弥补的生存方式使得更多的营养物质在混菌系统乃至海洋生物圈中循环,该研究颠覆了海洋光自养生物和异养生物竞争相同的稀缺营养物和生态位空间的普遍看法。与此相反,由于它们在长期稳态系统中的互补性,它们更可能相互受益。
3.2 营养限制解除在碳源匮乏的生存条件下,一些光合微生物混菌体仍可生存。Beliaev等[76]通过转录组分析解释了S. elongatus PCC 7002与腐败极毛杆菌Shewanella putrefaciens W3-18-1之间的相互关系。研究发现,除了通过乳酸氧化或光合固定碳来解除部分碳限制从而发生生长偶联之外,S. putrefaciens W3-18-1中一些相应的生物物质合成的基因,如丙氨酸、甲硫氨酸合成基因的下调,这表明S. elongatus PCC 7002可为生存环境提供特定的氨基酸。研究还发现,在共培养期间,S. elongatus PCC 7002中与Fe调节相关的基因的mRNA水平广泛降低,表明S. elongatus PCC 7002在共培养期间更容易获取铁元素。此外,Bernstein等[77]通过转录组分析解析了嗜热聚球藻Thermosynechococcus elongatus BP-1与红色亚栖杆菌Meiothermus ruber A之间的相互作用关系。T. elongatus BP-1可以为M. ruber A提供有机碳、氧气和还原氮,并且由于异养菌的存在,蓝细菌生物量的积累和由高浓度溶解的氧气诱导的抗应激性均增加。该研究阐明了初级生产者蓝细菌通过调节关键代谢基因的表达水平,如光合作用、碳吸收/固定、维生素合成和活性氧物质(Reactive oxygen species,ROS)清除的核心基因的表达来适应异养菌的存在。该研究指出,异养细菌可以间接调节光合自养初级生产者的基因表达,导致其一系列的生理变化。
4 合成生物学技术构建人工合成混菌体系 4.1 适应混菌体系构建的光合微生物改造自然界中由于长期进化而形成的光合微生物混菌体系不胜枚举,但在应用的过程中缺少灵活性与普适性。如前所述,蔗糖作为一种常见的碳源,其被证实是光合微生物尤其是淡水蓝细菌内最具代表性的碳水化合物代谢物。大多数淡水蓝藻菌株在遭遇盐胁迫的环境下细胞内会合成并积累蔗糖作为相容性溶质,以抵抗盐胁迫并维持细胞内外的渗透压平衡,从而保持细胞的内环境稳态[78]。对于天然蓝藻细胞,当胞内积累的蔗糖浓度足以抵抗外界的渗透压时,蔗糖的合成和降解就处于一种平衡状态,这种天然的蔗糖代谢调控模式从根本上限制了蓝细菌蔗糖产量的提升。为了突破这种限制,Ducat等[20]将来自E. coli W (一种可天然利用蔗糖的大肠杆菌)的cscB基因导入S. elongatus PCC 7942,首次实现了蓝细菌胞内蔗糖的胞外分泌。该方式有效突破了蓝细菌蔗糖合成能力的瓶颈,为后续的人工构建光合微生物混菌体系奠定了基础。
4.2 人工光合微生物混菌培养体系的建立与应用利用蓝细菌合成有机碳源供给异养菌的生长,是目前构建人工光合微生物混菌培养体系的主流方向。Ducat等[20]通过直接向产糖S. elongatus PCC 7942体系中接种S. cerevisiae,发现酵母细胞在此体系中可以很好地维持生存,初步证实了人工构建光合微生物混菌体系的可行性。以此为基础,Ducat等[22]继续探索了3种经典的工程菌(大肠杆菌、枯草芽孢杆菌和酵母菌)与产糖S. elongatus PCC 7942的共培养状况。该研究显示,大肠杆菌和酵母菌与蓝细菌的混菌体系能够较为稳定地维持数周到数月的时间,而且在面对环境波动(主要为光照的节律性变化)时,该体系展现了很强的鲁棒性并能够实现一定的高附加值产品的合成,如聚羟基丁酸酯PHB和淀粉酶。随后,Ducat等[21]利用固定化策略对人工合成混菌体系进行了优化,使用海藻酸钠对产糖S. elongatus PCC 7942进行包埋固定化。这种固定化处理方式已经通过实验证实对蓝藻细胞的生存与产糖影响较小,且可以有效地限制细胞数量的增长,使得通过生长消耗的碳源可以更加有效地转移到蔗糖生产方面。与非固定化状态相比进行了包埋固定化的产糖S. elongatus PCC 7942产糖效率提高了3倍左右。将其与玻利维亚盐单胞菌Halomonas boliviensis (天然的PHB生产者)进行共培养,该人工合成的混菌体系可维持长达5个月的培养时间,并且在培养过程中始终维持着H. boliviensis生物量稳定与PHB产量的持续增长。同样的,该体系也对环境波动与外来微生物污染表现出极强的鲁棒性与抵抗能力,不需要额外添加抗生素等策略用以维持体系稳定。此外,Ducat等还证实,除H. boliviensis之外,还可将共培养菌株替换成可用于PHB生产的大肠杆菌,这充分表明了人工合成混菌体系灵活性与普适性。但就现有研究来看,构建人工混菌体系时所用到的异养菌必须具备蔗糖的利用能力,而许多异养菌无法天然利用蔗糖作为碳源。因此需要对异养微生物进行可蔗糖利用化的改造。鉴于此,Lowe等[79]将来自天然可利用蔗糖的E. coli W中的cscA-cscB系统导入恶臭假单胞菌Pseudomonas putida,其中cscA是蔗糖水解酶,可将蔗糖水解成葡萄糖与果糖,cscB则可促进蔗糖由胞外转移到胞内,这样P. putida就拥有了蔗糖利用能力,并由此构建了可以进行PHA合成的光驱动混菌系统。
4.3 人工光合微生物混菌体系的拓展与机理研究为了更好地了解并利用人工合成混菌系统进行研究,Smith等[80]利用棕色固氮菌Azotobacter vinelandii与产糖S. elongatus PCC 7942构建混菌体系,设计了一种双向互通式共生系统。该系统里,蓝藻为A. vinelandii提供蔗糖作为碳源,A. vinelandii还可以为蓝藻提供氮源,相较于上述体系有了进一步的优化,无需额外添加任何有机氮源与碳源即可进行高附加值产物的合成。在现阶段的研究中,混菌体系中的异养微生物的生长完全依赖于蓝细菌所分泌的蔗糖,但有趣的是,异养微生物也同时促进蓝藻的生长,图 1D为人工合成混菌体系的模式图。Ducat等[22]的研究已经证实,混菌培养下每毫升菌液蓝藻的细胞数是单培养下的2–3倍,但有关这种促进作用的具体机理仍处于研究阶段。蓝藻进行光合作用容易产生活性氧,其在培养基中大量积累会抑制蓝藻的生长,Li等[81]在研究产糖S. elongatus PCC 7942和黏红酵母Rhodotorula glutinis组成的人工混菌体系时发现R. glutinis的存在可有效清除体系内的活性氧物质从而解除蓝藻的生长抑制。
5 总结与展望光合微生物是地球上重要的初级生产者,其高效的光合固碳作用为生物圈提供了近20%的有机碳。有研究还表明,光合细菌营养价值高、净化水质能力强,且具有增强动物抗病力的功能[82]。因此,自然界中以光合微生物存在为基础的混菌体系不胜枚举。经过数亿年的进化,独特的生存条件使得各个混菌体系拥有自身独特的优势与特点。经过简单改良的天然混菌体系在污水处理、高价值物质生产等领域已经展现了这些天然聚生体的巨大利用价值。但是,这些天然聚生体的应用仍旧存在一定的困难。其一,如何发现适应生物工程应用的混菌体系。自然环境中有不计其数的混菌聚生体,如何更加有效在这些混菌聚生体中找到目的体系是我们迫切需要解决的问题。以污水处理为例,目前使用的混菌系统需要根据不同的菌株对污水中不同离子的处理能力进行筛选,但筛选菌株的效率依旧非常低,因此,创建更好的菌株筛选方法,高通量筛选目的体系是我们需要探究的方向。其二,如何进一步提高混菌体系的稳定性。天然混菌体通常是在自然条件下经过长期进化形成互利共生体系,这种混菌体系具有非常高的稳定性,但普适性与灵活性较差,这为提高人工混菌体系的稳定性提供了一个良好的思路与解决方案。获得共培养的工程菌株后,利用定向进化的方法将工程菌株进行驯化,避免人工构建的混菌体系其容易崩溃的问题。
想要更进一步解决以上问题,还需要我们对混菌体系之间的相互作用机理进行深入的理解。目前的研究已经证实,一些异养菌可以通过改变光合微生物生长环境中的营养物质或小分子成分来间接地影响光合微生物的基因表达,但是,我们目前对不同种群间相互作用的理论知识的理解尚显不足。有研究表明,铜绿假单胞菌、大肠杆菌、蓝细菌、枯草芽孢杆菌等其种群的细胞数量会影响到自身的某些基因的表达量[83-86]。在大肠杆菌中,Gupta等[87]已经成功将这种群体感应系统应用于工程大肠杆菌的改造,并显著提高了目标产品的产量,如肌醇产量由0.23 g/L提高至1.28 g/L、葡糖二酸从不可检测到 > 0.8 mg/L、莽草酸酯从不可检测到 > 100 mg/L。此外,Christie-Oleza等[75]对海洋天然存在的“聚球藻-玫瑰杆菌”共生体系进行解析时还发现,光合蓝细菌与异养菌无论以何种初始接种比例接种于培养基,其种群数量在体系稳定之时双菌的数量总会维持在10︰1左右。由此我们可以猜测,除了营养关系之外,是否混菌成员之间也存在着某些群体感应系统,并且这种群感系统对双菌和多菌的比例调控起着重要作用。相信这些问题的解决可以使混菌体系应用于更广泛的领域,同时对理解自然界的进化规律也有着推动作用。
未来,通过系统运用合成生物学、系统生物学、生物信息学、组学等研究策略,深入解析光合混菌体系种群之间的遗传和代谢机制,对自然混菌体系进行更进一步的优化改进,并构建全新的混菌体系,相信这种技术一定会出现新的发展与突破。
| [1] |
Hawksworth D. The variety of fungal-algal symbioses, their evolutionary significance, and the nature of lichens. Bot J Linn Soc, 1988, 96(1): 3-20. DOI:10.1111/j.1095-8339.1988.tb00623.x |
| [2] |
Andrews JS, Rolfe SA, Huang WE, et al. Biofilm formation in environmental bacteria is influenced by different macromolecules depending on genus and species. Environ Microbiol, 2010, 12(9): 2496-2507. DOI:10.1111/j.1462-2920.2010.02223.x |
| [3] |
Hays SG, Ducat DC. Engineering cyanobacteria as photosynthetic feedstock factories. Photosynthesis Res, 2015, 123(3): 285-295. |
| [4] |
Wintermute EH, Silver PA. Dynamics in the mixed microbial concourse. Genes Dev, 2010, 24(23): 2603-2614. DOI:10.1101/gad.1985210 |
| [5] |
Benavent-González A, Delgado-Baquerizo M, Fernández-Brun L, et al. Identity of plant, lichen and moss species connects with microbial abundance and soil functioning in maritime Antarctica. Plant Soil, 2018, 429(1/2): 35-52. |
| [6] |
Lutzoni F, Miadlikowska J. Lichens. Curr Biol, 2009, 19(13): R502-R503. DOI:10.1016/j.cub.2009.04.034 |
| [7] |
Giraud E, Fleischman D. Nitrogen-fixing symbiosis between photosynthetic bacteria and legumes. Photosynthesis Res, 2004, 82(2): 115-130. |
| [8] |
Ramanan R, Kim BH, Cho DH, et al. Algae-bacteria interactions: evolution, ecology and emerging applications. Biotechnol Adv, 2016, 34(1): 14-29. DOI:10.1016/j.biotechadv.2015.12.003 |
| [9] |
Ryu BG, Kim W, Nam K, et al. A comprehensive study on algal-bacterial communities shift during thiocyanate degradation in a microalga-mediated process. Bioresour Technol, 2015, 191: 496-504. DOI:10.1016/j.biortech.2015.03.136 |
| [10] |
Angelis S, Novak AC, Sydney EB, et al. Co-culture of microalgae, cyanobacteria, and macromycetes for exopolysaccharides production: process preliminary optimization and partial characterization. Appl Biochem Biotechnol, 2012, 167(5): 1092-1106. DOI:10.1007/s12010-012-9642-7 |
| [11] |
Wang M, Keeley R, Zalivina N, et al. Advances in algal-prokaryotic wastewater treatment: a review of nitrogen transformations, reactor configurations and molecular tools. J Environ Manage, 2018, 217: 845-857. DOI:10.1016/j.jenvman.2018.04.021 |
| [12] |
Loutseti S, Danielidis DB, Economou-Amilli A, et al. The application of a micro-algal/bacterial biofilter for the detoxification of copper and cadmium metal wastes. Bioresour Technol, 2009, 100(7): 2099-2105. DOI:10.1016/j.biortech.2008.11.019 |
| [13] |
Bai XL, Acharya K. Removal of trimethoprim, sulfamethoxazole, and triclosan by the green alga Nannochloris sp. J Hazard Mater, 2016, 315: 70-75. DOI:10.1016/j.jhazmat.2016.04.067 |
| [14] |
Rana A, Joshi M, Prasanna R, et al. Biofortification of wheat through inoculation of plant growth promoting rhizobacteria and cyanobacteria. Eur J Soil Biol, 2012, 50: 118-126. DOI:10.1016/j.ejsobi.2012.01.005 |
| [15] |
Kumar M, Prasanna R, Bidyarani N, et al. Evaluating the plant growth promoting ability of thermotolerant bacteria and cyanobacteria and their interactions with seed spice crops. Sci Horticult, 2013, 164: 94-101. DOI:10.1016/j.scienta.2013.09.014 |
| [16] |
Prasanna R, Jaiswal P, Nayak S, et al. Cyanobacterial diversity in the rhizosphere of rice and its ecological significance. Indian J Microbiol, 2009, 49(1): 89-97. |
| [17] |
Prasanna R, Joshi M, Rana A, et al. Influence of co-inoculation of bacteria-cyanobacteria on crop yield and C-N sequestration in soil under rice crop. World J Microb Biot, 2012, 28(3): 1223-1235. DOI:10.1007/s11274-011-0926-9 |
| [18] |
Manjunath M, Kanchan A, Ranjan K, et al. Beneficial cyanobacteria and eubacteria synergistically enhance bioavailability of soil nutrients and yield of okra. Heliyon, 2016, 2(2): e00066. DOI:10.1016/j.heliyon.2016.e00066 |
| [19] |
Andrianantoandro E, Basu S, Karig DK, et al. Synthetic biology: new engineering rules for an emerging discipline. Mol Syst Biol, 2006, 2: 2006.0028. |
| [20] |
Ducat DC, Avelar-Rivas JA, Way JC, et al. Rerouting carbon flux to enhance photosynthetic productivity. Appl Environ Microbiol, 2012, 78(8): 2660-2668. DOI:10.1128/AEM.07901-11 |
| [21] |
Weiss TL, Young EJ, Ducat DC. A synthetic, light-driven consortium of cyanobacteria and heterotrophic bacteria enables stable polyhydroxybutyrate production. Metab Eng, 2017, 44: 236-245. DOI:10.1016/j.ymben.2017.10.009 |
| [22] |
Hays SG, Yan LLW, Silver PA, et al. Synthetic photosynthetic consortia define interactions leading to robustness and photoproduction. J Biol Eng, 2017, 11: 4. DOI:10.1186/s13036-017-0048-5 |
| [23] |
Allahverdiyeva Y, Suorsa M, Tikkanen M, et al. Photoprotection of photosystems in fluctuating light intensities. J Exp Bot, 2014, 66(9): 2427-2436. |
| [24] |
Graham PJ, Nguyen B, Burdyny T, et al. A penalty on photosynthetic growth in fluctuating light. Sci Rep, 2017, 7: 12513. DOI:10.1038/s41598-017-12923-1 |
| [25] |
Saroussi S, Karns DAJ, Thomas DC, et al. Alternative outlets for sustaining photosynthetic electron transport during dark-to-light transitions. Proc Natl Acad Sci USA, 2019, 116(23): 11518-11527. DOI:10.1073/pnas.1903185116 |
| [26] |
Yokoi H, Tokushige T, Hirose J, et al. H2 production from starch by a mixed culture of Clostridium butyricum and Enterobacter aerogenes. Biotechnol Lett, 1998, 20(2): 143-147. |
| [27] |
Ozmihci S, Kargi F. Effects of starch loading rate on performance of combined fed-batch fermentation of ground wheat for bio-hydrogen production. Int J Hydrogen Energy, 2010, 35(3): 1106-1111. DOI:10.1016/j.ijhydene.2009.11.048 |
| [28] |
Argun H, Kargi F, Kapdan IK. Hydrogen production by combined dark and light fermentation of ground wheat solution. Int J Hydrogen Energy, 2009, 34(10): 4305-4311. DOI:10.1016/j.ijhydene.2009.03.033 |
| [29] |
Argun H, Kargi F, Kapdan IK. Effects of the substrate and cell concentration on bio-hydrogen production from ground wheat by combined dark and photo-fermentation. Int J Hydrogen Energy, 2009, 34(15): 6181-6188. DOI:10.1016/j.ijhydene.2009.05.130 |
| [30] |
Liu GZ, Shen JQ. Effects of culture and medium conditions on hydrogen production from starch using anaerobic bacteria. J Biosci Bioeng, 2004, 98(4): 251-256. DOI:10.1016/S1389-1723(04)00277-4 |
| [31] |
Melis A. Photosynthetic H2 metabolism in Chlamydomonas reinhardtii (unicellular green algae). Planta, 2007, 226(5): 1075-1086. DOI:10.1007/s00425-007-0609-9 |
| [32] |
Oey M, Sawyer AL, Ross IL, et al. Challenges and opportunities for hydrogen production from microalgae. Plant Biotechnol J, 2016, 14(7): 1487-1499. DOI:10.1111/pbi.12516 |
| [33] |
Ban SD, Lin WT, Wu FY, et al. Algal-bacterial cooperation improves algal photolysis-mediated hydrogen production. Bioresour Technol, 2018, 251: 350-357. DOI:10.1016/j.biortech.2017.12.072 |
| [34] |
Renuka N, Sood A, Prasanna R, et al. Phycoremediation of wastewaters: a synergistic approach using microalgae for bioremediation and biomass generation. Int J Environ Sci Technol (Tehran), 2015, 12(4): 1443-1460. DOI:10.1007/s13762-014-0700-2 |
| [35] |
Dunne EJ, Coveney MF, Marzolf ER, et al. Nitrogen dynamics of a large-scale constructed wetland used to remove excess nitrogen from eutrophic lake water. Ecol Eng, 2013, 61: 224-234. DOI:10.1016/j.ecoleng.2013.09.039 |
| [36] |
Hu GJ, Zhou M, Hou HB, et al. An ecological floating-bed made from dredged lake sludge for purification of eutrophic water. Ecol Eng, 2010, 36(10): 1448-1458. DOI:10.1016/j.ecoleng.2010.06.026 |
| [37] |
Liu JZ, Danneels B, Vanormelingen P, et al. Nutrient removal from horticultural wastewater by benthic filamentous algae Klebsormidium sp., Stigeoclonium spp. and their communities: from laboratory flask to outdoor Algal Turf Scrubber (ATS). Water Res, 2016, 92: 61-68. DOI:10.1016/j.watres.2016.01.049 |
| [38] |
Hernández-Crespo C, Gargallo S, Benedito-Durá V, et al. Performance of surface and subsurface flow constructed wetlands treating eutrophic waters. Sci Total Environ, 2017, 595: 584-593. DOI:10.1016/j.scitotenv.2017.03.278 |
| [39] |
Liu JZ, Vyverman W. Differences in nutrient uptake capacity of the benthic filamentous algae Cladophora sp., Klebsormidium sp. and Pseudanabaena sp. under varying N/P conditions. Bioresour Technol, 2015, 179: 234-242. DOI:10.1016/j.biortech.2014.12.028 |
| [40] |
Markou G, Georgakakis D. Cultivation of filamentous cyanobacteria (blue-green algae) in agro-industrial wastes and wastewaters: a review. Appl Energy, 2011, 88(10): 3389-3401. DOI:10.1016/j.apenergy.2010.12.042 |
| [41] |
Breuer G, Lamers PP, Martens DE, et al. Effect of light intensity, pH, and temperature on triacylglycerol (TAG) accumulation induced by nitrogen starvation in Scenedesmus obliquus. Bioresour Technol, 2013, 143: 1-9. DOI:10.1016/j.biortech.2013.05.105 |
| [42] |
Ma BY, Zhang GM, Wang HY, et al. Research progress on application of photosynthetic microbial mixed culture. China Biotechnol, 2016, 36(8): 113-122 (in Chinese). 马博远, 张光明, 王航瑶, 等. 光照混菌培养应用研究进展. 中国生物工程杂志, 2016, 36(8): 113-122. |
| [43] |
Li H, Zhao QY, Huang H. Current states and challenges of salt-affected soil remediation by cyanobacteria. Sci Total Environ, 2019, 669: 258-272. DOI:10.1016/j.scitotenv.2019.03.104 |
| [44] |
Abou-Shady A. Reclaiming salt-affected soils using electro-remediation technology: PCPSS evaluation. Electrochim Acta, 2016, 190: 511-520. DOI:10.1016/j.electacta.2016.01.036 |
| [45] |
Saifullah, Dahlawi S, Naeem A, et al. Biochar application for the remediation of salt-affected soils: Challenges and opportunities. Sci Total Environ, 2018, 625: 320-335. DOI:10.1016/j.scitotenv.2017.12.257 |
| [46] |
Yoshimura H, Kotake T, Aohara T, et al. The role of extracellular polysaccharides produced by the terrestrial cyanobacterium Nostoc sp. strain HK-01 in NaCl tolerance. J Appl Phycol, 2012, 24(2): 237-243. DOI:10.1007/s10811-011-9672-5 |
| [47] |
Han PP, Sun Y, Jia SR, et al. Effects of light wavelengths on extracellular and capsular polysaccharide production by Nostoc flagelliforme. Carbohydr Polym, 2014, 105: 145-151. DOI:10.1016/j.carbpol.2014.01.061 |
| [48] |
Tiwari ON, Khangembam R, Shamjetshabam M, et al. Characterization and optimization of Bioflocculant exopolysaccharide production by cyanobacteria Nostoc sp. BTA97 and Anabaena sp. BTA990 in culture conditions. Appl Biochem Biotechnol, 2015, 176(7): 1950-1963. DOI:10.1007/s12010-015-1691-2 |
| [49] |
Nain L, Rana A, Joshi M, et al. Evaluation of synergistic effects of bacterial and cyanobacterial strains as biofertilizers for wheat. Plant Soil, 2010, 331(1/2): 217-230. |
| [50] |
Glaesener AG, Merchant SS, Blaby-Haas CE. Iron economy in Chlamydomonas reinhardtii. Front Plant Sci, 2013, 4: 337. |
| [51] |
Kropat J, Gallaher SD, Urzica EI, et al. Copper economy in Chlamydomonas: prioritized allocation and reallocation of copper to respiration vs. photosynthesis. Proc Natl Acad Sci USA, 2015, 112(9): 2644-2651. DOI:10.1073/pnas.1422492112 |
| [52] |
Malasarn D, Kropat J, Hsieh SI, et al. Zinc deficiency impacts CO2 assimilation and disrupts copper homeostasis in Chlamydomonas reinhardtii. J Biol Chem, 2013, 288(15): 10672-10683. DOI:10.1074/jbc.M113.455105 |
| [53] |
Muñoz R, Guieysse B. Algal-bacterial processes for the treatment of hazardous contaminants: a review. Water Res, 2006, 40(15): 2799-2815. DOI:10.1016/j.watres.2006.06.011 |
| [54] |
Subashchandrabose SR, Ramakrishnan B, Megharaj M, et al. Mixotrophic cyanobacteria and microalgae as distinctive biological agents for organic pollutant degradation. Environ Int, 2013, 51: 59-72. DOI:10.1016/j.envint.2012.10.007 |
| [55] |
Shen L, Li ZF, Wang JJ, et al. Characterization of extracellular polysaccharide/protein contents during the adsorption of Cd (Ⅱ) by Synechocystis sp. PCC6803. Environ Sci Pollut Res, 2018, 25(21): 20713-20722. DOI:10.1007/s11356-018-2163-3 |
| [56] |
Boivin MEY, Greve GD, García-Meza J, et al. Algal-bacterial interactions in metal contaminated floodplain sediments. Environ Pollut, 2007, 145(3): 884-894. DOI:10.1016/j.envpol.2006.05.003 |
| [57] |
Tang X, He LY, Tao XQ, et al. Construction of an artificial microalgal-bacterial consortium that efficiently degrades crude oil. J Hazard Mater, 2010, 181(1/3): 1158-1162. |
| [58] |
Subashchandrabose SR, Ramakrishnan B, Megharaj M, et al. Consortia of cyanobacteria/microalgae and bacteria: biotechnological potential. Biotechnol Adv, 2011, 29(6): 896-907. DOI:10.1016/j.biotechadv.2011.07.009 |
| [59] |
Mahdavi H, Prasad V, Liu Y, et al. In situ biodegradation of naphthenic acids in oil sands tailings pond water using indigenous algae-bacteria consortium. Bioresour Technol, 2015, 187: 97-105. DOI:10.1016/j.biortech.2015.03.091 |
| [60] |
Ryu BG, Kim J, Han JI, et al. Feasibility of using a microalgal-bacterial consortium for treatment of toxic coke wastewater with concomitant production of microbial lipids. Bioresour Technol, 2017, 225: 58-66. DOI:10.1016/j.biortech.2016.11.029 |
| [61] |
Steinbüchel A. Polyhydroxyalkanoic acids//Byrom D, Ed. Biomaterials. Londonl Palgrave Macmillan, 1991: 123–213.
|
| [62] |
Reis MAM, Serafim LS, Lemos PC, et al. Production of polyhydroxyalkanoates by mixed microbial cultures. Bioprocess Biosystems Eng, 2003, 25(6): 377-385. DOI:10.1007/s00449-003-0322-4 |
| [63] |
Salehizadeh H, van Loosdrecht MCM. Production of polyhydroxyalkanoates by mixed culture: recent trends and biotechnological importance. Biotechnol Adv, 2004, 22(3): 261-279. DOI:10.1016/j.biotechadv.2003.09.003 |
| [64] |
Albuquerque MGE, Torres CAV, Reis MAM. Polyhydroxyalkanoate (PHA) production by a mixed microbial culture using sugar molasses: effect of the influent substrate concentration on culture selection. Water Res, 2010, 44(11): 3419-3433. DOI:10.1016/j.watres.2010.03.021 |
| [65] |
Moita R, Freches A, Lemos PC. Crude glycerol as feedstock for polyhydroxyalkanoates production by mixed microbial cultures. Water Res, 2014, 58: 9-20. DOI:10.1016/j.watres.2014.03.066 |
| [66] |
Fradinho JC, Domingos JMB, Carvalho G, et al. Polyhydroxyalkanoates production by a mixed photosynthetic consortium of bacteria and algae. Bioresour Technol, 2013, 132: 146-153. DOI:10.1016/j.biortech.2013.01.050 |
| [67] |
Sutherland IW. Novel and established applications of microbial polysaccharides. Trends Biotechnol, 1998, 16(1): 41-46. DOI:10.1016/S0167-7799(97)01139-6 |
| [68] |
Wei PL. A summary of microbial extra polysaccharides. J Zhejiang Univ Sci & Technol, 2002, 14(2): 8-12 (in Chinese). 魏培莲. 微生物胞外多糖研究进展. 浙江科技学院学报, 2002, 14(2): 8-12. DOI:10.3969/j.issn.1671-8798.2002.02.003 |
| [69] |
Miura Y, Saitoh C, Matsuoka S, et al. Stably sustained hydrogen production with high molar yield through a combination of a marine green alga and a photosynthetic bacterium. Biosci Biotechnol Biochem, 1992, 56(5): 751-754. DOI:10.1271/bbb.56.751 |
| [70] |
Kawaguchi H, Hashimoto K, Hirata K, et al. H2 production from algal biomass by a mixed culture of Rhodobium marinum A-501 and Lactobacillus amylovorus. J Biosci Bioeng, 2001, 91(3): 277-282. DOI:10.1016/S1389-1723(01)80134-1 |
| [71] |
Xu LL, Li DZ, Wang QX, et al. Improved hydrogen production and biomass through the co-cultivation of Chlamydomonas reinhardtii and Bradyrhizobium japonicum. Int J Hydrogen Energy, 2016, 41(22): 9276-9283. DOI:10.1016/j.ijhydene.2016.04.009 |
| [72] |
Xu LL, Cheng XL, Wu SX, et al. Co-cultivation of Chlamydomonas reinhardtii with Azotobacter chroococcum improved H2 production. Biotechnol Lett, 2017, 39(5): 731-738. DOI:10.1007/s10529-017-2301-x |
| [73] |
Ren ML, Zhang GY, Ye Z, et al. Metagenomic analysis reveals potential interactions in an artificial coculture. AMB Express, 2017, 7: 193. DOI:10.1186/s13568-017-0490-2 |
| [74] |
Romine MF, Rodionov DA, Maezato Y, et al. Underlying mechanisms for syntrophic metabolism of essential enzyme cofactors in microbial communities. ISME J, 2017, 11(6): 1434-1446. DOI:10.1038/ismej.2017.2 |
| [75] |
Christie-Oleza JA, Sousoni D, Lloyd M, et al. Nutrient recycling facilitates long-term stability of marine microbial phototroph-heterotroph interactions. Nat Microbiol, 2017, 2(9): 17100. DOI:10.1038/nmicrobiol.2017.100 |
| [76] |
Beliaev AS, Romine MF, Serres M, et al. Inference of interactions in cyanobacterial-heterotrophic co-cultures via transcriptome sequencing. ISME J, 2014, 8(11): 2243-2255. DOI:10.1038/ismej.2014.69 |
| [77] |
Bernstein HC, McClure RS, Thiel V, et al. Indirect interspecies regulation: transcriptional and physiological responses of a cyanobacterium to heterotrophic partnership. mSystems, 2017, 2(2): e00181-16. |
| [78] |
Hagemann M. Molecular biology of cyanobacterial salt acclimation. FEMS Microbiol Rev, 2011, 35(1): 87-123. DOI:10.1111/j.1574-6976.2010.00234.x |
| [79] |
Löwe H, Hobmeier K, Moos M, et al. Photoautotrophic production of polyhydroxyalkanoates in a synthetic mixed culture of Synechococcus elongatus cscB and Pseudomonas putida cscAB. Biotechnolr Biof, 2017, 10: 190. DOI:10.1186/s13068-017-0875-0 |
| [80] |
Smith MJ, Francis MB. A designed A. vinelandii-S. elongatus coculture for chemical photoproduction from air, water, phosphate, and trace metals. ACS Synth Biol, 2016, 5(9): 955-961. DOI:10.1021/acssynbio.6b00107 |
| [81] |
Li TT, Li CT, Butler K, et al. Mimicking lichens: incorporation of yeast strains together with sucrose-secreting cyanobacteria improves survival, growth, ROS removal, and lipid production in a stable mutualistic co-culture production platform. Biotechnol Biof, 2017, 10: 55. DOI:10.1186/s13068-017-0736-x |
| [82] |
Li YQ, Kan ZR, Mu SM, et al. Study progress of photosynthetic bacteria. J Hebei Univ: NatI Sci Ed, 2005, 25(5): 554-560 (in Chinese). 李彦芹, 阚振荣, 穆淑梅, 等. 光合细菌研究进展. 河北大学学报:自然科学版, 2005, 25(5): 554-560. |
| [83] |
Bareia T, Pollak S, Eldar A. Self-sensing in Bacillus subtilis quorum-sensing systems. Nat Microbiol, 2018, 3(1): 83-89. |
| [84] |
Smith RS, Iglewski BH. P. aeruginosa quorum-sensing systems and virulence. Curr Opin Microbiol, 2003, 6(1): 56-60. DOI:10.1016/S1369-5274(03)00008-0 |
| [85] |
Sharif DI, Gallon J, Smith CJ, et al. Quorum sensing in Cyanobacteria: N-octanoyl-homoserine lactone release and response, by the epilithic colonial cyanobacterium Gloeothece PCC6909. ISME J, 2008, 2(12): 1171-1182. DOI:10.1038/ismej.2008.68 |
| [86] |
Sperandio V, Torres AG, Kaper JB. Quorum sensing Escherichia coli regulators B and C (QseBC): a novel two-component regulatory system involved in the regulation of flagella and motility by quorum sensing in E. coli. Mol Microbiol, 2002, 43(3): 809-821. DOI:10.1046/j.1365-2958.2002.02803.x |
| [87] |
Gupta A, Reizman IMB, Reisch CR, et al. Dynamic regulation of metabolic flux in engineered bacteria using a pathway-independent quorum-sensing circuit. Nat Biotechnol, 2017, 35(3): 273-279. |
 2020, Vol. 36
2020, Vol. 36




