中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王孜楠, 李柱, 刘鸿雁, 吴龙华
- Wang Zinan, Li Zhu, Liu Hongyan, Wu Longhua
- 不同类型污染土壤中赤子爱胜蚓对伴矿景天重金属吸收的影响初报
- Effect of Eisenia foetida on the metal uptake by Sedum plumbizincicola in different types of contaminated soils
- 生物工程学报, 2020, 36(3): 549-559
- Chinese Journal of Biotechnology, 2020, 36(3): 549-559
- 10.13345/j.cjb.200037
-
文章历史
- Received: January 20, 2020
- Accepted: March 18, 2020
2. 中国科学院南京土壤研究所 土壤环境与污染修复重点实验室,江苏 南京 210008
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, Jiangsu, China
土壤重金属易通过食物链途径在植物、动物和人体内积累,对人类健康构成严重威胁[1-2]。全国土壤污染状况调查公报显示,全国土壤污染总超标率为16.1%,为主要无机污染物,镉污染点位超标率为7.0%[3],因此土壤镉污染的修复成为当前污染治理的主要任务之一。在各种修复技术中,植物修复因其环境友好、可原位实施等特点已被广泛研究和实际应用[4-5]。但某些土壤条件制约着植物修复效率,如镉的有效性较低[6]、土壤肥力低、土壤物理结构差等[7-9]。因此,如何提高植物修复效率是重金属污染修复研究的重要方向之一[10]。
作为土壤动物生物量的最大组成部分,蚯蚓可改善土壤结构、提高土壤养分有效性[11]。蚯蚓在土壤中的活动影响了土壤有机物转化和养分元素的释放,可增强土壤微生物活性[12]。在蚯蚓的取食、掘穴和排泄等生命活动过程中,对土壤重金属的生物有效性产生直接或间接的影响,进而提高植物对重金属的吸收量[13-15]。研究表明,在重金属污染土壤中施加蚯蚓有利于植物的生长以及重金属的吸收[16]。综合来看,蚯蚓促进植物修复效果可能存在两种主要途径,一方面是蚯蚓促进植物生长,另一方面则是蚯蚓对土壤重金属有效性的影响[16-17]。Groenigen等[18]通过对58篇文献462组数据进行统计分析发现,蚯蚓增加植物地上部生物量23%,地下部生物量20%,以及总的生物量21%。研究表明,蚯蚓具有提高土壤养分有效性的作用[19-20],蚯蚓活动使土壤有效氮含量增加了20%-23%、有效磷增加21.6%-41.9%、有效钾增加13.7%-22.0%[21-22]。蚓粪中的激素类物质对植株的生物量增加也有显著的促进作用[23]。不仅如此,蚯蚓的掘穴能够起到改善土壤通气与持水能力的作用,这对植物生长及其水分利用效率具有积极的影响[24]。此外,在促进植物生物量增加的同时,蚯蚓的活动能够促进植物对重金属的吸收[15, 25-26]。尽管有较多关于蚯蚓对土壤重金属作用与影响的文献报道,但不同类型土壤上蚯蚓是否能对污染土壤中重金属的超积累植物吸取修复起强化作用还缺乏证据[25]。
伴矿景天(Sedum plumbizincicola X.H. Guo et S.B. Zhou ex L.H. Wu),是近年来在中国发现的景天科植物新种[27-28],具有较强的镉、锌吸收富集能力,是镉污染土壤吸取修复的理想植物[27]。但也有研究表明,不同土壤性质对伴矿景天修复效率存在较大影响,例如石灰性土壤中伴矿景天对镉、锌的去除效率明显低于酸性土壤[29],高紧实度土壤修复效率较低[30]等。现有的伴矿景天强化修复措施主要有加硫酸化[31]、施用秸秆[32]以及农艺措施[33]等,目前对于伴矿景天修复的土壤动物强化研究相对较少,鉴于目前在伴矿景天实际农田修复中往往存在生长不良、修复效率低等问题,故开展蚯蚓添加下的伴矿景天修复试验。本文选取我国南方3种不同类型的重金属污染土壤为研究对象,探讨赤子爱胜蚓Eisenia foetida对超积累植物伴矿景天生长和重金属吸收性的影响,以期探明蚯蚓强化超积累植物修复的影响因素,为重金属污染土壤的植物修复提供理论依据。
1 材料与方法 1.1 供试材料供试土壤分别采自贵州省贵阳市乌当区水田镇、广东省韶关市曲江区乌石镇、贵州省黔南州罗甸县罗沙乡,为农田表层0-20 cm土壤。依据中国土壤系统分类,本研究供试土壤的土壤类型分别为常湿淋溶土(Perudic Luvisols)、水耕人为土(Stagnic Anthrosols)和湿润雏形土(Udic Cambisols),3种土壤均为我国南方地区常见类型,且重金属污染问题突出。3种土壤的差异主要在于pH、养分和重金属有效性方面,其基本性质见表 1。试验用伴矿景天为扦插育苗,选择大小相近、长势一致、发育良好的伴矿景天枝条。蚯蚓为赤子爱胜蚓Eisenia foetida,购于江苏省句容市某蚯蚓养殖场,选取同代、体重相近、有明显环带、健壮有活力的成年蚓,添加处理前在温室中适应环境7 d,后将蚯蚓置于湿润滤纸上48 h进行清肠。
| Soils | pH | SOC (g/kg) | Total concentration | Available concentration | ||||||
| Cd (mg/kg) | Zn (mg/kg) | Ca (g/kg) | N (mg/kg) | P (mg/kg) | K (mg/kg) | Mg (mg/kg) | ||||
| Perudic Luvisols | 5.29 | 31.6 | 2.51 | 96.0 | 1.4 | 178.0 | 10.2 | 36.1 | 88.6 | |
| Stagnic Anthrosols | 6.20 | 22.6 | 2.39 | 116.0 | 1.3 | 121.0 | 19.3 | 65.4 | 63.3 | |
| Udic Cambisols | 7.62 | 26.8 | 4.17 | 203.0 | 5.3 | 219.0 | 25.5 | 37.5 | 191.0 | |
包括两季,第一季盆栽试验选用3种土壤(表 1),每土壤设3个处理,分别为:(1)无伴矿景天、无蚯蚓对照(CK);(2)种植伴矿景天(T);(3)种植伴矿景天、添加蚯蚓(ET)。每处理4次重复,每盆装土1.5 kg (烘干基)。每盆扦插伴矿景天4株,植物生长期间浇去离子水,保持土壤含水量在最大田间最大持水量的60%左右。添加蚯蚓处理,根据已有文献作参考[34-36],综合本试验条件,设置每盆投放量为10条,蚯蚓总质量约4.5 g,所有处理将盆体(包括没有接种蚯蚓处理)外边沿用封口膜围成一周并固定,防止蚯蚓逃逸。
第二季种植,选取第一季蚯蚓没有强化效应的水耕人为土(Stagnic Anthrosols)为供试土壤,设置处理包括:(1)种植伴矿景天(T-2);(2)种植伴矿景天、添加蚯蚓(ET-2);(3)种植伴矿景天、施用秸秆(TS-2);(4)种植伴矿景天、添加蚯蚓、施用秸秆(ETS-2)。第一季和第二季种植时间分别为2019年5-7月和9-11月。每季试验结束后收获伴矿景天地上部及存活蚯蚓,蚯蚓记录存活数量与体重。修复后土壤经混匀、取样、自然风干,分别过2 mm和0.15 mm尼龙筛、备用。伴矿景天地上部用自来水、去离子水洗净,105 ℃杀青30 min,75 ℃烘干72 h,记录干重,研磨粉碎后备测。
1.3 分析方法伴矿景天地上部样品采用HNO3-H2O2消解法消解,待测液Cd、Zn采用火焰原子吸收光谱法测定,P、K、Ca、Mg采用电感耦合等离子体原子发射光谱法测定;伴矿景天地上部全N采用H2SO4-H2O2消解-半微量开氏法测定。土壤有效Cd和Zn采用0.01 mol/L CaCl2提取,土液比1:10,浸提液采用石墨炉原子吸收光谱法测定;土壤碱解N采用碱解扩散法测定;水溶性P、K、Ca、Mg采用土水比1:10浸提,电感耦合等离子体发射光谱法测定。
1.4 数据统计分析数据统计与分析采用Microsoft Office Excel 2019与IBM SPSS Statistics 25,比较方式采用独立样本t检验或双向方差分析(ANOVA),置信区间为95%。
2 结果与分析 2.1 伴矿景天生物量及养分吸收量在酸性常湿淋溶土,接种蚯蚓处理(ET)的伴矿景天地上部生物量比未接种处理(T)提高了105.9% (P < 0.05),而在中性水耕人为土和碱性湿润雏形土,接种蚯蚓与未接种处理没有显著差异(图 1)。所有接种蚯蚓处理,伴矿景天氮吸收量均显著升高(P < 0.05),酸性常湿淋溶土、中性水耕人为土和碱性湿润雏形土分别增加了56.3%、74.5%和28.0% (表 2)。此外,酸性常湿淋溶土ET处理,伴矿景天P、K、Ca、Mg总吸收量分别增加112%、128%、82.2%和106% (表 2)。

|
| 图 1 三类土壤施加赤子爱蚓后伴矿景天地上部生物量的差异 Fig. 1 Dry matter above ground of S. plumbizincicola in 1st season. Letters above the bar indicate significant difference (P < 0.05) by t-test between T and ET treatments in same soil. |
| |
| Soils | Treatment | Nutrients content in shoot | ||||
| N (mg/pot) | P (mg/pot) | K (mg/pot) | Ca (mg/pot) | Mg (mg/pot) | ||
| Perudic Luvisols | T | 144.0b | 14.3b | 80.2b | 299b | 19.8b |
| ET | 225.0a | 30.6a | 185.0a | 550a | 41.0a | |
| Stagnic Anthrosols | T | 79.1b | 18.8a | 103.0a | 322a | 19.9a |
| ET | 138.0a | 22.9a | 126.0a | 382a | 24.5a | |
| Udic Cambisols | T | 186.0b | 14.9a | 63.5a | 394a | 27.0a |
| ET | 238.0a | 17.7a | 74.1a | 434a | 32.4a | |
| Letters of the same column indicate significant difference (P < 0.05) by t-test between T and ET treatments in same soil. | ||||||
第二季盆栽试验添加秸秆处理中,ETS-2相比TS-2处理伴矿景天地上部生物量增加96.6%,未添加秸秆处理中ET-2相比T-2增加12.5%,但没有显著差异(图 2);此外,添加秸秆TS-2生物量显著低于未添加秸秆S-2处理。添加蚯蚓的处理中,ETS-2处理生物量相对ET-2处理增加了20% (图 2)。养分吸收结果显示,ET-2处理相较T-2处理伴矿景天各养分吸收均显著增加,N、P、K、Ca、Mg分别提高68%、37%、23.7%、10.3%和30.9% (表 3)。ETS-2处理相较TS-2处理N、P、K、Ca、Mg也显著增加,增加量分别为151%、108%、102%、85.8%和63.5% (表 3)。
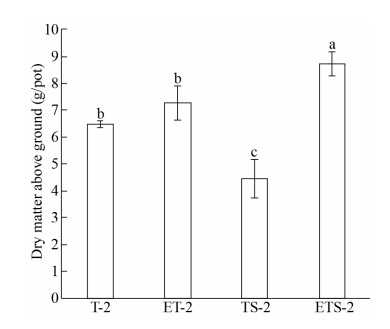
|
| 图 2 水耕人为土第二季修复伴矿景天地上部生物量差异 Fig. 2 Dry matter above ground of S. plumbizincicola grown on Stagnic Anthrosols. S. plumbizincicola shoot for 2nd season. Letters above the bar indicate significant difference (P < 0.05) by ANOVA between T-2, ET-2, TS-2 and ETS-2 treatments. |
| |
| Treatment | N (mg/pot) |
P (mg/pot) |
K (mg/pot) |
Ca (mg/pot) |
Mg (mg/pot) |
| T-2 | 43.8b | 9.49b | 67.2b | 175b | 11.00b |
| ET-2 | 73.6a | 13.00a | 83.2a | 193a | 14.40a |
| TS-2 | 31.0b | 8.65b | 64.5b | 113b | 9.60b |
| ETS-2 | 77.8a | 18.00a | 130.0a | 210a | 15.70a |
| Letters of the same column indicate significant difference (P < 0.05) by ANOVA between T-2, ET-2, TS-2 and ETS-2 treatments. | |||||
第一季伴矿景天地上部Cd浓度结果显示,酸性常湿淋溶土ET处理下伴矿景天Cd和Zn浓度均显著降低,降低比例分别为15.6%和34.1%。碱性湿润雏形土ET处理伴矿景天Cd浓度降低11.7%,其余处理无显著差异。第二季种植下,T-2与ET-2处理重金属浓度无显著性差异,添加秸秆下ETS-2处理Cd、Zn浓度显著低于TS-2处理,相对降低量分别为38%和37.4%。
从总吸收量结果来看,酸性常湿淋溶土ET处理下伴矿景天Cd吸收总量为1.87 mg/pot,为T处理的172%,Zn吸收总量为13.3 mg/pot,为T处理的136%,均达到显著水平(P < 0.05)。在中性水耕人为土与碱性湿润雏形土处理下未观察到吸收量显著变化(P > 0.05)。第二季(S2)种植下,未添加秸秆的T-2及ET-2处理未发现显著差异(P > 0.05);添加秸秆下TS-2处理的伴矿景天Cd、Zn浓度显著升高(P < 0.05),而ETS-2处理Cd、Zn浓度相对TS-2处理较低(图 4),但总体Cd、Zn吸收量高于TS-2处理22%和23% (图 4);秸秆与蚯蚓联用(ETS-2)相比于对照(T-2)伴矿景天对Cd、Zn的吸收分别增加了66.4%和52.6%。
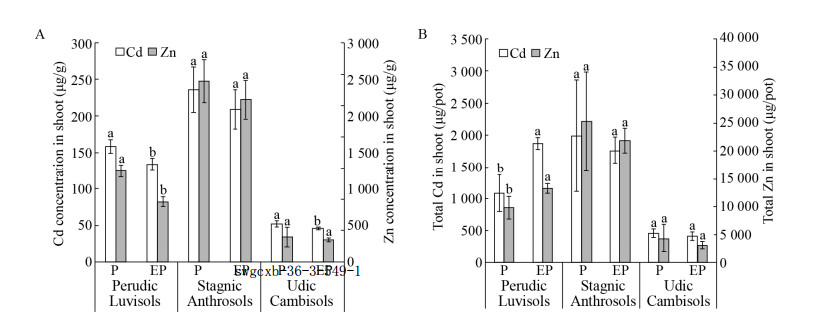
|
| 图 3 第一季修复后伴矿景天地上部Cd和Zn浓度(A)与吸收量(B) Fig. 3 Cd and Zn concentrations in shoot of S. plumbizincicola. Letters above the bar indicate significant difference (P < 0.05) by t-test between T and ET treatments in same soil and element. |
| |

|
| 图 4 第二季修复后伴矿景天地上部Cd和Zn浓度(A)与吸收量(B) Fig. 4 Total Cd and Zn uptake by shoot of S. plumbizincicola. Letters above the bars indicate significant difference (P < 0.05) by ANOVA between T-2, ET-2, TS-2 and ETS-2 treatments in same element. |
| |
对修复后土壤pH和重金属有效性分析表明,第一季ET处理下酸性常湿淋溶土与中性水耕人为土pH相较CK处理显著降低(P < 0.05)。修复后土壤CaCl2提取态Cd、Zn浓度显著下降,酸性常湿淋溶土T与ET相较CK处理有效Cd降低量分别为69.0%和77.9%。且两处理间差异达显著水平(P < 0.05) (表 4)。而水耕人为土与湿润雏形土T与ET间未出现显著变化。
| Soils | Treatments | pH | CaCl2 extractable (mg/kg) | |
| Cd | Zn | |||
| Perudic Luvisols | CK | 5.74ab | 0.410a | 0.830a |
| T | 5.81a | 0.130b | 0.480b | |
| ET | 5.56b | 0.090c | 0.350c | |
| Stagnic Anthrosols | CK | 5.99a | 0.530a | 1.570a |
| T | 5.70b | 0.200b | 1.000b | |
| ET | 5.67b | 0.250b | 1.470a | |
| T-2 | 5.74b | 0.053ab | 0.910b | |
| ET-2 | 5.61c | 0.065a | 0.930b | |
| TS-2 | 6.32a | 0.041b | 1.370a | |
| ETS-2 | 6.23a | 0.045b | 1.060b | |
| Udic Cambisols | CK | 7.35a | 0.018a | 0.035a |
| T | 7.11b | 0.011b | 0.034a | |
| ET | 7.25a | 0.014b | 0.023a | |
| Letters of the same line for the treatments in 1st season indicate significant difference (P < 0.05) by ANOVA between CK, T and ET treatments in same soil. Letters of the same column for treatments of 2nd season indicate significant difference (P < 0.05) by ANOVA between T-2, ET-2, TS-2 and ETS-2 treatments. | ||||
第二季修复结果显示(表 4),蚯蚓处理ET-2相比T-2处理pH显著降低(P < 0.05),添加秸秆后则未观察到明显变化。第二季修复后土壤CaCl2提取态Cd和Zn浓度进一步降低。在添加秸秆处理TS-2与ETS-2相比未添加秸秆处理Cd下降更明显(P < 0.05)。
3 讨论通过向镉污染土壤投加蚯蚓以强化超积累植物修复,究其原理,一是通过促进超积累植物生长,二是提高超积累植物对镉的吸取。已有研究表明,蚯蚓影响植物生长的主要机制在于抑制作物病害、刺激与植物共生的微生物、分泌植物生长调节物质、改善土壤结构以及增加植物对养分的利用率这5个方面,其中改善土壤结构以及增加植物养分吸收是最为重要的途径[37]。超积累植物修复的强化主要体现在两个方面,一是植物生物量,二是地上部重金属浓度,可由该两者之一或同时增加而导致植物对重金属吸收量的增加。本研究发现,在不同类型土壤上蚯蚓对伴矿景天的强化修复效应存在明显差异。第一季种植修复中,蚯蚓添加的强化修复效果表现在酸性常湿淋溶土,由于地上部生物量大幅度增加,而导致伴矿景天对重金属吸收性明显增加,但该效应并未出现在其他两种土壤。其主要原因可能是这两组土壤下伴矿景天的生物量没有显著差异(图 1)。除生物量外,植物地上部重金属浓度升高亦为强化修复效应,但在本研究中并未出现植物镉和锌浓度增加的现象,这表明赤子爱胜蚓对伴矿景天修复效率的提高主要在于促生效应。一般情况下,植物地上部重金属浓度的增大,主要原因为土壤重金属有效性增加,或是促进植物生长、根系活力增强、富集重金属能力相对增强。有研究表明,蚯蚓活动能够使土壤重金属有效性发生变化[14, 38-39],但其作用因素复杂,且在不同土壤中对不同重金属可能产生截然不同的效应,如在某些土壤中产生钝化效应[15],在部分土壤中则产生活化效应[14]。从本研究结果来看,赤子爱胜蚓活动使伴矿景天养分元素吸收量得到较大幅度提高,其中以氮吸收增加最为显著,并且在蚯蚓作用下3种土壤的伴矿景天氮吸收均有明显提高,该结果与Groenigen等[18, 40-41]的研究结论相似。有效氮的增加可能由多方面因素导致,如蚯蚓的体表粘液、肠道分泌物、土壤有机质的加速矿化以及固氮菌的增多[21]。除提高氮素吸收外,有研究报道蚯蚓Pontoscolex corethrurus能够通过土壤有机磷矿化加快,从而增强磷的释放[42],促进植物对磷吸收。但蚯蚓对于氮、磷以外的其他元素的影响效果尚不统一[18]。对于本研究条件下的3种土壤,仅仅在酸性常湿淋溶土上接种蚯蚓,伴矿景天生长表现显著强化效应,其他两种土壤接种蚯蚓生物量均无显著差异(图 1)。通过对伴矿景天养分吸收分析,发现磷、钾、钙和镁4种元素的吸收量仅在酸性常湿淋溶土中接种蚯蚓处理存在显著增加,其他土壤中则均没有显著上升,养分吸收的不均衡提高可能是其他两个土壤中施加蚯蚓没有表现出促进伴矿景天生长的原因。
第二季吸取修复结果发现,中性水耕人为土中添加秸秆处理下伴矿景天地上部锌镉浓度显著增加,表明秸秆能强化伴矿景天根系对重金属吸收,该结果也验证之前研究[32];秸秆和蚯蚓同时处理,伴矿景天生物量显著增加,镉吸收增加但地上部浓度降低,表现出稀释效应。这可能是伴矿景天生长速度过快,而土壤有效态镉锌供不应求,固相中镉无法快速解吸释放的原因。秸秆和蚯蚓同时处理对于重金属吸收量上表现为增加效应,表明二者联用可起到强化伴矿景天修复作用。对于中性水耕人为土,在第一季和第二季中仅接种蚯蚓均未明显促进伴矿景天生长,但在第二季中外加秸秆再接种蚯蚓显著提高地上部生物量,而单添加秸秆处理则表现为生物量显著降低(图 1)。究其原因,可能是添加秸秆导致C/N比增大,秸秆在土壤中分解时消耗有效态氮,与植物竞争氮素,进而导致植物生物量降低[26];添加秸秆同时施加蚯蚓,蚯蚓活动可提高土壤有效氮,弥补秸秆分解的氮素需求,而蚯蚓活动对秸秆也起到了加速腐熟的效应[43],蚯蚓在土壤中大量吞食有机质,使其转变为更有利于植物吸收的矿质元素及其他小分子有机物等[44],进而促进植物生长。总体结果显示,植物在蚯蚓活动的刺激下吸收更多养分,特别是氮素的吸收[36],生物量增大,重金属吸收量也相应增加;另一方面,重金属吸收量的增加也可能与蚯蚓分泌物刺激根系生长有关[45-46],分布更广的根系能更有效地与土壤重金属产生接触,并且在蚯蚓洞穴中可能存在更多养分“热点”,使伴矿景天进一步增强养分吸收[47]。除养分增加外,蚯蚓活动形成的大量蚓穴能够改善土壤通气性,而活动过程中产生的各类有机酸、激素等可能进一步促进根系和植物生长[40]。但本研究中通过对土壤容重分析,接种蚯蚓与否并无显著差异,但在田间条件下蚯蚓通过改变土壤结构是否对伴矿景天生长具有促进效应,还有待进一步研究。同时,本研究仅局限于赤子爱胜蚓这一蚓种,对于其他类型的蚯蚓未进行研究,不同种类蚯蚓可能在摄食习性、肠道菌群、粘液组成上有较大差别[36, 48],从而导致不同的试验结果。
4 结论本研究以3种我国南方不同土壤类型的重金属污染土壤为研究对象,初步探究了赤子爱胜蚓对超积累植物伴矿景天对镉锌吸取修复的强化效应。结果发现,赤子爱胜蚓能促进伴矿景天对氮素吸收,但对其他养分(钾、钙、磷等)吸收效应的影响因土壤而异;赤子爱胜蚓强化修复效应主要原因在于伴矿景天生物量的提高,但强化效应因土壤而异:在西南地区常湿淋溶土条件下,引入赤子爱胜蚓伴矿景天对镉去除量增加了106%,在水耕人为土添加赤子爱胜蚓的同时加入秸秆使伴矿景天对镉的去除量增加了66.4%。
| [1] |
Chen WP, Yang Y, Xie T, et al. Challenges and countermeasures for heavy metal pollution control in farmlands of China. Acta Pedol Sin, 2018, 55(2): 261-272 (in Chinese). 陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策. 土壤学报, 2018, 55(2): 261-272. |
| [2] |
Fan T, Ye WL, Chen HY, et al. Review on contamination and remediation technology of heavy metal in agricultural soil. Ecol Environ Sci, 2013, 22(10): 1727-1736 (in Chinese). 樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究. 生态环境学报, 2013, 22(10): 1727-1736. DOI:10.3969/j.issn.1674-5906.2013.10.015 |
| [3] |
Chen NC, Zheng YJ, He XF, et al. Analysis of the report on the national general survey of soil contamination. J Agri Environ Sci, 2017, 36(9): 1689-1692 (in Chinese). 陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析. 农业环境科学学报, 2017, 36(9): 1689-1692. |
| [4] |
Sun X, Li Z, Wu LH, et al. Root-induced soil acidification and cadmium mobilization in the rhizosphere of Sedum plumbizincicola: evidence from a high-resolution imaging study. Plant Soil, 2019, 436(1/2): 267-282. |
| [5] |
Peng JS, Yi HY, Gong JM. Isolation and characterization of cadmium tolerant gene SpMT2 in the hyperaccumulator Sedum plumbizincicola. Chin J Biotech, 2020, 36(3): 541-548 (in Chinese). 彭佳师, 易红英, 龚继明. 超积累植物伴矿景天镉耐受基因SpMT2的分离及功能鉴定. 生物工程学报, 2020, 36(3): 541-548. |
| [6] |
Li Z, Wu LH, Luo YM, et al. Changes in metal mobility assessed by EDTA kinetic extraction in three polluted soils after repeated phytoremediation using a cadmium/zinc hyperaccumulator. Chemosphere, 2018, 194: 432-440. DOI:10.1016/j.chemosphere.2017.12.005 |
| [7] |
Ma Y, Dickinson NM, Wong MH. Interactions between earthworms, trees, soil nutrition and metal mobility in amended Pb/Zn mine tailings from Guangdong, China. Soil Biol Biochem, 2003, 35(10): 1369-1379. DOI:10.1016/S0038-0717(03)00216-5 |
| [8] |
Bhargava A, Carmona FF, Bhargava M, et al. Approaches for enhanced phytoextraction of heavy metals. J Environ Manage, 2012, 105: 103-120. DOI:10.1016/j.jenvman.2012.04.002 |
| [9] |
Hu PJ, Li Z, Zhong DX, et al. Research progress on the phytoextraction of heavy metal contaminated soils in China. Plant Physiol J, 2014, 50(5): 577-584 (in Chinese). 胡鹏杰, 李柱, 钟道旭, 等. 我国土壤重金属污染植物吸取修复研究进展. 植物生理学报, 2014, 50(5): 577-584. |
| [10] |
Gao Y, Luo YM. Earthworms as bioindicators of soil pollution and their potential for remediation of contaminated soils. Acta Pedol Sin, 2005, 42(1): 140-148 (in Chinese). 高岩, 骆永明. 蚯蚓对土壤污染的指示作用及其强化修复的潜力. 土壤学报, 2005, 42(1): 140-148. DOI:10.3321/j.issn:0564-3929.2005.01.022 |
| [11] |
Blouin MHM, Delgado E, Baker G, et al. A review of earthworm impact on soil function and ecosystem services. Eur J Soil Sci, 2013, 64(2): 161-182. DOI:10.1111/ejss.12025 |
| [12] |
Edwards CA, Lofty JR. Effects of earthworm inoculation upon the root-growth of direct drilled cereals. J Appl Ecol, 1980, 17(3): 533-543. DOI:10.2307/2402635 |
| [13] |
Sizmur T, Watts M J, Brown GD, et al. Impact of gut passage and mucus secretion by the earthworm Lumbricus terrestris on mobility and speciation of arsenic in contaminated soil. J Hazard Mater, 2011, 197: 169-175. DOI:10.1016/j.jhazmat.2011.09.071 |
| [14] |
Sizmur T, Palumbo-Roe B, Watts MJ, et al. Impact of the earthworm Lumbricus terrestris (L.) on As, Cu, Pb and Zn mobility and speciation in contaminated soils. Environ Pollut, 2011, 159(3): 742-748. DOI:10.1016/j.envpol.2010.11.033 |
| [15] |
Sizmur T, Hodson ME. Do earthworms impact metal mobility and availability in soil? A review. Environ Pollut, 2009, 157(7): 1981-1989. DOI:10.1016/j.envpol.2009.02.029 |
| [16] |
Wang DD, LI HX, Wei ZG, et al. Effects of earthworm on Zn concentration and total-Zn uptake of ryegrass and Indian Mustard in Zn polluted soil. Soils, 2008, 40(1): 73-77 (in Chinese). 王丹丹, 李辉信, 魏正贵, 等. 蚯蚓对污染土壤中黑麦草和印度芥菜吸收累积锌的影响. 土壤, 2008, 40(1): 73-77. |
| [17] |
Zhang N, Liao Y, Sun FL, et al. Earthworm population characteristics in soils different in land use and their relationships with biological fertility of the soils. Acta Pedol Sin, 2012, 49(2): 364-372 (in Chinese). 张宁, 廖燕, 孙福来, 等. 不同土地利用方式下的蚯蚓种群特征及其与土壤生物肥力的关系. 土壤学报, 2012, 49(2): 364-372. |
| [18] |
van Groenigen JW, Lubbers IM, Vos HMJ, et al. Earthworms increase plant production: a meta-analysis. Sci Rep, 2014, 4: 6365. |
| [19] |
Xu HJ, Chen H, Wang XL, et al. Earthworms stimulate nitrogen transformation in an acidic soil under different Cd contamination. Ecotoxicol Environ Saf, 2018, 165: 564-572. DOI:10.1016/j.ecoenv.2018.09.042 |
| [20] |
He H, Zheng HB, Liu JX, et al. Progress and prospect of effect and mechanism of earthworm on the cycle of soil carbon and nitrogen. Chin Agric Sci Bull, 2014, 30(33): 120-126 (in Chinese). 贺慧, 郑华斌, 刘建霞, 等. 蚯蚓对土壤碳氮循环的影响及其作用机理研究进展. 中国农学通报, 2014, 30(33): 120-126. |
| [21] |
Jusselme MD, Miambi E, Mora P, et al. Increased lead availability and enzyme activities in root-adhering soil of Lantana camara during phytoextraction in the presence of earthworms. Sci Total Environ, 2013, 445: 101-109. |
| [22] |
Bai JF, Lin XG, Yin R, et al. Effects of earthworm on enzyme activities of soil polluted by different concentrations of arsenic. J Soil Sci, 2007, 38(5): 978-983 (in Chinese). 白建峰, 林先贵, 尹睿, 等. 蚯蚓对As污染土壤酶活性及其P养分的影响. 土壤通报, 2007, 38(5): 978-983. DOI:10.3321/j.issn:0564-3945.2007.05.031 |
| [23] |
Cao J, Wang C, Huang Y, et al. Effects of earthworm on soil microbes and biological fertility: a review. Chin J Appl Ecol, 2015, 26(5): 1579-1586 (in Chinese). 曹佳, 王冲, 皇彦, 等. 蚯蚓对土壤微生物及生物肥力的影响研究进展. 应用生态学报, 2015, 26(5): 1579-1586. |
| [24] |
Kaur P, Bali S, Sharma A, et al. Effect of earthworms on growth, photosynthetic efficiency and metal uptake in Brassica juncea L. plants grown in cadmium-polluted soils. Environ Sci Pollut Res, 2017, 24(15): 13452-13465. DOI:10.1007/s11356-017-8947-z |
| [25] |
Lemtiri A, Lienard A, Alabi T, et al. Earthworms Eisenia fetida affect the uptake of heavy metals by plants Vicia faba and Zea mays in metal-contaminated soils. Appl Soil Ecol, 2016, 104: 67-78. DOI:10.1016/j.apsoil.2015.11.021 |
| [26] |
Zhu XP, Zheng CX, Jia HT, et al. Effects of adding earthworms and straw into soil on cadmium accumulation in rape. Agric Res Arid Areas, 2011, 29(4): 105-108 (in Chinese). 朱新萍, 郑春霞, 贾宏涛, 等. 土壤中添加蚯蚓及秸秆对油菜积累镉的影响. 干旱地区农业研究, 2011, 29(4): 105-108. |
| [27] |
Li JT, Gurajala HK, Wu LH, et al. Hyperaccumulator plants from China: a synthesis of the current state of knowledge. Environ Sci Technol, 2018, 52(21): 11980-11994. DOI:10.1021/acs.est.8b01060 |
| [28] |
Peng JS, Ding G, Yi HY, et al. Cloning and functional analysis of phytochelatin synthase gene from Sedum plumbizincicola. Acta Phytophysiol Sin, 2014, 50(5): 625-633 (in Chinese). 彭佳师, 丁戈, 易红英, 等. 伴矿景天植物螯合肽合酶基因的克隆及功能分析. 植物生理学报, 2014, 50(5): 625-633. |
| [29] |
Li Z, Wu LH, Hu P, et al. Repeated phytoextraction of four metal-contaminated soils using the cadmium/zinc hyperaccumulator Sedum plumbizincicola. Environ Pollut, 2014, 189: 176-183. DOI:10.1016/j.envpol.2014.02.034 |
| [30] |
Wang LL, Zhou T, Li Z, et al. Effects of soil compaction on phytoextraction of cadmium and zinc polluted soils by Sedum plumbizincicola. Soils, 2017, 49(5): 951-957 (in Chinese). 王丽丽, 周通, 李柱, 等. 土壤紧实度对伴矿景天生长及镉锌吸收性的影响研究. 土壤, 2017, 49(5): 951-957. |
| [31] |
Wu GM, Hu PJ, Zhou JW, et al. Sulfur application combined with water management enhances phytoextraction rate and decreases rice cadmium uptake in a Sedum plumbizincicola - Oryza sativa rotation. Plant Soil, 2019, 440(1/2): 539-549. |
| [32] |
Zhou T, Wu LH, Christie P, et al. The efficiency of Cd phytoextraction by S. plumbizincicola increased with the addition of rice straw to polluted soils: The role of particulate organic matter. Plant Soil,, 2018, 429(1/2): 321-333. |
| [33] |
Deng L, Li Z, Wang J, et al. Long-term field phytoextraction of zinc/cadmium contaminated soil by Sedum plumbizincicola under different agronomic strategies. Int J Phytorem, 2016, 18(2): 134-140. DOI:10.1080/15226514.2015.1058328 |
| [34] |
Zhou B, Tang JL, Dai JJ, et al. Remediating effluent sludge with earthworms: changes in heavy metal speciation and associated. Acta Ecol Sin, 2015, 35(19): 6269-6279 (in Chinese). 周波, 唐晶磊, 代金君, 等. 蚯蚓作用下污泥重金属形态变化及其与化学生物学性质变化的关系. 生态学报, 2015, 35(19): 6269-6279. |
| [35] |
Cheng JM, Yu XZ. Roles of earthworm in phytoremediation of copper and cadmium contaminated soil. Chin J Appl Environ Biol, 2006(3): 352-355 (in Chinese). 成杰民, 俞协治. 蚯蚓在植物修复铜、镉污染土壤中的作用. 应用与环境生物学报, 2006(3): 352-355. DOI:10.3321/j.issn:1006-687X.2006.03.013 |
| [36] |
Agapit C, Gigon A, Puga-Freitas R, et al. Plant-earthworm interactions: influence of age and proportion of casts in the soil on plant growth, morphology and nitrogen uptake. Plant Soil, 2018, 424(1/2): 49-61. |
| [37] |
Cunha L, Brown GG, Stanton DWG, et al. Soil animals and pedogenesis: the role of earthworms in anthropogenic soils. Soil Sci, 2016, 181(3/4): 110-125. DOI:10.1097/SS.0000000000000144 |
| [38] |
Kavehei A, Hose GC, Gore DB. Effects of red earthworms (Eisenia fetida) on leachability of lead minerals in soil. Environ Pollut, 2018, 237: 851-857. DOI:10.1016/j.envpol.2017.11.021 |
| [39] |
Leveque T, Dumat C, Lagier L, et al. Influence of earthworm bioturbation on metals phytoavailability and human gastric bioaccessibility. Environ Sci Pollut Res, 2018, 26(20): 20052-20063. |
| [40] |
Ortiz-Ceballos AI, Pena-Cabriales JJ, Fragoso C, et al. Mycorrhizal colonization and nitrogen uptake by maize: combined effect of tropical earthworms and velvetbean mulch. Biol Fertil Soils, 2007, 44(1): 181-186. DOI:10.1007/s00374-007-0193-y |
| [41] |
Agapit C, Gigon A, Puga-Freitas R, et al. Plant-earthworm interactions: influence of age and proportion of casts in the soil on plant growth, morphology and nitrogen uptake. Plant Soil, 2018, 424(1/2): 49-61. |
| [42] |
Patron JC, Sanchez P, Brown GC, et al. Phosphorus in soil and Brachiaria decumbens plants as affected by the geophagous earthworm Pontoscolex corethrurus and P fertilization. Pedobiologia, 1999, 43(6): 547-556. |
| [43] |
Yang W, Wang DS, Liu MQ, et al. Vermicomposting of different organic materials and three-dimensional excitation emission matrix fluorescence spectroscopic characterization of their dissolved organic matter. J Appl Ecol, 2015, 26(10): 3181-3188. |
| [44] |
Lavelle P. Earthworm activities and the soil system. Biol Fertil Soils, 1988, 6(3): 237-251. |
| [45] |
Agapit C, Gigon A, Blouin M. Earthworm effect on root morphology in a split root system. Plant Biosyst, 2018, 152(4): 780-786. DOI:10.1080/11263504.2017.1338627 |
| [46] |
Springett J, Gray R. The interaction between plant roots and earthworm burrows in pasture. Soil Biol Biochem, 1997, 29(3/4): 621-525. |
| [47] |
Hoang DTT, Razavi BS, Kuzyakov Y, et al. Earthworm burrows: Kinetics and spatial distribution of enzymes of C-, N- and P- cycles. Soil Biol Biochem, 2016, 99: 94-103. DOI:10.1016/j.soilbio.2016.04.021 |
| [48] |
Bottinelli N, Zhou H, Capowiez Y, et al. Earthworm burrowing activity of two non-Lumbricidae earthworm species incubated in soils with contrasting organic carbon content (Vertisol vs. Ultisol). Biol Fertil Soils, 2017, 53(8): 951-955. DOI:10.1007/s00374-017-1235-8 |
 2020, Vol. 36
2020, Vol. 36




