中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王义春, 王龑, 江均平, 赵月菊, 邢福国, 周露
- Wang Yichun, Wang Yan, Jiang Junping, Zhao Yueju, Xing Fuguo, Zhou Lu
- 玉米赤霉烯酮降解酶多拷贝毕赤酵母菌株的构建及高效表达
- High expression of zearalenone degrading enzyme in Pichia pastoris
- 生物工程学报, 2020, 36(2): 372-380
- Chinese Journal of Biotechnology, 2020, 36(2): 372-380
- 10.13345/j.cjb.190150
-
文章历史
- Received: April 20, 2019
- Accepted: August 23, 2019
玉米赤霉烯酮(Zearalenone,ZEN),为2, 4-二羟基苯甲酸内酯类化合物,主要由禾谷镰刀菌产生的一种霉菌毒素。ZEN具有雌激素活性,对生殖发育系统有毒害作用。摄入ZEN超标的母猪会出现外阴和乳腺肿大甚至阴道及直肠脱垂的症状[1]。ZEN有致癌性,能导致DNA收敛、染色体断裂[2],还可能通过雌激素受体通路和抑制凋亡促进人神经母细胞瘤SK-N-SH细胞的体外增殖[3]。Yang等[4]研究发现ZEN能导致老鼠变态精子数增加、精子的活力下降,同时受孕降低。梁梓森等[5]研究证明ZEN有血液毒性,可导致小鼠淋巴细胞明显减少(P < 0.05),白细胞及其他各组分细胞升高,血小板数量明显减少。
目前ZEN的降解方法主要有物理法(高压加热[6]、辐照[7]、吸附剂吸附[8])、化学法(臭氧、双氧水和碳酸钠处理[9-11])和生物法(微生物菌体吸附、酶降解)。传统物理化学方法有一定的局限性,如破坏营养物质、引入化学物质造成再次污染等。生物学方法具有反应条件温和、无化学试剂残留等优点,受到了人们的广泛关注。近年来,随着生物技术的发展,ZEN的生物降解有了一定进展。许多能降解ZEN的菌被分离发现,其中一些关键酶的基因已被克隆表达。来自粉红黏帚霉Gliocladium roseum的ZEN降解酶基因zhd101、zlhy-6、ZEN-jjm被成功克隆表达,重组蛋白均表现出较强的水解ZEN的能力[12-18],粗糙脉孢Neurospora crassa ZEN水解酶基因(ZNC)也获得了较高表达[19]。柴成梁等[20]分离到一种高比活玉米赤霉烯酮降解酶ZHD795,其比活是粉红黏帚霉ZEN降解酶的2.5倍。将ZEN降解酶基因转入玉米也有降解ZEN的活性[21]。另外,不动杆菌过氧化物酶也具有降解ZEN的能力[22]。但总的说来,玉米赤霉烯酮降解酶发酵水平还不高,还需要进一步提高产酶水平降低生产成本。
毕赤酵母表达系统是目前使用最多、最广泛的生产外源蛋白的工具之一[23],其表达载体pAO815能体外构建多拷贝质粒,可以方便获得多拷贝菌株。据报道粉红黏帚霉降解酶的最适反应温度为37 ℃,最适反应pH值为8.5,在50 ℃以下稳定,并对酸性环境有一定耐受能力,对玉米醪中的ZEN的降解率达72.70%,具有潜在的实用价值[24]。本研究对该酶的密码子进行优化,体外构建多拷贝表达载体,以期获得高效表达菌株。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株E. coli TOP10感受态细胞,购自北京全式金生物技术有限公司;pAO815质粒、Pichia pastoris GS115菌株由本实验室保存。
1.1.2 试剂限制性内切酶(EcoR Ⅰ、Bgl Ⅱ、BamH Ⅰ、Sal Ⅰ)、Pfu DNA聚合酶、T4 DNA连接酶等购自日本TaKaRa公司;小牛肠碱性磷酸酶(CIP)购自NEB公司;PCR产物纯化试剂盒、DNA胶回收试剂盒购自北京三博远志公司;YNB购自BD公司;D-山梨醇、ZEN标准品购自Sigma公司;玉米碴购自超市发;乙腈、甲醇(色谱级)购自美国Fisher公司;其他分析纯试剂购自国药集团化学试剂有限公司。
1.1.3 仪器与器材紫外凝胶成像仪,美国Alpha Innotech公司;凝胶电泳仪,北京百晶生物技术有限公司;高速冷冻离心机,德国Eppendorf公司;PCR扩增仪,日本TaKaRa公司;高效液相色谱仪,美国Waters公司;C18液相色谱柱,美国Agilent公司;电击转化仪,美国BTX公司;恒温振荡摇床,上海智诚公司。
1.2 方法 1.2.1 表达载体的构建单拷贝表达载体构建:编码粉红黏帚霉G. roseum玉米赤霉烯酮降解酶基因zlhy-6 (NCBI GenBank登录号:HQ825318)按P. pastoris酵母偏好密码子优化,和α信号肽编码序列整体(α-zlhy-6)化学合成,并在α-zlhy-6片段5′-、3′-端分别引入MfeⅠ、EcoRⅠ酶切位点。pAO815质粒用EcoRⅠ酶切、CIP去磷酸化,含α-zlhy-6片段的质粒用MfeⅠ/ EcoRⅠ酶切,电泳回收基因片段,基因片段和载体按摩尔比3:1–5:1用T4 DNA连接酶连接,转化大肠杆菌TOP10感受态,用氨苄青霉素筛选阳性克隆,测序,选择插入方向正确的pAO815- α-zlhy-6表达载体。
多拷贝表达载体的构建:以质粒pAO-α-zlhy-6为模板,用引物(GGAagatctAACATCCAAAGACG/ TAggatccGCACAAACGAAC,小写字体为引入的Bgl Ⅱ和BamHⅠ酶切位点) PCR扩增得到完整表达框5′AOX-α-zlhy-6-3′AOX-TT3′;PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸60 s,共35个循环;最后72 ℃延伸7 min。用试剂盒纯化回收扩增产物,连接到pGM-T载体,测序,获得正确的pGM-5′AOX-α-zlhy-6-3′AOX- TT3′质粒。该质粒经Bgl Ⅱ、BamH Ⅰ双酶切,回收表达框,与经BamHⅠ酶切、CIP去磷酸化的pAO-α-zlhy-6质粒酶连,得到含2个表达盒的pAO-(α-zlhy-6)2表达载体。获得的2拷贝表达载体再与2拷贝表达框进行酶切、酶连、转化,如此反复制备4拷贝、6拷贝的表达载体。
1.2.2 玉米赤霉烯酮降解酶重组酵母菌株的构建及鉴定毕赤酵母GS115感受态的制备及电击转化按文献[25]进行。表达载体用SalⅠ线性化,电击转化感受态,取20 µL复苏培养菌液涂布MD平板,30 ℃倒置培养3–5 d,随机从MD平板上挑取5个单菌落,分别接入5 mL BMGY培养基中,30 ℃、250 r/min培养36 h,500×g室温离心5 min收集菌体。菌体用2 mL BMMY培养基重悬,30 ℃、250 r/min诱导培养5 d,期间每隔24 h补加甲醇至0.5%,培养结束后,12 000×g离心5 min收集上清液,用SDS-PAGE分析表达蛋白,采用串联质谱(MS-MS)分析表达蛋白的分子量。
为比较不同拷贝转化子的蛋白表达量,用相同菌密度的转化子在同体积的BMMY培养基中诱导培养,设3个重复。取15 µL发酵上清液进行SDS-PAGE,利用凝胶图像分析软件BandScan 5.0分析蛋白带的总灰度,以相对灰度值表示,将1拷贝转化子的重组蛋白灰度值设为100。
1.2.3 重组菌诱导时间对蛋白表达的影响将成功表达重组蛋白的酵母菌株于50 mL BMGY培养基中,30 ℃、250 r/min培养OD600至2–6,8 000 r/min离心5 min收集菌体,将菌体转移至BMMY培养基中,以相同的菌密度,30 ℃、250 r/min诱导培养5 d,期间每隔24 h取样,并补加甲醇至终浓度0.5%,实验设3个重复。取15 µL样品进行SDS-PAGE,利用凝胶图像分析软件BandScan 5.0对重组蛋白的总灰度进行分析,以相对灰度值表示,诱导培养1 d的蛋白的灰度值设为100。
1.2.4 发酵pH、甲醇添加量、接种量对重组菌表达效果的影响参照1.2.3培养方法,考察诱导pH (将诱导培养基的初始pH分别调至3.0、4.0、5.0、6.0、7.0、8.0,并在培养过程中添加少量酸碱使发酵液pH基本保持不变)、甲醇添加量(甲醇体积分数为0.6%、0.8%、1.0%、1.2%、1.6%的诱导培养基上进行培养,每24 h分别补甲醇至初始浓度)、接种量(初始接种量分别设为2%、4%、6%、8%、10%)对蛋白表达的影响。不同条件下培养3 d后收集上清液,取15 µL样品进行SDS-PAGE,比较不同条件下上清液中的蛋白量。
1.2.5 重组蛋白ZEN降解活性测定发酵上清液40 µL、0.5 mg/mL ZEN 40 µL、0.05 mol/L Tris-HCl (pH 7.5) 920 µL,混匀,37 ℃反应30 min[15],加入等体积甲醇终止反应,HPLC检测ZEN残留量。酶活力定义:在上述条件下,每毫升发酵液每分钟降解1 μg ZEN为1个活力单位(U)。在相同反应体系下,测定0、30、60、120 min时ZEN的降解率。
1.2.6 玉米碴中ZEN的降解向玉米碴中添加ZEN使其含量为2 mg/kg,用缓冲液将酶液分别稀释2、5、10倍,按照发酵液与玉米碴(V:W) 1:1的比例混合均匀(即酶液添加量分别为0.1、0.2、0.5 mL/g),37 ℃反应0、3、6、12、24 h,不加酶液作为对照。按照国标GB/T 23504-2009[26]提取样品中的ZEN,HPLC检测ZEN的残留量。
1.2.7 ZEN的HPLC检测条件高效液相色谱采用C18色谱柱(4.6 mm× 150 mm,5 μm)、荧光检测器2475型,柱温30 ℃,流动相为乙腈-水(60:40,V:V),流速1.0 mL/min,进样体积20 µL,激发波长274 nm,发射波长440 nm。
1.2.8 数据分析采用DPS3.01数据处理系统对实验测得的数据进行方差分析。
2 结果与分析 2.1 基因密码子优化zlhy-6基因按P. pastoris偏好密码子优化,GC含量为49.9%,密码子适应指数(CAI)为0.81,和α信号肽编码序列整体(α-zlhy-6)化学合成(图 1)。

|
| 图 1 zlhy-6基因优化序列 Fig. 1 The optimized gene zlhy-6. The capitals: the optimized gene zlhy-6; the lowercase letters: the gene of α signal peptide. |
| |
将合成的α-zlhy-6片段质粒用MfeⅠ/EcoRⅠ酶切,电泳回收基因片段;pAO815质粒用EcoRⅠ酶切、CIP去磷酸化,将基因片段和载体按摩尔比3:1–5:1用T4 DNA连接酶连接,转化大肠杆菌TOP10感受态,提取质粒,测序,获得插入方向正确的pAO815-α-zlhy-6表达载体(图 2)。

|
| 图 2 多拷贝表达载体酶切电泳分析图 Fig. 2 Analysis of constructed plasmids with restriction endonucleases. (A) Hydrolyzed by BamHⅠ. (B) Hydrolyzed by Bgl Ⅱ/BamH Ⅱ. M: DNA marker; 1: pAO815; 2–5: pAO-α-zlhy-6, pAO-(α-zlhy-6)2, pAO-(α-zlhy-6)4, pAO- (α-zlhy-6)6; arrow: expression cassettes. |
| |
将连接到pGM-T上的表达框用BamHⅠ与Bgl Ⅱ双酶切回收,与表达质粒pAO-α-zlhy-6连接,转化,获得2拷贝表达载体pAO-(α-zlhy-6)2;再将2拷贝表达载体用BamHⅠ/BglⅡ双酶切,回收2拷贝表达框,与2拷贝表达框骨架酶连,得到4拷贝表达载体pAO-(α-zlhy-6)4;再将2拷贝表达框与4拷贝表达载体骨架酶连,得到6拷贝表达载体pAO-(α-zlhy-6)6。空载体、1拷贝、2拷贝、4拷贝、6拷贝表达载体分别为7.8 kb、8.8 kb、11.1 kb、15.8 kb、20.5 kb,经BamHⅠ酶切电泳结果如图 2A所示,随拷贝数的增加其分子量递增,Bgl Ⅱ/ BamHⅠ双酶切结果如图 2B所示,1拷贝质粒产生约4.0 kb (含组氨酸编码序列)、2.4 kb (含抗氨苄青霉素编码序列)及2.35 kb (单拷贝表达框5′AOX-α-zlhy-6-3′AOX-TT3′) 3个片段(单拷贝表达框与抗氨苄序列大小相当,电泳分不开,两片段重叠),2、4、6拷贝重组质粒分别出现4.7 kb、9.4 kb和14.1 kb的片段,表明多拷贝表达盒表达载体构建成功。
2.4 玉米赤霉烯酮降解酶重组酵母菌株的构建及鉴定将表达质粒用SalⅠ线性化,电击转化P. pastoris GS 115感受态细胞,从MD筛选平板上随机挑取5个转化子用BMMY培养基培养,用0.5%甲醇诱导5 d,用SDS-PAGE分析发酵上清液蛋白表达情况。结果表明1–6拷贝重组菌在分子量30 kDa附近均有一条蛋白带,而空载体pAO815重组酵母菌株无目标带(图 3)。经MS-MS分析,该蛋白的分子量为28.9 kDa,与理论分子量(28.92 kDa)一致,说明1–6拷贝玉米赤霉烯酮降解酶重组酵母菌构建成功。
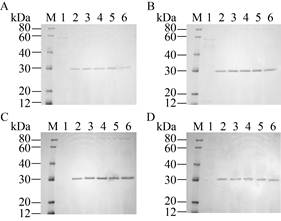
|
| 图 3 重组酵母的筛选 Fig. 3 Selection of recombinant GS115 transformants. (A–D) Harboring pAO-α-zlhy-6, pAO-(α-zlhy-6)2, pAO-(α-zlhy-6)4, pAO-(α-zlhy-6)6. M: protein marker; 1: transformant with pAO815; 2–6: fermentation for 1–5 days. |
| |
从不同拷贝数的转化子中各选出1株表达量高的菌株,采用相同菌浓度用BMMY培养基30 ℃、250 r/min诱导培养3 d (每24 h补加0.5%甲醇),用SDS-PAGE分析上清液中的蛋白。结果表明4拷贝菌株表达量最高,约为单拷贝转化子的3.4倍(图 4)。

|
| 图 4 拷贝数对蛋白表达水平的影响 Fig. 4 Effect of gene copies on protein expression level. (A) SDS-PAGE of supernatant of transformant haboring different gene copies. (B) Gray value of protein band. 1–4: pAO-α-zlhy-6, pAO-(α-zlhy-6)2, pAO-(α-zlhy-6)4, pAO-(α-zlhy-6)6. |
| |
取4拷贝的重组菌用BMMY培养基30 ℃、250 r/min诱导培养5 d,每24 h补加0.5%甲醇,24 h即产生可观的蛋白,第3天表达量达到最高(灰度值达142.43%),此后,重组蛋白又逐渐降低,第5天降至122.49% (图 5),结果表明最佳培养时间为3 d,超过3 d重组蛋白会发生降解。

|
| 图 5 诱导时间对重组菌株蛋白表达的影响 Fig. 5 Expression time-course of protein in P. pastoris. (A) SDS-PAGE of supernatant of transformant. (B) Gray value of protein band. M: protein marker; ck: pAO815; 1–5: fermentation for 1–5 days. |
| |
pH、甲醇添加量、接种量对4拷贝重组菌蛋白表达效果的影响如图 6所示。当pH为4.5–5.0时,蛋白表达量较高,而在其他pH条件下,表达量很低甚至几乎不表达。甲醇浓度在0.6%–1.2%时,蛋白均能得到较高的表达量,其中0.8%的甲醇浓度最佳。接种量在2%–10%范围时,随着接种量的增加表达量有所增加,当接种量达到10%时,表达量最高。

|
| 图 6 pH、甲醇添加量及接种量对蛋白表达量的影响 Fig. 6 Effect of pH, methanol and inoculation amount on protein expression. |
| |
重组菌酵母菌株经诱导培养3 d,1拷贝、2拷贝、4拷贝、6拷贝转化子发酵上清液ZEN降解活性分别为3.0、6.0、10、6.0 U/mL,结果与转化子的蛋白表达量一致(图 4)。酶解时间曲线表明反应1 h体系中ZEN降解99%以上,而空质粒对照菌株的发酵液无ZEN降解(图 7)。刘海燕等[15]在检测重组酶活性时,在1 mL反应体系中添加980 µL上清液(ZEN终浓度20 µg/mL),反应2 h ZEN明显降解;在相同条件下,本研究只添加了2/49的发酵上清液,作用1 h ZEN就被有效降解,表明本研究所构建的多拷贝菌株发酵液酶活性大约是他们报道[15]的49倍。
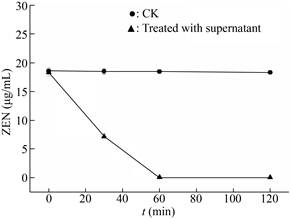
|
| 图 7 重组菌发酵上清液降解ZEN时间进程 Fig. 7 Time course of ZEN hydrolyzed by recombinant enzyme. |
| |
不少酶制剂作为添加剂应用于食品、饲料中,如溶菌酶、植酸酶等。但是ZEN降解酶在食品饲料中应用的报道还较少,因此本试验用酶发酵液对含ZEN (2 mg/kg)的玉米碴进行处理,初步考察其在饲料中的降解效果。玉米碴中酶液的添加量分别设为0.1、0.2和0.5 mL/g。结果如图 8所示,随着时间延长,样品中ZEN含量逐渐降低,反应前6 h降解速率较快,6 h以后降解速率趋于平缓。酶的添加量越高降解速率越快,降解率也越高。当酶的添加量为0.1 mL/g时,反应6 h,ZEN的降解率仅为14.28%,反应24 h后,ZEN的降解率为44.08%。当酶的添加量为0.5 mL/g时,处理6 h,ZEN的降解率即达到64.29%,处理24 h,玉米碴中ZEN的降解率为75.51%。数据表明,该酶对玉米碴中ZEN有较好的降解效果。
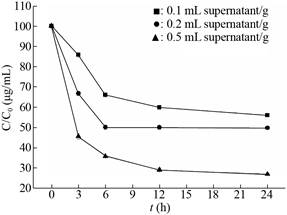
|
| 图 8 玉米碴中ZEN降解时间进程 Fig. 8 Time course of ZEN in corn hydrolyzed by recombinant enzyme. |
| |
本试验对玉米赤霉烯酮降解酶基因序列zlhy-6按照毕赤酵母密码子偏好性进行优化,与α-信号肽编码序列整体合成,并用pAO815质粒构建了多拷贝表达载体,将其电击转入毕赤酵母GS115菌株,获得ZEN降解酶高效分泌表达重组菌。重组蛋白分子量为28.9 kDa,与理论值一致。重组菌诱导发酵3 d,蛋白带浓度达最高,之后下降;在pH 5.0、4.5条件下诱导培养,表达量最高,其他pH表达量很少;每天添加0.8%的甲醇、接种量10%表达水平最高;4拷贝的转化子蛋白表达水平最高,发酵3 d,酶活性达到10 U/mL,约是文献[15]报道的49倍。在1 g玉米碴中添加0.1– 0.5 mL发酵上清液,水解24 h,ZEN的降解率为44.08%–75.51%。
本研究结果为提高ZEN降解酶工业发酵水平及酶的应用奠定了一定基础,也为该酶用于降解食品饲料中的ZEN提供一定的理论参考。但是,该酶的最适作用pH为8.5,最适反应温度为37 ℃[25],而食品、饲料的pH一般为中性偏酸性,消化道中的pH更低,此外,该酶不耐热,在生产和应用时酶活性会降低,所以,有必要通过一定手段,如定点突变、定向进化、结构延伸突变、糖基化修饰及杂合酶等方法降低酶的最适pH、提高酶的热稳定性,从而改善酶的性质,促进ZEN降解酶在食品、饲料中的应用。
| [1] |
He QH, Xu Y. Advance in study on zearalenone's toxicity and determination. J Hyg Res, 2005, 34(4): 502-504 (in Chinese). 何庆华, 许杨. 玉米赤霉烯酮毒性研究及检测方法进展. 卫生研究, 2005, 34(4): 502-504. DOI:10.3969/j.issn.1000-8020.2005.04.046 |
| [2] |
Kouadio JH, Dano SD, Moukha S, et al. Effects of combinations of Fusarium mycotoxins on the inhibition of macromolecular synthesis, malondialdehyde levels, DNA methylation and fragmentation, and viability in Caco-2 cells. Toxicon, 2007, 49(3): 306-317. DOI:10.1016/j.toxicon.2006.09.029 |
| [3] |
Zheng JC, Xiao XM, Zheng S, et al. Effects of zearalenone on the proliferation of SK-N-SH human neuroblastoma cells. Chin J Prev Med, 2007, 41(4): 295-298 (in Chinese). 郑继翠, 肖现民, 郑珊, 等. 玉米赤霉烯酮对SK-N-SH人神经母细胞瘤细胞增殖的影响. 中华预防医学杂志, 2007, 41(4): 295-298. DOI:10.3760/j:issn:0253-9624.2007.04.013 |
| [4] |
Yang JY, Wang GX, Liu JL, et al. Toxic effects of zearalenone and its derivatives α-zearalenol on male reproductive system in mice. Reprod Toxicol, 2007, 24(3/4): 381-387. |
| [5] |
Liang ZS, Liu CY, Ma YJ, et al. Effects of zearalenone on hematological and biochemical parameters in mice. Progr Vet Med, 2010, 31(5): 79-82 (in Chinese). 梁梓森, 刘长永, 马勇江, 等. 玉米赤霉烯酮对小鼠血常规及血液生化指标的影响. 动物医学进展, 2010, 31(5): 79-82. DOI:10.3969/j.issn.1007-5038.2010.05.019 |
| [6] |
Bullerman LB, Bianchini A. Stability of mycotoxins during food processing. Int J Food Microbiol, 2007, 119(1/2): 140-146. |
| [7] |
Aziz NH, El-Far FM, Shahin AAM, et al. Control of Fusarium moulds and fumonisin Bl in seeds by gamma-irradiation. Food Control, 2007, 18(11): 1337-1342. DOI:10.1016/j.foodcont.2005.12.013 |
| [8] |
Afriyie-Gyawu E, Wiles MC, Huebner HJ, et al. Prevention of zearalenone-induced hyperestrogenism in prepubertal mice. J Toxicol Environ Health, Part A, 2005, 68(5): 353-368. DOI:10.1080/15287390590900822 |
| [9] |
McKenzie KS, Sarr AB, Mayura K, et al. Oxidative degradation and detoxification of mycotoxins using a novel source of ozone. Food Chem Toxicel, 1997, 35(8): 807-820. DOI:10.1016/S0278-6915(97)00052-5 |
| [10] |
Abd Alla SAM. Zearalenone: Incidence, toxigenic fungi and chemical decontamination in Egyptian cereals. Nahrung, 1996, 41(6): 362-365. |
| [11] |
Trenholm HL, Charmley LL, Prelusky DB, et al. Washing procedures using water or sodium carbonate solutions for the decontamination of three cereals contaminated with deoxynivalenol and zearalenone. J Agric Food Chem, 1992, 40(11): 2147-2151. DOI:10.1021/jf00023a021 |
| [12] |
Takahashi-Ando N, Ohsato S, Shibata T, et al. Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene from Clonostachys rosea. Appl Environ Microbiol, 2004, 70(6): 3239-3245. DOI:10.1128/AEM.70.6.3239-3245.2004 |
| [13] |
Kakeya H, Takahashi-Ando N, Kimura M, et al. Biotransformation of the mycotoxin, zearalenone, to a non-estrogenic compound by a fungal strain of Clonostachys sp. Biosci Biotechnol Biochem, 2002, 66(12): 2723-2726. DOI:10.1271/bbb.66.2723 |
| [14] |
Cheng BC, Shi WT, Luo J, et al. Cloning of zearalenone-degraded enzyme gene (ZEN-jjm) and its expression and activity analysis. J Agric Biotechnol, 2010, 18(2): 225-230 (in Chinese). 程波财, 史文婷, 罗洁, 等. 玉米赤霉烯酮降解酶基因(ZEN-jjm)的克隆、表达及活性分析. 农业生物技术学报, 2010, 18(2): 225-230. DOI:10.3969/j.issn.1674-7968.2010.02.004 |
| [15] |
Liu HY, Sun CP, Wu SL, et al. Expression of zearalenone degrading enzyme gene from gliocladium roseum in Pichia pastoris GS115. J Chin Cereals Oils Assoc, 2011, 26(5): 12-17 (in Chinese). 刘海燕, 孙长坡, 伍松陵, 等. 玉米赤霉烯酮毒素降解酶基因的克隆及在毕赤酵母中的高效表达. 中国粮油学报, 2011, 26(5): 12-17. |
| [16] |
Tan QL, Xu F, Li P, et al. Construction of an ZEN-jjm expressing vector and its expression in Pichia pastoris. Chin J Microecol, 2010, 22(12): 1061-1064 (in Chinese). 谭强来, 徐锋, 黎鹏, 等. 玉米赤霉烯酮降解酶毕赤酵母表达载体的构建及其表达. 中国微生态学杂志, 2010, 22(12): 1061-1064. |
| [17] |
Wang RF, Zhou JG, Hu XJ, et al. Expression of ZHD1O1 in Kluyveromyces marxianus and the mutation breeding of high-field strain. J Fudan Univ: Nat Sci, 2017, 56(4): 431-437 (in Chinese). 王壬丰, 周峻岗, 胡小健, 等. 玉米赤霉烯酮降解酶在马克斯克鲁维酵母中的表达及高产菌株的诱变筛选. 复旦学报:自然科学版, 2017, 56(4): 431-437. |
| [18] |
La X, Wang QH, Zhou YL, et al. High-level expression of a ZEN-detoxifying gene by codon optimization and biobrick in Pichia pastori. Microbiol Res, 2016, 193: 48-56. DOI:10.1016/j.micres.2016.09.004 |
| [19] |
Bi K, Zhang W, Xiao ZZ, et al. Characterization, expression and application of a zearalenone degrading enzyme from Neurospora crassa. AMB Expr, 2018, 8(1): 194. DOI:10.1186/s13568-018-0723-z |
| [20] |
Chai CL, Chang XJ, Wang NX, et al. Cloning of ZEN-degrading enzyme ZHD795 and study on degradation activity. J Food Sci Technol, 2018, 36(6): 28-32 (in Chinese). 柴成梁, 常晓娇, 王楠希, 等. 玉米赤霉烯酮降解酶ZHD795编码基因克隆及降解活性研究. 食品科学技术学报, 2018, 36(6): 28-32. |
| [21] |
Igawa T, Takahashi-Ando N, Ochiai N, et al. Reduced contamination by the Fusarium mycotoxin zearalenone in maize kernels through genetic modification with a detoxification gene. Appl Environ Microbiol, 2007, 73(5): 1622-1629. DOI:10.1128/AEM.01077-06 |
| [22] |
Tang YQ, Xiao JM, Chen Y, et al. Secretory expression and characterization of a novel peroxiredoxin for zearalenone detoxification in Saccharomyces cerevisiae. Microbiol Res, 2013, 168(1): 6-11. DOI:10.1016/j.micres.2012.08.002 |
| [23] |
Damasceno LM, Huang CJ, Batt CA. Protein secretion in Pichia pastoris and advances in protein production. Appl Microbiol Biotechnol, 2012, 93(1): 31-39. DOI:10.1007/s00253-011-3654-z |
| [24] |
Hao XL. Fermentation optimization and application of zearalenone-degrading engineering strain[D]. Zhengzhou: Henan University of Technology, 2013 (in Chinese). 郝小龙.玉米赤霉烯酮降解工程菌的发酵优化及其应用[D].郑州: 河南工业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10463-1014117402.htm |
| [25] |
Wu SX, Letchworth GL. High efficiency transformation by electroporation of Pichia pastoris pretreated with lithium acetate and dithiothreitol. Biotechniques, 2004, 36(1): 151-154. |
| [26] |
Zhang HZ, Dong JJ, Lv N, et al. Determination of zearalenone in foods by immunoaffinity chromatography purification high performance liquid chromatography. GB/T 23504-2009. Issuance Department: National Standardization Management Committee, General Administration of Quality Supervision, Inspection and Quarantine, 2009 (in Chinese). 张辉珍, 董建军, 吕宁, 等. GB/T 23504-2009食品中玉米赤霉烯酮的测定免疫亲和层析净化高效液相色谱法.颁发部门: 国家标准化管理委员会, 国家质量监督检验检疫总局, 2009. |
 2020, Vol. 36
2020, Vol. 36




