中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张露露, 李晶哲, 马琰岩, 尚腾飞, 王子依, 刘长振
- Zhang Lulu, Li Jingzhe, Ma Yanyan, Shang Tengfei, Wang Ziyi, Liu Changzhen
- IL-6/STAT3报告基因系统的构建及抑制IL-6/STAT3信号通路的中药单体的筛选及验证
- Construction of IL-6/STAT3 reporter gene system for screening and validation of traditional Chinese medicine monomers inhibiting IL-6/STAT3 signaling pathway
- 生物工程学报, 2020, 36(2): 353-361
- Chinese Journal of Biotechnology, 2020, 36(2): 353-361
- 10.13345/j.cjb.190413
-
文章历史
- Received: September 16, 2019
- Accepted: December 18, 2019
信号转导和转录激活因子3 (STAT3)是STATs转录因子家族的一个重要成员。它将细胞因子和生长因子的多种信号从细胞膜传递到细胞核,在免疫、炎症、细胞自噬以及肿瘤形成等多种生理病理过程中发挥重要的调控作用[1]。STAT3通过调控下游基因、表观遗传机制、影响线粒体功能及肿瘤细胞干性等途径调节细胞增殖、细胞周期进程、细胞凋亡、血管生成、免疫逃逸等影响肿瘤的发生发展[2-3]。白细胞介素-6 (IL-6)是一种嗜神经细胞因子,主要参与免疫和炎症反应的调节。研究发现,IL-6广泛表达于各种恶性肿瘤包括前列腺、乳腺、肺癌和胶质母细胞瘤等肿瘤细胞中,并被认为是调节肿瘤周围炎症微环境的关键细胞因子[4]。有研究表明,IL-6参与了多种生物过程,如增殖、凋亡、存活以及入侵等,促进肿瘤的恶性进展[5]。IL-6可激活STAT3[6],IL-6的刺激促进STAT3的Tyr-705和Ser-727位点的磷酸化,从而促使STAT3形成同型或异型二聚体转移到细胞核内,并作为转录激活剂调节下游相关基因的表达,其中包含STAT3介导的许多与肿瘤细胞存活相关的基因如Bcl-2、Bcl-xl等的表达[7-8],促进肿瘤细胞的存活,同时可诱导肿瘤组织内调节性T细胞中多种细胞因子、生长因子和血管生成因子的表达,进一步激活IL-6/STAT3通路,因此在肿瘤微环境中肿瘤细胞和免疫细胞之间建立了正反馈回路[9-10]。
现有研究表明,肺癌、乳腺癌、结肠癌、子宫内膜癌等许多人类恶性肿瘤中存在STAT3的过度表达和/或组成型激活[11-12]。通过抑制IL-6/STAT3信号通路来抑制肿瘤的生长和恶化已成为有效的抗癌手段[13]。目前已有很多中药单体通过抑制IL-6/STAT3信号通路发挥抗癌作用的相关报道:研究表明槲皮素是T98G和U87胶质母细胞瘤细胞中IL-6/STAT3信号通路的有效抑制剂[14];马钱子碱可通过调节IL-6/STAT3通路,使得结肠癌SW480细胞的STAT3磷酸化激活受到抑制,从而发挥抗肿瘤作用[15];淫羊藿素主要通过抑制白细胞介素-6/JAK2/STAT3信号传导来介导抗多发性骨髓瘤活性[16];雷公藤内酯醇可通过阻断IL-6-JAK/STAT3途径阻断细胞增殖、减少炎症及防止肿瘤的形成[17];汉黄芩素可通过阻断IL-6/STAT3信号抑制肿瘤细胞在炎症微环境中的迁移[18]。因此,IL-6/STAT3在肿瘤防治方面有着重要的作用,是抗癌药物发现的有力靶标。
报告基因(Reporter gene)是一种能够编码特定蛋白或酶的基因。该基因序列可以与基因表达调节序列相融合,或与其他目的基因序列相连接形成新的基因序列,进而通过检测该报告基因产物的表达水平来定性或定量反映目的基因的表达情况。本实验室通过前期研究,选定NanoLuc (NLuc)作为报告基因并构建多种转录因子报告基因系统来开展转录因子活性检测的研究工作[19]。NLuc是一种人工改造的荧光素酶,其酶活性强,分子量小(19.1 kDa),热稳定性高,发光持续时间长,没有翻译后修饰或二硫键;与萤火虫荧光素酶(Fluc)或海肾萤光素酶(Rluc)等传统荧光素酶相比,其发光强度强100倍,且不依赖ATP[20]。故以Nluc作为报告基因构建的转录因子活化状态检测体系具有灵敏度高、重复性好等特点。在本研究中,我们期望通过对现有逆转录病毒载体进行改造,构建一种含有STAT3增强子序列和NLuc报告基因序列的新表达载体,并进一步构建受IL-6/STAT3信号通路调控的稳定表达NLuc荧光素酶的细胞系。该细胞系可用于STAT3活化状态定量检测和与IL-6/STAT3信号通路相关药物的筛选。在此基础上,我们开展了一系列中药单体对IL-6/STAT3信号通路抑制作用的筛选和验证工作,期望发掘出可抑制IL-6/STAT3信号通路的新中药单体。
1 材料与方法 1.1 材料与仪器 1.1.1 菌株、细胞株及质粒感受态大肠杆菌Escherichia coli DH5α购自天根生化科技(北京)有限公司;小鼠单核巨噬细胞Raw264.7由本实验室保存、人胚肾上皮包装细胞GP2-293;STAT3增强子序列由北京普尔普乐生物科技合成;Bcl-2引物序列、Bcl-x引物序列及GADPH引物序列(表 1)由生工生物工程(上海)股份有限公司合成。
| mRNA | Primer | Sequences (5′–3′) |
| mBcl-2 | Forward | ACTTCTCTCGTCGCTACCGTCGTG |
| Reverse | TGTTGACGCTCTCCACACACATGAC | |
| mBcl-x | Forward | ACCGGAGAGCGTTCAGTGATCTAAC |
| Reverse | CTTGCAATCCGACTCACCAATACC | |
| mβ-Actin | Forward | TGCTGTCCCTGTATGCCTCTGG |
| Reverse | TTCCCTCTCAGCTGTGGTGGTG |
371型细胞恒温培养箱(Thermo Fisher),IVIS-Lumina Ⅲ小动物活体成像系统(PerkinElmer),酶标仪,电转仪,Western blotting全套仪器(Bio-Rad),CFX Connect荧光定量PCR仪(Bio-Rad),Allegra X15R水平转子离心机(Beckman),QIAcube全自动核酸提取仪(Qiagen),ChemiDocTM化学发光成像系统(Bio-Rad)。
1.1.3 主要试剂限制性内切酶、T4 DNA连接酶(Thermo);白细胞介素-6 (IL-6) (Peprotech);A1 (长春新碱,Vincristine)、A2 (长春花碱,Vinblastine)、B1 (白杨素,Chrysin)、B3 (桉脂素,Eudesmin)、B4 (白射干素、Dichotomitin)、B5 (白当归素,Byakangelicin)、B6 (贝母甲素,Peimine)、T4 (石斛碱,Dendrobine)、T6 (粉防己碱,Tetrandrine)、T7 (川续断皂苷乙,Dipsacoside B)、T8 (虎杖苷,Polydatin)、Y2 (薏苡素,Coixol)、Q2 (澳洲茄碱,Solasonine)、B7 (白藜芦醇,Resveratrol)、A09-1 (大蒜素,Allicin)、E1 (儿茶素,Cianidanol)、A9 (木犀草素,Luteolin)、Y8 (杨梅素,Myricetin)、L1 (辣椒素,Nonivamide)、X5 (小檗碱,Berberine)等中药单体(成都瑞芬思生物科技);质粒小提试剂盒、Trizol RNA抽提试剂、RIPA强效裂解液(碧云天生物科技),反转录试剂盒(Qiagen);腔肠素(Sigma);αMEM培养基、胰蛋白酶(HyClone)、胎牛血清(Gibco),BCA蛋白定量试剂盒(Thermo),琼脂糖凝胶回收试剂盒(天根生化科技(北京)有限公司);免疫印迹显影液(Millipore),STAT3单克隆抗体、P-STAT3单克隆抗体、Bcl-2单克隆抗体、Bcl-x单克隆抗体(Abcam);抗兔IgG二抗、兔源β-Actin单克隆抗体(Cell Signaling Technology)。
1.2 方法 1.2.1 逆转录病毒载体的构建及验证将合成的STAT3增强子序列(5′-GTCGACAT TTCCCGTAAATCGTCGA-3′,10倍重复)经PacⅠ和XhoⅠ双酶切插入到pQCXIP-NF-κB-NLuc重组质粒中[19],替代原有的NF-κB增强子序列,形成具有STAT3结合位点的重组逆转录病毒载体pQCXIP-STAT3-Nluc (图 1)。载体含有的NanoLuc (Nluc)序列的N端部分含有分泌信号肽,可帮助蛋白分泌到细胞外的培养基中。去除了增强子序列,仅保留TATA box序列的质粒pQCXIP- TATA-NLuc作为对照载体。所构建质粒经测序表明构建成功。

|
| 图 1 质粒pQCXIP-STAT3-NLuc的构建示意图 Fig. 1 Schematic representation of the construction of pQCXIP-STAT3-NLuc plasmid. |
| |
用DMEM+10% FBS培养基37 ℃、5% (V/V) CO2培养GP2-293,利用Lipofectamine 2000转染试剂将pQCXIP-STAT3-NLuc质粒、对照质粒pQCXIP-TATA-NLuc与pVSV-G病毒包装质粒共转入GP2-293细胞。5 h后培养基更换为αMEM+ 10% FBS继续培养,48 h后收集含病毒上清。
1.2.3 病毒侵染Raw264.7接种于6孔板中,αMEM+10% FBS,37 ℃、5% (V/V) CO2过夜培养。将上述收集的含8 μg/mL聚凝胺(Polybrene)的病毒上清加入细胞,并于水平转子离心机中32 ℃、1 800×g离心1.5 h,37 ℃静置5 h后更换为新鲜αMEM+ 10% FBS培养基继续培养。
1.2.4 稳定表达单克隆细胞系的筛选病毒侵染48 h后,2 μg/mL嘌呤霉素(Puromycin)加入Raw264.7细胞进行筛选。4 d后,将存活细胞按平均1个细胞/孔铺板。两周后,选取单克隆细胞株进行放大培养,将所获得的细胞株记为Raw264.7-STAT3。
1.2.5 单克隆细胞系验证Raw264.7-STAT3单克隆细胞按2×104个/孔接种于96孔板中,24 h后加入IL-6 (终浓度设0、5、10、20 ng/mL),24 h后,取培养基上清,加入底物腔肠素(Coelenterazine,3 μmol/L),使用小动物活体成像检测发光值,实验重复3次。
1.2.6 抑制IL-6/STAT3信号通路中药单体的筛选Raw264.7-STAT3单克隆细胞接种于96孔板(2×104个/孔)。,将长春新碱、长春花碱、白杨素、桉脂素、白射干素、白当归素、贝母甲素、石斛碱、粉防己碱、川续断皂苷乙、虎杖苷、澳洲茄碱、白藜芦醇、大蒜素、儿茶素、木犀草素、杨梅素、辣椒素、小檗碱等中药单体分别按最大无毒药物浓度加入细胞,设药物组、空白组和IL-6阳性对照组,加药后置于37 ℃、5% (V/V) CO2培养。12 h后更换未添加药物的培养基,4 h后取各孔内培养基20 μL,与100 μL底物腔肠素(3 μmol/L)混合,使用小动物活体成像系统测定发光值。同时,使用CCK8法测定细胞成活率,实验重复3次。
1.2.7 Western blotting分析Raw264.7细胞与T4 (石斛碱)、T6 (粉防己碱)共培养,16 h后收集细胞,用RIPA细胞裂解液提取蛋白,用BCA蛋白定量试剂盒进行蛋白浓度测定,并按常规操作进行Western blotting分析,实验重复3次。
1.2.8 Real-time PCR分析Raw264.7细胞与T4 (石斛碱)、T6 (粉防己碱)共培养,16 h后收集细胞,用Trizol提取试剂盒提取总RNA,以β-actin为对照,Bcl-2、Bcl-x为检测目的物,用CFX Connect荧光定量PCR仪按常规操作进行Real-time PCR分析,实验重复3次。其中涉及引物见表 1。
2 结果与分析 2.1 pQCXIP-STAT3-NLuc报告基因的构建前期通过去除CMV启动子、插入NF-κB增强子/TATA box序列以及插入Nluc荧光素酶基因序列对逆转录病毒载体pQCXIP进行重组改造,获得重组质粒pQCXIP-NFKB-Nluc,研究结果表明以此设计的报告基因系统是一个高效、灵敏和便捷的药物筛选检测工具[19]。在此基础上,将STAT3增强子序列通过PacⅠ和XhoⅠ双酶切替换NF-κB增强子序列。新构建的质粒经双酶切获得的条带(图 2,STAT3泳道)与理论上插入条带长度(260 bp)相符,且明显不同于原载体上的酶切条带(图 2,NF-κB泳道),结果表明新的重组质粒pQCXIP-STAT3-Nluc构建成功。
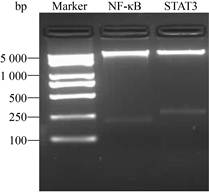
|
| 图 2 pQCXIP-STAT3-NLuc重组质粒的构建及鉴定 Fig. 2 Construction and identification of pQCXIP- STAT3-NLuc recombinant plasmid. |
| |
构建成功的pQCXIP-STAT3-NLuc质粒、pVSV-G病毒包装质粒共转染GP2-293细胞,通过逆转录病毒上清侵染Raw264.7-STAT3细胞、嘌呤霉素筛选及单克隆分离,成功获得稳定表达STAT3-NLuc的单克隆细胞系。IL-6加入STAT3- NLuc细胞系及NF-κB-NLuc刺激24 h后进行NLuc酶活性检测。结果表明(图 3),在IL-6作用下,STAT3-NLuc细胞上清中的酶活性上升,且作用呈明显的浓度依赖性。10 ng/mL及20 ng/mL组酶活性可达0 ng/mL组酶活性的18和23倍,差异极具有统计学意义(***P < 0.001)。结果表明STAT3- NLuc稳定细胞系构建成功。而在IL-6作用下,NF-κB-NLuc酶活性几乎没有变化,说明构建该系统的特异性。

|
| 图 3 STAT3-Nluc报告基因系统构建验证 Fig. 3 Construction verification of STAT3-Nluc reporter gene system. (A) STAT3-Nluc reporter gene system. (B) NF-κB-Nluc reporter gene system. ***P < 0.001. |
| |
Raw264.7-STAT3细胞经IL-6 (10 ng/mL)及十余种中药单体刺激12 h后,取培养液上清检测NLuc发光值,同时用CCK8法检测细胞活性。结果表明(图 4)药品代号为Y8 (杨梅素)、L1 (辣椒素)、X5 (小檗碱)、T4 (石斛碱)、T6 (粉防己碱)、T7 (川续断皂苷乙)、T8 (虎杖苷)、A9 (木犀草素)等8种中药单体化合物对STAT3转录活性有一定的下调作用,其中L1、X5、T4、T6、T7、T8、A9对STAT3转录活性的下调作用具有显著统计学差异(*P < 0.05;**P < 0.01;***P < 0.001)。下调作用最强的两个中药单体T4 (石斛碱,50 μmol/L)及T6 (粉防己碱,5 μmol/L)对IL-6刺激STAT3转录活性的降低程度均超过50%,因此被选取用于开展后续研究。
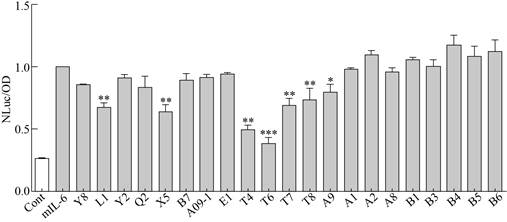
|
| 图 4 Raw264.7-STAT3细胞系中药单体化合物筛选 Fig. 4 Screening of traditional Chinese medicine monomer drugs in cell lines of Raw264.7-STAT3. *P < 0.05, **P < 0.01, ***P < 0.001. |
| |
IL-6以及中药单体化合物T4 (石斛碱)和T6 (粉防己碱)作用于Raw264.7细胞16 h后,收集细胞利用Western blotting检测STAT3及其下游蛋白Bcl-2及Bcl-x的含量变化。结果表明(图 5及图 6),IL-6刺激可显著提高STAT3、P-STAT3、Bcl-2及Bcl-x的含量。与单独IL-6刺激组相比,加入不同浓度的T4及T6均可显著下调IL-6对STAT3、P-STAT3、Bcl-2及Bcl-x的增加量,且作用呈浓度依赖性(*P < 0.05;**P < 0.01)。
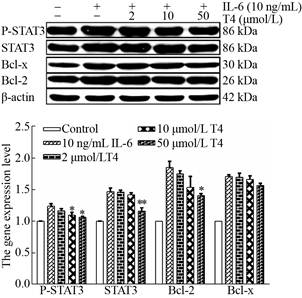
|
| 图 5 中药单体化合物T4 (石斛碱)对Raw264.7细胞系的Western blotting分析 Fig. 5 Western blotting analysis of Raw264.7 cell line by traditional Chinese medicine monomer T4 (Dendrobine). *P < 0.05, **P < 0.01. |
| |
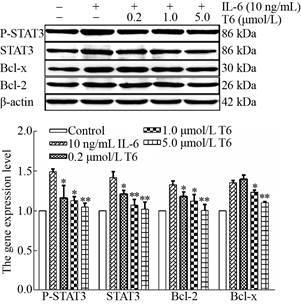
|
| 图 6 中药单体化合物T6 (粉防己碱)对Raw264.7细胞系的Western blotting分析 Fig. 6 Western blotting analysis of Raw264.7 cell line by traditional Chinese medicine monomer T6 (Tetrandrine). *P < 0.05, **P < 0.01. |
| |
用Real-time PCR检测中药单体化合物T4 (石斛碱)、T6 (粉防己碱)对Raw264.7细胞Bcl-2及Bcl-x的mRNA表达水平的影响。结果表明(图 7),IL-6刺激可显著提高Bcl-2及Bcl-x的mRNA表达水平。相比于单独IL-6刺激组,不同浓度的T4 (石斛碱)及T6 (粉防己碱)的加入均能显著降低IL-6对Bcl-2及Bcl-x的mRNA表达的刺激作用(***P < 0.001),且作用也呈一定的浓度依赖性。该结果与蛋白水平的检测结果相一致。以上结果说明筛选获得的T4 (石斛碱)、T6 (粉防己碱)具有抑制IL-6/STAT3信号通路,进而下调STAT3转录的肿瘤存活相关基因Bcl-2和Bcl-x表达的作用。
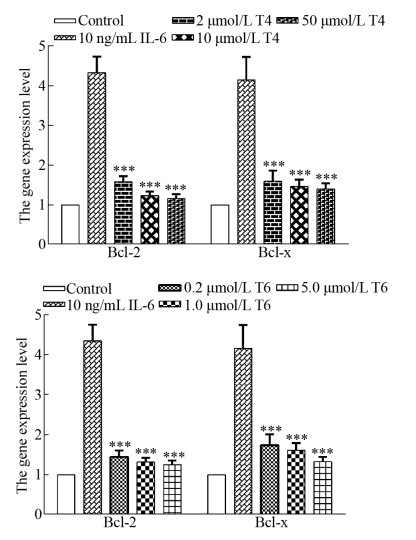
|
| 图 7 中药单体化合物T4 (石斛碱)、T6 (粉防己碱)对Raw264.7细胞系中STAT3相关基因Bcl-2、Bcl-x表达影响的Real-time PCR结果 Fig. 7 Real-time PCR results of the effects of traditional Chinese medicine monomers T4 and T6 on the expression of STAT3 related genes Bcl-2 and Bcl-x in Raw264.7 cell line.***P < 0.001. |
| |
本研究通过对实验室原有重组质粒pQCXIP-NF-κB-NLuc改造,将设计的STAT3增强子序列替代原有的NF-κB增强子序列,成功构建重组逆转录病毒载体pQCXIP-STAT3-NLuc,并将该载体转染及包装得到的逆转录病毒侵染Raw264.7细胞,通过嘌呤霉素药物筛选最终得到能稳定有效表达STAT3-NLuc的Raw264.7- STAT3细胞株。利用STAT3信号通路刺激物IL-6对构建细胞的荧光素酶活性变化进行检测,10 ng/mL及20 ng/mL组酶活性可达0 ng/mL组酶活性的18倍和23倍,明显高于其他研究构建的STAT3转录系统[21],差异极具有统计学意义(***P < 0.001),而IL-6对NF-κB的转录活性基本无影响,该结果表明Raw264.7-STAT3细胞系可以高效及特异地检测STAT3的转录活性(图 3),该系统可成为筛选调控STAT3转录活性的药物的有力工具。
研究表明,IL-6及其受体(IL-6R)在许多肿瘤中呈高表达[22]。在生理状况下,IL-6可通过磷脂酰肌醇-3-激酶(PI3K)、Janus激酶(JAK)等不同的激酶级联过程发挥其功能,而其通过JAK直接激活STAT1和STAT3,在肿瘤的形成过程中也扮演了重要角色[23]。大量机制研究也证明在慢性炎症介导的肿瘤形成以及肿瘤生存和发展中,IL-6/STAT3信号通路发挥重要作用[14, 24]。因此,寻找适当的药物抑制IL-6/STAT3信号通路的活化从而抑制肿瘤的生长和恶化具有重要意义及发展前景。我国中草药资源丰富,运用中药治疗肿瘤也具有良好的临床疗效,目前已有很多关于中药单体可通过抑制IL-6/STAT3信号通路发挥抗癌作用的报道[25-27]。本研究进一步利用构建的STAT3转录因子报告基因系统筛选抑制IL-6/STAT3信号通路的中药单体。进行一系列的中药单体筛选后,得到8种能下调IL-6激活的STAT3转录活性的中药单体,其中效果较强的石斛碱(50 μmol/L)及粉防己碱(5 μmol/L)对IL-6刺激STAT3转录活性的降低程度均超过50%。我们随后以P-STAT3、STAT3、Bcl-2和Bcl-x为指标,利用Western blotting和Real-time PCR技术验证粉防己碱及石斛碱对IL-6/STAT3信号通路的抑制效果。研究表明,Raw264.7细胞经粉防己碱及石斛碱作用后,IL-6刺激导致的STAT3、P-STAT3含量及其下游蛋白Bcl-2和Bcl-x的表达量均随中药浓度的增加而降低,且呈剂量依赖性,并具有显著统计学差异(图 5–7)。这些结果表明利用我们构建的STAT3转录因子报告基因系统可以快速、便捷地筛选到可抑制IL-6/STAT3信号通路的中药单体,虽然已有研究通过免疫印迹实验发现粉防己碱能够抑制STAT3信号通路,从而抗胶质瘤增殖[28],但本研究采用IL-6/STAT3报告基因系统更加准确地说明了粉防己碱对于STAT3转录水平的干预。同时,本研究首次发现了石斛碱对STAT3信号通路的调控作用,基于以往对于石斛碱抗肿瘤的报道,其作用机制是否与STAT3信号通路的抑制相关,尚未可知,有待深入研究。
综上,本研究将目的基因表达调控序列(STAT3)与编码荧光素酶报告基因序列(NLuc)连接,共转染Raw264.7细胞,构建了一套可快速、便捷筛选抑制IL-6/STAT3信号通路的药物的工具系统,可简单通过检测细胞内荧光素酶活性反映药物对STAT3转录活性的调控作用,最终筛选和验证了粉防己碱及石斛碱这两种可用于IL-6/STAT3信号通路相关的肿瘤防治的中药单体。该工具系统灵敏度高、检测方便,不仅能特异性地筛选出对目的基因具有靶向调控活性的药物,还有助于发现其作用的具体靶位及作用机理,在靶向药物筛选中具有极大的优越性,在药物筛选中有广阔的应用前景。该工具系统可应用于今后更多、更广泛的药物筛选,同时筛选获得的药物有可能进一步发展成肿瘤防治的候选药物,因此研究具有一定的理论及应用价值,可用于发掘更多、更有效的药物,为癌症的攻克带来新的突破。
| [1] |
Frank DA. STAT3 as a central mediator of neoplastic cellular transformation. Cancer Lett, 2007, 251(2): 199-210. |
| [2] |
Masuda M, Wakasaki T, Suzui M, et al. Stat3 orchestrates tumor development and progression: the achilles' heel of head and neck cancers?. Curr Cancer Drug Targets, 2010, 10(1): 117-126. |
| [3] |
Xiong A, Yang Z, Shen Y, et al. Transcription factor STAT3 as a novel molecular target for cancer prevention. Cancers, 2014, 6(2): 926-957. |
| [4] |
Lou W, Ni ZY, Dyer K, et al. Interleukin-6 induces prostate cancer cell growth accompanied by activation of stat3 signaling pathway. Prostate, 2015, 42(3): 239-242. |
| [5] |
Johnson DE, O'Keefe RA, Grandis JR. Targeting the IL-6/JAK/STAT3 signalling axis in cancer. Nat Rev Clin Oncol, 2018, 15(4): 234-248. |
| [6] |
Cui X, Liu J, Bai L, et al. P0024 IL-6 induces malignant transformation of rat mesenchymal stem cells in association with enhanced STAT3 signalling. Eur J Cancer, 2014, 105(1): 64-71. |
| [7] |
Bhattacharya S, Ray R, Johnson L. STAT3-mediated transcription of Bcl-2, Mcl-1 and c-IAP2 prevents apoptosis in polyamine-depleted cells. Biochem J, 2005, 392(2): 335-344. |
| [8] |
Kovalovich K, Li W, DeAngelis R, et al. Interleukin-6 protects against Fas-mediated death by establishing a critical level of anti-apoptotic hepatic proteins FLIP, Bcl-2, and Bcl-xL. J Biol Chem, 2001, 276(28): 26605-26613. |
| [9] |
Shain KH, Yarde DN, Meads MB, et al. β1 integrin adhesion enhances IL-6-mediated STAT3 signaling in myeloma cells: implications for microenvironment influence on tumor survival and proliferation. Cancer Res, 2009, 69(3): 1009-1015. |
| [10] |
Yu H, Kortylewski M, Pardoll D. Crosstalk between cancer and immune cells: role of STAT3 in the tumour microenvironment. Nat Rev Immunol, 2007, 7(1): 41-51. |
| [11] |
Klampfer L. Signal transducers and activators of transcription (STATs): Novel targets of chemopreventive and chemotherapeutic drugs. Curr Cancer Drug Targets, 2006, 6(2): 107-121. |
| [12] |
Turkson J, Jove R. STAT proteins: novel molecular targets for cancer drug discovery. Oncogene, 2000, 19(56): 6613-6626. |
| [13] |
Altieri DC. Survivin, cancer networks and pathway-directed drug discovery. Nat Rev Cancer, 2008, 8(1): 61-70. |
| [14] |
Michaud-Levesque J, Bousquet-Gagnon N, Béliveau R. Quercetin abrogates IL-6/STAT3 signaling and inhibits glioblastoma cell line growth and migration. Exp Cell Res, 2012, 318(8): 925-935. |
| [15] |
Li L, Wang C, Lu HD. Brucine induces apoptosis in colon cancer SW480 cells via inhibiting IL-6/STAT3 signaling pathway. Chin J Pathophysiol, 2016, 32(6): 998-1003 (in Chinese). 李逦, 王纯, 卢宏达. 马钱子碱通过抑制IL-6/STAT3信号通路诱导结肠癌SW480细胞凋亡. 中国病理生理杂志, 2016, 32(6): 998-1003. |
| [16] |
Zhu SC, Wang ZH, Li ZJ, et al. Icaritin suppresses multiple myeloma, by inhibiting IL-6/JAK2/STAT3. Oncotarget, 2015, 6(12): 10460-10472. |
| [17] |
Wang ZP, Jin HF, Xu RD, et al. Triptolide downregulates Rac1 and the JAK/STAT3 pathway and inhibits colitis-related colon cancer progression. Exp Mol Med, 2009, 41(10): 717-727. |
| [18] |
Zhao Y, Yao J, Wu XP, et al. Wogonin suppresses human alveolar adenocarcinoma cell A549 migration in inflammatory microenvironment by modulating the IL-6/STAT3 signaling pathway. Mol Carcinog, 2015, 54(S1): E81-E93. |
| [19] |
Guo ZL. Construction and verification of NF-κB luciferase reporter gene system. Chin J Biotech, 2016, 32(10): 1465-1473 (in Chinese). 郭志兰. NF-κB荧光素酶报告基因系统的构建及验证. 生物工程学报, 2016, 32(10): 1465-1473. |
| [20] |
Hall MP, Unch J, Binkowski BF, et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chem Biol, 2012, 7(11): 1848-1857. |
| [21] |
Wang B, Zhang Y, Wang LY, et al. Establishment of STAT3 luciferase reporter gene assay system. J Shanxi Med Univ, 2017, 48(11): 1108-1113 (in Chinese). 王博, 张英, 王林玉, 等. STAT3荧光素酶报告基因检测系统的构建及其检测STAT3活化能力的研究. 山西医科大学学报, 2017, 48(11): 1108-1113. |
| [22] |
Kastritis E, Charidimou A, Varkaris A, et al. Targeted therapies in multiple myeloma. Target Oncol, 2009, 4(1): 23-36. |
| [23] |
Hodge DR, Hurt EM, Farrar WL. The role of IL-6 and STAT3 in inflammation and cancer. Eur J Cancer, 2005, 41(16): 2502-2512. |
| [24] |
Aggarwal BB, Kunnumakkara AB, Harikumar KB, et al. Signal transducer and activator of transcription-3, inflammation, and cancer: how intimate is the relationship?. Ann New York Acad Sci, 2009, 1171(1): 59-76. |
| [25] |
Song H, Wang RX, Wang SM, et al. A low-molecular-weight compound discovered through virtual database screening inhibits Stat3 function in breast cancer cells. Proc Natl Acad Sci USA, 2005, 102(13): 4700-4705. |
| [26] |
Ren XM, Duan L, He Q, et al. Identification of niclosamide as a new small-molecule inhibitor of the STAT3 signaling pathway. ACS Med Chem Lett, 2010, 1(9): 454-459. |
| [27] |
Zhang CL, Li BQ, Zhang X, et al. Curcumin selectively induces apoptosis in cutaneous T-cell lymphoma cell lines and patients' PBMCs: potential role for STAT-3 and NF-κB signaling. J Invest Dermatol, 2010, 130(8): 2110-2119. |
| [28] |
Ma JW, Zhang Y, Li R, et al. Tetrandrine suppresses human glioma growth by inhibiting cell survival, proliferation and tumour angiogenesis through attenuating STAT3 phosphorylation. Eur J Pharmacol, 2015, 764: 228-239. |
 2020, Vol. 36
2020, Vol. 36




