中国科学院微生物研究所、中国微生物学会主办
文章信息
- 程慧, 陈园园, 朱亚鑫, 曹蓉, 徐国强, 张晓梅, 史劲松, 许正宏
- Hui Cheng, Yuanyuan Chen, Yaxin Zhu, Rong Cao, Guoqiang Xu, Xiaomei Zhang, Jinsong Shi, Zhenghong Xu
- 谷氨酸棒杆菌一步法发酵糖质原料生产γ-聚谷氨酸[h1]
- γ-Polyglutamic acid production in Corynebacterium glutamicum using sugar by one-step fermentation
- 生物工程学报, 2020, 36(2): 295-308
- Chinese Journal of Biotechnology, 2020, 36(2): 295-308
- 10.13345/j.cjb.190071
-
文章历史
- Received: February 22, 2019
- Accepted: July 2, 2019
- Published: December 11, 2019
2. 江南大学 粮食发酵与工艺技术国家工程实验室,江苏 无锡 214122;
3. 江南大学 生物工程学院,江苏 无锡 214122;
4. 江南大学 药学院,江苏 无锡 214122
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
4. School of Pharmaceutical Sciences, Jiangnan University, Wuxi 214122, Jiangsu, China
γ-聚谷氨酸(γ-PGA)是一种由L-谷氨酸和D-谷氨酸单体聚合成的生物聚合物,分为γ-L-PGA (仅由L-谷氨酸单体聚合而成)、γ-D-PGA (仅由D-谷氨酸单体聚合而成)、γ-LD-PGA (由D-谷氨酸、L-谷氨酸两种单体聚合而成)。γ-PGA具有高水溶性、良好的生物降解特性、较强的增稠能力、对高金属离子具有优异的吸收性和结合能力等性质[1]。近年来,γ-PGA广泛应用于食品、化妆品、生物医学、环境保护等领域。在食品工业中,γ-PGA可以用作食品补充剂、增强剂、冷冻保护剂和减油剂[2-3];在医药领域,γ-PGA因其良好的生物兼容性和无细胞毒性,可以作为重要的生物医药材料(如抗凝血材料和药物载体)[4];在环境保护领域,γ-PGA作为絮凝剂用来除去污水中的重金属离子[5]。此外,大分子的γ-聚谷氨酸可以提高幼苗的胁迫耐受性,增加种子萌发率[6],在农业生产中有重要用途。
已报道的γ-PGA合成方法有化学合成法、肽合成法、生物转化法和微生物发酵法。与其他方法相比,微生物发酵法具有许多优点,包括廉价的原料、较小的环境污染、较高的天然产物纯度和温和的反应条件[2, 7]。在微生物发酵法中,目前主要的生产菌株是枯草芽孢杆菌Bacillus subtilis和地衣芽孢杆菌Bacillus licheniformis,两者均为谷氨酸依赖型菌株,在发酵过程中需添加外源谷氨酸作为前体物质。例如,浙江大学Huang等[8]在10 L发酵罐中采用高密度发酵工艺,利用枯草芽孢杆菌生产γ-聚谷氨酸,最高产量101.1 g/L,但发酵过程中需添加30 g/L的谷氨酸和40 g/L酵母浸出物,流加750 g/L的葡萄糖,生产成本较高。为解决上述问题,研究人员尝试从自然界中筛选非谷氨酸依赖型菌株,Geng等从发酵食品中分离获得不依赖于谷氨酸的解淀粉芽孢杆菌LL3[9],Shin等从非巴氏灭菌的酱油中分离出非谷氨酸依赖型菌株枯草芽孢杆菌C1[10],但均存在γ-聚谷氨酸产量不高、菌株遗传背景不清晰、不易进行基因操作等缺点。除此之外,Cao等[11]利用代谢工程手段,从解淀粉芽孢杆菌LL3中克隆γ-PGA合成酶基因pgsBCA,分别在大肠杆菌JM109和谷氨酸棒杆菌ATCC13032中成功表达,但是,其基因工程菌发酵产γ-PGA产量较低。
在芽孢杆菌Bacillus sp.中,γ-PGA合成酶是γ-聚谷氨酸合成的关键酶。在枯草芽孢杆菌中已鉴定出γ-PGA合成途径关键酶编码基因pgsB、pgsC、pgsA和pgsE,其中PgsB和PgsC是ATP依赖型酶,催化γ-PGA聚合,在PgsA存在下,其活性得到进一步增强[13],而在无PgsA存在下,枯草芽孢杆菌可以过量产生具有富含L-谷氨酸的单体比率的γ-PGA[14]。在炭疽杆菌中编码γ-PGA的合成酶基因簇为capBCAE[7, 12]。由capE编码的47个氨基酸的肽位于炭疽杆菌膜上,Candela等认为CapE与CapA可能存在互动,在γ-聚谷氨酸合成中具介导γ-PGA转运的作用[15-16],决定合成的γ-PGA被保留或释放。来源于枯草芽孢杆菌的PgsE也被命名为YwtC,它类似于CapE,有关PgsE蛋白在γ-PGA合成中的作用报道较少。Ashiuchi等在枯草芽孢杆菌分别敲除pgsB、pgsC、pgsA,发现敲除菌株无法合成γ-PGA,由此推断编码γ-PGA合酶复合物的关键基因为pgsBCA。本研究以产L-谷氨酸的谷氨酸棒杆菌为底盘微生物,外源表达来源于B. subtilis ATCC6051-U γ-PGA合成酶基因簇pgsBCA,以期实现在不添加外源谷氨酸的条件下,直接利用葡萄糖一步法合成γ-聚谷氨酸。
1 材料与方法 1.1 菌株与质粒菌株:Bacillus subtilis从ATCC购买,菌株号为ATCC 6051-U,是γ-聚谷氨酸合成酶的基因簇pgsBCA的来源菌株。谷氨酸棒杆菌F343由江南大学郑璞教授提供,谷氨酸棒杆菌ATCC13032由本实验室保藏。
质粒:pZM1由美国伦斯勒理工学院Mattheos A. G. Koffas教授惠赠。
1.2 培养基与试剂LB-Glu培养基(g/L):蛋白胨10,酵母膏5,NaCl 5,葡萄糖1 (LB-Glu平板加入2%的琼脂),pH 7.0–7.2。
种子培养基(g/L):玉米浆35,葡萄糖25,K2HPO4 1.5,MgSO4 0.6,FeSO4 0.005,MnCl2·4H2O 0.005,尿素2.5 (分消,过滤除菌),pH 7.2–7.3,每250 mL三角瓶中装液25 mL。
发酵培养基(g/L):葡萄糖120,玉米浆10,K2HPO4 1.0,MgSO4 0.6,FeSO4·7H2O 0.002,MnCl2·4H2O 0.002,尿素7.0 (分消,过滤除菌),硫胺素7.5×10–5,pH 7.2–7.3,500 mL三角瓶装液量为50 mL。
三乙胺乙腈:三乙胺1.4 mL,乙腈8.6 mL,混匀(现配现用)。
PITC乙腈:PITC 25 μL,乙腈2 mL (不超过7 d)。
1.3 培养条件1) 活化培养条件:从保菌管中吸取菌液2–5 µL,在LB-Glu培养基中进行划线,谷氨酸棒杆菌及本文所涉及的所有谷氨酸棒杆菌基因工程菌株32 ℃下培养32 h,枯草芽孢杆菌30 ℃下培养12 h。
2) 种子培养条件:从活化平板上挑取单菌落,接入种子培养基,谷氨酸棒杆菌及其基因工程菌株在往复式摇床中,120 r/min、32 ℃培养24 h,枯草芽孢杆菌在回旋式摇床中30 ℃下培养12 h。
3) 发酵培养条件:
谷氨酸棒杆菌及枯草芽孢杆菌:从种子培养基中取1.0 mL于50 mL发酵培养基中,在往复式摇床中120 r/min 37 ℃培养至发酵结束。
本文所涉及的所有谷氨酸棒杆菌基因工程菌:从种子培养基中取2.5 mL于发酵培养基中,在往复式摇床中120 r/min、32 ℃培养,添加诱导剂IPTG后32 ℃下培养1 h,将温度调为37 ℃。
5 L发酵罐的培养条件:5 L发酵罐装液量为3.5 L,用25%氨水和25%稀盐酸流加调节初始pH为7.2,发酵罐转速为300 r/min,到发酵稳定期将转速设置成与溶氧关联,使溶氧维持在30%,通气量为1 vvm,接种量为10%,36 ℃下发酵12 h,在39 ℃培养至48 h。
1.4 构建重组质粒pZM1-pgsB、pZM1-pgsC、pZM1-pgsA以B. subtilis ATCC 6051-U的基因组为模板,分别以pgsB-NdeⅠF/pgsB-BamHⅠ-R、pgsC-NdeⅠ- F/pgsC-BamHⅠ-R、pgsA-NdeⅠ-F/pgsA-BamHⅠ-R为引物(序列见表 1),PCR扩增出带酶切位点的目的基因pgsB、pgsC、pgsA片段。将酶切的目的基因pgsB片段与双酶切(NdeⅠ、BamHⅠ)线性化的载体pZM1用T4 DNA连接酶进行过夜连接,并转化到大肠杆菌JM109感受态细胞中,在含有25 mg/L的卡那霉素(Kan) LB-Glu抗性平板上进行筛选,获得的转化子经菌落PCR验证及酶切验证,得到正确的转化子,再用同样的方法将pgsC、pgsA分别连接到载体pZM1中。
| Primer name | Sequence (5′–3′) |
| pgsB-NdeⅠ-F | TATACATATGTGGTTACTCATTATAGCCTGTGC |
| pgsB-BamHⅠ-R | CGCGGATCCCTAGCTTACGAGCTGCTTAACCTTG |
| pgsB-R1 | CCATGACATCCATGTGGTCTTCTAAAAC |
| pgsB-F2 | GTTTTAGAAGACCACATGGATGTCATGG |
| pgsC-NdeⅠ-F | TATACATATGTTCGGATCAGATTTATACATCG |
| pgsC-BamHⅠ-R | CGCGGATCCTTAAATTAAGTAGTAAACAAACATGATAGC |
| pgsA-NdeⅠ-F | TATACATATGAAAAAAGAACTGAGCTTTCAT |
| pgsA-BamHⅠ-R | CGCGGATCCTTATTTAGATTTTAGTTTGTCGCTATG |
| 16S-R | ATATCAGGAGGAACACCAAT |
| 16S-F | ACTACCAGGGTATCTAATCC |
| PgsBCA-R | AAGCCAATATCGGTGTTA |
| PgsBCA-F | TATAAGGAATAGTAGCGGTAA |
分别培养携带组成型和诱导型质粒的谷氨酸棒杆菌基因工程菌株(C. glutamicum ATCC 13032 pZM1 (Peftu) pgsBCA、C. glutamicum ATCC 13032 pZM1 (Ptac) pgsBCA),收集两者对数生长期(8 h、16 h、24 h)的菌体,液氮研磨并用Trizol®试剂提取出总RNA,以Revert Aid First Strand cDNA Synthesis Kit (TaKaRa)逆转录出的cDNA为模板,以C. glutamicum ATCC 13032的16S rRNA用作内部参考基因,以相应的基因引物(表 1)进行荧光定量PCR。
1.6 分析方法 1.6.1 生物量的检测将各个取样点的样品稀释至OD600值为0.2–0.8,量取200 μL,用核酸蛋白仪在波长600 nm处测取吸光度。
1.6.2 谷氨酸含量的检测1) 氨基酸的衍生化
将不同取样点的样(或氨基酸标样) 12 000 r/min离心10 min取上清200 μL,置于1.5 mL离心管中,12 000 r/min离心5 min,加入三乙胺乙腈和PITC乙腈各100 μL,混匀,反应1–2 h,加入任己烷400 μL,剧烈振荡后放置10 min,取下层PITC-氨基酸溶液,用0.45 μm针式过滤器过滤,取滤液100 μL加入到400 μL的水中,稀释混匀,加入进样瓶[17]。
2) 高效液相色谱(HPLC)分析
流动相A(2 L):15.2 g乙酸钠,加入1 850 mL超纯水溶解后用冰醋酸调pH至6.5,0.45 μm过滤膜抽滤,然后加入140 mL HPLC级乙腈,混匀,超声30 min。
流动相B:80%乙腈水溶液。
柱温40 ℃,波长250 nm。
色谱柱:Hypersil ODS-C18 4 mm×125 mm。
1.6.3 γ-聚谷氨酸含量的检测样品处理:将发酵液12 000 r/min离心15 min,取上清,稀释适当倍数,用0.45 μm过滤膜过滤,取500 μL于2 mL进样瓶中,待测[18]。
色谱柱:TSKgel super Aw 4000、TSKgel super Aw 5000。
流动相:0.3 mol/L Na2SO4,用冰醋酸调节流动相pH至4.0左右[18]。
柱温:35 ℃,进样量50 μL。
检测器:Waters液相RID示差检测器。
1.6.4 葡萄糖含量的检测通过HPLC检测分析,HPLC仪器为Waters 1515,检测器为示差检测器。
1.6.5 NMR的检测条件1H-NMR用VARIAN-300核磁共振仪测定,工作频率为299.95 MHz,以D2O为溶剂,50 ℃下采样2 s,延迟时间10 s。
2 结果与分析 2.1 以菌株C. glutamicum ATCC13032为底盘微生物外源表达pgsBCA 2.1.1 γ-PGA生产菌株的构建为研究谷氨酸棒杆菌一步法发酵糖质原料生产γ-聚谷氨酸,根据方法1.4构建了诱导型表达载体pZM1(Ptac)pgsB、pZM1(Ptac)pgsC、pZM1 (Ptac)pgsA。随后用酶AvrⅡ、SalⅠ酶切质粒pZM1(Ptac)pgsC获得元件Ptac-lacO-RBS- pgsC-T7 (图 1),同时以酶NheⅠ、SalⅠ双酶切获得的线性质粒pZM1(Ptac)pgsB为载体,由于NheⅠ与AvrⅡ为一对同尾酶,故用T4 DNA连接酶将上述元件和载体于4 ℃过夜连接,得到重组质粒pZM1(Ptac)pgsBC。在此质粒基础上用相同方法连接上元件Ptac-lacO-RBS-pgsA-T7,得到重组质粒pZM1(Ptac)pgsBCA,将重组质粒转化到大肠杆菌JM109后,提取质粒作为模板,并用酶AvrⅡ和SalⅠ进行双酶切验证。条带大小与pgsBCA理论大小(3 500 bp)相符,pZM1(Ptac)全长8 304 bp,条带验证结果与理论大小相符,为正确重组质粒(图 2)。

|
| 图 1 重组质粒pZM1(Ptac)pgsBCA的构建过程 Fig. 1 Construction of recombinant plasmid pZM1 (Ptac) pgsBCA. |
| |

|
| 图 2 重组质粒pZM1(Ptac/eftu)pgsBCA的酶切验证 Fig. 2 Identification of recombinant plasmids with enzyme digestion. M: DNA marker; 1: pZM1(Ptac)pgsBCA; 2: pZM1(Peftu)pgsBCA. |
| |
用酶AvrⅡ和SalⅠ双酶切质粒pZM1(Ptac) pgsBCA获得含有γ-PGA合成酶基因pgsBCA的元件,同时以酶NheⅠ、SalⅠ双酶切获得组成型线性载体pZM1(Peftu),将上述所得元件和线性载体用T4 DNA连接酶于4 ℃过夜连接,构建携带组成型表达载体的重组质粒pZM1(Peftu) pgsBCA,所得两个质粒经金唯智生物技术有限公司测序,结果正确。将上述验证正确的组成型和诱导型重组质粒分别电转入C. glutamicum ATCC 13032中,在含有25 μg/L的卡那霉素抗性平板中进行筛选,挑取转化子进行菌落PCR,验证正确。
2.1.2 产物核磁共振鉴定图 3A是纯化得到发酵产物的1H核磁共振谱,从图中可见谱峰的化学位移。其中水的化学位移为4.810 ppm;化学位移为H 2.056–2.203 ppm的是γ-聚谷氨酸分子式(图 3B)中2号质子的特征谱峰,2号H质子由于与1号α位手性碳原子上的H质子相耦合而生成双峰;图 3B中3号(γ位)氢质子的个数与2号(β位)的氢质子个数相同,因此是一个峰面积为2号双峰面积之和的单峰,其化学位移为H 2.480 ppm (图 3A);1号处氢质子与手性碳原子相连,受羧基的影响而使其向低磁场移动,化学位移为H 3.985 ppm (图 3A)。从图 3A可以看出,该化合物的氢谱信号峰并不多,α位的羧基向高磁场位移,说明发酵产物中存在γ-酰胺键,产物为γ-聚谷氨酸,这与陈雄等[19]的研究结果保持一致。

|
| 图 3 发酵产物的核磁共振鉴定(A:产自C. glutamicum ATCC13032 pZM1(Ptac)pgsBCA的γ-PGA的核磁共振氢谱图;B: γ-PGA的结构式) Fig. 3 Nuclear magnetic resonance identification of fermentation products. (A) Molecular structure of γ-PGA. (B) NMR of γ-PGA from C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA. |
| |
通过对产自重组菌C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA的发酵产物的NMR检测,γ-聚谷氨酸中的γ-酰胺键上的特殊氢峰1、2、3号峰都能被检测到,说明C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA发酵的聚合物是通过γ位上的羧基形成的肽键,是γ-聚谷氨酸。说明已成功在谷氨酸棒杆菌中异源表达合成酶基因pgsBCA,发酵生成γ-聚谷氨酸。
2.1.3 摇瓶发酵特性评价将重组菌C. glutamicum ATCC 13032 pZM1 (Ptac) pgsBCA按方法1.3进行发酵,结果如图 4所示,发酵到16 h,菌株由对数生长期进入到稳定期,生物量在24 h达到OD600 12.33(图 4A)。发酵进行到48 h,γ-聚谷氨酸产量最高,达到1.43 g/L (图 4C),同时(48 h)谷氨酸含量达到10.63 g/L (图 4D),葡萄糖剩余量为47.0 g/L (图 4B)。发酵液中谷氨酸含量较多,这可能与γ-聚谷氨酸的合成机制有关。Ashiuchi等[20]认为由pgsBCA编码的γ-聚谷氨酸合酶由催化部位定位在细胞膜上,因此发酵液中谷氨酸含量较多可能是因为在C. glutamicum ATCC 13032中的胞内谷氨酸大量外排,而未被聚合。也有学者认为L-谷氨酸在聚合之前需在L-谷氨酸激酶的催化下被活化,以获得聚合的额外能量,L-谷氨酸激酶较少或酶活不够高也可能是原因之一。

|
| 图 4 C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA摇瓶发酵性能 Fig. 4 Fermentation performance by C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA in flask. (A) The curve of biomass. (B) The curve of residual glucose. (C) The curve of γ- PGA content. (D) The curve of glutamate content. |
| |
将验证正确的重组子C. glutamicum ATCC 13 032 pZM1(Peftu)pgsBCA在上述发酵培养基(添加25 μg/L卡那霉素)中发酵,发酵液无明显粘度,通过HPLC在检测方法1.6.3下测γ-聚谷氨酸含量,并未检测到目标产物。
2.1.4 IPTG添加时间及浓度的优化异丙基硫代半乳糖苷(IPTG)和乳糖均是乳糖操纵子的有效诱导剂。乳糖有双效作用,既能作为诱导剂,又可以作碳源,在诱导过程中很不稳定;IPTG由于不被菌体代谢,诱导效率高,诱导效果持续稳定而受到广泛应用,然而IPTG对于细胞具有潜在的毒性,因此适宜的诱导时间对重组菌发酵产γ-PGA较为重要。因此,采用单因素实验优化IPTG的诱导时间(0 h、2 h、3 h、4 h、5 h)和诱导浓度(0 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L),探究其对γ-PGA产量的影响。
由图 5A可知,在0 h进行诱导时,谷氨酸棒杆菌基因工程菌不能积累γ-PGA,随着诱导时间的延长,γ-PGA的产量先上升后下降,在2 h诱导时,γ-PGA的产量最高,为1.76 g/L,较3 h添加IPTG时的产量(1.48 g/L)上升了18.92%。在此基础上,通过单因素实验优化IPTG的添加浓度,结果如图 5B所示。随着IPTG浓度的增加,γ-PGA的产量先上升后下降,当IPTG的浓度为0.8 mmol/L时,γ-PGA的产量最高,为1.98 g/L,较添加浓度为1.0 mmol/L时的产量增加了12.50%。因此通过对诱导条件的优化,确定其较优的诱导条件为:在发酵2 h时进行诱导,诱导浓度为0.8 mmol/L。

|
| 图 5 诱导条件的优化(A:诱导时间的优化;B:诱导浓度的优化) Fig. 5 Optimization of induction conditions. (A): Optimization of induction time. (B): Optimization of induction concentration. |
| |
C. glutamicum ATCC 13032作为谷氨酸棒杆菌的模式菌株,具有清晰的遗传背景,但其谷氨酸产量较低。因此,我们选用一株高产谷氨酸的工业菌株C. glutamicum F343作为底盘微生物,以期提高γ-聚谷氨酸产量。
将上述验证正确的重组质粒pZM1(Ptac) pgsBCA转化到谷氨酸棒杆菌F343感受态中,以含有25 μg/L卡那霉素的LB-Glu抗性平板进行筛选,挑出转化子进行菌落PCR,验证结果正确。
2.2.1 底盘微生物C. glutamicum F343发酵产L-谷氨酸的发酵特性研究谷氨酸作为γ-聚谷氨酸的前体物质,提高出发菌株F343的谷氨酸产量是高产γ-聚谷氨酸的重要基础。因此我们首先进行F343菌株发酵产谷氨酸的研究,在发酵过程中,分别每4 h、8 h用pH试纸检测发酵液pH,并用1%的无菌尿素调节pH在7.2–7.3之间。分别测定了菌体生物量、葡萄糖消耗量和谷氨酸产量,结果如图 6所示。

|
| 图 6 C. glutamicum F343摇瓶发酵性能 Fig. 6 Fermentation performance by C. glutamicum F343 in flask. (A) The curve of biomass. (B) The curve of residual glucose. (C) The curve of glutamate content. |
| |
从图 6C可知,从12 h到36 h,谷氨酸含量迅速增加,相同时间点上,通过每4 h调节一次pH的谷氨酸含量比每8 h调节一次pH的谷氨酸含量显著提高,在36 h时,通过每4 h调节一次pH的谷氨酸含量达到11.05 g/L,相比8 h调节一次pH,提高了60.72%。说明F343产谷氨酸的发酵过程中,实时调控pH是谷氨酸高产的关键。从糖耗的曲线图 6B中可以看出,在每4 h调节一次pH与每8 h调节一次pH的条件下,F343菌株对碳源的利用无明显差异。不同的pH调节对菌株生长的影响如图 6A所示,从图中可已看出,在不同的pH调节时菌体生长都呈S型曲线,在0 h到8 h之间,两种pH调节对生物量无显著影响,但在12 h到36 h之间,每4 h调节一次pH的生物量提高显著。其中,在36 h时,每4 h调节一次pH的生物量达到OD600为27.58,相比每8 h调节一次pH的生物量(OD600为23.02)提高19.80%。说明F343菌体的生长对pH很敏感,这与Zheng等[21]的研究结果保持一致。
为进一步提高C. glutamicum F343的谷氨酸产量,作者在实验方法1.3的5 L发酵罐的培养条件下开展了谷氨酸棒杆菌的罐上发酵实验。结果如图 7所示,C. glutamicum F343菌体在16 h达到生长稳定期,生物量OD600达到50.00,较摇瓶发酵水平的生物量OD600 (26.00)提高了92.30%,同时葡萄糖在16 h时被迅速消耗,剩余量为27.60 g/L。谷氨酸在12 h之后开始积累,到32 h间积累迅速,在32 h达到44.61 g/L,在发酵结束时(48 h),谷氨酸含量达到47.61 g/L,较摇瓶水平(11.08 g/L)提高了3.29倍。以上结果显示,谷氨酸棒杆菌F343是一株对发酵液pH敏感的菌株,通过对发酵pH的实时控制显著提升了谷氨酸的产量,为谷氨酸棒杆菌发酵生产γ-PGA提供了充足的前体物质。Zheng等通过两阶段控制C. glutamicum F343发酵过程中的pH,在最初的26 h内,pH值控制在7.3和7.5之间,在最后4 h内,pH值控制在7.2和7.5之间,使谷氨酸含量显著提高,说明C. glutamicum F343对发酵pH较为敏感。本实验结果与其结果一致[21]。
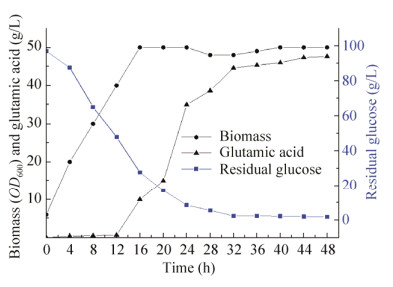
|
| 图 7 C.glutamicumF343在5 L发酵罐水平的发酵性能 Fig. 7 Fermentation profile of C. glutamicum F343 in 5 L Fermentor. |
| |
在方法1.3的培养条件下,考察了菌株C. glutamicum F343 pZM1(Ptac)pgsBCA的发酵特性。如图 7A所示,发酵进行到24 h时,菌株C. glutamicum F343 pZM1(Ptac)pgsBCA已经进入稳定期,菌体生物量OD600达到11.46,同时,谷氨酸和γ-聚谷氨酸的产量也迅速增加,分别达到6.90 g/L (图 8D)和8.79 g/L (图 8C),同一时间点上(24 h),葡萄糖含量由最初的120.0 g/L下降到77.6 g/L。随着发酵时间的延长,谷氨酸和γ-聚谷氨酸进一步积累,发酵进行到48 h时,γ-聚谷氨酸的产量达到最高10.23 g/L (图 8C),较C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA的产量(1.98 g/L)提高了4.16倍,这可能是因为底盘微生物C. glutamicum F343较C. glutamicum ATCC13032的产谷氨酸能力更强,在摇瓶水平上,C. glutamicum F343的谷氨酸产量约为C. glutamicum ATCC 13032的10倍(数据未显示),为γ-聚谷氨酸的合成提供了较为充足的前体物质。在36 h时谷氨酸积累达到最高11.10 g/L (图 8D),随着发酵时间的延长,谷氨酸和γ-PGA均有部分下降,在96 h时,谷氨酸、γ-PGA以及葡萄糖含量分别为7.86 g/L、9.07 g/L和49.6 g/L。
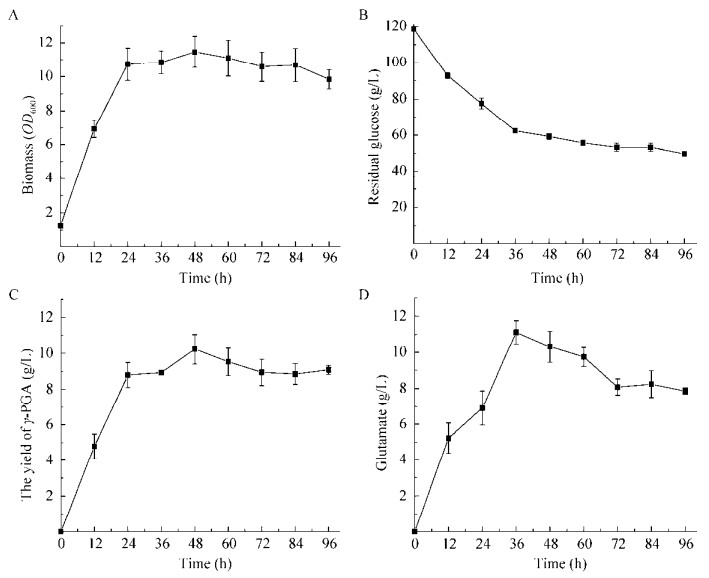
|
| 图 8 C. glutamicum F343 pZM1(Ptac)pgsBCA摇瓶发酵性能 Fig. 8 Fermentation performance by C. glutamicum F343 pZM1(Ptac)pgsBCA in flask. (A) The curve of biomass. (B) The curve of residual glucose. (C) The curve of γ- PGA content. (D) The curve of glutamate content. |
| |
γ-聚谷氨酸产量较48 h的产量下降11.34%,此实验结果分别与Huang等[8]在B. subtilis和Regestein等[22]在B. licheniformis中的研究保持一致,即在发酵过程中γ-PGA的含量受环境和微生物生长等影响而减少,这也可能是因为谷氨酸棒杆菌里存在一种类似于CWlO的细胞壁水解酶,这种酶广泛存在于各种细菌中,且其调控机理不清晰[23]。
在方法1.3条件下,考察了C. glutamicum F343 pZM1(Ptac)pgsBCA发酵罐水平的发酵性能,结果如图 9所示,由图可以看出,菌株在24 h进入稳定期,生物量在48 h达到OD600 27.00,与摇瓶水平上的生物量OD600 (11.46)相比,提高了1.35倍,与5 L发酵罐水平上的C. glutamicum F343的生物量(OD600为50.00)相比,下降了46%;谷氨酸产量在16 h之前迅速增加,在16 h之后产量相对稳定,在40 h谷氨酸的积累量最大,为18.00 g/L,较摇瓶水平上的谷氨酸积累量(6.90 g/L)提高了1.61倍;γ-PGA的产量先上升后下降,在24 h达到最高产量20.08 g/L,较摇瓶水平上的产量(10.23 g/L)提高了1.03倍;葡萄糖的含量在发酵过程中逐渐降低,在48 h时,其葡萄糖剩余量为12.0 g/L,γ-PGA产物得率为0.19 g/g。

|
| 图 9 C. glutamicum F343 pZM1(Ptac)pgsBCA发酵罐水平的发酵性能 Fig. 9 Fermentation profile of C. glutamicum F343 pZM1(Ptac)pgsBCA in 5 L fermentor. |
| |
分别对产自菌株B. subtilis ATCC6051-U和C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA进行醇沉,低温烘干,加水溶解后用20 kDa的透析袋进行透析后冷冻干燥,获得白色纯化样品,用流动相稀释至适当倍数,采用凝胶渗透色谱(GPC)法分别检测其分子量,两者的数均分子量(Mn)分别为9.24×105 (±21.60%) Da和1.01×106 (±6.31%) Da。重均分子量(Mw)分别为1.20×106 (±11.17%) Da和1.61×106 (±2.48%) Da。产自C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA分子量较B. subtilis的相比较,重均分子量提高了34.77%。峰顶处分子量的大小由Mp表征,结合表 2中的数据,产自谷氨酸棒杆菌F343重组菌的γ-PGA的Mp (1.80×106(±1.14%) Da)较对照菌株的Mp (1.19×106(±4.97%) Da)提高了51.26%。
| Strains | Molecular weight | |||
| Mn(×105 Da) | Mp(×106 Da) | Mw(×106 Da) | Mz(×106 Da) | |
| B. subtilis ATCC6051-U | 9.24(±21.60%) | 1.19(±4.97%) | 1.20(±11.17%) | 1.67(±26.57%) |
| F343pZM1(Ptac)-pgsBCA | 10.10(±6.31%) | 1.80(±1.42%) | 1.61(±2.48%) | 2.45(±5.79%) |
从图 10A中,我们可以看出B. subtilis ATCC 6051-U所产的γ-PGA的GPC峰图有2个峰,在12 min存在1个峰使峰图不成正态分布曲线,说明其分子量的分布不均一,而由图 10B可知,其峰型接近正态分布图,无叉开的小峰,较图 10A相比,其γ-PGA分子量的分散性较差,即F343 pZM1(Ptac)pgsBCA所产的γ-PGA均一性较B. subtilis ATCC6051-U好。

|
| 图 10 凝胶渗透色谱检测(A:产自B. subtilis ATCC6051-U的γ-PGA的凝胶渗透色谱;B:产自C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA的凝胶渗透色谱) Fig. 10 Detection by gel permeation chromatography. (A) GPC of γ-PGA from B. subtilis fermentation production. (B) GPC of γ-PGA from C. glutamicum F343 pZM1(Ptac)pgsBCA fermentation production. |
| |
γ-聚谷氨酸在现代农业、生物医药、化妆品行业、环保行业及食品行业有着广泛的应用,目前主要生产菌株为谷氨酸依赖型菌株,发酵过程中需添加外源谷氨酸,具有生产成本较高的问题。目前,对γ-聚谷氨酸合成酶的异源重组表达获得的γ-聚谷氨酸产量仍处于较低水平。
本研究首次利用合成生物学技术构建了两株重组菌株,分别是诱导型菌株C. glutamicum ATCC13032 pZM1 (Ptac)pgsBCA和组成型菌株C. glutamicum ATCC13032 pZM1(Peftu)pgsBCA。进一步发酵结果表明,仅诱导型菌株可以成功产γ-PGA。为探究其原因,采用qRT-PCR技术,比较了组成型和诱导型重组菌株中pgsBCA基因转录水平上的差异,如图 11所示,pgsBCA基因在诱导型菌株中的转录强度较组成型相比较弱,在8 h、16 h、24 h分别下降了57.05%、66.27%、45.28%。导致组成型菌株不生产γ-PGA的可能原因是pgsBCA基因的过早或过强表达不利于γ-PGA的合成。在对IPTG的诱导时间的优化结果(图 5A)也支持这一假设,即在0 h开始诱导时,诱导型菌株不生产γ-PGA,在2 h之后诱导,γ-PGA的产量下降,即γ-PGA的产量对诱导时间较为敏感,诱导时间不同pgsBCA的表达时间也有所差异,这与枯草芽孢杆菌中的诱导表达机制一致[10]。在γ-PGA生产菌株枯草芽孢杆菌中,pgs操纵子的完全启动需要SwrAA和磷酸化形式的DegU(DegU~P)共存[24],DegU (DegU~P)或SwrAA单独存在仅对pgs操纵子的转录和γ-PGA的生成有微弱影响[25],因此,γ-PGA合成酶是需要在菌体特定的生长期启动表达。通过NMR定性检测发酵产物结构,发现发酵产物是具有γ酰胺键的γ-PGA。将诱导型菌株C. glutamicum F343 pZM1(Ptac)pgsBCA发酵到48 h,γ-聚谷氨酸达到最高产量1.43 g/L (图 4C)。2010年,Cao等[26]在C. glutamicum ATCC13032中外源表达来自B. licheniformis NK-03的γ-聚谷氨酸合成酶基因pgsBCA,产量达到0.69 g/L,与之相比,本研究达到的产量提高了约2倍。

|
| 图 11 组成型及诱导型工程菌株pgsBCA基因转录水平的比较 Fig. 11 Comparison of transcript levels of pgsBCA gene in constitutive and inducible engineering strains. |
| |
为进一步提高γ-PGA的产量,本研究提出通过提高底盘微生物的产谷氨酸能力来提高γ-PGA产量的策略,选用一株高产谷氨酸的谷氨酸棒杆菌F343为底盘微生物,构建重组菌C. glutamicum F343 pZM1 (Ptac)pgsBCA。通过对底盘微生物C. glutamicum F343谷氨酸发酵性能的探究,发现C. glutamicum F343菌株是一株对发酵pH较敏感的菌株。在本文的发酵条件下γ-PGA产量大幅度提高,最终摇瓶产量达到10.23 g/L,耗糖56.62 g/L (48 h),5 L发酵罐的产量达到20.08 g/L,耗糖108.0 g/L。在枯草芽孢杆菌的生产菌株中,目前γ-PGA最高产量为101.1 g/L[8],发酵过程中需添加30 g/L的谷氨酸和40 g/L酵母浸出物,流加750 g/L的葡萄糖;在地衣芽孢杆菌中γ-PGA最高的产量是45.73 g/L[27],但其消耗糖80 g/L,添加外源谷氨酸和柠檬酸各20 g/L、18 g/L,而谷氨酸的成本价约为工业葡萄糖的4倍,因此如果通过发酵优化等策略进一步提高菌株C. glutamicum F343 pZM1(Ptac)pgsBCA直接利用葡萄糖发酵产γ-PGA的产量,将有望节约γ-PGA的发酵成本。除此之外,地衣芽孢杆菌和枯草芽孢杆菌主要原料为甘油,因此本研究在直接利用葡萄糖为原料生产γ-PGA上具有很大优势。
最后,本研究纯化出产自C. glutamicum F343 pZM1(Ptac) pgsBCA和B. subtilis ATCC6051-U的γ-PGA,测得其重均分子量较B. subtilis ATCC6051-U产的天然γ-PGA的相比提高了34.77%,推测可能由于在枯草芽孢杆菌中存在γ-PGA降解基因ggt、cwlO、pgdS[28-29]。不同的相对分子质量的γ-聚谷氨酸的用途也各不相同,例如相对分子质量在2 kDa时常应用在现代农业中[30-31],在45-60 kDa的γ-PGA是良好的药物载体[32],化妆品级的集中在80–120 kDa[33],200 kDa左右的主要用作抑菌剂和絮凝剂[34],目前已经可以通过各类酶解法、碱水解法等方法控制其相对分子质量[35]。因此我们发酵所获得的高分子量的γ-PGA具有很大的应用潜力,为其在化妆品、医药等各个行业的应用奠定了良好的基础。
| [1] |
Hsueh YH, Huang KY, Kunene SC, et al. Poly-γ-glutamic acid synthesis, gene regulation, phylogenetic relationships, and role in fermentation. Int J Mol Sci, 2017, 18(12): 2644. DOI:10.3390/ijms18122644 |
| [2] |
Luo ZT, Guo Y, Liu JD, et al. Microbial synthesis of poly-γ-glutamic acid:current progress, challenges, and future perspectives. Biotechnol Biofuels, 2016, 9: 134. |
| [3] |
Sung MH, Park C, Kim CJ, et al. Natural and edible biopolymer poly-γ-glutamic acid:synthesis, production, and applications. Chem Rec, 2005, 5(6): 352-366. |
| [4] |
Clarke DE, Pashuck ET, Bertazzo S, et al. Self-Healing, self-assembled β-sheet peptide poly (γ-glutamic acid) hybrid hydrogels. J Am Chem Soc, 2017, 139(21): 7250-7255. DOI:10.1021/jacs.7b00528 |
| [5] |
Yao J, Xu H, Wang J, et al. Removal of Cr (Ⅲ), Ni (Ⅱ) and Cu (Ⅱ) by poly (γ-glutamic acid) from Bacillus subtilis NX-2. J Biomater Sci, Polym Ed, 2007, 18(2): 193-204. DOI:10.1163/156856207779116702 |
| [6] |
Lei P, Pang X, Feng XH, et al. The microbe-secreted isopeptide poly-γ-glutamic acid induces stress tolerance in Brassica napus L.seedlings by activating crosstalk between H2O2 and Ca2+. Sci Rep, 017, 7: 41618. DOI:10.1038/srep41618 |
| [7] |
Ashiuchi M. Microbial production and chemical transformation of poly-γ-glutamate. Microb Biotechnol, 2013, 6(6): 664-674. DOI:10.1111/1751-7915.12072 |
| [8] |
Huang J, Du YM, Xu GH, et al. High yield and cost-effective production of poly (γ-glutamic acid) with Bacillus subtilis. Eng Life Sci, 2011, 11(3): 291-297. DOI:10.1002/elsc.201000133 |
| [9] |
Geng WT, Cao MF, Song CJ, et al. Complete genome sequence of Bacillus amyloliquefaciens LL3, which exhibits glutamic acid-independent production of poly-γ-glutamic acid. J Bacteriol, 2011, 193(13): 3393-3394. |
| [10] |
Shin IL, Wu JY, Wu PJ, et al. An unusual bioconjugate of glycerol and poly (γ-glutamic acid) produced by Bacillus subtilis C1. J Microbiol Biotechnol, 2005, 15(5): 919-923. |
| [11] |
Cao MF, Geng WT, Liu L, et al. Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgsBCA genes. Bioresour Technol, 2011, 102(5): 4251-4257. |
| [12] |
Ashiuchi M, Kamei T, Misono H. Poly-γ-glutamate synthetase of Bacillus subtilis. J Mol Catal B:Enzym, 2003, 23(26): 101-106. DOI:10.1016/S1381-1177(03)00076-6 |
| [13] |
Gomez Leonard C, Housewright RD, Thorne CB. Effects of some metallic ions on glutamyl polypeptide synthesis by Bacillus Subtilis. J Bacteriol, 1958, 76(5): 499-503. |
| [14] |
Sawada K, Araki H, Takimura Y, et al. Poly-L-gamma-glutamic acid production by recombinant Bacillus subtilis without pgsA gene. AMB Express, 2018, 8: 110. DOI:10.1186/s13568-018-0636-x |
| [15] |
Ashiuchi M, Soda K, Misono H. A poly-γ-glutamate synthetic system of Bacillus subtilis IFO 3336:gene cloning and biochemical analysis of poly-γ-glutamate produced by Escherichia coli clone cells. Biochem Biophys Res Commun, 1999, 263(1): 6-12. DOI:10.1006/bbrc.1999.1298 |
| [16] |
Candela T, Mock M, Fouet A. CapE, a 47-amino-acid peptide, is necessary for Bacillus anthracis polyglutamate capsule synthesis. J Bacteriol, 2005, 187(22): 7765-7772. |
| [17] |
Zhang XM, Lai LH, Xu GQ, et al. Effects of pyruvate kinase on the growth of Corynebacterium glutamicum and L-serine accumulation. Process Biochem, 2017, 55: 32-40. |
| [18] |
Wu Q, Xu H, Xu L, et al. Biosynthesis of poly (γ-glutamic acid) in Bacillus subtilis NX-2:regulation of stereochemical composition of poly (γ-glutamic acid). Process Biochem, 2006, 41(7): 1650-1655. DOI:10.1016/j.procbio.2006.03.034 |
| [19] |
Chen X.Highyield of poly-γ-glutamic acid from Bacillus subtilis and its application[D].Wuhan: Huazhong Agricultural University, 2005. 陈雄.枯草芽胞杆菌高产聚-γ-谷氨酸及其应用研究[D].武汉: 华中农业大学, 2005. |
| [20] |
Ashiuchi M, Kamei T, Song JJ, et al. Physiological and biochemical characteristics of poly γ-glutamate synthetase complex of Bacillus subtilis. Eur J Biochem, 2001, 268(20): 5321-5328. DOI:10.1046/j.0014-2956.2001.02475.x |
| [21] |
Zheng P, Liu M, Liu XD, et al. Genome shuffling improves thermotolerance and glutamic acid production of Corynebacteria glutamicum. World J Microbiol Biotechnol, 2012, 28(3): 1035-1043. |
| [22] |
Regestein Née Meissner L, Arndt J, Palmen TG, et al. Investigation of poly (γ-glutamic acid) production via online determination of viscosity and oxygen transfer rate in shake flasks. J Biol Eng, 2017, 11: 23. DOI:10.1186/s13036-017-0065-4 |
| [23] |
Mitsui N, Murasawa H, Sekiguchi J. Disruption of the cell wall lytic enzyme CwlO affects the amount and molecular size of poly-γ-glutamic acid produced by Bacillus subtilis (natto). J Gen Appl Microbiol, 2011, 57(1): 35-43. |
| [24] |
Stanley NR, Lazazzera BA. Defining the genetic differences between wild and domestic strains of Bacillus subtilis that affect poly-γ-DL-glutamic acid production and biofilm formation. Mol Microbiol, 2005, 57(4): 1143-1158. DOI:10.1111/j.1365-2958.2005.04746.x |
| [25] |
Osera C, Amati G, Calvio C, et al. SwrAA activates poly-γ-glutamate synthesis in addition to swarming in Bacillus subtilis. Microbiology, 2009, 155(7): 2282-2287. |
| [26] |
Cao MF, Song CJ, Jin YH, et al. Synthesis of poly (γ-glutamic acid) and heterologous expression of pgsBCA genes. J Mol Catal B:Enzym, 2010, 67(12): 111-116. |
| [27] |
Mitsunaga H, Meissner L, Palmen T, et al. Metabolome analysis reveals the effect of carbon catabolite control on the poly (γ-glutamic acid) biosynthesis of Bacillus licheniformis ATCC 9945. J Biosci Bioeng, 2016, 121(4): 413-419. DOI:10.1016/j.jbiosc.2015.08.012 |
| [28] |
Feng J, Gao WX, Gu YY, et al. Functions of poly-γ-glutamic acid (γ-PGA) degradation genesin γ-PGA synthesis and cell morphology maintenance. Appl Microbiol Biotechnol, 2014, 98(14): 6397-6407. DOI:10.1007/s00253-014-5729-0 |
| [29] |
Scoffone V, Dondi D, Biino G, et al. Knockout of pgdS and ggt genes improves γ-PGA yield in B. subtilis. Biotechnol Bioeng, 2013, 110(7): 2006-2012. |
| [30] |
Lei P, Xu ZQ, Ding Y, et al. Effect of poly (γ-glutamic acid) on the physiological responses and calcium signaling of rape seedlings (Brassica napus L.) under cold stress. J Agric Food Chem, 2015, 63(48): 10399-10406. DOI:10.1021/acs.jafc.5b04523 |
| [31] |
Xu ZQ, Lei P, Feng XH, et al. Analysis of the metabolic pathways affected by poly (γ-glutamic Acid) in Arabidopsis thaliana based on geneChip microarray. J Agric Food Chem, 2016, 64(32): 6257-6266. DOI:10.1021/acs.jafc.6b02163 |
| [32] |
Ye HF, Jin L, Hu RZ, et al. Poly (γ, L-glutamic acid)-cisplatin conjugate effectively inhibits human breast tumor xenografted in nude mice. Biomaterials, 2006, 27(35): 5958-5965. DOI:10.1016/j.biomaterials.2006.08.016 |
| [33] |
Liu X, Liu F, Liu SY, et al. Poly-γ-glutamate from Bacillus subtilis inhibits tyrosinase activity and melanogenesis. Appl Microbiol Biotechnol, 2013, 97(22): 9801-9809. |
| [34] |
Bhat AR, Irorere VU, Bartlett T, et al. Improving survival of probiotic bacteria using bacterial poly-γ-glutamic acid. Int J Food Microbiol, 2015, 196: 24-31. DOI:10.1016/j.ijfoodmicro.2014.11.031 |
| [35] |
ShaYY, Zhang YT, Qiu YB, et al. Efficient biosynthesis of low-molecular-weight poly-γ-glutamic acid by stable overexpression of PgdS hydrolase in Bacillus amyloliquefaciens NB. J Agric Food Chem, 2019, 67(1): 282-290. |
 2020, Vol. 36
2020, Vol. 36




