中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张婉婷, 吴官县, 徐思凡, 王秋媛, 刘洋, 满朝来
- Zhang Wanting, Wu Guanxian, Xu Sifan, Wang Qiuyuan, Liu Yang, Man Chaolai
- 不同品系肉鸡Gimap5基因的表达与功能
- Expression and function characterization of Gimap5 gene from different breeds of broilers
- 生物工程学报, 2020, 36(2): 259-266
- Chinese Journal of Biotechnology, 2020, 36(2): 259-266
- 10.13345/j.cjb.190224
-
文章历史
- Received: May 29, 2019
- Accepted: August 16, 2019
- Published: September 9, 2019
GTP酶免疫相关蛋白(GTPase of the immune- associated protein, Gimap),曾命名为免疫相关核苷酸结合蛋白(Immune-associated nucleotide-binding protein, Ians),家族成员众多,该家族蛋白特征是N-端含有AIG-1结构域,主要表达于淋巴细胞和造血系统细胞[1-2]。Gimap5是GTP酶免疫相关蛋白家族成员之一[3],在促进T细胞存活方面发挥关键调控作用。例如,糖尿病大鼠模型的淋巴细胞减少症是由Gimap5基因移码突变引起的[4-6],即Gimap5蛋白羧基端的215个氨基酸被19个其他氨基酸取代,导致跨膜区肽链部分缺失,引发T细胞凋亡[7-8]。Chen等[9]研究发现维持T细胞静息状态需要抑制mTORC1通路活性,当Gimap5基因缺失时会导致AKT/mTORC1通路的组成性激活,促进T细胞减少;Nitta等[10]在小鼠中发现Gimap5与抗凋亡蛋白Bcl-2和Bcl-xL有关,可能通过与Bcl-2家族成员相互作用,调节胸腺发育与T淋巴细胞存活。此外,Gimap5基因突变还会导致大鼠易患炎症性肠病(Inflammatory bowel disease, IBD)[11],相似的情况在小鼠中也有发生,即Gimap5基因突变小鼠易患结肠炎,原因可能是机体淋巴细胞减少会诱导CD4+T细胞增殖和发挥效应,进而诱发肠道炎症[12]。
目前,鸡免疫和炎性肠病仍是困扰禽业生产的主要问题,而关于鸡Gimap5基因的相关研究未见报道。虽然研究已确凿表明,Gimap5基因是参与细胞免疫和肠道炎症的重要基因[9-12],但是Gimap5基因调控淋巴细胞存活和肠炎的作用机制仍不明晰[13]。
本研究首次克隆AA+肉鸡和三黄鸡Gimap5基因全长编码序列,并进行组织表达谱分析和功能鉴定,以期为深入研究Gimap5基因功能奠定基础。
1 材料与方法 1.1 实验动物与试剂本研究所用AA+肉雏鸡和三黄鸡购自从哈尔滨市香坊养鸡场;所用TRIzol试剂购自Invitrogen公司;逆转录试剂盒(FSQ301)购自TOYOBO公司(上海);高保真聚合酶(Pyrobest DNA polymerase)和pMD18-T载体购自宝生物(大连)有限公司;大肠杆菌脂多糖(Lipopolysaccharide, LPS)购自普洛麦格(北京)生物技术有限公司。
1.2 Gimap5基因克隆及生物信息学分析本研究所用引物利用Primer Premier 5.0软件设计,由生工生物工程(上海)股份有限公司合成。根据红原鸡(Gallus gallus) Gimap5基因预测序列(GenBank登录号:XM_015281120.2)设计PCR引物P1和P2,引物序列信息见表 1。采用TRIzol试剂提取脾脏总RNA,利用逆转录试剂盒(FSQ301)合成cDNA (方法参照试剂说明书)。PCR反应体系(25 μL)如下:2.5 μL 10×Taq DNA聚合酶缓冲液,2.0 μL dNTPs (2.5 mmol/L),0.8 μL上、下游引物(10 μmol/L),0.1 μL Taq酶,0.5 μL cDNA (20 ng/μL)和灭菌去离子水18.3 μL。PCR反应条件为:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min,4 ℃终止反应。将PCR产物纯化后克隆到pMD18-T载体上,鉴定为阳性的3个重组子交由华大基因科技服务(上海)有限公司测序。利用SOPMA、SWISS- MODEL和DNAMAN等软件对Giamp5基因的核苷酸序列和氨基酸序列进行生物信息学分析。
| Primer name | Sequences (5′–3′) |
| Gimap5 primer (P1) |
ACCGACAGGCCGTGCTCCTTTGACT |
| Gimap5 primer (P2) |
TGTGCCATGTGGGGACTGTGGGATT |
| Gimap5 primer (P3) |
TGGTGCAGGAGAACGAGGGCAAGTA |
| Gimap5 primer (P4) |
CTCTGCTTTTCCTATCTTCTCTGTA |
| β-actin primer (P5) |
GGCACCACACTTTCTACAAT |
| β-actin primer (P6) |
TAACACCATCACCAGAGTCCATCAC |
分别随机选取和采集10只14日龄健康AA+和三黄鸡的心脏、肝脏、脾脏、肺脏、肾脏、胸腺、大肠、小肠、肌胃、腺胃、皮肤、骨骼肌、脂肪、脑、血和法氏囊等16种组织,迅速置于液氮中冷冻,并于−80 ℃保存备用。采用TRIzol试剂提取各组织的总RNA并合成cDNA (方法同1.2)。利用实时定量PCR (Reverse transcription quantitative real-time polymerase chain reaction, RT-qPCR)技术检测Gimap5基因在AA+雏鸡和三黄鸡各组织中转录表达特性。根据Gimap5基因编码区设计RT-qPCR引物P3和P4。以β-actin (GenBank登录号:No. NM_205518)为内参基因,内参引物为P5和P6。目的基因Gimap5与内参基因β-actin的RT-qPCR反应体系剂量以及反应程序相同。20 μL反应体系为:2 μL cDNA (20 ng/μL)、0.6 μL上游引物(10 μmol/L)、0.6 μL下游引物(10 μmol/L)、10 μL SYBR Green Realtime PCR Master Mix (TOYOBO,上海)、0.4 μL 50×ROX reference dye和6.4 μL H2O;反应程序为:95 ℃ 10 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,40个循环;4 ℃终止反应。
1.4 Gimap5基因在炎症反应中表达特性分析随机选取健康状况良好、体重相近的11日龄AA+雏鸡分为2组:即对照组(生理盐水接种组)和试验组(LPS接种组),每组10只,自由采食和饮水。试验组雏鸡从11 d开始连续3 d腹腔注射LPS生理盐水稀释液,LPS注射量分别为:50 μg/kg (12 d)、50 μg/kg (13 d)和500 μg/kg (14 d),对照组注射相同剂量的生理盐水。分别收集14 d雏鸡(LPS处理72 h)肝脏、胸腺、法氏囊和脾脏等组织脏器迅速置于液氮中,并−80 ℃保存备用[14]。分别提取炎症雏鸡模型的血液、肝脏、脾脏、胸腺、法氏囊等几种免疫相关组织总RNA,利用RT-qPCR技术定量分析Gimap5基因在各组织脏器中转录活性变化,具体RT-qPCR反应条件同1.4。
1.5 统计分析本实验随机选取3只雏鸡进行定量分析,每个样品进行3次技术重复。RT-qPCR采用2–△Ct方法定量分析Gimap5组织表达谱的相对表达活性,采用2–△△Ct方法定量计算Gimap5在炎症反应组织中的相对表达活性,利用SPSS 20.0软件对所得数据进行单因素方差分析,数据利用GraphPad Prism 5.0软件进行作图。
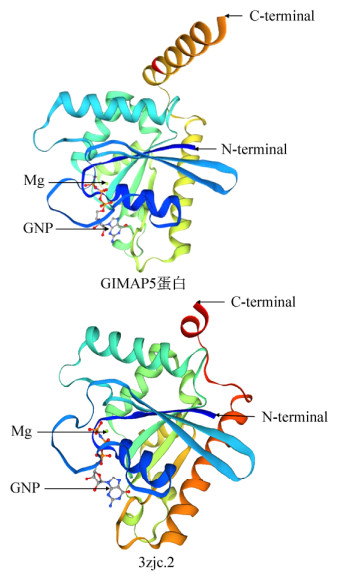
2 结果与分析 2.1 Gimap5基因的克隆与序列分析本实验克隆获得两品系肉鸡Gimap5基因全长编码序列771 bp,每个品系鸡的3个重组子测序结果均一致,编码256个氨基酸(AA+肉鸡GenBank登录号:MK214432;三黄鸡GenBank登录号:MK214433),定位于2号染色体,包含2个外显子和1个内含子。ProtParam软件分析表明,Gimap5蛋白等电点为8.10,分子量为29 053.33 Da,不含信号肽。TragetP1.1软件预测Gimap5蛋白具有线粒体作用位点(SP),这与Daheron等[15]在线粒体中检测到Gimap5蛋白结果相一致。利用ExPaSy-prosite、SMART和Predict protein等软件分析发现Gimap5蛋白存在AIG-1结构域(1–201 AA)、跨膜序列(233–252 AA)和3类功能位点(1个cAMP和cGMP依赖性蛋白激酶磷酸化位点、6个酪蛋白激酶磷酸化位点和3个N-肉豆蔻酰化位点) (图 1)。SOPMA软件分析表明,Gimap5蛋白二级结构包含α-螺旋占51.95% (133 AA)、无规卷曲占30.86% (79 AA)、延伸链占14.06% (36 AA)和β折叠占3.12% (8 AA)等几种结构形式。利用SWISS-MODEL软件对Gimap5蛋白的三级结构进行模拟预测,发现Gimap5蛋白序列(1–199 AA)与3zjc.2蛋白部分结构(14–213 AA)相似(图 2)。通过比较13个物种Gimap5基因核苷酸编码序列同源性,结果表明,Giamp5基因在不同物种间同源性较低(图 3)。Gimap5基因在鸟类(69%以上)和哺乳动物类(67%以上)各自内部同源性相对较高,但二类之间的同源性偏低(55%以上)。Gimap5氨基酸序列进化树分析表明,鹈鹕和鸡等鸟类形成一簇,而人、小鼠、猪、大鼠和马等哺乳动物组成另一簇(图 4)。

|
| 图 1 AA+肉鸡Gimap5基因核苷酸和氨基酸序列 Fig. 1 Nucleotide and amino acid sequences of the Gimap5 gene of AA+ broiler. Initiation codon is shadowed; Asterisk indicates the stop codon; AIG-1 domain (1–220 AA) (single nderline) is indicated; Transmembrane sequence (233–252 AA) is indicated with double underline; cAMP and cGMP dependent protein kinase phosphorylation site (227-RKYS-230AA); Casein kinase phosphorylation sites (52-TVID-55AA, 97-TQED-100AA, 124-TRGE-127AA, 133-TLDD-136AA, 139-TYTD-142AA, 165-TSAE-168AA); N-myristoylation sites (9-GGGRSA-16AA, 44-GLWNGQ-49AA, 239- GVILTA-244AA) are boxed; ·indicate SNP site. Based on the predicted sequence of the Gallus gallus Gimap5 gene (XM_015281120.2), the SNP of AA+ broilers is 165 nt (T to C), and Sanhuang broiler SNPs are 165 nt (T to C) and 616 nt (A to G), respectively. |
| |
|
| 图 2 Gimap5基于3zjc.2晶体结构同源性建模 Fig. 2 Homology modeling of the chicken Gimap5 based on the crystal structure of 3zjc.2. 3zjc.2: GMPPNP-bound human GIMAP7 L100Q variant. Gimap5 and 3zjc.2 all contain the Mg and GNP (phosphor amino phosphonic acid-guanylate ester) ligands with similar structures, but their structures change at the C-terminal. |
| |

|
| 图 3 Gimap5核苷酸序列同源性分析 Fig. 3 Homology analysis of the poultry Gimap5 genes. Analysis was done using the DNAMAN software (http://www.lynnon.com). Numbers on the branches represent percentage of homology. |
| |

|
| 图 4 Gimap5氨基酸序列进化性分析 Fig. 4 Evolutionary analysis of Gimap5 amino acid sequences. The phylogenetic tree was constructed using the neighbor-joining (N-J) method within MEGA7.0. Numbers on the branches represent bootstrap values for 1 000 replications. |
| |
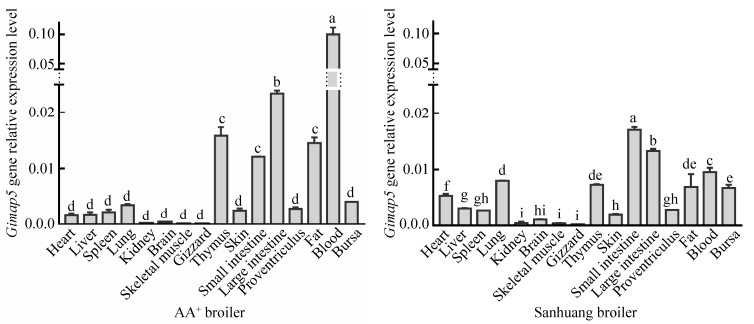
组织转录表达谱分析表明,AA+和三黄鸡Gimap5基因表达于各个组织脏器,并且二者间表达变化规律基本相似。例如,Gimap5基因在两品系鸡的胸腺、小肠、大肠、血液和脂肪等器官中转录活性均较高,而在肝脏、脾脏、肾脏、脑、肌肉、肌胃、皮肤、腺胃等器官中均较低(图 5)。Gimap5基因在AA+肉鸡血液中表达活性显著高于其他组织,而在三黄鸡小肠中表达活性高于其他组织。
|
| 图 5 Gimap5在AA+和三黄鸡不同组织中的表达模式 Fig. 5 Expression patterns of Gimap5 in different tissues of AA+ and Sanhuang broiler. The internal reference gene is β-actin; Significant difference (P < 0.05). Same letters indicate no signficant different. Different letters indicate significant difference. |
| |
结果表明,Gimap5基因在实验组雏鸡的血、肝脏和法氏囊等组织中表达活性呈现显著变化,即在AA+肉鸡的血和肝脏中活性均显著下调(P < 0.05),而在法氏囊中显著上调(P < 0.01);Gimap5基因在脾脏和胸腺中的转录活性变化不显著(图 6)。

|
| 图 6 Gimap5基因在炎症反应中的相对表达活性 Fig. 6 Relative expression activity of the Gimap5 gene in inflammatory response. * and ** indicate differences that are statistically significant at P < 0.05 and P < 0.01, respectively. |
| |
肉鸡因其生长速度快和饲养周期短等优势已经成为禽业生产的主力军。三黄鸡与AA+肉鸡在生长速率、抗病能力以及肉质风味等方面存在较大差异,这种品系间的天然差异可能为靶基因的表达与功能特性研究提供方便。
将AA+肉鸡和三黄鸡Gimap5基因测序结果与红原鸡Gallus gallus进行同源性比较,结果显示两种品系肉鸡均在165位核苷酸存在1个SNP位点(T→C),同时三黄鸡在616位核苷酸存在另一个SNP位点(A→G),但这些SNP位点都未导致相应氨基酸改变,表明Gimap5基因在鸡的不同品系进化过程中高度保守。蛋白结构分析表明鸡Gimap5蛋白C-端的α-螺旋区域即为跨膜序列(233–252 AA),提示鸡Gimap5蛋白通过跨膜序列锚定于细胞器膜上,进而通过N-端的AIG-1结构域发挥功能,这与Dallberg和Daheron等[15-16]发现Gimap5蛋白主要定位于内质网、线粒体和高尔基体等具有膜结构细胞器中检测到结果相印证。3D结构同源模拟分析,表明Gimap5与3zjc.2空间结构间存在高度相似性,Gimap7蛋白(3zjc.2的突变体)能够激活Gimap2蛋白GTP酶,进而在淋巴细胞存活中发挥作用[17-18],Gimap5是否具有Gimap7相似的作用有待后续研究。大部分前体蛋白需要经过翻译后修饰才能成为活性蛋白,而Gimap5具有多个磷酸化位点和肉豆蔻酰化位点,这些位点对Gimap5蛋白活化和调控机制有待深入研究。同源性和进化性分析表明,Gimap5在鸟类和陆生哺乳动物间的亲缘和进化关系存在一定距离,暗示鸡Gimap5基因可能在功能和特性等方面与哺乳动物同源基因存在一定的差异。
组织转录表达特性分析发现,Gimap5基因在AA+肉鸡血液中表达活性显著高于其他组织,并在三黄鸡血液中也具有较高活性,Gimap5基因在AA+肉鸡血液中表达量大约是三黄鸡的10倍。研究表明Gimap5是小鼠造血母细胞(Hematopoietic progenitor cells, HPCs)存活的重要稳定因子[19],Gimap5基因的高表达是否与AA+肉鸡血细胞的更新代谢和功能相关,有待进一步研究。Gimap5基因在AA+肉鸡和三黄鸡的胸腺组织中均具有较高转录活性,AA+肉鸡的表达量大约是三黄鸡的2倍。Chen等[20]研究表明,Gimap5基因表达活性与免疫调控呈正相关,推测AA+肉鸡和三黄鸡间的免疫力存在差异,Gimap5基因在雏鸡胸腺中表达与T细胞增殖分化的相关性值得研究。此外,Gimap5基因在AA+肉鸡和三黄鸡脂肪中均具有较高表达活性。Gimap5通过调节脂肪细胞线粒体Ca2+摄取,进而调节脂肪细胞的增殖与分化[21]。Gimap5基因在AA+鸡的表达量大约是三黄鸡的2倍,暗示Gimap5基因可能是导致不同品系鸡脂肪差异沉积的因素之一。Gimap5基因在两品系鸡的大肠和小肠中也具有较高的表达活性,研究表明,Gimap5基因突变会损害免疫耐受和促进淋巴细胞凋亡,Gimap5基因突变小鼠会发生重度结肠炎[12, 22]。Gimap5基因在AA+肉鸡中的表达量大约是三黄鸡的2倍,推测Gimap5基因在肠道中的差异表达可能与不同品系鸡肠道免疫状态相关。此外,Gimap5基因在两品系鸡其他组织中的表达活性整体偏低,Gimap5基因是否发挥类似管家基因的功能有待后续研究。
炎症雏鸡模型分析表明,鸡Gimap5是炎症反应相关基因。血液Gimap5基因显著下调(P < 0.05)可能与机体炎症反应中血液应激状态相关,同时暗示,Gimap5基因在炎性疾病的诊断标记物中可能具有潜在应用价值。研究表明雏鸡接种LPS后会影响肝脏和脾脏功能[23-24],小鼠Gimap5基因功能缺失会导致T、B淋巴细胞减少[12, 25]。炎症雏鸡模型中,Gimap5基因在肝脏和脾脏中表达下调,可能与这两种外周免疫器官的炎症应激状态有关,而Gimap5基因在胸腺和法氏囊中表达上调,可能分别与T、B细胞增殖分化的活性上调有关。诚然,本研究仅进行了mRNA水平的转录活性分析,蛋白水平变化是否与mRNA水平一致以及Gimap5基因表达改变的详细机制有待后续研究。
本研究选用AA+肉鸡与三黄鸡作为实验动物,首次克隆了肉鸡Gimap5基因全长编码序列,分析Gimap5组织表达分布特性和炎症反应功能。实验表明,Gimap5基因在不同品系肉鸡间表达活性存在差异,在炎症反应的免疫相关组织中呈显著性变化。Gimap5可能是一个参与组织功能、机体发育和炎症免疫反应的多功能基因,并在炎症反应诊断标记物中具有潜在应用价值。
| [1] |
Krücken J, Schroetel RMU, Müller IU, et al. Comparative analysis of the human Gimap gene cluster encoding a novel GTPase family. Gene, 2004, 341: 291-304. DOI:10.1016/j.gene.2004.07.005 |
| [2] |
Chen XL, Serrano D, Ghobadi F, et al. TCR and IL-7 signaling are altered in the absence of functional GTPase of the immune associated nucleotide binding protein 5(GIMAP5). PLoS One, 2016, 11(3): e0151837. DOI:10.1371/journal.pone.0151837 |
| [3] |
Nitta T, Takahama Y. The lymphocyte guard-IANs:regulation of lymphocyte survival by IAN/GIMAP family proteins. Trends Immunol, 2007, 28(2): 58-65. DOI:10.1016/j.it.2006.12.002 |
| [4] |
Wong VWY, Saunders AE, Hutchings A, et al. The autoimmunity-related GIMAP5 GTPase is a lysosome-associated protein. Self Nonself, 2010, 1(3): 259-268. DOI:10.4161/self.1.3.12819 |
| [5] |
Rutledge EA, Fuller JM, van Yserloo B, et al. Sequence variation and expression of the Gimap gene family in the BB rat. Exp Diabetes Res, 2009, 2009: 835650. |
| [6] |
Wallis RH, Wang KS, Marandi L, et al. Type 1 diabetes in the BB rat:a polygenic disease. Mol Immunol, 2009, 58(4): 1007-1017. |
| [7] |
Fuller JM, Bogdani M, Tupling TD, et al. Genetic dissection reveals diabetes loci proximal to the gimap5 lymphopenia gene. Physiol Genomics, 2009, 38(1): 89-97. DOI:10.1152/physiolgenomics.00015.2009 |
| [8] |
Lang JA, Kominski D, Bellgrau D, et al. Partial activation precedes apoptotic death in T cells harboring an IAN gene mutation. Eur J Immunol, 2004, 34(9): 2396-2406. DOI:10.1002/eji.200324751 |
| [9] |
Chen XL, Serrano D, Mayhue M, et al. Gimap5 deficiency is associated with increased AKT activity in T lymphocytes. PLOS One, 2015, 10(10): e0139019. DOI:10.1371/journal.pone.0139019 |
| [10] |
Nitta T, Nasreen M, Seike T, et al. IAN family critically regulates survival and development of T lymphocytes. PLoS Biol, 2006, 4(4): e103. DOI:10.1371/journal.pbio.0040103 |
| [11] |
Cousins L, Graham M, Tooze R, et al. Eosinophilic bowel disease controlled by the BB rat-derived lymphopenia/Gimap5 gene. Gastroenterology, 2006, 131(5): 1475-1485. DOI:10.1053/j.gastro.2006.09.023 |
| [12] |
Barnes MJ, Aksoylar H, Krebs P, et al. Loss of T cell and B cell quiescence precedes the onset of microbial flora-dependent wasting disease and intestinal inflammation in Gimap5-deficient mice. J Immunol, 2010, 184(7): 3743-3754. DOI:10.4049/jimmunol.0903164 |
| [13] |
Patterson AR, Endale M, Lampe K, et al. Gimap5-dependent inactivation of GSK3β is required for CD4+ T cell homeostasis and prevention of immune pathology. Nat Commun, 2018, 9(1): 430. DOI:10.1038/s41467-018-02897-7 |
| [14] |
Mu WT, Chang Y, Zhao DX, et al. Differential expression analysis of inflammatory response related genes through LPS induction in different-breed chicken. Chin J Vet Sci, 2016, 36(6): 944-949 (in Chinese). 穆卫涛, 常杨, 赵冬雪, 等. LPS诱导不同品系雏鸡炎症反应相关基因的差异表达分析. 中国兽医学报, 2016, 36(6): 944-949. |
| [15] |
Dahéron L, Zenz T, Siracusa LD, et al. Molecular cloning of Ian4:a BCR/ABL-induced gene that encodes an outer membrane mitochondrial protein with GTP-binding activity. Nucleic Acids Res, 2001, 29(6): 1308-1316. DOI:10.1093/nar/29.6.1308 |
| [16] |
Dalberg U, Markholst H, Hornum L. Both Gimap5 and the diabetogenic BBDP allele of Gimap5 induce apoptosis in T cells. Int Immunol, 2007, 19(4): 447-453. DOI:10.1093/intimm/dxm009 |
| [17] |
Schwefel D, Fröhlich C, Eichhorst J, et al. Structural basis of oligomerization in septin-like GTPase of immunity-associated protein 2(GIMAP2). Proc Natl Acad Sci USA, 2010, 107(47): 20299-20304. DOI:10.1073/pnas.1010322107 |
| [18] |
Schwefel D, Arasu BS, Marino SF, et al. Structural insights into the mechanism of GTPase activation in the GIMAP family. Structure, 2013, 21(4): 550-559. DOI:10.1016/j.str.2013.01.014 |
| [19] |
Chen YH, Yu M, Dai XZ, et al. Critical role for Gimap5 in the survival of mouse hematopoietic stem and progenitor cells. J Exp Med, 2011, 208(5): 923-935. DOI:10.1084/jem.20101192 |
| [20] |
Chen XL, Serrano D, Mayhue M, et al. GTPase of the immune-associated nucleotide-binding protein 5(GIMAP5) regulates calcium influx in T-lymphocytes by promoting mitochondrial calcium accumulation. Biochem J, 2013, 449(2): 353-364. DOI:10.1042/BJ20120516 |
| [21] |
Wang CH, Chen YF, Wu CY, et al. Cisd2 modulates the differentiation and functioning of adipocytes by regulating intracellular Ca2+ homeostasis. Hum Mol Genet, 2014, 23(18): 4770-4785. DOI:10.1093/hmg/ddu193 |
| [22] |
Endale M, Aksoylar HI, Hoebe K. Central role of Gimap5 in maintaining peripheral tolerance and T cell homeostasis in the gut. Mediators Inflamm, 2015, 2015: 436017. |
| [23] |
Wan YH, Freeswick PD, Khemlani LS, et al. Role of lipopolysaccharide (LPS), interleukin-1, interleukin-6, tumor necrosis factor, and dexamethasone in regulation of LPS-binding protein expression in normal hepatocytes and hepatocytes from LPS-treated rats. Infect Immun, 1995, 63(7): 2435-2442. DOI:10.1128/IAI.63.7.2435-2442.1995 |
| [24] |
Groeneveld PH, van Rooijen N. Localization of intravenously injected lipopolysaccharide (LPS) in the spleen of the mouse.An immunoperoxidase and histochemical study. Virchows Arch B, 1985, 48(3): 237-245. |
| [25] |
Schulteis RD, Chu HY, Dai XZ, et al. Impaired survival of peripheral T cells, disrupted NK/NKT cell development, and liver failure in mice lacking Gimap5. Blood, 2008, 112(13): 4905-4914. DOI:10.1182/blood-2008-03-146555 |
 2020, Vol. 36
2020, Vol. 36




