中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张婷, 何青, 徐梓钧, 索菲娅, 张成武, 胡强
- Zhang Ting, He Qing, Xu Zijun, Suo Feiya, Zhang Chengwu, Hu Qiang
- 不同营养盐及浓度对黄丝藻Tribonema sp. FACHB-1786生长及脂质积累的影响
- Effects of substrate on growth and lipid accumulation of Tribonema sp. FACHB-1786
- 生物工程学报, 2020, 36(11): 2478-2493
- Chinese Journal of Biotechnology, 2020, 36(11): 2478-2493
- 10.13345/j.cjb.200264
-
文章历史
- Received: May 9, 2020
- Accepted: July 13, 2020
- Published: August 13, 2020
2. 中国科学院水生生物研究所,湖北 武汉 430072;
3. 暨南大学 水生生物研究中心,广东 广州 510632;
4. 国投生物科技投资公司,北京 100142;
5. 乌鲁木齐职业大学,新疆 乌鲁木齐 830012
2. Center for Microalgal Biotechnology and Biofuels, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, Hubei, China;
3. Research Center of Hydrobiology, Department of Ecology, Jinan University, Guangzhou 510632, Guangdong, China;
4. Microalgal Biotechnology Center, SDIC Biotech Investment Corporation, Beijing 100142, China;
5. Urumqi Vocational University, Urumchi 830012, Xinjiang, China
化石燃料的过度开发和使用,使人类陷入全球能源危机的同时,其燃烧排放的温室气体对环境和人类健康构成严重威胁。生物燃料的使用,不会净零排放二氧化碳,且可持续再生,因此被认为是可替代化石燃料的清洁型能源。微藻具有易培养、生长速率快、油脂和碳水化合物含量高、不占用耕地等优势,为更理想的生物燃料原料。目前能源微藻的研究大都集中在栅藻Scenedesmus spp.、小球藻Chlorella spp.等单细胞微藻上,微小的细胞尺寸使其在大规模培养时容易被原生动物(轮虫、变形虫等)吞食,从而引起培养系统崩溃[1-2]。离心是收获单细胞微藻最快且有效的方法,但同时也伴随着高能量的消耗和高额的设备成本。过滤、重力沉降和溶气浮等收获方法则常需要添加絮凝剂,因此在收获的微藻生物质和水中含有的絮凝剂残留物,不仅可能会污染微藻生物质,同时也不利于培养基的循环再利用[3]。由于缺乏高效经济的微藻生物质收获技术,极大地阻碍了微藻生物燃料市场化的应用和发展。
黄丝藻Tribonema sp.是一种节状不分支丝状微藻,单节细胞长7-20 μm,宽3-1.5 μm,藻丝长度为0.5-3 mm[4]。在大规模培养中,较长的藻丝及其较大细胞尺寸赋予了黄丝藻抵抗原生动物和浮游动物吞食的能力,且有助于微藻细胞的经济采收。黄丝藻还具有极高的产油能力,实验室培养条件下,其油脂含量可达细胞干重的50%以上,其中,棕榈油酸(C16:1 Δ9,Palmitoleic acid),占总脂肪酸含量的50%左右[5-7]。棕榈油酸具有良好的抗低温和抗氧化特性,因此黄丝藻被认为是适于制备优质生物燃料的重要原料。工业上,棕榈油酸还可用于1-辛烯的高效生产[8-9]。此外,棕榈油酸还具有抗菌、抗炎、抗糖尿病、抗心血管疾病、减肥等医药保健功能[10-11]。黄丝藻脂肪酸组分中还含有EPA (C20:5 ω3,eicosapentaenoic acid),可占细胞内总脂肪酸含量的11.97%[12]。EPA是人体必需的多不饱和脂肪酸,在人类生长发育和营养健康中发挥重要作用[13]。因此,黄丝藻被认为是潜在的可持续生产生物燃料和高附加值产品的重要原料。
在微藻高密度培养过程中,不同营养盐浓度、光照强度、温度、二氧化碳浓度等因素均可直接影响微藻的光合速率和代谢活性,从而影响微藻细胞生长及其各种生化组分的积累[14]。其中,营养无机盐能够在光能的作用下转化形成微藻细胞内油脂、蛋白质和碳水化合物等有机大分子。因此,研究不同营养盐浓度对微藻细胞生长和脂质积累的影响至关重要。
氮是微藻细胞中结构和功能蛋白的必要元素,是影响微藻生长和代谢的重要营养因子之一;氮的缺失会引起藻细胞内蛋白质含量下降,光合利用效率受阻,油脂或碳水化合物含量增加。磷参与合成了多种微藻正常生长代谢所需的结构和功能性细胞组分,是影响微藻生长的又一重要营养元素;缺磷会降低光合磷酸化、ATP合成水平和Calvin循环效率,从而影响叶绿素合成和细胞分裂,引起藻细胞内生化组分的变化和积累[15]。此外,铁和镁在微藻生长过程中发挥着极为重要的作用,是微藻生长的必需矿质元素。铁的含量会影响微藻对硝酸盐、亚硝酸盐的吸收和固定[16]。Mg2+是叶绿体的主要成分,与细胞内碳水化合物的合成和降解以及氮代谢有着密切的联系。Guo等[17]研究结果表明,低氮胁迫不仅会抑制丝状黄丝藻Tribonema sp.的生长,同时也会降低其细胞内油脂含量的积累;在氮充足的条件下,黄丝藻可实现高生物量和高油脂含量。Wang等[18]研究发现,低磷胁迫会抑制小型黄丝藻Tribonema minus的生长,但对其细胞内油脂含量积累无影响,不同磷浓度间小型黄丝藻油脂含量积累差异不显著(P > 0.5);缺铁会抑制小型黄丝藻的生长和脂质积累,但不同铁浓度对其生长和脂质积累无影响。徐梓钧等[19]通过研究不同初始氮浓度对囊状黄丝藻Tribonema utriculosum SAG22.94生长和油脂积累的影响,结果表明,囊状黄丝藻与Guo等[17]研究的丝状黄丝藻表现出相同的油脂积累规律;但过低或过高氮浓度均不利于其生长,囊状黄丝藻的最适生长氮浓度为255 mg/L,说明黄丝藻属具有种间特异性。
与普通的产油单细胞微藻相比,黄丝藻具有特殊的油脂积累规律,可在适宜氮浓度或氮充足条件下实现高生物量和高油脂含量,这在一定程度上解决了单细胞产油微藻在低氮胁迫下低油脂产率的难题,适合作为新型产油微藻的模式藻株进行开发利用。目前,黄丝藻在高产油脂的培养条件上的研究还相对鲜见,因此本研究以一株理想的产油丝状黄丝藻Tribonema sp. FACHB-1786为研究对象,探究不同浓度的NaNO3、K2HPO4、(NH4)3FeC12H10O14、MgSO4对其生物量和脂质积累的影响;探明不同条件下该黄丝藻生物量、油脂含量及脂肪酸组分的差异,筛选出适合该黄丝藻生长的最适营养盐浓度,并揭示其油脂积累规律,以期能够获得提高黄丝藻脂质生产效率的最佳培养策略,同时对其进行生物柴油质量评估,为后期黄丝藻应用于生物燃料的生产提供一定的理论依据和参考。
1 材料与方法 1.1 藻种和培养条件黄丝藻Tribonema sp. FACHB-1786来源于中国科学院水生生物研究所藻种库。在内径为5 cm的1 L柱状光生物反应器中添加700 mL的BG-11培养基,并通入含2% CO2的空气压缩气体搅拌、培养温度为(25±1) ℃、光照强度为300 μmol/(m2·s)、24 h持续光照条件下,用4种不同营养元素(NaNO3、K2HPO4、(NH4)3FeC12H10O14、MgSO4)的不同浓度,对黄丝藻Tribonema sp. FACHB- 1786进行条件优化研究。藻种最初接种浓度为(0.5±0.02) g/L,一周期培养时间为12 d。所有实验都进行了3个生物学重复和3个技术平行。每次取样间隔2 d,冷冻干燥后用于组分分析。
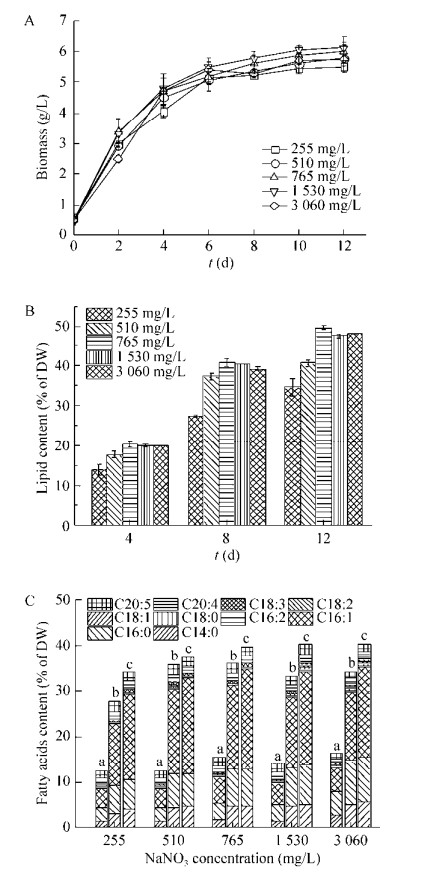
1.2 生物量的测定采用恒重法来测定生物量。在105 ℃烘箱中,将已编号的GF/C滤膜(Glass microfiber filters)置于其中,并烘干至恒重记录重量(M0)。取藻样10 mL (V),真空抽滤后放入105 ℃烘箱中烘干至恒重(M1),并与上述滤膜编号相对应记录数据。生物质浓度(Dry weight,DW)计算公式如下。
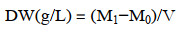
|
采用Khozin-Goldberg I、Alonzo F改良后的方法对总脂含量进行测定[20-21]。具体分析过程可参考文献[22],利用差量法计算藻粉中总脂的含量,计算公式为:

|
其中,m0为称取的干燥藻粉重量;m1为初始干燥2 mL EP管重量;m2为最终2 mL EP管和油脂的恒定重量。
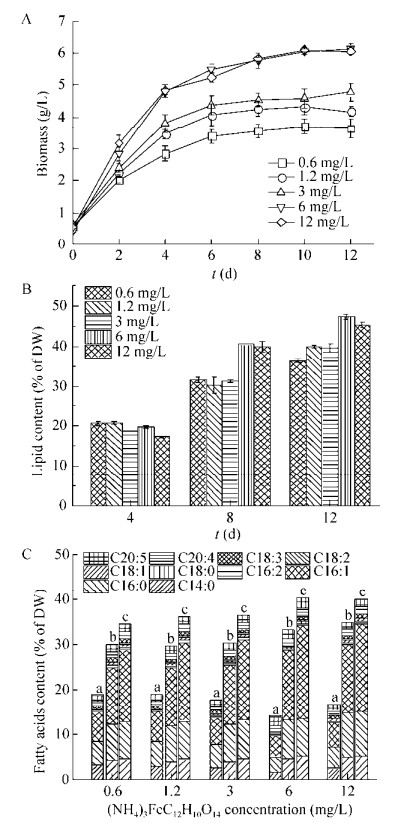
单位体积总脂产率的计算公式为:
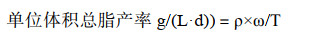
|
其中,ρ为生物质浓度,g/L;ω为总脂含量,%;Τ为培养时间。
1.4 脂肪酸成分分析采用Laurens等、Bigogno等的方法进行改良[23-24]。具体分析过程可参考文献[22]。GC-FID(气相色谱-氢火焰离子化检测器)主要仪器参数有:色谱柱HP-88 Column (60 m×0.25 mm× 0.2 μm);进样口温度250 ℃;升温程序为柱温50 ℃保持2 min,以每分钟25 ℃升温到175 ℃,保持5 min,再以每分钟7 ℃升温到210 ℃,保持2 min,最后以每分钟2 ℃升温到230 ℃,保持1 min;分流比为20:1。
1.5 生物柴油的质量评价生物柴油质量评价的指标主要有:十六烷值(Cetane number,CN)、皂化值(Saponification value,SV)、碘值(Iodine value,IV)、长链饱和因子(Long-chain saturated factor,LCSF)和凝点(Cold filter plugging point,CFPP)等,利用各数学模型对上述参数进行评估[25-26]。

|
其中,db为脂肪酸的双键数目;mi为脂肪酸的百分含量(%);M为各脂肪酸的分子量;C16、C18、C20、C22、C24为对应各脂肪酸的百分含量(下文用缩写字母代表各指标)。
1.6 数据处理利用软件Office Excel 2010和Origin10.3对结果进行作图分析,统计检验采用SPSS (19.0版)中的单因素方差分析进行,P < 0.05为差异有统计学意义。
2 结果与分析 2.1 不同起始NaNO3浓度对黄丝藻FACHB-1786生物量及脂质积累的影响实验设置5个不同氮元素浓度(255、510、765、1 530、3 060 mg/L)对黄丝藻FACHB-1786进行培养,其中1 530 mg/L为正常BG-11培养基氮浓度,在此氮浓度条件下获得最大生物量为6.12 g/L。但单因素方差分析表明,各氮浓度组间生物量差异不显著(P > 0.05)。不同NaNO3初始浓度对黄丝藻FACHB-1786生物量影响不显著(图 1A),而对总脂含量积累影响较显著(图 1B)。在培养12 d氮浓度为765 mg/L的条件下,获得最大总脂含量占细胞干重的49.57%。在初始培养阶段,藻细胞总脂含量积累受不同初始氮浓度的影响不大;在培养后期,NaNO3浓度在765-3 060 mg/L范围内对总脂含量的影响均不显著(P > 0.05),而在255-510 mg/L范围时与其相比具有显著性差异(P < 0.05)。黄丝藻总脂肪酸含量均随培养时间的延长而增加(图 1C)。在培养12 d NaNO3浓度为1 530 mg/L时获得最大总脂肪酸含量为40.69%。脂肪酸组成成分主要为棕榈酸(C16:0)、豆蔻酸(C14:0)、棕榈油酸(C16:1)、二十碳四烯酸(C20:4)和二十碳五烯酸(C20:5),这5种脂肪酸含量可占细胞内总脂肪酸含量的90%以上,其中含量最高的是棕榈油酸,占总脂肪酸含量56.87%,EPA占总脂肪酸含量高达15.6%。
|
| 图 1 不同起始NaNO3浓度对黄丝藻Tribonema sp. FACHB-1786生物量(A)、油脂(B)和脂肪酸含量(C)积累的影响(a: 4 d;b: 8 d;c: 12 d) Fig. 1 Effects of different initial NaNO3 concentrations on the accumulation of biomass (A), lipid (B) and fatty acids contents (C) of Tribonema sp. FACHB-1786. a: 4 d; b: 8 d; c: 12 d. |
| |
实验设置7个不同磷元素浓度(4、8、20、40、80、160、240 mg/L)对黄丝藻FACHB-1786进行培养,其中40 mg/L为正常BG-11培养基磷浓度。不同初始K2HPO4浓度对黄丝藻FACHB- 1786生物量影响差异显著(图 2A)。在培养前2天,黄丝藻生长速率随磷浓度增加而加快,后随培养时间延长,低浓度和过高浓度的磷元素均会抑制藻细胞生长,黄丝藻在磷浓度为80 mg/L时,获得最大生物量为6.42 g/L,各浓度组间生物量具有显著性差异(P < 0.05)。在培养初期,黄丝藻在4-8 mg/L和160-240 mg/L磷浓度条件下,细胞内积累的总脂含量均显著高于20-80 mg/L磷浓度条件下的总脂含量(P < 0.05) (图 2B);与上述生物量相结合,该黄丝藻在适宜磷浓度下可快速生长积累生物质,而在受到胁迫(缺磷或富磷)时,藻细胞开始积累油脂。在培养后期,随着培养时间延长,磷浓度降低,黄丝藻在20-80 mg/L低磷浓度胁迫下积累油脂,80 mg/L的磷浓度条件下获得最大总脂含量,占细胞干重的51.08%,但各磷浓度组间总脂含量差异不显著(P > 0.05)。其细胞内总脂肪酸含量变化与总脂含量的变化相对应(图 2C)。在培养12 d K2HPO4浓度为80 mg/L时获得最大总脂肪酸含量为48.41%,显著高于其他各浓度组(P < 0.5)。其中棕榈油酸占总脂肪酸含量的54.65%,EPA最高可占总脂肪酸含量的11.84%。

|
| 图 2 不同起始K2HPO4浓度对黄丝藻Tribonema sp. FACHB-1786生物量(A)、油脂(B)和脂肪酸含量(C)积累的影响 Fig. 2 Effects of different initial K2HPO4 concentrations on the accumulation of biomass (A), lipid (B) and fatty acids contents (C) of Tribonema sp. FACHB-1786. |
| |
实验设置5个Fe2+浓度(0.6、1.2、3、6、12 mg/L)对黄丝藻FACHB-1786进行培养,其中6 mg/L为常用BG-11培养基Fe2+浓度,在该Fe2+浓度条件下获得最大生物量为6.12 g/L (图 3A)。当Fe2+浓度从0.6 mg/L增加至6 mg/L时,该黄丝藻生物量与Fe2+浓度成正比例关系,且各组间生物量具有显著性差异(P < 0.05);而当继续增加Fe2+浓度至12 mg/L时,黄丝藻生物量不再增加,与培养基正常Fe2+浓度组生物量差异不显著(P > 0.05)。不同Fe2+浓度对黄丝藻总脂含量积累影响显著(图 3B)。培养初期,不同Fe2+浓度对黄丝藻细胞内油脂积累影响不大;但随培养时间延长,黄丝藻在Fe2+浓度为0.6-3 mg/L之间时,细胞内总脂含量差异不显著(P > 0.05),在Fe2+浓度为6-12 mg/L之间总脂含量差异不显著(P > 0.05),但在这两种相对低Fe2+浓度与充足Fe2+浓度之间总脂含量具有显著性差异(P < 0.05);黄丝藻在Fe2+浓度为6 mg/L时,获得最大总脂含量,占细胞干重的47.77%。该黄丝藻细胞内棕榈油酸占细胞干重的含量随培养时间延长而增加(图 3C),在Fe2+浓度6 mg/L条件下,棕榈油酸占总脂肪酸含量从初期的34.55%增加到后期的50.66%,EPA最高占总脂肪酸含量的14.37%。
|
| 图 3 不同起始(NH4)3FeC12H10O14浓度对黄丝藻Tribonema sp. FACHB-1786生物量(A)、油脂(B)和脂肪酸含量(C)积累的影响 Fig. 3 Effects of different initial (NH4)3FeC12H10O14 concentrations on the accumulation of biomass (A), lipid (B) and fatty acids contents (C) of Tribonema sp. FACHB-1786. |
| |
实验设置7个Mg2+浓度(7.5、15、37.5、75、150、300、450 mg/L)对黄丝藻FACHB-1786进行培养,其中75 mg/L为常用BG-11培养基Mg2+浓度,当初始Mg2+浓度从7.5 mg/L增加至450 mg/L时,该黄丝藻生物量随Mg2+浓度增加而增加,在Mg2+浓度为450 mg/L时,获得最大生物量为8.09 g/L (图 4A);当Mg2+浓度低于37.5 mg/L时,黄丝藻生长受到明显抑制。各浓度组间生物量具有显著性差异(P < 0.05)。不同Mg2+浓度对黄丝藻总脂含量积累影响显著(图 4B)。培养前期,藻细胞内油脂积累量随Mg2+浓度增加而下降;随培养时间延长,过高或过低的Mg2+浓度均不利于黄丝藻油脂含量的积累,在300-450 mg/L Mg2+浓度条件下,该藻总脂含量仅占细胞干重的27.5%左右,显著低于其他各Mg2+浓度组(P < 0.05);而在Mg2+浓度为75 mg/L条件下,获得最高总脂含量,占细胞干重的47.41%,显著高于其他各浓度组(P < 0.05);同时,也在该浓度条件下获得最高棕榈油酸含量,占细胞内总脂肪酸含量的50.99% (图 4C)。

|
| 图 4 不同起始MgSO4浓度对黄丝藻Tribonema sp. FACHB-1786生物量(A)、油脂(B)和脂肪酸含量(C)积累的影响 Fig. 4 Effects of different initial MgSO4 concentrations on the accumulation of biomass (A), lipid (B) and fatty acids contents (C) of Tribonema sp. FACHB-1786. |
| |
在4种不同营养盐(NaNO3、K2HPO4、(NH4)3FeC12H10O14、MgSO4)的不同浓度培养条件下,黄丝藻棕榈油酸和EPA产率均随各营养盐浓度增加呈先上升后下降的趋势(表 1)。在培养第8天,NaNO3浓度为765 mg/L、K2HPO4浓度为80 mg/L、(NH4)3FeC12H10O14浓度为6 mg/L和MgSO4浓度为75 mg/L时获得最大棕榈油酸产率,分别为129.56 mg/(L·d)、135.74 mg/(L·d)、111.73 mg/(L·d)和111.73 mg/(L·d)。而EPA产率均随培养时间延长呈下降趋势,在培养第4天,NaNO3浓度为1 530 mg/L、K2HPO4浓度为40 mg/L、(NH4)3FeC12H10O14浓度为6 mg/L和MgSO4浓度为75 mg/L时获得最大EPA产率,为24.2 mg/(L·d)。
| Nutrients | Concentrations | 4 d | 8 d | 12 d | |||
| C16:1 | C20:5 | C16:1 | C20:5 | C16:1 | C20:5 | ||
| NaNO3 (mg/L) | 255 | 43.06±2.196 | 18.30±0.93 | 90.03±0.97 | 15.56±0.17 | 85.62±2.98 | 8.81±0.31 |
| 510 | 47.68±3.23 | 20.27±1.37 | 123.34±5.09 | 15.92±0.66 | 101.94±7.40 | 10.25±0.74 | |
| 765 | 67.27±6.15 | 23.20±2.12 | 129.56±6.65 | 15.83±0.81 | 109.16±8.63 | 10.19±0.81 | |
| 1 530 | 56.91±0.83 | 24.20±0.35 | 111.73±4.38 | 15.23±0.60 | 105.09±3.05 | 12.33±0.36 | |
| 3 060 | 62.61±7.36 | 14.12±1.66 | 99.51±2.69 | 9.92±0.27 | 93.638±1.96 | 8.015±0.17 | |
| K2HPO4 (mg/L) | 4 | 51.90±0.99 | 7.29±0.14 | 50.15±1.25 | 3.88±0.10 | 44.10±0.79 | 2.89±0.05 |
| 8 | 56.58±1.08 | 9.41±0.18 | 63.63±0.61 | 5.34±0.05 | 54.59±6.47 | 3.56±0.42 | |
| 20 | 60.73±0.05 | 13.86±0.01 | 98.80±0.81 | 9.69±0.08 | 94.39±2.40 | 6.77±0.17 | |
| 40 | 80.88±1.18 | 24.20±0.35 | 111.73±4.38 | 15.22±0.60 | 105.09±3.05 | 12.33±0.36 | |
| 80 | 62.58±3.09 | 17.44±0.86 | 135.74±3.60 | 11.87±0.31 | 124.66±4.86 | 7.93±0.31 | |
| 160 | 77.63±2.40 | 16.08±0.50 | 79.95±0.49 | 8.02±0.05 | 88.18±1.32 | 5.78±0.09 | |
| 240 | 79.19±0.81 | 16.33±0.17 | 83.27±4.08 | 8.05±0.39 | 85.28±0.24 | 6.15±0.02 | |
| (NH4)3FeC12H10O14 (mg/L) | 0.6 | 46.52±3.57 | 11.35±0.87 | 57.24±3.58 | 7.16±0.45 | 49.14±3.88 | 5.06±0.40 |
| 1.2 | 57.19±2.59 | 13.67±0.62 | 68.84±3.85 | 8.59±0.48 | 60.28±2.45 | 6.11±0.25 | |
| 3 | 57.77±4.22 | 14.55±1.06 | 75.87±3.72 | 8.65±0.42 | 71.52±4.07 | 6.48±0.37 | |
| 6 | 56.91±0.83 | 24.20±0.35 | 111.73±4.38 | 15.22±0.60 | 105.09±3.05 | 12.33±0.36 | |
| 12 | 65.79±2.72 | 19.03±0.79 | 111.02±1.07 | 11.13±0.11 | 98.00±1.64 | 7.88±0.13 | |
| MgSO4 (mg/L) | 7.5 | 33.59±2.78 | 6.47±0.54 | 38.41±3.23 | 3.81±0.32 | 27.43±2.16 | 2.16±0.17 |
| 15 | 30.50±4.15 | 6.10±0.83 | 42.46±4.66 | 3.98±0.44 | 30.36±3.12 | 2.44±0.25 | |
| 37.5 | 34.09±1.18 | 6.84±0.24 | 54.03±0.20 | 5.37±0.02 | 44.51±0.55 | 3.36±0.04 | |
| 75 | 56.91±0.83 | 24.20±0.35 | 111.73±4.38 | 15.22±0.60 | 105.09±3.05 | 12.33±0.36 | |
| 150 | 44.04±1.21 | 14.92±0.41 | 61.02±2.46 | 11.02±0.45 | 109.58±3.46 | 9.25±0.29 | |
| 300 | 30.44±3.07 | 16.54±1.67 | 66.53±2.22 | 12.17±0.41 | 74.81±2.25 | 9.37±0.28 | |
| 450 | 32.56±1.92 | 17.96±1.06 | 68.54±0.54 | 13.00±0.10 | 71.13±1.37 | 9.61±0.18 | |
黄丝藻均在培养第8天时获得最大总脂单位体积产率。在不同NaNO3浓度梯度中(图 5A),总脂单位体积产率最高在765 mg/L和1 530 mg/L氮浓度的条件下,可高达290.98 mg/(L·d),显著高于其他各浓度组(P < 0.05)。在不同K2HPO4浓度梯度中(图 5B),该藻在磷浓度为80 mg/L时获得最大总脂单位体积产率,为319.58 mg/(L·d),高于其他各浓度组。在不同(NH4)3FeC12H10O14浓度梯度实验中(图 5C),黄丝藻在6 mg/L和12 mg/L Fe2+浓度条件下获得高总脂单位体积产率,为290.62 mg/(L·d),极显著高于其他相对低Fe2+浓度组(P < 0.01)。在不同MgSO4浓度梯度中(图 5D),Mg2+浓度在75 mg/L条件下获得最大总脂单位体积产率,为291.92 mg/(L·d),极显著高于其他各浓度组(P < 0.01)。综合以上实验结果表明,黄丝藻FACHB-1786在NaNO3浓度为765 mg/L、K2HPO4浓度为80 mg/L、柠檬酸铁铵浓度为6 mg/L、MgSO4浓度为75 mg/L条件下培养至8 d,可获得最大总脂单位体积产率。

|
| 图 5 不同营养盐初始浓度对黄丝藻Tribonema sp. FACHB-1786总脂单位体积产率的影响 Fig. 5 Effects of initial concentrations of different nutrients on total lipits volumetric productivities of Tribonema sp. FACHB-1786 FACHB-1786. (A) NaNO3.(B) K2HPO4. (C) (NH4)3FeC12H10O14. (D) MgSO4. |
| |
根据微藻的脂肪酸组成,利用相应的数学模型[25-26]分别计算SV、IV、CN、LCSF、CFPP,来对黄丝藻生产生物柴油的质量进行评价。CN是衡量燃烧性能的重要指标,较高的十六烷值可以保证燃料均匀燃烧、发动机工作平稳、热功率高、耗油量低、排放正常[27]。通过相关公式计算出黄丝藻FACHB-1786在不同营养盐浓度下培养至第8天的生物柴油质量数据,并与欧盟(EN 14214-2002)≥51、美国(ASTMD6751-2003) 47-65、德国(DIN V51606-1997)≥49和中国(GB/T20828- 2007)≥49[28-30]生物柴油标准相关指标进行比较(表 2)。结果表明,NaNO3组在氮浓度3 060 mg/L时CN值较高为52.69;K2HPO4组中浓度为80 mg/L时CN值最高为53.01;(NH4)3FeC12H10O14组中浓度为12 mg/L时CN值最高为51.80;MgSO4组中浓度为15 mg/L时CN值最高为50.83。黄丝藻在各培养条件下的油脂IV值均符合中国、欧盟和美国规定小于120的标准[31]。
| Nutrients | Concentration | C14 | C16 | C18 | C20 | SN | IV | CN | CFPP | LCSF |
| (%TFA) | (%TFA) | (%TFA) | (%TFA) | |||||||
| NaNO3 (mg/L) | 255 | 11.22 | 72.35 | 1.87 | 14.55 | 217.06 | 112.98 | 46.02 | -15.76 | 0.23 |
| 510 | 12.35 | 72.35 | 3.25 | 10.91 | 215.84 | 100.88 | 48.89 | -15.86 | 0.2 | |
| 765 | 13.15 | 76.03 | 1.64 | 10.81 | 222.48 | 100.47 | 48.23 | -15.87 | 0.19 | |
| 1 530 | 13.97 | 74.62 | 2.43 | 10.73 | 222.77 | 96.06 | 49.19 | -15.87 | 0.19 | |
| 3 060 | 14.27 | 73.33 | 4.16 | 8.24 | 219.4 | 82.15 | 52.69 | -15.92 | 0.18 | |
| K2HPO4 (mg/L) | 4 | 11.06 | 76.52 | 3.96 | 8.46 | 218.67 | 92.26 | 50.5 | -15.91 | 0.18 |
| 8 | 11.46 | 76.03 | 4.23 | 8.28 | 218.75 | 89.99 | 51 | -15.91 | 0.18 | |
| 20 | 11.65 | 75.26 | 4.11 | 8.98 | 218.56 | 90.81 | 50.84 | -15.89 | 0.19 | |
| 40 | 13.97 | 74.62 | 2.45 | 10.73 | 222.81 | 96.09 | 49.18 | -15.87 | 0.19 | |
| 80 | 14.12 | 75.33 | 3.44 | 7.11 | 219.94 | 80.46 | 53.01 | -15.96 | 0.16 | |
| 160 | 19.79 | 68.95 | 3.78 | 7.48 | 221.24 | 80.26 | 52.91 | -15.97 | 0.16 | |
| 240 | 19.69 | 69.69 | 3.21 | 7.41 | 221.37 | 80.32 | 52.88 | -15.97 | 0.16 | |
| (NH4)3FeC12H10O14 (mg/L) | 0.6 | 13.44 | 71.34 | 5.49 | 9.73 | 218.47 | 93.05 | 50.35 | -15.86 | 0.2 |
| 1.2 | 12.69 | 72.16 | 5.52 | 9.63 | 218.31 | 93.77 | 50.2 | -15.86 | 0.2 | |
| 3 | 12.93 | 72.71 | 5.13 | 9.24 | 218.59 | 91.82 | 50.61 | -15.88 | 0.19 | |
| 6 | 13.97 | 74.62 | 2.45 | 10.73 | 222.81 | 96.09 | 49.18 | -15.87 | 0.19 | |
| 12 | 13.72 | 73.28 | 4.58 | 8.42 | 219.16 | 86.23 | 51.8 | -15.91 | 0.18 | |
| MgSO4 (mg/L) | 7.5 | 12.36 | 76.91 | 2.17 | 8.56 | 219.36 | 91.62 | 50.57 | -15.93 | 0.17 |
| 15 | 12.46 | 77.1 | 2.09 | 8.36 | 219.46 | 90.41 | 50.83 | -15.94 | 0.17 | |
| 37.5 | 12.15 | 76.55 | 2.68 | 8.62 | 219.15 | 90.83 | 50.77 | -15.92 | 0.18 | |
| 75 | 13.97 | 74.62 | 2.45 | 10.73 | 222.81 | 96.09 | 49.18 | -15.87 | 0.19 | |
| 150 | 10.62 | 73.08 | 3.49 | 12.81 | 217.03 | 100.02 | 48.94 | -15.79 | 0.22 | |
| 300 | 8.41 | 71.45 | 5.7 | 14.43 | 215.55 | 114.28 | 45.91 | -15.71 | 0.24 | |
| 450 | 8.92 | 70.25 | 5.74 | 15.09 | 215.47 | 117.78 | 45.13 | -15.69 | 0.25 |
SV值是衡量油脂腐蚀性和使用性能的重要指标,其越大越易引起发动机内积碳增加、喷嘴结焦,从而影响生物柴油的燃烧性。与石化柴油相比本文中各油脂SV值偏大,但均在可接受的质量范围内。CFPP是衡量燃料低温流动性的重要参数,CFPP越小表明生物柴油低温性能越好[32]。在各培养条件下的油脂均在-15 ℃左右,表明该黄丝藻具有较好的CFPP。LCSF表示长链饱和脂肪酸的比例,其越大生物柴油的低温性越差,各培养条件下油脂LCSF在0.17-0.25,在各营养元素培养组中NaNO3浓度3 060 mg/L、K2HPO4浓度为80-240 mg/L、(NH4)3FeC12H10O14浓度12 mg/L、MgSO4浓度为7.5-15 mg/L时的LCSF最小,具有较好的低温稳定性。
3 讨论自然界中,微藻需要同化其生境中的氮元素来满足自身的生长和繁殖,但不同藻种对氮源的种类和浓度需求不同[33]。苏怡等[34]研究表明不同氮浓度除影响真眼点藻纲8株微藻的生长外,还影响藻细胞内油脂含量积累和脂肪酸组成。Li等[35]研究表明微藻在环境胁迫条件下,其细胞内作用于脂肪酸和三酰甘油酯(TAG)生物合成途径的多种关键酶(如乙酰辅酶A羧化酶(ACCase)、二酰基甘油酰基转移酶(DGAT)、半乳糖基转移酶(GTs)、甘油-3-磷酸酰基转移酶(GPAT))等活性被提高,从而促进藻细胞内油脂含量的积累。比如,低氮胁迫能够促进拟微绿球藻Nannochloropsis spp.、小球藻、栅藻、牟氏角毛藻Chaetoceros muelleri、舟形藻Navicula saprophila和筒柱藻Cylindrotheca fusiformis等单细胞藻类的脂质积累,但同时低氮胁迫也会使其生长受到抑制[36-38]。本次研究在以NaNO3为氮源的几种氮浓度条件下对黄丝藻FACHB-1786进行了培养,结果表明,相较于氮限制,充足的氮浓度(765-3 060 mg/L)更有利于黄丝藻的生长和藻细胞内油脂含量的积累。这与Guo等[17]、徐梓钧等[19]研究的其他株系黄丝藻表现出相同的油脂积累规律,认为在氮充足的培养条件下,黄丝藻可以积累更多的油脂,这与以往研究的产油单细胞微藻在低氮胁迫条件下的脂质积累规律不同,说明黄丝藻可能具有特殊的脂质积累规律。此外,我们的研究结果还表明,黄丝藻的生物量在氮浓度为255-3 060 mg/L之间无显著差异,这与Guo等[17]研究结果类似,但与徐梓钧等[19]对囊状黄丝藻SAG22.94的研究结果不同,说明黄丝藻在不同氮浓度条件下生长具有种间特异性。
磷作为一种宏观元素,在藻类细胞生长、代谢和其他生命过程(如光合作用、呼吸作用、信号转导和ATP合成)中发挥重要作用。本次研究结果显示,不同磷浓度对黄丝藻FACHB-1786生长影响差异显著,其生长的最适磷浓度为80 mg/L。Liang等和Mandotra等[39-40]的研究结果也表明了微藻生长需要一定的磷浓度,缺磷会降低微藻细胞内光合磷酸化水平、ATP合成和Calvin循环效率,影响叶绿素合成和细胞分裂过程,从而影响微藻的生长。而过高的磷浓度,可能会使培养基中氮/磷比例失调,从而抑制微藻的生长。此外,本研究中不同磷浓度对黄丝藻油脂含量积累的影响差异不显著(P > 0.05),这与以往单细胞微藻在受到高低磷胁迫条件下脂质积累的研究结果不一致[39-41]。Liang等[39]研究表明,缺磷会使小球藻细胞分裂速率减慢,但对光合速率影响较小,导致细胞中碳的大量积累,而过量的碳源可被藻细胞持续利用,并进入Krebs循环,从而使油脂生物合成途径中ACCAse等关键酶的活性增强,促进藻细胞内油脂含量的积累。然而,由于磷浓度对黄丝藻生物量的影响,仍导致其总脂单位体积产率的不同。这与Wang等[18]对小型黄丝藻T. minus的研究结果一致。说明在氮、磷胁迫条件下,与其他常见的含油单细胞微藻相比,黄丝藻具有特殊的脂质代谢途径,但具体机理还尚不清楚,有待后续进一步研究。
铁是微藻细胞内氧化还原反应的必需元素,在光合、呼吸、固氮、DNA合成和金属蛋白的催化反应等生命活动中发挥重要作用。本研究结果表明,低铁胁迫会抑制黄丝藻细胞的生长和脂质含量的积累,其生长和脂质积累的最适Fe2+浓度为6 mg/L,在该铁离子浓度下可获得更高的总脂、总脂肪酸含量、棕榈油酸和EPA产率。该结果与Liu等[42]报道关于小球藻的研究结果相似。但与Wang等[18]报道的0.6-6 mg/L的铁离子浓度对小型黄丝藻生长和脂质积累的研究结果不一致,再次说明黄丝藻的种间特异性。以往研究认为在铁元素过剩的培养条件下,Fe2+可能通过铁催化Fenton反应产生羟自由基(-OH),-OH和其他一些活跃的氧基团(1O2、O2-、H2O2或AO2-)对促进藻细胞内生物活性物质合成起着关键作用[43]。刘彩霞等[44]研究结果表明,缺铁和高铁对小球藻生长均具有胁迫效应,在缺铁条件下,小球藻生长受抑制,但能获得较高油脂含量;高浓度铁能促进小球藻生长,但不利于藻细胞油脂的积累。Concas等[45]提出,一定浓度的铁可能会导致自由基的产生增加,从而改变脂质合成的相关代谢途径。另一种观点认为铁可能会增加乙酰辅酶A羧化酶(ACCase)的活性,加速乙酰辅酶A向丙二酰辅酶A不可逆羧化,导致脂质的积累。
镁是植物生长必需的营养元素,其作为叶绿素的中心原子,对维持叶绿素结构和功能发挥重要作用,在光能及酶促作用中参与光合作用和糖类、蛋白质、脂肪等代谢活动。Huang等[46]研究表明,小球藻在异养过程中,缺镁胁迫能显著增加藻细胞内油脂含量。张硕等[47]研究表明少量的Mg2+对微藻生长及色素合成具有一定的促进作用,但过高浓度的Mg2+会抑制内生蓝藻Endogenous cyanobacteria的生长,其生长的最适Mg2+浓度为45 mg/L。张森等[48]发现0.03-0.3 mmol/L的镁浓度对链带藻Desmodesmus sp.的生长和油脂含量几乎无影响。说明不同微藻对Mg2+浓度需求不同。我们首次探究了镁离子浓度对黄丝藻生长和油脂积累的影响,结果表明,高浓度镁离子能显著增加该黄丝藻生物量,但不利于其油脂的积累;而过低的镁离子浓度,会导致藻细胞生长代谢停滞。推测认为可能在高镁离子浓度下,黄丝藻细胞内叶绿体含量增加,光合作用效率提高,细胞分裂旺盛,促使藻细胞快速生长。然而只有在适当镁离子浓度(75 mg/L)下,黄丝藻才能获得更高的总脂、总脂肪酸含量和棕榈油酸和EPA产率。王珊等[49]研究结果表明,缺镁胁迫会抑制藻细胞中叶绿素合成,从而影响光合作用,导致微藻生长受到抑制、蛋白质合成受阻,使碳同化进入脂类合成代谢途径,促进微藻油脂含量增加。其次,Mg2+还通过影响细胞内脂肪酸合成关键酶乙酰辅酶A羧化酶的活性,进而影响微藻脂肪酸的合成。因此,在后续的规模化培养研究时可以考虑对黄丝藻进行镁浓度两步法添加培养,如先在高Mg2+浓度条件下提高黄丝藻生物量,再在常用培养基的Mg2+浓度下诱导藻细胞脂质积累。Wang等[50]对小型黄丝藻T. minus正常培养条件下脂质积累和代谢分析,结果表明,T. minus细胞内编码ACCase基因(EC 6.4.1.2)、G3P-酰基转移酶基因(GPAT,EC 2.3.1.15)和磷脂:二酰基甘油酰基转移酶基因(PDAT,EC 2.3.1.158)在稳定期会显著上调,促进了T. minus细胞内脂肪酸和TAG的生物合成。这对我们了解黄丝藻FACHB-1786脂质积累的生物合成和代谢途径有一定的帮助,但对其在特殊环境下的脂质代谢机制还有待进一步研究。
总脂单位体积产率是综合油脂含量和生物量来反映微藻产油性能的一个重要评价指标。黄丝藻(FACHB-1786)在765 mg/L NaNO3、80 mg/L K2HPO4、6 mg/L (NH4)3FeC12H10O14、75 mg/L MgSO4培养条件下其总脂单位体积产率高达319.58 mg/(L·d)。Haik等[51]研究表明藻类甲酯化后所产生的油脂,其物理和化学性质与生物柴油燃料的性能更为相似,对发动机的使用性能和使用寿命更为有益。Knothe[32]、吴桂秀等[52]研究认为,脂肪酸的饱和程度是影响生物柴油性质的重要因素,饱和脂肪酸能够增加生物柴油氧化稳定性和点火性,但会降低其低温流动性。相反地,多不饱和脂肪酸能够提高生物柴油低温流动性,但同时也会降低其稳定性。因此,评价一株微藻是否适合作为原料生产生物柴油时,其脂肪酸的组成成分的分析是非常重要的。Miao等[53]研究认为,碳原子在C12-C18之间的脂肪酸能够有效提高生物柴油的十六烷值。黄丝藻FACHB-1786的单不饱和及饱和脂肪酸可占总脂肪酸含量的50%以上,这更有助于提高其油脂的CN值、抗氧化性和增强油脂的抗低温性能,通过对其进行生物柴油质量评估,证明其是适合生产生物柴油的一个重要原料。
4 总结与展望本研究通过对氮、磷、铁、镁4种营养盐的不同浓度进行培养优化,获得提高黄丝藻FACHB-1786脂质生产效率的最佳营养盐浓度为765 mg/L NaNO3、80 mg/L K2HPO4、6 mg/L (NH4)3 FeC12H10O14和75 mg/L MgSO4,为后期该藻投用于室外规模化培养和生产提供一定的理论依据和参考。其中,我们首次探究了镁离子浓度对黄丝藻生长和脂质含量积累的影响,结果表明,提高镁离子能够显著提高黄丝藻的生物量,在镁离子浓度为450 mg/L时,获得最大生物质浓度为8.09 g/L,是目前报道的黄丝藻在自养条件下的最高生物量。因此,后期我们可设计实验采用两步法添加镁离子浓度对黄丝藻进行诱导培养,先在高镁离子浓度下提高黄丝藻生物量,再在常用培养基的镁浓度下诱导藻细胞内脂质积累。此外,黄丝藻在不同氮、磷、铁浓度下藻细胞生长规律与以往研究的其他株系的黄丝藻有所差异,说明黄丝藻具有种间特异性。同时,黄丝藻在不同氮、磷浓度下藻细胞内油脂含量的积累规律也不同于传统的产油单细胞微藻,说明黄丝藻具有特殊的脂质积累代谢规律,其具体油脂积累代谢途径还尚不清楚,有待后续进一步研究。
5 致谢感谢武汉中国科学院水生生物研究所提供黄丝藻的藻种;感谢国投生物科技投资有限公司、国投微藻生物科技中心微藻生物能源与资源北京市重点实验室提供实验平台。
| [1] |
Wang H, Zhang W, Chen L, et al. The contamination and control of biological pollutants in mass cultivation of microalgae. Bioresour Technol, 2013, 128: 745-750. DOI:10.1016/j.biortech.2012.10.158 |
| [2] |
Sydney EB, Da Silva TE, Tokarski A, et al. Screening of microalgae with potential for biodiesel production and nutrient removal from treated domestic sewage. Appl Energ, 2011, 88(10): 3291-3294. DOI:10.1016/j.apenergy.2010.11.024 |
| [3] |
Barros AI, Gonçalves AL, Simões M, et al. Harvesting techniques applied to microalgae: a review. Renew Sust Energ Rev, 2015, 41: 1489-1500. DOI:10.1016/j.rser.2014.09.037 |
| [4] |
Wang H, Gao LL, Chen L, et al. Integration process of biodiesel production from filamentous oleaginous microalgae Tribonema minus. Bioresour Technol, 2013, 142: 39-44. DOI:10.1016/j.biortech.2013.05.058 |
| [5] |
Wang H, Gao LL, Zhou WJ, et al. Growth and palmitoleic acid accumulation of filamentous oleaginous microalgae Tribonema minus at varying temperatures and light regimes. Bioproc Biosyst Eng, 2016, 39(10): 1589-1595. DOI:10.1007/s00449-016-1633-6 |
| [6] |
Wang H, Zhou WJ, Shao HM, et al. A comparative analysis of biomass and lipid content in five Tribonema sp. strains at autotrophic, heterotrophic and mixotrophic cultivation. Algal Res, 2017, 24: 284-289. DOI:10.1016/j.algal.2017.04.020 |
| [7] |
Zhou WJ, Wang H, Chen L, et al. Heterotrophy of filamentous oleaginous microalgae Tribonema minus for potential production of lipid and palmitoleic acid. Bioresour Technol, 2017, 239: 250-257. DOI:10.1016/j.biortech.2017.05.045 |
| [8] |
Wang H, Ji CL, Bi SL, et al. Joint production of biodiesel and bioethanol from filamentous oleaginous microalgae Tribonema sp. Bioresour Technol, 2014, 172: 169-173. DOI:10.1016/j.biortech.2014.09.032 |
| [9] |
Kolouchová I, Sigler K, Schreiberová O, et al. New yeast-based approaches in production of palmitoleic acid. Bioresour Technol, 2015, 192: 726-734. DOI:10.1016/j.biortech.2015.06.048 |
| [10] |
Wang FF, Hu Q, Zhang CW. Recent research advance on palmitoleic acid of microalgae. Nat Prod Res Dev, 2017, 29(7): 1240-1247, 1198 (in Chinese). 王飞飞, 胡强, 张成武. 微藻中棕榈油酸的研究进展. 天然产物研究与开发, 2017, 29(7): 1240-1247, 1198. |
| [11] |
Moloudizargari M, Mortaz E, Asghari MH, et al. Effects of the polyunsaturated fatty acids, EPA and DHA, on hematological malignancies: a systematic review. Oncotarget, 2018, 9(14): 11858-11875. DOI:10.18632/oncotarget.24405 |
| [12] |
Wang H, Ji B, Wang JF, et al. Growth and biochemical composition of filamentous microalgae Tribonema sp. as potential biofuel feedstock. Bioproc Biosyst Eng, 2014, 37(12): 2607-2613. DOI:10.1007/s00449-014-1238-x |
| [13] |
Innes J, Calder PC. The differential effects of eicosapentaenoic acid and docosahexaenoic acid on cardiometabolic risk factors: a systematic review. Int J Mol Sci, 2018, 19(2): 532. DOI:10.3390/ijms19020532 |
| [14] |
Krzemińska I, Piasecka A, Nosalewicz A, et al. Alterations of the lipid content and fatty acid profile of Chlorella protothecoides under different light intensities. Bioresour Technol, 2015, 196: 72-77. DOI:10.1016/j.biortech.2015.07.043 |
| [15] |
Raghothama KG. Phosphate transport and signaling. Curr Opin Plant Biol, 2000, 3(3): 182-187. DOI:10.1016/S1369-5266(00)00062-5 |
| [16] |
Xia JL, Li L, Wan MX, et al. Isolation and identification of two strains of microalgae and the effect of Fe3+ on their growth and lipid accumulation. J Wuhan Univ: Nat Sci Ed, 2010, 56(3): 325-330 (in Chinese). 夏金兰, 李丽, 万民熙, 等. 两株微藻的分离鉴定及Fe3+对其生长和脂质积累的影响. 武汉大学学报:理学版, 2010, 56(3): 325-330. |
| [17] |
Guo FJ, Wang H, Wang JF, et al. Special biochemical responses to nitrogen deprivation of filamentous oleaginous microalgae Tribonema sp. Bioresour Technol, 2014, 158: 19-24. DOI:10.1016/j.biortech.2014.01.144 |
| [18] |
Wang H, Zhou WJ, Cheng WT, et al. Strategy study on enhancing lipid productivity of filamentous oleaginous microalgae Tribonema. Bioresour Technol, 2016, 218: 161-166. DOI:10.1016/j.biortech.2016.06.083 |
| [19] |
Xu ZJ, Hu Q, Liu GX, et al. Novel lipid accumulation pattern in a a utriculosum SAG22. 94 under different initial nitrogen concentrations. Plant Sci J, 2018, 36(3): 411-419 (in Chinese). 徐梓钧, 胡强, 刘国祥, 等. 囊状黄丝藻在不同初始氮浓度条件下特殊的油脂积累规律. 植物科学学报, 2018, 36(3): 411-419. |
| [20] |
Khozin-Goldberg I, Shrestha P, Cohen Z. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa. Biochim Biophys Acta Mol Cell Biol Lipids, 2005, 1738(1/3): 63-71. |
| [21] |
Alonzo F, Mayzaud P. Spectrofluorometric quantification of neutral and polar lipids in zooplankton using Nile red. Mar Chem, 1999, 67(3/4): 289-301. |
| [22] |
Zhang T. The study on growth and lipid accumulation of several strains of filamentous algae under different culture conditions[D]. Urumqi: Xinjiang University, 2018: 11-13 (in Chinese). 张婷.不同培养条件对几株丝状藻生长及油脂积累的研究[D].乌鲁木齐: 新疆大学, 2018: 11-13. |
| [23] |
Laurens LML, Quinn M, van Wychen S, et al. Accurate and reliable quantification of total microalgal fuel potential as fatty acid methyl esters by in situ transesterification. Anal Bioanal Chem, 2012, 403(1): 167-178. DOI:10.1007/s00216-012-5814-0 |
| [24] |
Bigogno C, Khozin-Goldberg I, Boussiba S, et al. Lipid and fatty acid composition of the green oleaginous alga Parietochloris incisa, the richest plant source of arachidonic acid. Phytochemistry, 2002, 60(5): 497-503. DOI:10.1016/S0031-9422(02)00100-0 |
| [25] |
Kalayasiri P, Jeyashoke N, Krisnangkura K. Survey of seed oils for use as diesel fuels. J Am Oil Chem Soc, 1996, 73(4): 471-474. DOI:10.1007/BF02523921 |
| [26] |
Ramos MJ, Fernández CM, Casas A, et al. Influence of fatty acid composition of raw materials on biodiesel properties. Bioresour Technol, 2009, 100(1): 261-268. DOI:10.1016/j.biortech.2008.06.039 |
| [27] |
Wang LB, Yu HY, He XH, et al. Influence of fatty acid composition of woody biodiesel plants on the fuel properties. J Fuel Chem Technol, 2012, 40(4): 397-404. DOI:10.1016/S1872-5813(12)60018-8 |
| [28] |
Dias JM, Alvim-Ferraz MCM, Almeida MF. Comparison of the performance of different homogeneous alkali catalysts during transesterification of waste and virgin oils and evaluation of biodiesel quality. Fuel, 2008, 87(17/18): 3572-3578. |
| [29] |
Knothe G, Razon LF, Madulid DA, et al. Methyl esters (biodiesel) from Pachyrhizus erosus seed oil. Biofuels, 2018, 9(4): 449-454. DOI:10.1080/17597269.2016.1275493 |
| [30] |
Chaisutyakorn P, Praiboon J, Kaewsuralikhit C. The effect of temperature on growth and lipid and fatty acid composition on marine microalgae used for biodiesel production. J Appl Phycol, 2018, 30(1): 37-45. DOI:10.1007/s10811-017-1186-3 |
| [31] |
Krisnangkura K. A simple method for estimation of cetane index of vegetable oil methyl esters. J Am Oil Chem Soc, 1986, 63(4): 552-553. DOI:10.1007/BF02645752 |
| [32] |
Knothe G. Dependence of biodiesel fuel properties on the structure of fatty acid alkyl esters. Fuel Process Technol, 2005, 86(10): 1059-1070. DOI:10.1016/j.fuproc.2004.11.002 |
| [33] |
Hu ZX, An M, Duan SS, et al. Effects of nitrogen sources on the growth, contents of total lipids and total hydrocarbons of Botryococcus braunii. Acta Ecol Sin, 2009, 29(6): 3288-3294 (in Chinese). 胡章喜, 安民, 段舜山, 等. 不同氮源对布朗葡萄藻生长、总脂和总烃含量的影响. 生态学报, 2009, 29(6): 3288-3294. |
| [34] |
Su Y, Gao BY, Huang LD, et al. Effects of different nitrogen source and concentration supplies on the growth and lipid accumulation of Eustgmatophycean microalgae. Acta Hydrobiol Sin, 2017, 41(3): 677-691 (in Chinese). 苏怡, 高保燕, 黄罗冬, 等. 不同氮源及氮浓度对真眼点藻纲微藻生长及油脂积累的影响. 水生生物学报, 2017, 41(3): 677-691. |
| [35] |
Li YT, Han DX, Yoon K, et al. Molecular and cellular mechanisms for lipid synthesis and accumulation in microalgae: biotechnological implications//Richmond A, Hu Q, eds. Handbook of Microalgal Culture. 2nd ed. West Sussex: Wiley Blackwell, 2013: 545-565.
|
| [36] |
Adams C, Godfrey V, Wahlen B, et al. Understanding precision nitrogen stress to optimize the growth and lipid content tradeoff in oleaginous green microalgae. Bioresour Technol, 2013, 131: 188-194. DOI:10.1016/j.biortech.2012.12.143 |
| [37] |
Griffiths MJ, Harrison STL. Lipid productivity as a key characteristic for choosing algal species for biodiesel production. J Appl Phycol, 2009, 21(5): 493-507. DOI:10.1007/s10811-008-9392-7 |
| [38] |
Griffiths MJ, Van Hille RP, Harrison STL. Lipid productivity, settling potential and fatty acid profile of 11 microalgal species grown under nitrogen replete and limited conditions. J Appl Phycol, 2012, 24(5): 989-1001. DOI:10.1007/s10811-011-9723-y |
| [39] |
Liang KH, Zhang QH, Gu M, et al. Effect of phosphorus on lipid accumulation in freshwater microalga Chlorella sp. J Appl Phycol, 2013, 25(1): 311-318. DOI:10.1007/s10811-012-9865-6 |
| [40] |
Mandotra SK, Kumar P, Suseela MR, et al. Evaluation of fatty acid profile and biodiesel properties of microalga Scenedesmus abundans under the influence of phosphorus, pH and light intensities. Bioresour Technol, 2016, 201: 222-229. DOI:10.1016/j.biortech.2015.11.042 |
| [41] |
Liang JJ, Jiang XM, Ye L, et al. Effects of nitrogen, phosphorus and iron on the growth, total lipid content and fatty acid composition of Phaeodactylum tricornutum mutant strain. Chin J Ecol, 2016, 35(1): 189-198 (in Chinese). 梁晶晶, 蒋霞敏, 叶丽, 等. 氮、磷、铁对三角褐指藻诱变株生长、总脂及脂肪酸的影响. 生态学杂志, 2016, 35(1): 189-198. |
| [42] |
Liu ZY, Wang GC, Zhou BC. Effect of iron on growth and lipid accumulation in Chlorella vulgaris. Bioresour Technol, 2008, 99(11): 4717-4722. DOI:10.1016/j.biortech.2007.09.073 |
| [43] |
Richmond A. Handbook of microalgal culture: biotechnology and applied phycology. Oxford: Blackwell Science, 2003.
|
| [44] |
Liu CX, Gu WH, Huang AY, et al. Proteomic analysis of mixotrophic cultivation of Chlorella vulgaris exposed to different iron concentrations. Mar Sci, 2017, 41(3): 1-7 (in Chinese). 刘彩霞, 顾文辉, 黄爱优, 等. 兼养小球藻在不同浓度Fe3+培养下的蛋白质组学研究. 海洋科学, 2017, 41(3): 1-7. |
| [45] |
Concas A, Steriti A, Pisu M, et al. Comprehensive modeling and investigation of the effect of iron on the growth rate and lipid accumulation of Chlorella vulgaris cultured in batch photobioreactors. Bioresour Technol, 2014, 153: 340-350. DOI:10.1016/j.biortech.2013.11.085 |
| [46] |
Huang GH, Chen F. Effect of metal ions on biomass and total fatty acids content of Chlorella vulgaris. Mod Food Sci Technol, 2009, 25(5): 474-477, 465 (in Chinese). 黄冠华, 陈峰. 金属离子对小球藻Chlorella vulgaris生物量和总脂肪酸含量的影响的研究. 现代食品科技, 2009, 25(05): 474-477, 465. |
| [47] |
Zhang S. The analysis lipid and study growth conditions of an endogenous cyanobacteria[D]. Tianjin: Hebei University of Technology, 2015 (in Chinese). 张硕.一株内生蓝藻脂类分析以及其生长条件初步研究[D].天津: 河北工业大学, 2015. |
| [48] |
Zhang S, Liu PH, Wang Y, et al. Effects of concentrations of iron, calcium and magnesium on the growth and lipid accumulation of microalgal strain Desmodesmus sp. WC08. Guangdong Agric Sci, 2014, 41(4): 126-130 (in Chinese). 张森, 刘平怀, 王影, 等. 铁、镁及钙对微藻Desmodesmus sp. WC08生长和油脂积累的影响. 广东农业科学, 2014, 41(4): 126-130. |
| [49] |
Wang S, Zhao SX, Wei CL, et al. Effect of magnesium deficiency on photosynthetic physiology and Triacylglyceride (TAG) accumulation of Chlorella vulgaris. Environ Sci, 2014, 35(4): 1462-1467 (in Chinese). 王珊, 赵树欣, 魏长龙, 等. 缺镁胁迫对普通小球藻光合生理及油脂积累的影响. 环境科学, 2014, 35(4): 1462-1467. |
| [50] |
Wang H, Gao LL, Shao HM, et al. Lipid accumulation and metabolic analysis based on transcriptome sequencing of filamentous oleaginous microalgae Tribonema minus at different growth phases. Bioproc Biosyst Eng, 2017, 40(9): 1327-1335. DOI:10.1007/s00449-017-1791-1 |
| [51] |
Haik Y, Selim MYE, Abdulrehman T. Combustion of algae oil methyl ester in an indirect injection diesel engine. Energy, 2011, 36(3): 1827-1835. |
| [52] |
Wu GX, Gao BY, Zhou ZW, et al. Effects of high and low nitrogen concentration on the growth and lipids accumulation pattern of two oleaginous microalgae. Microbiol China, 2015, 42(8): 1442-1452 (in Chinese). 吴桂秀, 高保燕, 周芷薇, 等. 高、低氮浓度对2株真眼点藻的生长和油脂积累的影响. 微生物学通报, 2015, 42(8): 1442-1452. |
| [53] |
Miao XL, Wu QY. Biodiesel production from heterotrophic microalgal oil. Bioresour Technol, 2006, 97(6): 841-846. DOI:10.1016/j.biortech.2005.04.008 |
 2020, Vol. 36
2020, Vol. 36




