中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李肖鹤, 李健, 后文, 郑沈, 朱向东
- Li Xiaohe, Li Jian, Hou Wen, Zheng Shen, Zhu Xiangdong
- 土壤中拮抗菌株铜绿假单胞菌HBD-12次级代谢产物的分离鉴定及其体外抗菌抗肿瘤活性检测
- Isolation, structural identification of secondary metabolites from Pseudomonas aeruginosa HBD-12 with antibacterial and antitumor activities
- 生物工程学报, 2020, 36(11): 2451-2458
- Chinese Journal of Biotechnology, 2020, 36(11): 2451-2458
- 10.13345/j.cjb.200160
-
文章历史
- Received: March 24, 2020
- Accepted: June 11, 2020
- Published: June 16, 2020
微生物分布广泛,因其次级代谢产物结构新颖、活性多样成为了微生物药物研发的重要资源[1-2]。自从微生物次级代谢产物中提取出青霉素以来[3],沿用青霉素的制作方法,人们又相继发现卡那霉素、红霉素、链霉素等常见抗生素,并将其成功运用到了临床治疗当中[4-6]。近年来,随着医药领域的飞速发展,存在于微生物次级代谢产物中的活性物质也越来越多地被发掘利用。舒雪纯等[7]从粉红粘帚霉发酵提取物中分离得到6种化合物,经检测发现所有化合物对金黄色葡萄球菌、枯草芽孢杆菌等4种病原菌具有显著抑制活性。Yu等[8]从曲霉Aspergillus versicolor中得到3个四羟基蒽酮二聚体,其中5-epiasperdichrome化合物对铜绿假单胞菌、枯草芽孢杆菌、溶血性弧菌等存在抑制作用;Chiba等[9]从一株梅花状青霉FKI-7215发酵液中分离得到产物Herquline A,经研究发现该产物能够抑制流感病毒复制。丰富的微生物资源拓宽了微生物药物研发的来源,但目前为止可在实验室培养的微生物仅占微生物总数的1%[10]。因此,对微生物次级代谢产物的开发与研究显得十分重要。
此外,采用生物转化技术进行结构修饰或改造化合物能够得到前体所不具有的新特征性合物[11-13]。Ma等[14]用枯草芽孢杆菌对甘草次酸进行微生物转化得到5种具有抗炎活性的新代谢产物。Yu等[15]对人参中的Rb1、Re及Rg1等成分进行了微生物转化,产物的量和抗炎症的效果明显提高(P < 0.05)。匍匐根霉转化孕烯醇酮能产生对胆碱酯酶、酪氨酸酶抑制活性较母体更高的产物[16]。近年来,利用微生物转化甾体化合物并对其产物活性进行研究的学者也日益增多[17-18],截至目前记录在案的甾醇类药物多达300余种,成为仅次于抗生素的畅销药[19]。
本研究中,以孕烯醇酮为唯一碳源制作筛选培养基,筛选到一株铜绿假单胞菌Pseudomonas aeruginosa HBD-12,采用管碟法[20]分别测定了该菌株对8种指示菌的抑菌活性,并对HBD-12菌株的次生代谢产物进行初步分离纯化及结构鉴定,以Aurora A为筛选模型对已分离的单体化合物进行抗肿瘤活性测定。期望此项研究能为微生物资源在甾醇类药物以及抗菌、抗肿瘤药物的研发应用提供科学的参考依据。
1 材料与方法 1.1 材料土样:于2019年3月,采用五点取样法从武汉科技大学垃圾回收点所置放垃圾堆周围采取土样。
供试菌种:指状青霉Penicillium digitatum、大肠杆菌Escherichia coli、苏云金芽孢杆菌Bacillus thuringiensis、意大利青霉Penicillium italicum等均由江西农业大学生物科学与工程学院实验室提供。
试剂:孕烯醇酮(上海阿拉丁试剂有限公司);Sephadex LH20 (Pharmacia公司,美国);GF245硅胶层析板(青岛海洋化工有限公司);甲醇、氯仿(国药集团);HTRF激酶检测试剂盒(Cisbio公司)。
1.2 仪器旋转蒸发仪(EYELAN-1100,Tokyo Rikakikai Co.LTD.);质谱仪Agilent G6220A (Agilent,美国);核磁共振仪Avance600 (Bruker公司,瑞士)。
1.3 培养基马铃薯培养基(g/L):土豆200,葡萄糖20,pH自然。
富集培养基(g/L):土豆200,葡萄糖20,酵母膏5,pH自然。
筛选培养基(g/L):孕烯醇酮1,SDS 0.5,KNO3 1,MgSO4 0.5,K2HPO4 0.5,NaCl 0.5,FeSO4·7H2O 0.01,琼脂20,pH 7.0。
1.4 菌落筛选参照范丹等的方法[21]稍作修改,将10 g土样加入到盛有90 mL无菌水的锥形瓶中,放置于28 ℃、180 r/min的摇床中振荡培养30 min,静置后取上清液1 mL加入到富集培养基中,30 ℃、180 r/min摇床中振荡培养24 h,从富集培养液中取200 μL加入到100 mL液体筛选培养基中, 30 ℃、180 r/min摇床中振荡培养36 h,经过3次转移培养之后,取200 μL涂布于固体筛选培养基中,30 ℃恒温培养箱倒置培养,根据不同菌落形态挑出单菌落接种在斜面培养基中,4 ℃冰箱进行保藏。
1.5 抑菌活性测定活化分离到的菌株接种于发酵培养基中,30 ℃、180 r/min摇床振荡培养至稳定期,4 ℃、5 000 r/min冷冻离心20 min得到发酵上清液备用。将大肠杆菌、苏云金芽孢杆菌、意大利青霉、指状青霉等4株待测指示菌菌悬液按1%的接种量,分别加入到冷却至50 ℃左右的LB和PDA培养基中制备待测琼脂平板。利用管碟法对菌株进行抑菌活性测定,在每个待测平板中放置3个牛津杯,分别在牛津杯中加入200 μL无菌水、发酵液上清液、1/2浓度发酵液上清液和1/4浓度发酵液上清液,细菌指示菌37 ℃恒温培养箱培养1 d、真菌指示菌28 ℃恒温培养箱培养3 d后,观察是否有抑菌圈并测量其大小。
1.6 菌株的鉴定挑取菌株划线接种于LB培养基上,37 ℃恒温培养箱中培养24 h后观察菌株的形态特征,并对菌株进行相关生理生化实验。
利用Ezup柱式细菌基因组提取试剂盒(生工生物工程(上海)股份有限公司)提取菌株基因组DNA,以PrimerA (5′-AGTTTGATCMTGGCTC AG-3′)和PrimerB (5′-GGTTACCTTGTTACGAC TT-3′)为上下游引物对菌株的16S rDNA进行扩增。PCR扩增产物用1%琼脂糖凝胶电泳进行检测后,切胶回收,送至生工生物工程(上海)股份有限公司进行测序,获得序列上传到GenBank中进行BLAST序列分析比对,用MEGA (7.0)软件中的邻接法(Neighbor-Joining法)构建系统发育树[22],对该菌株的分类地位进行分析。
1.7 次级代谢产物的分离菌体发酵液经离心得到上清液,用等体积氯仿反复萃取发酵上清液3次,然后用真空旋转蒸发仪对有机相进行40 ℃浓缩干燥,用适量硅胶拌样,干法上样后,使用200-300目的硅胶层析柱进行分离,洗脱剂氯仿:甲醇=100:1、100:2、100:3、100:4一直到100:25梯度洗脱,每30 mL收集一馏分,进行TLC分析检测,合并相同馏分,质量较大的合并相上样于Sephadex LH-20凝胶柱进行凝胶色谱分离,洗脱剂甲醇:氯仿=1:1洗脱,收集各馏分,TLC分析检测,合并相同组分,质量较大的合并相用Rp-C 18反相色谱,洗脱剂甲醇:水=3:7、4:6、1:1、7:3、10:0进行洗脱,TLC分析检测,合并相同组分,对产物进行波谱鉴定分析。
1.8 化合物的结构鉴定利用1 H-NMR、13 C-NMR(DEPT 90°和135°)、2D-NMR (HSQC,HMBC)等核磁共振波谱仪对分离产物进行分析,氘代氯仿作为溶剂,内标为四甲基硅烷,再利用一级质谱图测定化合物的相对分子质量,甲醇作为溶剂,进一步验证所得化合物的结构。
1.9 抗肿瘤活性检测用DMSO溶解两个单体化合物,低温保存,确保DMSO在最终反应体系中的浓度控制在不影响检测活性的范围之内。确定化合物浓度为20 μg/mL,以Aurora-A激酶(AURKA)为筛选模型,使用HTRF试剂盒(Cisbio公司提供)检测活性。采用HTRF技术,底物具有单磷酸化位点,其一端接上生物素。在生物素端,生物素能与streptavidin-XL 665 (acceptor)相连,完成标记。而在经过磷酸化之后,该底物与抗磷酸化位点的抗体(已标有Donor)结合,从而产生FRET信号。
2 结果与分析 2.1 筛选结果通过筛选得到3株真菌、3株细菌能以孕烯醇酮作为唯一碳源进行生长繁殖,分别对这6株菌进行纯化并保藏。
2.2 抑菌活性测定经测定观察发现菌株HBD-12对大肠杆菌、苏云金芽孢杆菌、意大利青霉、指状青霉都有一定的抑菌活性(图 1)。数据显示(表 1),抑菌活性随发酵液浓度的增加而增大(P<0.05)。
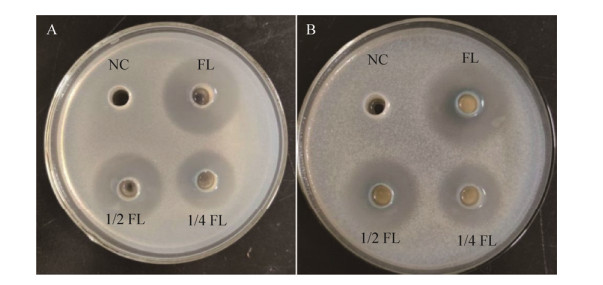
|
| 图 1 HBD-12菌株对大肠杆菌(A)和苏云金芽孢杆菌(B)的抑制作用 Fig. 1 The inhibitory effects of Pseudomonas aeruginosa HBD-12 fermentation broth on E. coli (A) and B. thuringiensis (B). NC: negative control; FL: fermentation liquor. |
| |
| Indicator bacteria | Inhibition zone diameter (mm) | ||
| Fermentation liquid | 1/2 Fermentation liquid | 1/4 Fermentation liquid | |
| Escherichia coli | 37.23±0.25a | 31.08±0.96b | 25.10±1.69c |
| Bacillus thuringiensis | 32.00±1.54a | 26.10±1.43b | 21.88±2.13c |
| Penicillium italicum | 38.80±0.52a | 30.12±2.02b | 26.00±1.53c |
| Penicillium digitatum | 39.30±1.18a | 31.09±0.87b | 25.27±1.57c |
| Different lowercase letters in the same line showed significant differences at 0.05 level. | |||
菌株HBD-12的16S rDNA测序结果在GenBank中进行Blast比对分析,上传序列号为MK817578,并绘制Neighbor-Joining系统发育树(图 2),系统发育树显示HBD-12菌株与铜绿假单胞菌Pseudomonas aeruginosa FDB和Pseudomonas aeruginosa OF4亲缘关系最近。因此确定HBD-12菌株归为Pseudomonas aeruginosa。

|
| 图 2 菌株HBD-12的系统发育聚类图(邻接法) Fig. 2 The Neighbor-Joining tree of strain HBD-12. |
| |
Pseudomonas aeruginosa HBD-12菌株为革兰氏阴性杆菌,37 ℃条件下在牛肉膏蛋白胨培养基中培养,开始为蓝绿色,培养3 d后颜色加深变为紫红色,菌落光滑,略微凸起,呈粘稠状。光学显微镜下观察菌体为杆状,长短不一(图 3)。

|
| 图 3 菌株Pseudomonas aeruginosa HBD-12的菌落 Fig. 3 The morphology of the colony of Pseudomonas aeruginosa HBD-12. |
| |
经过大批量发酵菌株HBD-12共获得6 L发酵液,浓缩后用氯仿萃取得到2 g浸膏,依次运用各分离技术分离纯化,最终获得2个单一化合物,其中化合物HBD1的质量为24.1 mg,化合物HBD2的质量为4.2 mg。
2.5 菌株HBD-12次级代谢产物结构解析化合物1 (HBD-1)的结构鉴定:从13C-NMR谱可知,化合物有12个碳信号。DEPT图谱显示7个次甲基,且在低磁场中,化学位移值δ分别为131.9、130.8、130.4、129.6、129.1、119.8和108.9,还有5个季碳信号。负离子模式ESI-MS数据显示准分子离子峰质荷比(m/z)为195.056 1 (计算为195.055 8),推测其化学式为C12H8N2O。由HSQC图谱可知氢的信号δ 7.24、7.76、7.78、7.83、7.85、8.19和8.27与碳信号δ 108.9、131.9、119.8、130.4、130.8、129.1和129.6相关,综上确定化合物HBD1为1-羟基-9, 10-二氮杂菲。
化合物2 (HBD-2)的结构鉴定:从13C-NMR谱可知,化合物有12个碳信号。DEPT图谱显示7个次甲基,低磁场中有5个季碳。ESI-MS数据显示准分子离子峰质荷比(m/z)为197.071 6 (计算为197.071 4),推测化学式为C12H10N2O。由HSQC图谱可知氢的信号δ 7.93、7.95、7.98、8.24、8.30、8.45和9.02与碳信号δ 131.8、131.1、129.4、129.1、129.7、134.3、136.0相关。此外,2个N上的氢化学位移分别是10.78和6.41。1H-1H-SOCY谱表明δ 9.02与8.45及7.93相关,综上确定化合物HBD2为3-羟基-9, 10-二氢二氮杂菲。
2.6 化合物抑制Aurora-A活性测定使用Cisbio公司的HTRF激酶检测试剂盒对浓度为20 μg/mL的1-羟基-9, 10-二氮杂菲(HBD1)和3-羟基-9, 10-二氢二氮杂菲(HBD2)进行活性检测,实验结果显示,两种化合物对Aurora-A均具有抑制活性(表 2)。
| ID | Sample | Conc (μg/mL) | Type | Result (%) |
| 1 | HBD1 | 20 | % Inhibition | 78.39±2.29 |
| 2 | HBD2 | 20 | % Inhibition | 60.34±8.35 |
铜绿假单胞菌次级代谢产物种类繁多,主要包括生长素、铁载体、抗生素、酶和糖类等。据报道显示,Supothina等[23]从铜绿假单胞菌中分离出12种4-羟基喹啉衍生物和3种吩嗪类生物碱,它们分别表现出抗疟疾活性以及对癌症细胞的毒性作用。Gupta等[24]研究证明,铜绿假单胞菌能够产生胞外几丁质酶可以防治癌细胞的转移并具有除菌作用。周莲等[25]研究发现,铜绿假单胞菌可产生申嗪霉素和吩嗪-1-酰胺,提示了该菌株具有潜在的抗菌、抗肿瘤等生物活性。
在本研究中,我们以孕烯醇酮作为唯一碳源制作筛选培养基,对采自武汉科技学院的土样进行筛菌,得到一株Pseudomonas aeruginosa HBD-12,经抑菌活性测定发现该菌株对大肠杆菌、苏云金芽孢杆菌、意大利青霉和指状青霉具有较强的抑制作用,结合Wang等[26]研究发现,铜绿假单胞菌能够产生吩嗪-1-羧酸或吩嗪-1-甲酰胺类抗生素,其中吩嗪-1-羧酸对多种植物病原菌具有抑制作用,初步推测菌株Pseudomonas aeruginosa HBD-12次级代谢产物中可能含有吩嗪类化合物,其在生防药物的研发中具有很好的应用价值。运用柱层析法分离该菌株次级代谢产物得到了2个单体化合物,经波谱分析鉴定结果显示HBD1为1-羟基-9, 10-二氮杂菲,质量为24.10 mg;HBD2为3-羟基-9, 10-二氢二氮杂菲,质量为4.20 mg。我们首次把Aurora-A激酶作为筛选模型,测定两个化合物的抗肿瘤活性,发现这两个化合物均能够抑制AURKA的活性,其中化合物1-羟基-9, 10-二氮杂菲对AURKA的抑制率高达78.39%±2.29%。Katayama等[27]研究表明,抑制Aurora激酶的活性会破坏细胞周期,阻止细胞增殖,引起多种类型的肿瘤细胞凋亡。后续研究可对该化合物进行肿瘤细胞系的验证试验,以期可以将该化合物作为Aurora激酶的特异性抑制剂为肿瘤治疗提供新的资源。由于化合物质量较少,未对单体化合物进行抑菌活性测定。研究发现,转录调控因子Pip对铜绿假单胞菌吩嗪合成代谢具有促进作用,提高了次生代谢产物的量[28]。接下来可通过优化发酵工艺和条件或利用合成的方法进一步提高发酵效率,并对该菌株的抑菌机理进行深入研究。
| [1] |
Tao LY, Zhang YW, Li YQ, et al. Detection of volatile metabolites of Trichoderma asperellum and its analysis of antagonistic activity. Chin J Biotech, 2020, 36(6): 1-9 (in Chinese). 陶玲芸, 张怡雯, 李雅乾, 等. 棘孢木霉挥发性次级代谢产物检测及抑菌活性分析. 生物工程学报, 2020, 36(6): 1-9. |
| [2] |
Quan CS, Liu J, Zhou W, et al. Isolation, purification and antitumor activity of Bacillomycin D from Bacillus amyloliquefaciems Q-426. Chin J Biotech, 2018, 34(2): 235-245 (in Chinese). 权春善, 刘静, 周伟, 等. 解淀粉芽孢杆菌Q-426 Bacillomycin D的分离纯化及其抗肿瘤活性. 生物工程学报, 2018, 34(2): 235-245. |
| [3] |
Yang SC, Lin CH, Sung CT, et al. Antibacterial activities of bacteriocins: application in foods and pharmaceuticals. Front Microbiol, 2014, 5: 241. |
| [4] |
Zhang GZ, Luo YH. The advances of the research on macrolide antibiotics. Prog Veterin Med, 2004, 25(3): 33-36 (in Chinese). 张桂枝, 罗永煌. 大环内酯类抗生素研究进展. 动物医学进展, 2004, 25(3): 33-36. |
| [5] |
Lee YR, Burton CE. Eravacycline, a newly approved fluorocycline. Eur J Clin Microbiol Infect Dis, 2019, 38(10): 1787-1794. DOI:10.1007/s10096-019-03590-3 |
| [6] |
Vázquez-Laslop N, Mankin AS. How macrolide antibiotics work. Trends Biochem Sci, 2019, 43(9): 668-684. |
| [7] |
Shu XC, Zhang YB, Guan LL, et al. Antibacterial secondary metabolites of Clonostachysrosea, an endophytic fungus from Blumeabalsamifera (L.) DC. Chin J Biotech, 2020, 36(8): 1-10 (in Chinese). 舒雪纯, 张影波, 官玲亮, 等. 艾纳香内生真菌粉红粘帚霉抗菌次生代谢产物. 生物工程学报, 2020, 36(8): 1-10. |
| [8] |
Yu GH, Wu GW, Sun ZC, et al. Cytotoxic Tetrahydroxanthone Dimers from the mangrove-associated fungus Aspergillus versicolor HDN1009. Mar Drugs, 2018, 16(9): 335. DOI:10.3390/md16090335 |
| [9] |
Chiba T, Asami Y, Suga T, et al. Herquline A, produced by Penicillium herquei FKI-7215, exhibits anti-influenza virus properties. Biosci Biotechnol Biochem, 2017, 81(1): 59-62. DOI:10.1080/09168451.2016.1162084 |
| [10] |
Zhang ZY, Ding LJ, He S. Research Progress on in situ cultivation of uncultured microorganisms. Nat Prod Res Dev, 2018, 30(5): 907-913 (in Chinese). 张作艳, 丁立建, 何山. 未培养微生物原位培养技术研究进展. 天然产物研究与开发, 2018, 30(5): 907-913. |
| [11] |
Restaino OF, Marseglia M, De Castro C, et al. Biotechnological transformation of hydrocortisone to 16α-hydroxy hydrocortisone by Streptomyces roseochromogenes. Appl Microbiol Biotechnol, 2014, 98(3): 1291-1299. DOI:10.1007/s00253-013-5384-x |
| [12] |
De Pádua RM, Meitinger N, Filho JDDS, et al. Biotransformation of 21-O-acetyl-deoxycorticosterone by cell suspension cultures of Digitalis lanata (strain W. 1. 4). Steroids, 2012, 77(13): 1373-1380. DOI:10.1016/j.steroids.2012.07.016 |
| [13] |
Sultan S, Noor MZBM, Anouar E, et al. Structure and absolute configuration of 20β-hydroxyprednisolone, a biotransformed product of predinisolone by the marine endophytic fungus Penicilium lapidosum. Molecules, 2014, 19(9): 13775-13787. DOI:10.3390/molecules190913775 |
| [14] |
Ma Y, Liu JM, Chen RD, et al. Microbial transformation of glycyrrhetinic acid and potent neural anti-inscommatory activity of the metabolites. Chin Chem Lett, 2017, 28(6): 1200-1204. DOI:10.1016/j.cclet.2017.02.019 |
| [15] |
Yu SS, Zhou XL, Li F, et al. Microbial transformation of ginsenoside Rb1, Re and Rg1 and its contribution to the improved anti-inflammatory activity of ginseng. Sci Rep, 2017, 7: 138. DOI:10.1038/s41598-017-00262-0 |
| [16] |
Sultana N. Microbial biotransformation of bioactive and clinically useful steroids and some salient features of steroids and biotransformation. Steroids, 2018, 136: 76-92. DOI:10.1016/j.steroids.2018.01.007 |
| [17] |
Bhatti HN, Khera RA. Biological transformations of steroidal compounds: a review. Steroids, 2012, 77(12): 1267-1290. DOI:10.1016/j.steroids.2012.07.018 |
| [18] |
Andrushina VA, Druzhinina AV, Yaderets VV, et al. Hydroxylation of steroids by Curvularia lunata mycelium in the presence of methyl-β-cyclodextrine. Appl Biochem Microbiol, 2011, 47(1): 42-48. DOI:10.1134/S0003683811010029 |
| [19] |
Tong WY, Dong X. Microbial biotransformation: recent developments on steroid drugs. Recent Patents Biotechnol, 2009, 3(2): 141-153. DOI:10.2174/187220809788700157 |
| [20] |
Han NN, Dai Q, Yu LN, et al. Influence of the differences of gentamicin components on the reliability test of the potency determination. Chin J Antibiot, 2018, 43(2): 211-215 (in Chinese). 韩宁宁, 戴青, 于丽娜, 等. 庆大霉素组分差异对效价测定可靠性测验的影响. 中国抗生素杂志, 2018, 43(2): 211-215. |
| [21] |
Fan D, Xiong BJ, Pang CP, et al. Screening and optimization of cholesterol conversion strain. Acta Microbiol Sin, 2014, 54(10): 1161-1170 (in Chinese). 范丹, 熊冰剑, 庞翠萍, 等. 胆固醇转化菌株的筛选及发酵条件优化. 微生物学报, 2014, 54(10): 1161-1170. |
| [22] |
Wang RL, Xu WF, Wang F, et al. Isolation and identification of an antagonistic endophytic bacterium from mulberry for biocontrol against Boeremia exigua. Acta Microbiol Sin, 2019, 59(11): 2130-2143 (in Chinese). 王若琳, 徐伟芳, 王飞, 等. 桑树内生拮抗菌的分离鉴定及其对桑断枝烂叶病的生防初探. 微生物学报, 2019, 59(11): 2130-2143. |
| [23] |
Supong K, Thawai C, Supothina S, et al. Antimicrobial and anti-oxidant activities of quinoline alkaloids from Pseudomonas aeruginosa BCC76810. Phytochem Lett, 2016, 17: 100-106. DOI:10.1016/j.phytol.2016.07.007 |
| [24] |
Gupta CP, Kumar B, Dubey RC, et al. Chitinase-mediated destructive antagonistic potential of Pseudomonas aeruginosa GRC1 against Sclerotinia sclerotiorum causing stem rot of peanut. Biocontrol, 2006, 51(6): 821-835. DOI:10.1007/s10526-006-9000-1 |
| [25] |
Zhou L, Jiang HX, Jin KM, et al. Isolation, identification and characterization of rice rhizobacterium Pseudomonas aeruginosa PA1201 producing high level of biopesticide "Shenqinmycin" and phenazine-1-carboxamide. Acta Microbiol Sin, 2015, 55(4): 401-411 (in Chinese). 周莲, 蒋海霞, 金凯明, 等. 高产申嗪霉素和吩嗪-1-酰胺的水稻根际铜绿假单胞菌PA1201分离、鉴定与应用潜力. 微生物学报, 2015, 55(4): 401-411. |
| [26] |
Wang B, Waters AL, Sims JW, et al. Complex Marine Natural Products as Potential Epigenetic and Production Regulators of Antibiotics from a Marine Pseudomonas aeruginosa. Microb Ecol, 2013, 65(4): 1068-1075. |
| [27] |
Katayama H, Sen S. Aurora kinase inhibitors as anticancer molecules. Biochim Biophys Acta, 2010, 1799(10/12): 829-839. |
| [28] |
Zhang Y, Cui QN, Zhao Z, et al. Positive regulation in expression of the phenazine-producing operon phz2 mediated by pip in Pseudomonas aeruginosa PAO1. Acta Microbiol Sin, 2013, 53(2): 127-135 (in Chinese). 张圆, 崔钦娜, 赵哲, 等. Pip介导铜绿假单胞菌吩嗪基因簇phz2的表达. 微生物学报, 2013, 53(2): 127-135. |
 2020, Vol. 36
2020, Vol. 36




