中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张楠, 孙世博, 张岳, 杨宜佳, 张意慈, 陈继红, 徐卫平, 马强, 许建强
- Zhang Nan, Sun Shibo, Zhang Yue, Yang Yijia, Zhang Yici, Chen Jihong, Xu Weiping, Ma Qiang, Xu Jianqiang
- 硒蛋白TrxR1介导甲萘醌还原:催化特性和抑制作用
- Selenoprotein thioredoxin reductase mediated menadione reduction: catalytic properties & inhibition effects
- 生物工程学报, 2020, 36(10): 2139-2150
- Chinese Journal of Biotechnology, 2020, 36(10): 2139-2150
- 10.13345/j.cjb.200066
-
文章历史
- Received: February 17, 2020
- Accepted: May 12, 2020
2. 中国检验检疫科学研究院,北京 100176;
3. 大连理工大学 海洋科学与技术学院,辽宁 盘锦 124221
2. Chinese Academy of Inspection and Quarantine, Beijing 100176, China;
3. School of Ocean Science and Technology (OST), Dalian University of Technology, Panjin 124221, Liaoning, China
哺乳动物硒蛋白硫氧还蛋白还原酶(Thioredoxin reductase 1,TrxR1)属于吡啶核苷酸二硫化物氧化还原酶家族,通过催化调节硫氧还蛋白(Thioredoxin,Trx)的氧化还原状态参与多种细胞进程,如拮抗氧化应激、支持DNA合成、抵抗凋亡信号[1]。TrxR1通常为首尾相对的同型二聚体,每个亚基包括N端-CVNVGC-催化结构域、C端-GCUG催化结构域、黄素腺嘌呤二核苷酸(Flavin adenine dinucleotide,FAD)结构域和还原型烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate,NADPH)结构域[2]。在TrxR1电子传递过程中,FAD首先接收NADPH的电子,随后打开N端活性位点Cys59-Cys64之间的二硫键,其中Cys64与FAD形成电子转移复合物,Cys59则与另一亚基C末端Sec498形成硒硫键中间体,最终还原C端活性中心,进而催化多种底物[3]。据报道,TrxR在乳腺癌[4]、肺癌[5]、肝癌[6]等癌细胞中高表达,这与氧化还原信号在肿瘤发生发展中的重要作用紧密相关,高水平的TrxR1有利于肿瘤细胞应对无限增殖、高代谢水平而产生的过量活性氧(Reactive oxygen species,ROS),这表明TrxR1与癌症发生发展、表型维持密切相关,因此TrxR1被认为是癌症治疗中的潜在靶点[7]。
醌类化合物具有六元环状共轭不饱和二酮的结构,可以诱发氧化应激,加速氧化还原循环并导致细胞毒性。多种醌类化合物具有高度反应活性,受TrxR1催化还原[8]。研究表明,在TrxR1介导的胡桃醌(Juglone)还原中,无论是删减化的TrxR1还是U498C突变体,均可增强TrxR1对Juglone的氧化还原速率,同时TrxR1 N端突变会致使反应速率大幅降低,这表明在TrxR1介导醌类还原中,多个活性中心,包括FADH2、FAD-Cys64的电子转移复合物以及潜在的Cys64-Sec498 (对于-GC突变体则可能是Cys64-Cys497),均直接参与电子传递[9]。有研究报道详尽地揭示了TrxR1介导胡桃醌还原的分子机制,证明TrxR1中除活性位点Sec498外,还原态FAD半醌自由基、N端Cys59和C端Cys497共同参与催化,其中Cys497是高效还原胡桃醌、大量生成超氧自由基的关键残基[10]。此外,9, 10-PQ和PQQ等醌类化合物可以接受来自TrxR1的电子,并呈现高度硒依赖性[11]。
甲萘醌(图 1)是一种两性萘醌类化合物,可被机体吸收并诱导产生大量活性氧,被广泛应用于氧化应激相关研究[12]。研究表明,甲萘醌可以增强TrxR1介导的活性氧产生,进而影响细胞氧化还原稳态,促进癌细胞死亡[13],这表明甲萘醌可能参与TrxR1氧化还原循环反应,然而TrxR1还原甲萘醌的催化细节尚不清晰,亟需深入研究。同时,紫草素[14]、兰雪醌[15]等萘醌分子对TrxR1的活性产生不可逆抑制,而甲萘醌对TrxR1的修饰位点和作用机制尚未见报道,需要系统论证。
|
| 图 1 甲萘醌的化学结构及其还原产物 Fig. 1 Structure of menadione and its reduced form. |
| |
本研究深入分析硒蛋白TrxR1和甲萘醌的相互作用,通过测定TrxR1介导甲萘醌还原的动力学反应,分析TrxR1 N端和C端活性中心在甲萘醌还原中的作用,并利用LC-MS鉴定甲萘醌对TrxR1的修饰,系统论证了TrxR1介导甲萘醌的还原机制和甲萘醌靶向TrxR1的抑制作用,有助于进一步理解TrxR1与萘醌类分子的相互作用,并为以TrxR1为靶点抗肿瘤药物开发提供有益参考。
1 材料与方法 1.1 材料与仪器大肠杆菌BL21(DE3) gor-菌株、大鼠TrxR1的表达质粒pET-TRSTER (6.8 kb)、辅助质粒pSUABC (9.0 kb)由瑞典卡罗林斯卡医学院Arne Holmgren教授和Elias S.J. Arnér教授共同馈赠。甲萘醌(Menadione)、胡桃醌(Juglone)、9, 10-PQ、NADPH、5, 5′-Dithiobis-(2-nitrobenzoic acid) (缩写DTNB)、二甲基亚砜、LC-MS级甲酸购自Sigma-Aldrich公司。MAbPac RP LC分析柱和HPLC级乙腈购自Thermo Scientific公司。ÄKTA StartTM蛋白纯化工作站、2′, 5′-ADP SepharoseTM亲和基质、预装柱16/60 SephacrylTM S-300 HR、NAPTM-5脱盐柱均购自GE Healthcare Life Sciences公司。全功能酶标仪SYNERGY H1购自美国Bio-Tek公司。精确微量紫外分光光度计UV5 BIO购自瑞士Mettler Toledo公司。
1.2 重组大鼠TrxR1定点突变体的质粒构建为研究TrxR1催化甲萘醌还原的作用及可能机制,我们以野生型大鼠TrxR1为模板,对其关键氨基酸进行突变,相关引物见表 1。使用Phusion High-Fidelity DNA Polymerase进行Inverse PCR,向20 μL PCR反应体系中加入1 ng DNA模板和0.5 μmol/L上下游引物,PCR条件如下:98 ℃预变性2 min;98 ℃变性10 s,69 ℃退火15 s,72 ℃延伸3 min,30个循环;之后72 ℃延伸10 min。通过1%琼脂糖凝胶电泳分析PCR产物并切胶回收目的条带。随后使用Eco31Ⅰ和DpnⅠ在37 ℃条件下对回收产物双酶切消化30 min并精制纯化,在22 ℃条件下使用T4 DNA连接酶连接2 h,热击转化至大肠杆菌DH5α感受态细胞中,提取质粒DNA并测序,引物合成和DNA序列测定委托生工生物工程(上海)股份有限公司完成。
| No. | Name | Mutation site | Sequence (5′-3′) |
| 1 | F_N01 | C59S | gcggtctcggaacgtcagtgaacgtgggctgc |
| 2 | F_N02 | C64S | gcggtctcggaacgtgtgtgaacgtgggctccatacctaaaaaac |
| 3 | F_C01 | U498C | gcggtctccagtccggatgctgcggctaagccccagaatc |
| 4 | F_C02 | -GC | gcggtctccagtccggatgctaaggctaagccccagaatc |
| 5 | R_N01 | N-term mutation | gcggtctccgttcccccgagaccccatc |
| 6 | R_C01 | C-term mutation | gcggtctcggactggaggatgtctcc |
重组大鼠TrxR1及其突变体的制备参照文献方法进行[16],步骤如下:1)共表达菌株的制备:取100 μL含有pET-TRSTER质粒的BL21(DE3) gor-感受态细胞,向其中加入1 μL 50 ng/μL pSUABC质粒,轻微混匀并在冰中静置20 min,之后在42 ℃水浴条件下热击90 s,随后立即置于冰中3 min,然后加入900 μL无抗性LB培养基,在37 ℃、200 r/min条件下培养1 h,取100 μL菌液用无菌涂布棒在抗性平板均匀涂布,倒置于37 ℃恒温培养箱过夜培养。次日挑取单克隆并接菌于3 mL LB并振荡培养,即获得含有pSUABC质粒和pET-TRSTER质粒的共表达菌株。2)重组大鼠TrxR1的表达:按照2%接种量,将过夜培养的共表达菌液接种至1 L新鲜LB培养基,37 ℃、220 r/min条件培养至对数生长末期,即OD600=2.4,依次添加终浓度为0.5 mmol/L的IPTG、5 nmol/L的Selenite、100 μg/mL的L-Cysteine。然后在24 ℃、220 r/min条件下振荡培养24 h,以诱导表达TrxR1及其突变体。
1.4 TrxR1及突变体蛋白的纯化诱导培养结束后,收集菌液,在4 000 r/min条件下离心10 min,弃去上清,使用少量TE缓冲液(含2 mmol/L EDTA,pH 7.5)重悬菌体,加入终浓度1 mg/mL溶菌酶以破碎细胞壁,经过反复冻融3次,以充分释放胞内蛋白,随后使用超声破碎仪打碎核酸,最后以13 000 r/min低温离心20 min,小心收集上清液,即为TrxR粗酶液。用0.45 μm无菌滤膜对上清样品进行过滤除杂后,依次使用2′, 5′-ADP SepharoseTM亲和层析、30 kDa cut-off Centrifugal Filters超滤离心管、16/60 SephacrylTM S-300 HR凝胶过滤分离纯化目的蛋白TrxR1。
1.5 TrxR1突变体蛋白浓度测定Bradford法测定蛋白浓度:使用96孔酶标板,标准浓度测定反应体系为200 μL。步骤如下:取5 μL不同浓度的BSA标准蛋白溶液(0、0.1、0.2、0.3、0.4、0.5 mg/mL)加入96孔板中,用于绘制标准曲线(n=3),将5 μL待测浓度的TrxR1溶液,加入96孔板中,每个样品3组平行。向上述孔中加入195 μL 1×Bradford Solution试剂,混合均匀3 min后,使用酶标仪在595 nm下测定吸光度值,根据标准曲线,计算未知样品浓度。
FAD浓度测定法标定TrxR1浓度:TrxR1浓度通过测定463 nm处酶溶液的吸光度值,以二聚体非共价结合的FAD浓度进行标定。1个FAD对应1个TrxR1亚基,2个FAD分子对应1个TrxR1二聚体蛋白。测定步骤如下:使用1 cm光程石英比色杯,使用TE缓冲液作为空白对照,标准测试体系为500 μL,使用紫外分光光度计,在463 nm下测试3次,数据取平均值。采用FAD的摩尔吸光系数11 300 L/(mol·cm)进行浓度计算。
1.6 TrxR1及突变体蛋白的电泳分析取30 μL适当浓度蛋白样品,加入10 μL 4×SDS上样缓冲液并混匀,6 000 r/min离心30 s,将样品于100 ℃金属浴加热5 min,13 000 r/min离心1 min,随后混合均匀。接着取下新鲜配制聚丙烯酰胺凝胶的梳子,向电泳槽加入1×Gly-Tris电泳缓冲液至没过胶孔,在胶孔中点样后,设置90 V电压电泳30 min,120 V电泳90 min。电泳结束后,使用R-250考马斯亮蓝染液对凝胶振荡染色2 h,使用脱色液对凝胶振荡脱色直至胶背景脱色干净,使用Champ plus 500紫外凝胶成像系统拍照记录。
1.7 以甲萘醌为底物的稳态反应动力学分析使用96孔酶标板,标准反应体系为200 μL。反应液包括0-200 μmol/L不同浓度甲萘醌、30 nmol/L大鼠TrxR1或50 nmol/L酵母GR和200 μmol/L NADPH,50 mmol/L TE缓冲液(pH 7.5)。通过向反应体系加入5 μL纯酶引发甲萘醌还原反应,反应程度通过产物NADPH的消耗来评估。在340 nm监测30 min。活力检测及酶促反应动力学常数的计算均使用NADPH的摩尔吸光系数6 200 L/(mol·cm)。所有酶促反应均在25 ℃条件下进行测试,间隔10 s读数,使用未加酶的反应液作为空白对照。
1.8 甲萘醌抑制TrxR1活力测定0.2 μmol/L大鼠TrxR1与100 μmol/L NADPH孵育10 min,以还原TrxR1的N端二硫键及C端硒硫键。0.2 μmol/L还原态酶或氧化态酶与不同浓度的甲萘醌(0、1、2、3、4、5 μmol/L)共孵育60 min。孵育结束后,通过DTNB还原法检测TrxR1活力。使用0-2.5 mmol/L不同浓度的DTNB,在412 nm跟踪反应产物TNB-的吸光度值增加,TNB-的摩尔吸光系数为13 600 L/(mol·cm)。所有酶促反应均在25 ℃条件下进行测试,按照10 s间隔读数,使用未加酶的反应液作为空白对照。
1.9 LC/MS分析色谱条件:色谱柱MAbPacTM RP LC柱(规格2.1 mm×50 mm×4.0 μm);流速:0.25 mL/min;流动相:A为纯水,B为乙腈,A、B两相均用甲酸调至pH为3.0;梯度洗脱程序:0-2.0 min (10% B),2.0-4.0 min (10%-50% B),4.0-5.0 min (50%-90% B),5.0-6.0 min (90% B),6.0-6.1 min (90%-10% B);柱温:75 ℃;进样量:10 μL。
质谱条件:电喷雾离子源(ESI),正离子扫描模式,喷雾电压:3.5 kV;透镜电压:50 V;鞘气:氮气;辅助气:氦气;离子传输管温度:320 ℃;辅助气温度300 ℃;扫描模式:一级全扫描;分辨率:17 500;扫描范围:600-3 000 (m/z)。
2 结果与分析 2.1 重组大鼠TrxR1活性位点突变大鼠硒蛋白TrxR1具有N端和C端两个反应活性中心,包含参与氧化还原的3个半胱氨酸和1个硒代半胱氨酸。我们构建了大鼠TrxR1突变体(表 1),用于确定位点突变对酶活的影响以及抑制剂对位点的选择。首先,在TrxR1基因N端的Cys59、Cys64位点处进行单点突变,得到了“C59S/GCUG和C64S/GCUG” 2个突变体,然后对TrxR1的C末端进行U498C突变或Sec498删减化,得到了“GCCG、GC” 2个突变体质粒。接着在C末端突变体基础上对N端的Cys59、Cys64位点处进行质粒的定点突变,得到了C59S/GCCG、C64S/GCCG、C59S/GC、C64S/GC双位点突变的4个突变体质粒。最后,经过DNA测序检验正确,成功获得重组突变体质粒。
2.2 重组大鼠TrxR1突变体蛋白的制备野生型大鼠TrxR1及其突变体使用经典方法进行表达,之后使用ADP-Sepharose和Sephacryl S-300两步柱层析获得纯化,SDS-PAGE分析检测,如图 2所示,纯化的目的蛋白TrxR1,呈现55 kDa单一条带,且背景中除目标条带外无杂蛋白带出现。经典活力检测使用二硫键小分子底物DTNB,检测野生型TrxR1比活力为23.5 U/mg。

|
| 图 2 重组大鼠TrxR1的12%还原型SDS-PAGE电泳检测 Fig. 2 12% reducing SDS-PAGE analysis of recombinant rat TrxR1. |
| |
我们分别检测和比较了突变体和野生型TrxR1的酶活力,结果如图 3A所示。在DTNB还原反应中,野生型TrxR1呈现较高活力,其余突变体酶活力几乎丧失殆尽,表明对于TrxR1经典底物,TrxR1的C末端硒代半胱氨酸Sec498是必需的。此外,TrxR1的N端突变体结果表明,N端活性中心参与电子传递过程,关键半胱氨酸突变同样导致了酶的失活。

|
| 图 3 TrxR及其突变体分别以DTNB和Menadione为底物检测酶促底物还原活力 Fig. 3 DTNB reducing activity assay and menadione reducing assay using mutant TrxR1 variants. (A) DTNB reducing activity. Enzyme activities with DTNB were measured with 5 nmol/L TrxR1 variants and 300 μmol/L NADPH by following TNB- formation at 412 nm for 3 min. (B) Menadione reducing activity. Enzyme activities with menadione were measured with 30 nmol/L TrxR1 variants and 200 μmol/L NADPH by following NADPH consumption at 340 nm for 30 min. |
| |
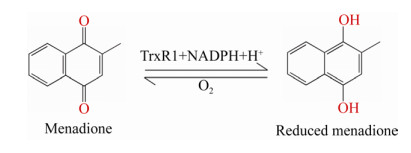
为了研究TrxR1还原甲萘醌的位点特异性,我们进行了酶促反应动力学检测。在200 μL反应体系中,包含30 nmol/L重组大鼠TrxR1或其突变体蛋白、0-200 μmol/L甲萘醌、200 μmol/L NADPH和50 mmol/L Tris-HCl (pH 7.5),以测定TrxR1还原甲萘醌kcat和Km (图 4)。C末端突变为硒代半胱氨酸突变为半胱氨酸,即C末端序列由-GCUG突变为-GCCG,突变体的kcat/Km为(10.0±0.88) L/(μmol·min),是野生型TrxR1的2.7倍(野生型酶kcat/Km=(3.6±0.47) L/(μmol·min))。值得注意的是,当N端活性中心的半胱氨酸Cys59或Cys64突变为丝氨酸时,均导致了转换数的大幅下降。删减化TrxR1(-GC)在甲萘醌的还原中并没有相对较高的反应速率,无论其N端活性中心的半胱氨酸是否突变,kcat/Km均小于(0.83±0.19) L/(μmol·min)。
|
| 图 4 以甲萘醌做为底物时的rTrxR1突变体的酶活动力学曲线 Fig. 4 Kinetics curves for enzymatic activities of rTrxR1 variants with menadione as substrate. (A) W.T. TrxR1, C59S mutant and C64S mutant. (B) -GCCG mutant, -GCCG/C59S mutant and -GCCG/C64S mutant. (C) -GC mutant, -GC/C59S mutant and -GC/C64S mutant. |
| |
为了研究哪些氨基酸残基位点是甲萘醌作为反应底物的关键位点,我们制备了不同的TrxR1突变体并进行了稳态反应动力学分析(表 2),突变位置涉及TrxR1的N端2个半胱氨酸催化残基和C端1个半胱氨酸催化残基,以及C端498位的硒代半胱氨酸活性催化残基。对表 2进行横纵对比,我们发现C端Cys498比Sec498催化效率高,但是亲和力降低了,整体转换数是WT的3倍。此外,在同样C端条件下,N端Cys59在酶促反应中催化能力比Cys64贡献大,在天然C端位点里差距较大,而Cys64比Cys59对酶对底物亲和力的贡献大,在天然C端里差距也较大,这个现象至少在-GCUG、GCCG和-GC中表现高度一致。不仅如此,我们还发现-GC和-GCCG相比,酶对底物亲和力和转换数均降低了。以上结果表明在甲萘醌被还原的过程中,催化能力排序是-GCCG > -GC > -GCUG,二硫键的作用大于硒硫键,且大于单一半胱氨酸催化残基。
| TrxR1 variants | kcat (min-1) | Km (μmol/L) | kcat/Km (L/(μmol·min)) |
| N-term/C-term | |||
| intact/-GCUG | 58.6±2.6 | 16.5±2.9 | 3.6±0.47 |
| C59S/-GCUG | 20.4±1.5 | 17.0±5.1 | 1.2±0.27 |
| C64S/-GCUG | 45.0±7.0 | 90.7±32.6 | 0.5±0.10 |
| intact/-GCCG | 342.3±13.1 | 34.2±4.3 | 10.0±0.88 |
| C59S/-GCCG | 24.0±2.6 | 35.9±12.5 | 0.67±0.16 |
| C64S/-GCCG | 35.5±3.1 | 46.3±11.9 | 0.76±0.13 |
| Intact/-GC | 27.2±2.7 | 32.8±10.7 | 0.83±0.19 |
| C59S/-GC | 67.0±19.2 | 200.9±97.5 | 0.33±0.07 |
| C64S/-GC | 80.9±22.2 | 228.4±101.5 | 0.35±0.06 |
| Note: All analysis was performed in triplicate at 25 ℃ and values are expressed as x±s. | |||
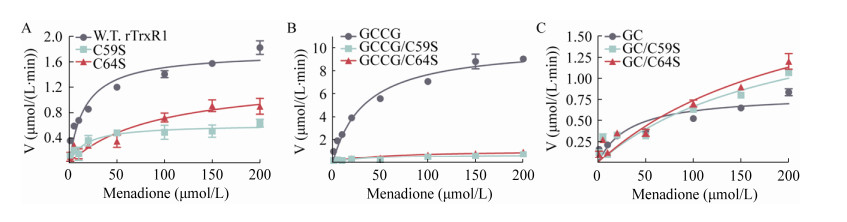
谷胱甘肽还原酶(GR)与TrxR同属一个蛋白家族,除了GR不含硒,两者结构和性质较为相似。但是C端不含Sec位点,因此我们试图通过进一步实验来判断甲萘醌是否也同为GR的底物(图 5)。反应体系中包含50 nmol/L酵母GR、0-200 μmol/L甲萘醌、200 μmol/L NADPH和50 mmol/L Tris-HCl (pH 7.5)。结果表明,不含Sec位点的GR可以还原甲萘醌,甲萘醌是GR的底物,kcat/Km为(0.82±0.22) L/(μmol·min),仅为TrxR1的1/4,表明TrxR1还原甲萘醌的催化效率高于GR。此外,yGR的Km是(10.0±3.4) μmol/L,野生型大鼠TrxR的Km为(16.5±2.9) μmol/L (表 3),这表明甲萘醌相对于GR的亲和力高于TrxR1。
|
| 图 5 yGR和WT rat TrxR1还原甲萘醌动力学参数 Fig. 5 Kinetic parameters of yGR and rTrxR with menadion. |
| |
| kcat (min-1) | Km (μmol/L) | kcat/Km [L/(μmol·min)] | |
| Yeast GR | 8.2±0.6 | 10.0±3.4 | 0.82±0.22 |
| Rat TrxR1 | 58.6±2.6 | 16.5±2.9 | 3.6 ±0.47 |
我们前期研究表明,胡桃醌及其衍生物会不可逆芳基化修饰TrxR1中硒代半胱氨酸和半胱氨酸,进而抑制TrxR1的活力。为了研究甲萘醌是否存在类似作用,我们检测了甲萘醌(0-5 μmol/L)对还原态TrxR1和氧化态TrxR1的抑制。结果如图 6所示,在DTNB还原中,不同浓度甲萘醌对氧化态TrxR1的酶促反应结果趋于一致,并没有呈现明显抑制。相反的是,还原态的TrxR1活性会随甲萘醌的浓度升高而下降,随着甲萘醌浓度的上升,反应速率下降,表明还原态的TrxR1更易受到甲萘醌的攻击。

|
| 图 6 甲萘醌对TrxR1的DTNB活力的抑制作用 Fig. 6 Inhibitory effect of menadione on the DTNB reducing activity of TrxR1. (A) Inhibition of oxidized TrxR1 by menadione. TrxR1 was incubated with different concentrations of menadione in the absence of NADPH. (B) Inhibition of reduced TrxR1 by menadione. TrxR1 was pre-incubated with 200 μmol/L NADPH for 10 min before incubated with different concentrations of menadione. |
| |
我们通过质谱方法鉴定甲萘醌-TrxR1加合物。首先,将1 μmol/L NADPH预还原的野生型大鼠TrxR1与200 μmol/L甲萘醌共孵育6 h。缓冲体系为Tris-HCl含EDTA,总体积为250 µL。然后,使用NAP-5脱盐柱将缓冲液置换为碳酸氢铵溶液(pH 7.8),随后真空干燥,再用Millin-Q超纯水溶解。接下来,通过LC-MS液相质谱联用对野生型TrxR1与甲萘醌孵育的产物进行质谱分析。通过Biofinder软件选择目标峰进行反卷积。结合已报道的质谱结果和分子量的理论计算可知,TrxR1单个亚基为54 665 Da,甲萘醌分子量为172 Da,因此加合物的分子量为54 837 Da,结果如图 7所示,在LC-MS的结果中检测到TrxR1单个亚基分子量为54 666.30 Da,相对应TrxR1-Menadione加合物同样被检测到,分子量为54 836.98 Da。

|
| 图 7 大鼠TrxR1与1分子menadione加合物的LC-MS分析 Fig. 7 LC-MS analysis of rat TrxR1-Menadione adducts. 1 μmol/L reduced recombinant rat TrxR was incubated with 200 μmol/L menadione for 6 h, buffer exchanged using dialysis tube and freeze-dried before subjected to mass analysis. |
| |
醌类化合物的细胞毒性主要包括诱发氧化应激、加速氧化还原循环,其作用机理受到广泛关注。进一步理解醌类化合物细胞内分子靶标,对于理解醌类化合物的药理毒性至关重要。研究表明,醌类分子与TrxR1直接反应,介导活性氧产生是醌类化合物重要的毒性作用机理。同时,应用醌类小分子及其衍生物抑制TrxR/Trx系统活力,造成细胞内氧化还原失衡,包括ROS产生积累而无法清除,破坏细胞微环境,蛋白质巯基氧化还原态的失衡,会直接导致细胞氧化应激,引导癌细胞死亡[17]。这表明不论是醌类化合物细胞毒性或潜在化疗药物的性质,都与细胞氧化还原系统及氧化还原酶密切相关。
既往研究显示,TrxR1可进行硒依赖和非硒依赖酶促反应,具有非常广的底物谱,不仅包括生理底物Trx、TRP14,还包括多种小分子如DTNB、Selenite、Toxoflavin,这些底物均呈现了硒依赖的反应特性[18-19]。而多种醌类物质作为TrxR1的底物,可以通过单电子/双电子转移机制,生成半醌中间体进而大量生成超氧化物,导致氧化应激,例如,TrxR1可以通过单电子转移方式促使甲萘醌生成活跃的半醌中间体。在本实验中,甲萘醌还原呈非硒依赖性,有别于上述提及的底物,推测可能与TrxR1多个活性位点直接作用被还原。
谷胱甘肽(Glutathione,GSH)系统和Trx系统同为哺乳动物体内重要的抗氧化系统,二者相互协调,共同行使机体的抗氧化作用[20]。TrxR1与谷胱甘肽还原酶(Glutathione reductase,GR)相似,N端活性结构域是-Cys-Val-Asn-Val-Gly-Cys-,不同之处在于TrxR1的C末端有含硒结构域-Gly-Cys-Sec-Gly。本实验中,TrxR1对甲萘醌的高效还原活力显著优于GR,这提示我们硒蛋白TrxR1因其灵活的C末端含硒催化结构而具有优于GR的甲萘醌催化还原活力。
但是,在使用TrxR1突变体,尤其是甲萘醌还原过程中,我们发现TrxR1突变体(-GCCG)的C端活性中心Cys498突变使甲萘醌还原反应非常高效,虽然其对底物亲和力有所降低,表明具有氧化还原反应活性的半胱氨酸催化残基在甲萘醌还原中发挥主导作用,而且498位优于497位。TrxR1的N端活性中心突变无论是Cys59还是Cys64,都促使甲萘醌还原反应中的电子传递变得十分低效。这些结果进一步揭示并佐证TrxR1电子传递路径中,N端活性中心的关键地位,同时TrxR1介导醌类化合物还原过程中独特的非硒依赖和N端依赖特性。有趣的是,删减化的TrxR1(-GC)与甲萘醌反应时,我们并没有观察到较野生型酶更高的反应活性,还原活力和底物亲和力反而变得比野生型TrxR1都低,这与胡桃醌还原的情形不同,说明甲萘醌还原与胡桃醌还原存在反应途径上的差异,并且在实验中TrxR1介导甲萘醌还原的反应速率较低,同时高浓度的甲萘醌又会抑制酶活性,包括对半胱氨酸或硒代半胱氨酸的芳基化修饰,可能是导致删减化酶(-GC)的kcat/Km较低的原因之一。
甲萘醌接受TrxR1传递的电子,同时会一定程度上抑制TrxR1活性。本研究中,我们发现氧化态的酶几乎不受甲萘醌的抑制,这表明处于自由状态巯基或硒巯基很可能是甲萘醌的靶点。由以往的研究可知,抑制剂进行亲电攻击,会不可逆修饰TrxR1的C端Sec残基,经由SecTRAPs途径,TrxR1由抗氧化转变为促氧化,表现出强烈的NADPH氧化酶活力,类似的亲电试剂还包括顺铂(Cisplatin,cDDP)、DNCB、美法仑(Melphalan)、姜黄素(Cucurmin)等抗癌药物,以及胡桃醌(Juglone)、紫草素(Shikonin)、兰雪醌(Plumbagin)、甲萘醌等萘醌类化合物[21]。在本研究中,我们着重探讨了氧化态或还原态的TrxR1酶活是否会受甲萘醌抑制。加入NADPH可以预先还原TrxR1,使其N端二硫键及C端硒硫键打开,变为自由硫醇或硒醇基团。结果显示,(图 6)只有在NADPH存在的情况下,甲萘醌才会呈现明显的抑制,这表明这种自由的硒巯基或巯基更容易受到醌类化合物的芳基化修饰。
本研究我们探究了甲萘醌对TrxR1的抑制作用和修饰。经过LC-MS质谱检测寻找TrxR与抑制剂的加合物,将是甲萘醌对TrxR1活性抑制、残基位点发生修饰的重要的直接证据[22]。幸运的是,在质谱检测结果(图 7)中发现,TrxR1受到甲萘醌抑制,产生一个分子甲萘醌的加合。由于硒代半胱氨酸具有高活性,半胱氨酸在醌类底物还原中具有更高活力,我们推测芳基化修饰的位点可能首先是TrxR1的C末端Sec498。当使用U498C实验时,498位硒代半胱氨酸残基变为半胱氨酸残基(Cys498),我们推测甲萘醌在此位点饱和攻击之后,会沿着Cys497、Cys59、Cys64,展开有限度的亲电攻击(残基修饰),此推论有待进一步实验证实。
胡桃醌被认为可以修饰4个以上的TrxR1半胱氨酸。有趣的是,本研究中甲萘醌修饰TrxR1的质谱结果,与胡桃醌不完全一样,这与两者不同化学结构导致反应速率差异密切相关。接下来,我们需要进一步精准检测甲萘醌对TrxR1的修饰位点和数量关系。
综上,本研究分析了甲萘醌与TrxR1的相互作用,包括TrxR1还原甲萘醌方式、甲萘醌抑制TrxR1的机制,同时我们通过LC-MS发现了甲萘醌芳基化修饰TrxR1生成TrxR-Menadione (1︰1)加合物。本研究将为理解甲萘醌的细胞功能、揭示硒蛋白TrxR1的电子传递机制和靶向TrxR1抗癌药物研发提供有益参考。
| [1] |
Arnér ESJ. Focus on mammalian thioredoxin reductases—important selenoproteins with versatile functions. Biochim Biophys Acta Gen Subj, 2009, 1790: 495-526. DOI:10.1016/j.bbagen.2009.01.014 |
| [2] |
Zhong LW, Arnér ESJ, Holmgren A. Structure and mechanism of mammalian thioredoxin reductase: The active site is a redox-active selenolthiol/ selenenylsulfide formed from the conserved cysteine-selenocysteine sequence. Proc Natl Acad Sci USA, 2000, 97: 5854-5859. DOI:10.1073/pnas.100114897 |
| [3] |
Cheng Q, Sandalova T, Lindqvist Y, et al. Crystal structure and catalysis of the selenoprotein thioredoxin reductase 1. J Biol Chem, 2009, 284: 3998-4008. DOI:10.1074/jbc.M807068200 |
| [4] |
Lu J, Chew EH, Holmgren A. Targeting thioredoxin reductase is a basis for cancer therapy by arsenic trioxide. Proc Natl Acad Sci USA, 2007, 104: 12288-12293. DOI:10.1073/pnas.0701549104 |
| [5] |
Lu J, Papp LV, Fang JG, et al. Inhibition of Mammalian thioredoxin reductase by some flavonoids: implications for myricetin and quercetin anticancer activity. Cancer Res, 2006, 66: 4410-4418. DOI:10.1158/0008-5472.CAN-05-3310 |
| [6] |
Zheng XQ, Ma WW, Sun RX, et al. Butaselen prevents hepatocarcinogenesis and progression through inhibiting thioredoxin reductase activity. Redox Biol, 2018, 14: 237-249. DOI:10.1016/j.redox.2017.09.014 |
| [7] |
Smart DK, Ortiz KL, Mattson D, et al. Thioredoxin reductase as a potential molecular target for anticancer agents that induce oxidative stress. Cancer Res, 2004, 64: 6716-6724. DOI:10.1158/0008-5472.CAN-03-3990 |
| [8] |
Cenas N, Nivinskas H, Anusevicius Z, et al. Interactions of quinones with thioredoxin reductase: a challenge to the antioxidant role of the mammalian selenoprotein. J Biol Chem, 2004, 279: 2583-2592. DOI:10.1074/jbc.M310292200 |
| [9] |
Anestål K, Prast-Nielsen S, Cenas N, et al. Cell death by SecTRAPs: Thioredoxin reductase as a prooxidant killer of cells. PLoS ONE, 2008, e1846. |
| [10] |
Xu JQ, Cheng Q, Arnér ESJ. Details in the catalytic mechanism of mammalian thioredoxin reductase 1 revealed using point mutations and juglone-coupled enzyme activities. Free Radic Bio Med, 2016, 94: 110-120. DOI:10.1016/j.freeradbiomed.2016.02.013 |
| [11] |
Xu JQ, Arnér ESJ. Pyrroloquinoline quinone modulates the kinetic parameters of the mammalian selenoprotein thioredoxin reductase 1 and is an inhibitor of glutathione reductase. Biochem Pharmacol, 2012, 83: 815-820. |
| [12] |
Mauzeroll J, Bard AJ, Owhadian O, et al. Menadione metabolism to thiodione in hepatoblastoma by scanning electrochemical microscopy. Proc Natl Acad Sci USA, 2004, 101: 17582-17587. DOI:10.1073/pnas.0407613101 |
| [13] |
Li J, Zuo X, Cheng P, et al. The production of reactive oxygen species enhanced with the reduction of menadione by active thioredoxin reductase. Metallomics, 2019, 11: 1490-1497. DOI:10.1039/C9MT00133F |
| [14] |
Duan DZ, Zhang BX, Yao J, et al. Shikonin targets cytosolic thioredoxin reductase to induce ROS-mediated apoptosis in human promyelocytic leukemia HL-60 cells. Free Radic Bio Med, 2014, 70: 182-193. DOI:10.1016/j.freeradbiomed.2014.02.016 |
| [15] |
Zhang JM, Peng SJ, Li XM, et al. Targeting thioredoxin reductase by plumbagin contributes to inducing apoptosis of HL-60 cells. Arch Biochem Biophys, 2017, 619: 16-26. DOI:10.1016/j.abb.2017.02.007 |
| [16] |
Rengby O, Johansson L, Carlson LA, et al. Assessment of production conditions for efficient use of Escherichia coli in high-yield heterologous recombinant selenoprotein synthesis. Appl Environ Microbiol, 2004, 70(9): 5159-5167. DOI:10.1128/AEM.70.9.5159-5167.2004 |
| [17] |
Ren XY, Santhosh SM, Coppo L, et al. The combination of ascorbate and menadione causes cancer cell death by oxidative stress and replicative stress. Free Radic Bio Med, 2019, 134: 350-358. DOI:10.1016/j.freeradbiomed.2019.01.037 |
| [18] |
Xu JQ, Eriksson SE, Cebula M, et al. The conserved Trp114 residue of thioredoxin reductase 1 has a redox sensor-like function triggering oligomerization and crosslinking upon oxidative stress related to cell death. Cell Death and Dis, 2015, 6(1): e1616. DOI:10.1038/cddis.2014.574 |
| [19] |
Gencheva R, Cheng Q, Arnér ESJ. Efficient selenocysteine-dependent reduction of toxoflavin by mammalian thioredoxin reductase. Biochim Biophys Acta Gen Subj, 2018, S0304-4165(18): 30146-6. |
| [20] |
Du YT, Zhang HH, Lu J, et al. Glutathione and glutaredoxin act as a backup of human thioredoxin reductase 1 to reduce thioredoxin 1 preventing cell death by aurothioglucose. J Biol Chem, 2012, 287: 38210-38219. DOI:10.1074/jbc.M112.392225 |
| [21] |
Zhang BX, Liu YX, Li XM, et al. Small molecules to target the selenoprotein thioredoxin reductase. Chem Asian J, 2018, 13: 3593-3600. DOI:10.1002/asia.201801136 |
| [22] |
Gaikwad NW, Rogan EG, Cavalieri EL. Evidence from ESI-MS for NQO1-catalyzed reduction of estrogen ortho-quinones. Free Radic Biol Med, 2007, 43: 1289-1298. DOI:10.1016/j.freeradbiomed.2007.07.021 |
 2020, Vol. 36
2020, Vol. 36