中国科学院微生物研究所、中国微生物学会主办
文章信息
- 叶金统, 孟颂东, 朱晓东
- Ye Jintong, Meng Songdong, Zhu Xiaodong
- 双特异抗体的研究进展
- Recent advances in the development of bispecific antibodies
- 生物工程学报, 2020, 36(1): 33-43
- Chinese Journal of Biotechnology, 2020, 36(1): 33-43
- 10.13345/j.cjb.190154
-
文章历史
- Received: April 22, 2019
- Accepted: July 16, 2019
- Published: July 22, 2019
2. 中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101
2. CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
双特异抗体是指可以结合两个不同抗原或一个抗原不同表位的特殊抗体,现已成为抗体工程领域的研究热点,在肿瘤免疫治疗及自身免疫疾病等领域具有广阔的应用前景。
双特异抗体最早出现在1961年,Nisonoff等将两种结合不同抗原的多克隆抗体的Fab’片段用化学交联剂制成双特异抗体[1]。在20世纪80年代,随着杂交瘤技术的发展,双特异抗体的研究也呈爆发式增长,并在20世纪90年代,已经有双特异抗体进入临床[2-3],但由于临床效果不佳,未能有批准的双特异抗体上市,双特异抗体的研究归于沉寂。近年来,基因工程的飞速发展,也带动了双特异抗体的研发进展[4]。2009年,由欧洲Trion Pharma公司开发的双特异抗体Catumaxomab获得欧盟药品管理(EMA)批准,用于治疗恶性腹水,是全球第一个批准上市的双特异抗体药。2014年,Amgen公司研制的Blinatumomab双特异抗体获得FDA批准用于急性淋巴细胞白血病的治疗。2017年11月,罗氏制药公司研制的Emicizumab被FDA批准上市,用于A型血友病的治疗。随着双特异抗体的临床应用成功及批准上市,双特异抗体已成为药物研究中的一个新热点,目前跨国药企和众多生物技术公司都在开发双特异抗体,大部分处于临床或者临床前研究。文中就双特异抗体的制备方法、结构类型和设计策略、作用机制、目前研究现状进行简要综述。
1 双特异抗体的制备方法双特异抗体含有两个不同的抗原结合域,在自然状态下是不存在的,只能通过人工制备。双特异的制备从最初将两个不同的、纯化的单克隆抗体化学偶联,或者将2个表达不同单克隆抗体的杂交瘤融合,构建4倍体杂交瘤,到近年来采用基因工程重组技术法构建各种类型的双特异抗体等[5],每一种制备方法都会产生独特的结构。
1.1 化学偶联法化学偶联法的原理是通过化学偶联剂(如领苯二马来酰亚胺、二硫代酰基苯甲酸等)将两个完整IgG或者F (ab′)2抗体片段通过二硫键或硫醚键连接形成双特异性抗体[1, 6]。该方法可快速、大量制备双特异性抗体,但在交联过程中抗体时有失活,而且难以保证产物的匀质性。
1.2 双杂交瘤法双杂交瘤法是将两株不同的杂交瘤细胞融合成双杂交瘤细胞株,再通过杂交瘤筛选法克隆靶细胞,但是,双杂交瘤细胞会产生两种重链和两种轻链,理论体系中会有10种不同组合的抗体存在,其中有9种轻、重链配对产物不是所需要的,只有轻链与重链同源配对、重链与重链异源配对这一种组合配对方式产生的抗体才是所需要的BsAb,大约仅占10%–50%。而且,从这些结构相似的抗体中将所需的BsAb分离纯化也费时费力,为抗体纯化及质控带来巨大挑战。利用杂交瘤方法制备双特异抗体随机性较大、效率低,但是抗体的生物活性较好,抗体结构比较稳定[7]。
1.3 基因工程法基因工程法制备原理就是利用基因工程技术对传统的抗体进行基因工程方面的改造,从而形成多种形式的双特异抗体,基因工程的飞速发展也为双特异抗体的研发奠定基础,利用基因工程技术制备双特异抗体是目前最常用的制备方法[8]。
2 双特异抗体的结构分类一般来说,双特异抗体按其结构来说可分为两大类,一类是含有Fc区的双特异抗体,另一类是缺乏Fc区的双特异抗体[9] (图 1)。

|
| 图 1 临床研究阶段的不同形式的双特异性抗体 Fig. 1 Various bispecific antibodies (bsAbs) are currently in clinical development or are already approved for cancer therapy. |
| |
传统的单克隆抗体含有Fc区,因为它的存在,相比于其他生物工程药物如细胞因子类,抗体药物的临床应用具备以下几方面的优势:1) Fc区含有蛋白A/G的识别区,工业化规模可采用高特异性亲和层析的方法,对目标药物蛋白进行最高效的模式化分离纯化。2) Fc区介导的效应功能在很多临床适应症如癌症治疗上有很重要的附加效应,如抗体依赖的细胞毒性(ADCC)、补体依赖的细胞毒作用(CDC),这些功能是某些抗体药物体现药效的根本。3)新生儿Fc受体(FcRn)主要表达在造血细胞以及血管内皮细胞、上皮细胞等表面,当抗体的Fc通过与新生儿Fc受体的结合而进入胞饮再循环过程而避免溶酶体途径降解,导致在血液里抗体有更长的半衰期[10]。含Fc区双特异抗体可以利用Fc的这3个特点使其本身有更好的临床应用。目前含Fc双特异抗体制备技术平台主要有Triomab quadroma、2 in 1-IgG、KIH IgG、CrossMab、DVD-Ig、Mebs-Ig等。
2.1.1 Triomab quadroma双特异性抗体Triomab quadroma双特异性抗体技术是将靶向CD3的大鼠源IgG2b抗体和靶向肿瘤细胞的小鼠源IgG2抗体进行体细胞杂交而获得的双特异抗体,该平台是由Fresenius和Trion Pharma公司合作开发,解决了重链与重链、轻链与轻链错配问题。纯化过程利用大鼠和小鼠抗体对蛋白质A不同的亲和力来获得双特异性抗体。Triomab抗体通过抗体的两个不同抗原结合域分别结合肿瘤细胞及T细胞,并通过抗体Fc功能区募集效应功能细胞(如NK细胞、巨噬细胞等)形成复合体,刺激T细胞分泌细胞因子清除肿瘤细胞[11]。Catumaxomab (EpCAM×CD3)就是基于该平台技术开发的双特异抗体。
2.1.2 KIH IgG (Knob-in-hole)双特异性抗体KIH (Knob-in-hole)技术由Genentech公司开发,利用基因工程技术对重链进行工程化改造以获得异源二聚体,是解决重链错配问题的一大突破。组成双特异性抗体的两条重链,在其中一条重链的CH3区引入突变,形成一个突起的类似“杵”的结构(Knob),在另一条重链CH3区引入突变形成一个凹陷的类似“臼”的结构(Hole),利用两条重链CH3区域的空间位阻效应利于两种异源抗体重链的正确装配。突变后,产品正确装配率可提高至90%以上,能够满足规模化生产的要求[12]。但是该技术还存在一个轻链错配问题,即不同的轻链与重链异源二聚体会发生随机配对,可通过采用一个能够同时结合两个抗原的共同轻链解决,然而不是所有的抗体都适用。因此,又出现很多在该技术基础上衍生出不同的解决轻链问题的双特异抗体结构。
2.1.3 CrossMAb双特异性抗体CrossMAb是一种抗体Fab抗体臂的功能区互换的技术,是由罗氏开发的技术平台。该技术是在“knob-in-hole”技术基础上,对双特异IgG抗体Fab臂功能区的交换形成,通过交换一条重链的CH1结构和对应轻链的CL结构域,而另外一条重链及轻链保持不变,经过交换的抗体轻链不易与未改造抗体的重链发生错配,由此产生轻重链的正确配对,这种互换技术保留了原始的抗原亲和力。同时结合KIH结构又可促进重链异源结合,进一步提高正确装配率[13]。
2.1.4 Ortho-Fab IgG双特异抗体Ortho-Fab IgG技术是Liu等报道的一种克服轻链错配的设计策略。该技术是在“knob-in-hole”技术的基础上,利用计算机建模,结合X晶体衍射技术将其中一个抗体的VH/VL及CH1/CL进行正交互补突变设计,减少轻链错配现象,实现单一细胞内高效表达双特异抗体[14]。
2.1.5 YBODY双特异抗体YBODY技术是由武汉友芝友公司开发的双特异技术平台,该技术是在“knob-in-hole”技术的基础上,形成异源二聚体的其中一条为正常重链,另外一条为Fc功能区的N端连接scFv,形成了不对称的双特异抗体,该抗体在生产工艺、药效和生物稳定性等方面获得重大突破,临床开发前景广阔[15]。
2.1.6 Two-in-one双特异性抗体Two-in-one抗体最早是由Genentech公司Bostrom等开发而成,该技术也是用来解决轻重链错配及重链与重链错配问题,通过对可变区进行工程化改造并通过噬菌体展示技术获得识别两个不同靶点的双特异抗体,又称为DAF抗体(Dual Action Fab,DAF)[16]。Two-in-one双特异性抗体具有正常IgG抗体的结构,稳定性良好,易于进行产业化生产,技术难点在于前期的工程化过程。
2.1.7 DVD-Ig双特异性抗体DVD-Ig (Dual Variable Domain-Ig)技术由Abbott开发而成,通过在正常IgG抗体的轻链和重链的N末端分别连接另一个抗体的VL和VH结构域以形成双特异抗体,即第2个抗体VH与第一个抗体VH融合在一起,第2个抗体VL与第一个抗体VL融合在一起,产生一个对每个抗原有两个结合位点的四价分子。这类分子与正常单抗具有相同的Fc区,可用通用抗体技术进行纯化生产[17]。
2.1.8 IgG-scFv及scFv2-Fc双特异抗体IgG-scFv双特异性抗体是将单链抗体(scFv)连接在正常IgG抗体分子Fc功能区的C末端,产生一个每个抗体都有两个不同结合域的四价分子,通过分子两端的不同的CDR区与靶分子结合实现双功能。而scFv2-Fc分子与IgG-scFv结构类似,是将两个scFv分子分别连接在Fc功能区的两端,形成双功能区[9]。
2.1.9 FIT-Ig双特异抗体FIT-Ig (Fabs-In-Tandem)是上海岸迈生物公司开发的,它是将两个Fab别连接在抗体两个重链的N端,但将新的Fab抗体臂的功能区进行互换,即新Fab的轻链CL和重链CH1互换,形成了250 kDa的四价蛋白,构建时是用3个片段共同转染到一个细胞里,因为分子没有Fc的突变,也没有单链抗体和linker等不稳定因素的引入,临床前表现较好的药效和成药性[18]。
2.1.10 Mebs-Ig双特异抗体Mebs-Ig (Mab editing bispecific immuoglobin)是北京康明百奥新药研发有限公司开发的新型双特异平台,具有很多“best-in-class”的特点:首先采用糖工程修饰的方法,将抗体的Fc糖链的岩藻糖敲除,大大增强了抗体的ADCC以及ADCP的能力,能招募更多的效应细胞杀伤靶细胞。同时使用共同轻链的方法,可将2个新Fab分别连接在抗体2个重链的N端,没有功能区的互换,解决了双抗链之间错配的问题。Mebs-Ig属于四价双特异分子,能保持更好的抗体亲和力。另外分子形式也没有不稳定的单链抗体或者Linker结构。因为只有2个片段,细胞株构建更为简单[19]。
2.2 不含Fc区双特异抗体不含Fc区双特异性抗体缺失了Fc区,由两个抗体的VH区及VL区组成或者由Fab片段组成,这类抗体分子体积小,利于组织渗透(如在肿瘤治疗中),但由于缺乏Fc区,不能介导Fc介导的效应功能,完全依赖其抗原结合能力来发挥疗效,且半衰期通常较短,在体内会快速发生肾清除。目前,此类双特异性抗体主要有BiTE、DART、TandAbs、bi-Nanobody等。
2.2.1 BiTE双特异抗体BiTE是由德国Micromet公司(2012年被Amgen收购)开发而成,是一种串联型的scFv,将一个结合T细胞抗原(通常是CD3)的scFv和结合肿瘤抗原的scFv串联而成。BiTE可同时结合T细胞及肿瘤细胞并诱导T细胞靶向杀伤肿瘤细胞。BiTE的分子量为55–60 kDa,属于小分子,渗透性好,可以到达大分子抗体难以到达的部位与抗原发生结合。但亲和力较低,在体内的半衰期较短[20]。Blinatumomab是基于该平台开发的双特异抗体药物的典型代表。
2.2.2 DART双特异性抗体DART (Dual affinity re-targeting)是由MacroGenics公司开发而成,是一种由两条多肽链结合形成的异源二聚体抗体,首先使用linker分别将一个抗体可变区的VH和VL与另一个抗体可变区的VL和VH序列连接形成scFv,之后共表达两个scFv片段,利用抗体VH和VL结构域链间相互作用形成双特异片段,并在两条多肽链的C末端引入了半胱氨酸形成链间二硫键,提高产品的稳定性[21]。
2.2.3 TandAbs双特异性抗体TandAbs是由Affimed公司开发的一类四价的双特异抗体,包含4个scFv结构域。TandAbs由两条肽链形成,其中每条肽链的N端到C端按VL1-VH2-VL2-VH1的顺序排列,两条肽链反向配对形成同源二聚体分子。TandAbs相对分子质量约为110 kDa,介于全分子抗体及BiTE之间,比较其他重组抗体片段有更长的半衰期。TandAbs可以同2种抗原结合,并且每种抗原都有2个结合位点。TandAbs可以招募效应细胞(T细胞或NK细胞),并对靶细胞(肿瘤细胞或癌细胞)起到杀伤效果。当TandAbs连接了T细胞与肿瘤细胞后,T细胞会被激活,释放穿孔素、颗粒酶、溶酶体酶等物质,这些物质会被传送到T细胞的细胞膜并分泌到细胞外的基质中。穿孔素会使靶细胞内形成气孔,从而促进裂解物质的进入,进而引起靶细胞的裂解[22]。
2.2.4 Bi-Nanobody双特异抗体Bi-Nanobody是Ablynx公司(2018年被Sanofi收购)开发,是一种单域抗体,来自于骆驼及美洲驼体内的一种缺失轻链的重链抗体的可变区片段。这类抗体的主要优点是分子小、稳定性高、易于连接,分子小使其易于穿过较深的组织并靶向一些正常IgG抗体难以到达的表位。不过,缺乏Fc的纳米抗体在体内的循环半衰期较短,可以通过融合人血清白蛋白或白蛋白功能区以延长半衰期[23]。
除上述结构外,还有其他的一些结构,如McDonagh CF等将两个scFv与人白蛋白融合,延长了抗体的体内半衰期[23-24],并进入临床研究,由于Ⅱ期临床失败,项目终止。
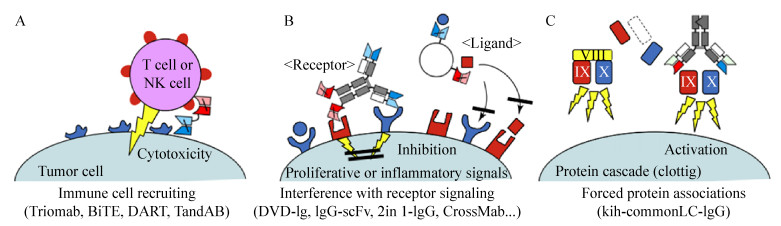
3 双特异抗体的作用机制与传统的单克隆抗体相比,双特异性抗体具有同时结合2个不同抗原表位的能力,可以通过不同的作用方式,如介导细胞毒作用、抑制信号通路、形成蛋白复合物等方式而起到特殊的生物学功能(图 2)。
大部分的双特异抗体都设计将免疫细胞重新定向到疾病发展过程中具有重要作用的靶细胞(比如肿瘤细胞),双特异性抗体拥有两个不同的抗原结合域,其中一个结合域靶向肿瘤细胞,另一结合域靶向免疫效应细胞上的标志抗原,达到召集免疫细胞清除肿瘤细胞的目的。目前已批准上市的2个双特异性抗体药物Removab (Catumaxomab)和Blicyto (Blinitumomab)都是通过这种机制而发挥作用的。
EpCAM (CD326,17-1A)是一种分子量约为40 kDa的跨膜糖蛋白,为钙非依赖性的上皮细胞间粘附分子,在上皮癌变发挥重要作用,包括肺癌、结肠癌、胰腺癌、胆管癌、乳腺癌等。Removab采用Triomab分子模式,依靠两个抗原结合臂分别结合细胞毒性T细胞的CD3位点和肿瘤细胞的EpCAM位点,从而引导T细胞杀伤靶细胞[25-27]。Blinatumomab是一种BiTE抗体药物,分别靶向T细胞CD3和肿瘤细胞CD19抗原,临床试验已经证明,Blinatumomab在极低浓度(10–100 pg/mL)下,依然可以召集T细胞杀伤肿瘤细胞。但是由于Blinatumomab的单链结构,缺乏Fc段导致药物在体内半衰期很短,实际使用时需要额外配备连续输液装置[28-30]。
3.2 抑制信号通路利用双特异抗体拮抗2种或多种信号传导配体,阻断双信号通路,是双特异抗体发挥作用的另一机制。受体酪氨酸激酶(Receptor tyrosine kinase,RTKs)是最大的一类酶联受体,如her家族和胰岛素样生长受体IGF受体,能够刺激或者调节肿瘤细胞的生长,在很多肿瘤细胞表面异常高表达,因此它们成为肿瘤治疗中的优先靶点。靶向RTKs的单靶点单克隆抗体,如靶向her1的cetuximab和panitumumab,以及靶向her2的tratuzumab和pertuzumab,已在肿瘤治疗中得到广泛应用。然而,肿瘤细胞可以通过信号通路的转换来破除这些抗体药物对其生长的抑制。因此,采用双特异性抗体药物介导的同时针对两条RTK信号通路的治疗,可以减少肿瘤细胞逃逸,从而提高疗效。
Tratuzumab和pertuzumab是靶向her2抗原domain Ⅱ和domain Ⅳ两个不同表位的抗体,两个抗体分别通过不同的信号通路,防止her2同源聚体和her家族其他成员的异源聚体形成,抑制肿瘤的生长,这两个抗体联合使用已在临床被验证具有很好的治疗效果。针对这两个表位的双特异抗体具有很大的市场前景。国内外有数家企业如苏州康宁杰瑞、北京天广实和北京康明百奥都有针对这两个不同表位的双特异抗体,3个公司都是采用了KIH的分子结构,其中康宁杰瑞和北京康明百奥在KIH结构基础上采用共同轻链解决了重轻链错配问题,而天广实则是分别表达两个半抗后体外包装形成双特异抗体,同时北京康明百奥和天广实进一步利用低岩藻糖细胞株生产抗体,进一步提高抗体对肿瘤的杀伤[19, 31-32]。
3.3 促进蛋白复合物形成利用双特异性抗体两个抗原结合臂可以结合不同抗原的特点,两个抗原结合臂分别结合两种特定蛋白分子,形成功能性复合体。利用该种复合体给药,可以减少机体内排斥反应,提高临床治疗效果。如罗氏研制的双特异抗体Emicizumab模拟了FVIII的功能,促进蛋白复合物形成[33-34]。
4 双特异抗体的研究现状抗体药物是全球最受欢迎的药物之一,近年来,不断有新的抗体药物批准上市,抗体药物的市场容量也在稳步增长,2017年全球抗体药物的销售额约1 200亿美元,且在逐年递增。双特异性抗体被誉为第二代抗体,具有广阔市场前景。有报告显示,2024年双特异性抗体药物的市场将达到58亿美元。
目前,全球已有3个双特异性抗体药物获得批准上市。Catumaxomab是全球首个获批的双特异性抗体药物,一种抗CD3和上皮细胞粘附分子(EpCAM)的小鼠双特异性抗体,于2009年被EMA批准上市,用于恶性腹腔积液的治疗。不过Catumaxomab目前并未获得FDA批准。Blinatumomab于2014年被FDA批准上市,是一种BiTE抗体药物,用于急性淋巴细胞白血病的治疗。相比化疗药物,Blinatumomab将复发性或难治性前体B细胞ALL中位生存时间延长了近一倍(7.7个月vs.4个月),2017年其销售额为1.75亿美元。Emicizumab在2017年11月被FDA批准上市,用于A型血友病的治疗。Emicizumab部分模拟了FVⅢ的功能,通过桥连FIXa与FX,促进FXa的产生,该药物的上市,打破了A型血友病此前只能采用VⅢ因子替代疗法的治疗现状。Emicizumab此前曾获突破性药物、孤儿药和优先审批资格,专家预测峰值销售可达50亿美元。除了目前已上市的3个双特异抗体外,至少还有60个以上处于临床前,30个处于临床研究或临床前研究的在研双特异抗体,约三分之二的双特异抗体都是集中在肿瘤治疗领域[35]。大部分抗肿瘤双特异抗体采用的是和Catumaxomab、Blinatumomab类似的组合形式,包含一个抗CD3抗原结合位点,用来招募T细胞至肿瘤细胞附近,第2个结合位点靶向CD19、CD20、CD33、CD123、HER1、HER2、CEA、PSMA、gpA33等肿瘤表面抗原。另外还有一些其他的抗原结合位点(通常是细胞因子)的双特异抗体组合形式处于临床,如HER2+HER3、IL1α+IL1β、IL13+IL17、CD30+ CD16A等。部分处于临床阶段的双特异抗体情况汇总如表 1。
| Name | Target | Disease | Trial | Developer |
| BiTE (bispecific T-cell retargeting) | ||||
| Blinatumonmab, AMG103, MT103 | CD19+CD3 | Acute lymphoblastic leukemia | Approved | Amgen |
| Solitomab, AMG110, MT110 | EpCAM+CD3 | Lung, gastric, colorectal, breast, Prostate, and ovarian cancer | PhaseⅠ (completed) | Amgen |
| AMG111, MT111, MEDI1565 | CEA+CD3 | Gastronintedtinal adenocarcinomas | PhaseⅠ (completed) | Amgen |
| Pasotuxizumab, AMG112, MT112 | PSMA+CD3 | Prostate cancer | PhaseⅠ | Bayer |
| AMG330 | CD33+CD3 | Acute myeloid leukemia | PhaseⅠ | Amgen |
| AMG420, BI836909 | BCMA+CD3 | Multiple myeloma | PhaseⅠ | Amgen, BOehringer Ingelheim |
| Quadroma, Triomab: T-cell recruitment | ||||
| Catumaxomab | EpCAM+CD3 | Malignant ascites | Approved | Fresenius, Trion |
| Ertumaxomab | HER2+CD3 | Breast cancer | PhaseⅡ | Fresenius |
| FBTA05 | CD20+CD3 | B-cell lymphoma | PhaseⅠ/Ⅱ | Fresenius |
| DART (dual-affinity retargeting): retargeting of T cell to tumors | ||||
| PF06671008 | P-cadherin+CD3 | Solid tumors | PhaseⅠ | MacroGenics, Pfizer |
| Flotetuzumab, MGD006 | CD123+CD3 | Acute myeloid leukemia | PhaseⅠ | MacroGenics |
| MGD007 | gpA33+CD3 | Colorectal cancer | PhaseⅠ | MacroGenics |
| MGD009 | B7H3+CD3 | Melanoma, colon, ovarian, prostate, pancreatic caner | PhaseⅠ | MacroGenics |
| MGD010 | CD32B+CD79B | Autoimmune disorders | PhaseⅠ | MacroGenics |
| MGD011, NJ64052781 | CD19+CD3 | B-cell malignancies | PhaseⅡ | MacroGenics, Janssen |
| DVD-Ig (dual-variable-domain IgG: blockade of proinflammatory cytokines | ||||
| Remtolumab, ABT122 | IL1α+IL1β | Osteoarthritis | PhaseⅡ | AbbVie |
| ABT165 | DLL4+VEGF | Solid tumors | PhaseⅠ | AbbVie |
| Lutikizumab, ABT981 | TNF+IL17A | Rheumatoid arthritis | PhaseⅡ | AbbVie |
| SARI56597 | IL4+IL13 | Idiopathic pulmonary fibrosis | PhaseⅡ (completed) | Sanofi |
| GSK2434735 | IL13+IL4 | Asthma | PhaseⅠ (completed) | GlaxoSmithKline |
| CrossMAb: Ticell recruitment | ||||
| Vanucizumab, RG7221 | Angiopoietin 2+VEGF | Colorectal cancer | PhaseⅡ (completed) | Roche |
| RG7716 | Angiopoietin 2+VEGF | Wet agerelated macular degeneration | PhaseⅡ | Roche |
| CrossMAb: targeted apoptosis | ||||
| RG7802 | CEA+CD3 | Solid tumors | PhaseⅠ | Roche |
| CrossMAb: two-ligand inactivation | ||||
| RG7386 | FAP+DR5 | Solid tumors | PhaseⅠ | Roche |
| TandAbs: retargeting of immune cells to tumors | ||||
| AFM11 | CD19+CD3 | Non-Hodgkin’s lymphoma | PhaseⅠ | Affimed |
| AFM13 | CD30+gpA33 | Hodgkin’s lymphoma | PhaseⅡ | Affimed |
| Nanobody: blockade of proinflammatory cytokines | ||||
| Ozoralizumab, ATN103 | TNF+HSA | Rheumatoid arthritis | PhaseⅡ | Ablynx |
| ALX0061 | IL6R+HSA | Rheumatoid arthritis, lupus | PhaseⅠ/Ⅱ | Ablynx, AbbVie |
| ALX0761 | IL17A/F+HSA | Psoriasis | PhaseⅠ | Ablynx, Merck |
| Nanobody: blockade of bone resorption | ||||
| ALX0141 | RANKL+HSA | Postmenopausal bone loss | PhaseⅠ | Ablynx |
| Nanobody: inactivation of two proteins | ||||
| BII034020 | Aβ40+Aβ42 | Alzheimer’s disease | PhaseⅠ | Boehringer ingelheim |
| IgG assembled from half-Abs: inactivation of two proteins | ||||
| BITS7201A, RG7990 | IL13+IL17 | Asthma | PhaseⅠ | Genentech, Novimmune |
| IgG assembled from half-Abs: hormone mimetic | ||||
| BFKB8488A, RG7992 | FGFRI+KLB | Type 2 diabetes | PhaseⅠ | Genentech |
| scFv-Fc-Fab fusions: inativation of protein ligands | ||||
| MEDI3902 | PSL+PcrV | Pneumonia | PhaseⅡ | MedImmune |
| MEDI0700 | BAFF+B7RPI | Lupus | PhaseⅠ | MedImmune |
| MEDI7352 | NGF+TNF | Osteoarthritis | PhaseⅠ | MedImmune |
| IgG fynomer: inactivation of two cytokines | ||||
| COVA322 | TNF+IL17A | Plaque psoriasis | PhaseⅠⅠ/Ⅱ | Janssen, Covagen |
双特异性抗体在肿瘤治疗领域的应用研究已经取得了一定进展,许多跨国药企和众多生物技术公司都在开发双特异抗体相关药物。国内也有不少企业涉足双特异抗体的研究开发领域,其中部分产品已进入临床或者临床申报阶段,截止2019年12月,国内已有22款双特异性抗体在CDE有相关申报记录(表 2)。
| 药品名称 | 靶点 | 阶段 | 企业名称 | 承办日期 |
| 重组人血管内皮生长因子受体-抗体-人补体受体1融合蛋白注射液 | VEGFR/CR1 | Ⅰ期 | 信达生物 | 2015.04.21 |
| 注射用重组抗HER2和CD3人源化双特异性抗体 | HER2/CD3 | Ⅰ期 | 友芝友 | 2016.04.14 |
| 注射用重组抗EpCAM和CD3人鼠嵌合双特异性抗体 | EpCAM/CD3 | Ⅰ期 | 友芝友 | 2017.02.13 |
| AK104注射液 | PD-1/CTLA-4 | Ⅱ期 | 中山康方 | 2017.08.21 |
| RC28-E注射液 | VEGFR/ FGFR | Ⅰ期 | 荣昌生物 | 2017.08.24 |
| 重组抗CD19m-CD3抗体注射液 | CD19/CD3 | Ⅰ期 | 健能隆 | 2017.09.08 |
| 注射用重组人源化抗HER2双特异性抗体 | HER2 | Ⅱ期 | 康宁杰瑞 | 2017.10.23 |
| SHR-1701注射液 | PD-L1/TGF-β | Ⅰ期 | 恒瑞医药 | 2018.02.03 |
| 注射用重组人源化双功能单克隆抗体MBS301 | HER2 | IND | 天广实 | 2018.04.26 |
| 重组人源化PDL1/CTLA-4双特异性单域抗体Fc融合蛋白注射液 | PDL1/CTLA-4 | Ⅱ期 | 康宁杰瑞 | 2018.05.07 |
| EMB-01注射液 | EGFR/c-MET | Ⅰ期 | 岸迈生物 | 2018.09.19 |
| IBI318 | PD1/PD-L1 | Ⅰ期 | 信达生物 | 2018.12.10 |
| ES101注射液 | PD-L1/4-1BB | Ⅰ期 | 科望生物 | 2018.12.11 |
| K193抗体注射液 | CD19/CD3 | Ⅰ期 | 北京绿竹 | 2019.02.03 |
| IBI315 | PD-1/HER2 | Ⅰ期 | 信达生物 | 2019.05.28 |
| SI-B001双特异性抗体注射液 | EGFR/Her3 | IND | 百利药业 | 2019.08.01 |
| 注射用IMM0306 | CD47/CD20 | IND | 宜明昂科 | 2019.08.24 |
| HX009注射液 | CD47/PD-1 | IND | 翰思生物 | 2019.08.24 |
| SI-B003双特异性抗体注射液 | 未知 | IND | 百利药业 | 2019.11.01 |
| IBI322 | PD-L1/CD 47 | IND | 信达生物 | 2019.11.07 |
| MGD013注射液 | PD-1/LAG-3 | IND | 再鼎医药 | 2019.11.16 |
| KD6001注射液 | CTLA-4/HER2 | IND | 康岱生物 | 2019.11.23 |
双特异性抗体作为新兴的抗体种类,被视为肿瘤和自身免疫疾病治疗等领域前瞻性药物,目前其在技术和产业化上仍存在一定的技术难点。全球生物技术公司大量投资双特异性抗体药物的开发途径,希望打开通向大品种、多适应症疾病治疗“新大陆”的新航线。从国内申报情况看,国内双特异性抗体目前已有一定的技术基础,但在靶点的选择、双抗的连接方式、适应症方向等方面与国际一流水平有较大的差距,特别是在专利布局上有很大的缺陷。未来的专利陷阱和专利挑战会对项目的进程产生重要影响。创新药不同于生物类似药,开发战略要从独特技术平台和自主知识产权入手,在速度基础上更看重靶点的确认性和产品分子的优越性,才能为未来临床和上市成功销售赢在起跑线上。相信未来几年,双特异性抗体药物将在抗体研发领域占据重要地位。
双特异抗体可结合两个靶点,在疾病的治疗策略选择上要有很强的科学依据,希望从靶点,作用机制等方面获得双特异的协同效应,即具备优于两种抗体联合治疗的科学原理。目前已经获批的双特异抗体药物主要有两大类:1)桥接两种靶细胞;2)靶向两种蛋白或者一种蛋白的两个表位。不论采用哪种类型的双特异抗体,开发目标是在安全性与/或疗效上优于现有疗法,或者实现使用剂量的减少。
分析获批上市的双特异抗体药物,主要存在以下几个问题:1) CNS神经系统毒性。例如Blicyto (Blinitumomab)在使用过程中,会有很强的CNS毒性。可能原因是抗CD3或Fc接合臂的二聚体会导致T细胞介导的神经毒性以及细胞因子风暴。2)同源二聚体。治疗血友病的Emicizumab即便采用了共同轻链以及knobs-in-hole等先进技术,但和其他类似的技术平台一样仍会有一定的同源二聚体成分,这些特定成分存在潜在的安全问题。3)免疫原性。比如Removab (Catumaxomab)除了链错配的问题,其蛋白序列全部来自于未人源化的动物(大鼠、小鼠)抗体序列,考虑免疫原性的产生是导致疗效不显著的重要原因;其他双特异品种也有可能因为产生额外结构域的新表位而可能导致强烈的免疫原性。以上这些问题,需要更多的非临床以及临床试验,去评估更多技术平台和产品的效益与风险比而不断被解决。
5 结语目前大部分的双特异抗体的临床应用是针对肿瘤治疗和炎症疾病,主要是利用双特异抗体同时定位参与病理生理过程中的不同靶点以提高疗效。目前大多双特异抗体都是处于临床或临床前研究,说明双特异抗体还是有一些亟待解决的问题,细胞因子风暴、神经毒性等不良反应以及生产工艺问题是双特异抗体的主要问题。科技手段的发展和更新,有助于双特异抗体存在的这些问题得到逐渐解决或改善,使其具有更强大的疗效和更低的副作用。随着越来越多的双特异抗体进入临床研究,将会有越来越多的双特异抗体上市,一些新的治疗策略正在研究中,可进一步支持这些分子用于治疗肿瘤,为肿瘤患者带来福音。
| [1] |
Nisonoff A, Rivers MM. Recombination of a mixture of univalent antibody fragments of different specificity. Arch Biochem Biophys, 1961, 93(2): 460-462. DOI:10.1016/0003-9861(61)90296-X |
| [2] |
Valone FH, Kaufman PA, Guyre PM, et al. Clinical trials of bispecific antibody MDX-210 in women with advanced breast or ovarian cancer that overexpresses HER-2/neu. J Hematother, 1995, 4(5): 471-475. DOI:10.1089/scd.1.1995.4.471 |
| [3] |
Valone FH, Kaufman PA, Guyre PM, et al. Phase Ia/Ib trial of bispecific antibody MDX-210 in patients with advanced breast or ovarian cancer that overexpresses the proto-oncogene HER-2/neu. J Clin Oncol, 1995, 13(9): 2281-2292. DOI:10.1200/JCO.1995.13.9.2281 |
| [4] |
Garber K. Bispecific antibodies rise again. Nat Rev Drug Discov, 2014, 13(11): 799-801. DOI:10.1038/nrd4478 |
| [5] |
Brinkmann U, Kontermann RE. The making of bispecific antibodies. MAbs, 2017, 9(2): 182-212. DOI:10.1080/19420862.2016.1268307 |
| [6] |
Staerz UD, Kanagawa O, Bevan MJ. Hybrid antibodies can target sites for attack by T cells. Nature, 1985, 314(6012): 628-631. DOI:10.1038/314628a0 |
| [7] |
Staerz UD, Bevan MJ. Hybrid hybridoma producing a bispecific monoclonal antibody that can focus effector T-cell activity. Proc Natl Acad Sci USA, 1986, 83(5): 1453-1457. DOI:10.1073/pnas.83.5.1453 |
| [8] |
Kontermann RE. Dual targeting strategies with bispecific antibodies. MAbs, 2012, 4(2): 182-197. DOI:10.4161/mabs.4.2.19000 |
| [9] |
Kontermann RE, Brinkmann U. Bispecific antibodies. Drug Discov Today, 2015, 20(7): 838-847. DOI:10.1016/j.drudis.2015.02.008 |
| [10] |
Kontermann RE. Strategies to extend plasma half-lives of recombinant antibodies. BioDrugs, 2009, 23(2): 93-109. DOI:10.2165/00063030-200923020-00003 |
| [11] |
Chelius D, Ruf P, Gruber P, et al. Structural and functional characterization of the trifunctional antibody catumaxomab. MAbs, 2010, 2(3): 309-319. DOI:10.4161/mabs.2.3.11791 |
| [12] |
Ridgway JB, Presta LG, Carter P. 'Knobs-into-holes' engineering of antibody CH3 domains for heavy chain heterodimerization. Protein Eng, 1996, 9(7): 617-621. DOI:10.1093/protein/9.7.617 |
| [13] |
Klein C, Schaefer W, Regula JT. The use of CrossMAb technology for the generation of bi- and multispecific antibodies. MAbs, 2016, 8(6): 1010-1020. DOI:10.1080/19420862.2016.1197457 |
| [14] |
Liu Z, Leng EC, Gunasekaran K, et al. A novel antibody engineering strategy for making monovalent bispecific heterodimeric IgG antibodies by electrostatic steering mechanism. J Biol Chem, 2015, 290(12): 7535-7562. DOI:10.1074/jbc.M114.620260 |
| [15] |
Zhou PF, Zhang J, Yan YX. Bispecific antibody: US, 9079965. 2015-07-14.
|
| [16] |
Bostrom J, Yu SF, Kan D, et al. Variants of the antibody herceptin that interact with HER2 and VEGF at the antigen binding site. Science, 2009, 323(5921): 1610-1614. DOI:10.1126/science.1165480 |
| [17] |
DiGiammarino E, Ghayur T, Liu JJ. Design and generation of DVD-Ig™ molecules for dual-specific targeting. Methods Mol Biol, 2012, 899: 145-156. |
| [18] |
Wu CB. Fabs-in-tandem immunoglobulin and uses thereof: US, 20160289341. 2016-10-06.
|
| [19] |
Xiao SH, Zhu XD. Biparatopic and multiparatopic antibodies with common light chain and method of use: WO/2018/191188. 2018-10-18.
|
| [20] |
Mack M, Riethmüller G, Kufer P. A small bispecific antibody construct expressed as a functional single-chain molecule with high tumor cell cytotoxicity. Proc Natl Acad Sci USA, 1995, 92(15): 7021-7025. DOI:10.1073/pnas.92.15.7021 |
| [21] |
Johnson S, Burke S, Huang L, et al. Effector cell recruitment with novel Fv-based dual-affinity re-targeting protein leads to potent tumor cytolysis and in vivo B-cell depletion. J Mol Biol, 2010, 399(3): 436-449. DOI:10.1016/j.jmb.2010.04.001 |
| [22] |
Reusch U, Burkhardt C, Fucek I, et al. A novel tetravalent bispecific TandAb (CD30/CD16A) efficiently recruits NK cells for the lysis of CD30+ tumor cells. MAbs, 2014, 6(3): 727-738. DOI:10.4161/mabs.28591 |
| [23] |
Guo TT, Liang JF, Nie L, et al. Progress in research of bispecific antibody drugs. Chin J New Drugs, 2016, 25(5): 518-523 (in Chinese). 郭婷婷, 梁锦峰, 聂磊, 等. 双特异性抗体药物的研究进展. 中国新药杂志, 2016, 25(5): 518-523. |
| [24] |
McDonagh CF, Huhalov A, Harms BD, et al. Antitumor activity of a novel bispecific antibody that targets the ErbB2/ErbB3 oncogenic unit and inhibits heregulin-induced activation of ErbB3. Mol Cancer Ther, 2012, 11(3): 582-593. DOI:10.1158/1535-7163.MCT-11-0820 |
| [25] |
Sebastian M. Review of catumaxomab in the treatment of malignant ascites. Cancer Manag Res, 2010, 2: 283-286. |
| [26] |
Kubo M, Umebayashi M, Kurata K, et al. Catumaxomab with activated T-cells efficiently lyses chemoresistant EpCAM-positive triple-negative breast cancer cell lines. Anticancer Res, 2018, 38(7): 4273-4279. DOI:10.21873/anticanres.12724 |
| [27] |
Heiss MM, Ströhlein MA, Jäger M, et al. Immunotherapy of malignant ascites with trifunctional antibodies. Int J Cancer, 2005, 117(3): 435-443. DOI:10.1002/ijc.21165 |
| [28] |
Topp MS, Gökbuget N, Zugmaier G, et al. Phase Ⅱ trial of the anti-CD19 bispecific T cell-engager blinatumomab shows hematologic and molecular remissions in patients with relapsed or refractory B-precursor acute lymphoblastic leukemia. J Clin Oncol, 2014, 32(36): 4134-4140. DOI:10.1200/JCO.2014.56.3247 |
| [29] |
Löffler A, Gruen M, Wuchter C, et al. Efficient elimination of chronic lymphocytic leukaemia B cells by autologous T cells with a bispecific anti-CD19/anti-CD3 single-chain antibody construct. Leukemia, 2003, 17(5): 900-909. DOI:10.1038/sj.leu.2402890 |
| [30] |
Bargou R, Leo E, Zugmaier G, et al. Tumor regression in cancer patients by very low doses of a T cell-engaging antibody. Science, 2008, 321(5891): 974-977. DOI:10.1126/science.1158545 |
| [31] |
Huang SJ, Li F, Liu HF, et al. Structural and functional characterization of MBS301, an afucosylated bispecific anti-HER2 antibody. MAbs, 2018, 10(6): 864-875. DOI:10.1080/19420862.2018.1486946 |
| [32] |
Wei HD, Cai HY, Jin YH, et al. Structural basis of a novel heterodimeric Fc for bispecific antibody production. Oncotarget, 2017, 8(31): 51037-51049. |
| [33] |
Shima M, Hanabusa H, Taki M, et al. Factor VⅢ-mimetic function of humanized bispecific antibody in hemophilia A. N Engl J Med, 2016, 374(21): 2044-2053. DOI:10.1056/NEJMoa1511769 |
| [34] |
Knight T, Callaghan MU. The role of emicizumab, a bispecific factor IXa- and factor X-directed antibody, for the prevention of bleeding episodes in patients with hemophilia A. Ther Adv Hematol, 2018, 9(10): 319-334. DOI:10.1177/2040620718799997 |
| [35] |
Thakur A, Lum LG. "NextGen" biologics: bispecific antibodies and emerging clinical results. Expert Opin Biol Ther, 2016, 16(5): 675-688. DOI:10.1517/14712598.2016.1150996 |
| [36] |
Sedykh SE, Prinz VV, Buneva VN, et al. Bispecific antibodies: design, therapy, perspectives. Drug Des Devel Ther, 2018, 12: 195-208. DOI:10.2147/DDDT.S151282 |
 2020, Vol. 36
2020, Vol. 36