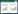中国科学院微生物研究所、中国微生物学会主办
文章信息
- 沈鸿霖, 张芝晴, 李少伟, 顾颖
- Shen Honglin, Zhang Zhiqing, Li Shaowei, Gu Ying
- HIV-1 Env三聚体抗原改造研究进展
- Progress in HIV-1 Env trimer design
- 生物工程学报, 2020, 36(1): 25-32
- Chinese Journal of Biotechnology, 2020, 36(1): 25-32
- 10.13345/j.cjb.190162
-
文章历史
- Received: April 25, 2019
- Accepted: May 21, 2019
- Published: June 18, 2019
2. 厦门大学 公共卫生学院 分子疫苗学与分子诊断学国家重点实验室,福建 厦门 361102
2. State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, School of Public Health, Xiamen University, Xiamen 361102, Fujian, China
人类免疫缺陷病毒1型(Human immunodeficiency virus,HIV-1)是导致艾滋病(Acquired immunodeficiency syndrome,AIDS)的主要病原体。据世界卫生组织(World health organization,WHO)统计报告,自1981年HIV-1发现至今,HIV-1感染者已逾7 000万人,超过3 500万人死于艾滋病相关疾病;截止2017年底,全球仍有3 690多万的HIV-1感染者,我国感染HIV-1的人数也逐年递增[1]。近年来,从精英患者血液中分离得到的广谱中和抗体能够中和多种亚型的HIV-1毒株,这提示通过疫苗诱导机体产生广谱中和抗体是预防、治疗艾滋病的突破点。因此,研制出高效的HIV-1疫苗对攻克艾滋病具有重大意义[2]。
HIV-1疫苗开发的主要目标是通过疫苗诱导机体产生广谱中和抗体。HIV-1病毒粒子表面的包膜糖蛋白(Envelope glycoprotein,Env)三聚体是中和抗体识别的唯一靶标[3]。通过设计并在体外表达稳定的Env三聚体,是目前HIV-1候选疫苗抗原的研究热点。早期,对于Env三聚体的设计只是简单地利用三聚体折叠序列辅助蛋白形成三聚体模序,例如在蛋白序列中添加牛痘病毒(Vaccinia virus,VACV)14K蛋白基因(分离自A27L基因)辅助gp120组装成三聚体[4];或者在Env蛋白基因序列末端添加T4噬菌体折叠序列辅助蛋白形成三聚体等[5]。随着研究的深入,目前已经提出了各种不同的策略来克服Env亚稳态,并产生用于结构和疫苗研究的稳定、均一的Env三聚体。其中典型的设计方法有SOSIP、NFL2P以及UFO设计方法。文中就这3种主要的Env三聚体改造策略进行综述,分析其优缺点,为后续的免疫原改造提供参考。
1 HIV-1 Env的结构和功能特征HIV-1 Env是由异源二聚体的单体形成的三聚体,每个单体含有受体结合蛋白gp120 (Surface glycoprotein,SU)和跨膜融合蛋白gp41 (Transmembrane protein,TM),以非共价相互作用连接[6]。前体Env蛋白(gp160)在内质网合成,并转运到高尔基体中进行相关糖基修饰和蛋白折叠,以形成三聚体构象,再由弗林蛋白酶(Furin)家族将gp160剪切为gp120和gp41亚基[7]。
HIV-1可感染CD4+ T淋巴细胞。在感染过程中,gp120与靶细胞表面CD4受体结合发生变构,暴露辅助受体CCR5/CXCR4结合部位,使病毒与细胞紧密结合;随后,gp41融合肽(Fusion peptides,FP)进行穿膜,重复序列Heptad repeat 1 (HR1)、Heptad repeat 2 (HR2)发生构象重排形成发卡结构,拉近病毒和靶细胞的距离并进行膜融合,以介导病毒基因组进入细胞[8]。
Env同样也是中和抗体结合的唯一靶标。广谱中和抗体主要是通过结合病毒表面Env三聚体阻止病毒入胞[9]。但并非所有病毒表面的突刺结构都是正确的Env三聚体构象,其病毒表面存在着一些单体形式的、更开放的、折叠不正确的Env[10],以诱导机体产生非中和抗体进行免疫逃逸[11]。目前所鉴定的广谱中和抗体的中和表位V1/V2区、V3区、CD4结合位点(CD4 binding site,CD4bs)、gp120/gp41交界面以及近膜端(Membrane proximal external region,MPER)均位于Env的胞外区段,且大多数广谱中和抗体识别的表位在不同程度上受三聚体四级结构的影响,更有甚者是三聚体结构依赖性抗体[12]:如识别gp120上V1/V2区的抗体PGT145以及识别gp120/gp41交界面的抗体35O22[13]。目前报道的广谱度较好的中和抗体VRC01 (约覆盖了由190种假病毒组成的假病毒盘中的91%[14-16])识别的表位CD4bs同样也受三聚体空间结构的影响。因此,类天然Env三聚体成为HIV-1疫苗设计候选疫苗抗原,设计并在体外表达稳定的类天然Env三聚体对HIV-1疫苗研究意义重大。
2 基于二硫键连接的SOSIP设计2013年,Sanders等以HIV-1 A亚型毒株BG505为设计毒株,通过构建二硫键(SOS)并引入三聚体突变(I559P),成功在体外表达类天然Env三聚体蛋白,并将这种改造方法命名为SOSIP设计[17]。改造方法如下(图 1):1)引入T501C\A605C双突变在gp120和gp41之间构建二硫键[18],使gp120和gp41以共价作用连接,构象更加稳定[19];2)对Furin酶切位点进行R6突变(REKR→RRRRRR)提高酶切效率;3)引入I559P突变有利于Env形成三聚体构象[20];4)利用人组织纤维蛋白溶酶原激活剂信号肽替换gp120原有的信号肽,并在启动子前面添加Kozak序列(GCCACC)以提高蛋白的表达量;5)删除gp41高度疏水性的MPER,增强了蛋白的可溶性表达和均一性[21-23]。
在蛋白纯化方面,通过引入T332N突变使真核表达的Env三聚体能与糖基依赖性抗体2G12结合[24]。利用抗体亲和层析对Env三聚体进行初步纯化,再用分子筛排阻层析(Size exclusion chromatography,SEC)进行二次纯化得到Env三聚体。改造后的Env三聚体与广谱中和抗体如VRC01、3BNC117等亲和力强,并能在电镜下看到其三聚体形态[25]。
SOSIP设计方法的出现掀起了类天然Env三聚体改造的热潮,研究者在此方法的基础上进行了一系列的优化。Joyce等将gp120 201位和433位氨基酸残基突变成两个半胱氨酸,以引入二硫键构建稳定性更好的“DS-BG505 SOSIP.664”突变体[26]。Ringe等在AMC008 SOSIP.664的基础上进行了L535M、L543Q/N双突变得到了稳定性更强的SOSIP.v3三聚体抗原,并在SOSIP.v3的基础上引入A316W、E64K/H66R突变得到免疫原性更强并能减少非中和表位暴露的半封闭式三聚体SOSIP.v4[27];Sullivan等通过引入二硫键和脯氨酸残基、填充gp120上的疏水性空腔等方法进行鸟枪法诱变,产生852个变体,以三聚体依赖性抗体PGT145结合活性为指标,通过高通量ELISA的方法,最终筛选出3株突变体Q203F、T538F和I548F,进一步提高了SOSIP三聚体的稳定性和免疫原性[28]。
将SOSIP改造的Env三聚体和非天然、不剪切状态的Env蛋白分别在小鼠、家兔和恒河猴上进行动物免疫验证其免疫原性。免疫结果显示,SOSIP改造的类天然Env三聚体可以在3种动物体内产生较高的血清中和滴度。其中家兔和Balb/C小鼠免疫产生的血清中和滴度最高,可达到10 000以上;恒河猴免疫产生的血清中滴度相对较弱。而非天然、不剪切状态的Env三聚体在3种实验动物体内的血清中和滴度较低,均小于100[2, 29-31]。这表明,类天然的Env三聚体相较于非天然的Env蛋白具有更强的免疫原性和诱导中和抗体的能力。
尽管SOSIP设计方法实现了类天然Env三聚体的体外表达,在HIV-1候选疫苗抗原设计上有了质的突破,但该方法存在通用性不高、产量低且结构不稳定等问题,仍然需要进一步的优化。
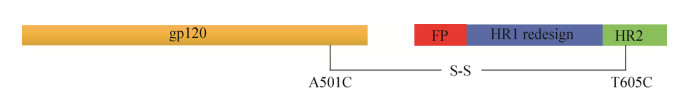
3 不依赖于酶切的NFL2P (Native flexibly linked)设计2015年,基于SOSIP改造方法的经验及存在的问题,新一代不依赖于酶切的类天然HIV-1 Env三聚体改造方法NFL2P问世[32]。NFL是指以更加天然、灵活的方式连接gp120和gp41两个亚基构建Env三聚体;2P指的是利用2个柔性的Linker连接。该方法以B亚型毒株JR-FL为改造毒株,相较于SOSIP改造方法,其通用性有所提高。除了将gp120的信号肽替换成人类CD5信号肽外,与SOSIP改造方法相比,NFL2P设计方法最大的不同是直接删除了Furin酶切位点REKR并将其替换成了两个柔性的Linker (G4S)2 (GGGGSGGGGS),以此产生了不依赖于Furin酶剪切的更加稳定的类天然Env三聚体(图 2)。
为了进一步增强类天然Env三聚体的免疫原性并暴露更多的广谱中和表位,Yang等通过对BG505 NFL.gp140和16055 NFL.Env三聚体进行脯氨酸扫描和二硫键扫描突变,筛选出3组突变方法——I201C/A433C (TD)、A501C/L663C (2CC+)和L555P;并在FP的上游添加了肠激酶切位点D4K形成了结构导向更加完整的NFL Env三聚体抗原,增强广谱中和表位融合肽FP的暴露[33]。Dubrovskaya等在10655 NFL三聚体蛋白的基础上,通过删除CD4结合位点附近潜在的N-聚糖位点(Potential N-glycan sites,PNGS)提高蛋白的稳定性及与靶向CD4bs的广谱中和抗体的亲和性,并且能快速刺激动物机体产生抗体应答,表明删除CD4bs结合位点附近的N-聚糖有利于相应抗体的产生[34]。
以16055 NFL TD CC三聚体为免疫原,对C57BL/6小鼠进行动物免疫,免疫剂量为10 μg/只;免疫10周后,其血清中和滴度达到15 000–17 000之间;且该三聚体与戊二醛交联后能增强其热稳定性并减少非中和表位的暴露,有利于诱导中和抗体[35-37]。虽然,不依赖于酶切的NFL2P改造方法相较于SOSIP改造方法在通用性和产量上有所提高,并能在动物体内激起良好的血清中和效果,但并没有彻底解决Env三聚体改造方法在不同毒株上的通用性问题。
4 基于HR1优化的UFO (Uncleaved prefusion-optimized)设计2016年,Zhu等提出了基于HR1优化的HIV-1 Env三聚体设计方法——UFO,解决了Env三聚体抗原设计在不同毒株上应用的通用性问题[38]。UFO设计是指不依赖于酶切并针对膜融合过程进行相关优化的类天然HIV-1 Env三聚体改造方法。通过对结构进行分析发现,SOSIP设计所产生Env三聚体中,gp41的HR1部分被包裹起来,无法观测到其结构特征,而HR1在HIV-1病毒入胞的过程中发生明显的构象变化介导病毒入胞。因此,HR1可能是影响Env三聚体结构稳定性的关键区域。SOSIP设计方法引入了二硫键及三聚体突变I559P,改变了原有的HR1的空间距离,这可能使这种三聚体改造方法缺乏通用性。
基于此,Zhu等开发了一种基于集合(Ensemble-based)的蛋白设计方法:利用深度测序技术,通过计算机模拟得到五段10氨基酸的低能结构环,利用这些能量较低的结构环对HR1进行替换,提高了Env三聚体的稳定性和表达量(图 3)。相较于SOSIP设计方法,UFO设计方法删除了I559P的突变,并尝试了不同长度的Linker代替Furin酶切位点。通过一系列的抗原分析,最终发现将Furin酶切位点替换成简单的G4S Linker能够提高Env三聚体的稳定性。将这种设计方法应用于HIV-1的不同亚型的毒株,如A亚型的BG505、B亚型的JRFL、B'/C亚型的CH115.12以及CN54。结果显示该设计方法在不同亚型的HIV-1毒株中均能产生良好的适用性,且表达的Env三聚体结构均一,并能和已报道的广谱中和抗体有较好的亲和性。
UFO的改造方法及其三聚体的晶体结构提示,gp41 ectodomain (gp41ECTO)区段是影响Env亚稳定性的主要因素,而Env的亚稳定性是HIV-1疫苗设计中必须克服的难题。UFO-BG改造方法的出现解决了Env三聚体亚稳定性的问题:用UFO方法改造的BG505 gp41 ECTO区段替换野生型病毒毒株的gp41 ECTO区域得到gp41 ECTO交换三聚体。将该改造方法应用于10株不同HIV-1毒株,跨越5个亚型,均体现出良好的适配性。且该改造方法产生的三聚体能在CHO细胞中高效表达,其产量、纯度及抗体亲和力均有了很大提高。UFO-BG改造方法为HIV-1疫苗设计提供了重要的候选疫苗抗原[39]。
以UFO和UFO-BG两种Env三聚体免疫小鼠,发现两种三聚体蛋白均能在小鼠体内激起较好的中和抗体水平;将该三聚体蛋白展示在60聚体的纳米颗粒上进行免疫时,结果显示其血清中和滴度显著提高近一个数量级[16, 40]。UFO设计方法有效解决了前两种三聚体设计方法中通用性不高、产量低及稳定性等问题,为HIV-1疫苗免疫原设计提供了新方法。
5 总结与展望HIV-1疫苗的研发对攻克艾滋病的流行和传播具有重要的意义,而HIV-1病毒表面包膜糖蛋白Env三聚体是抗体识别的唯一靶标,因此,设计并能在体外稳定表达Env三聚体蛋白是目前针对HIV-1疫苗免疫原设计的一大热点。随着研究的深入,Env三聚体免疫原设计的难题被一步步解决。SOSIP设计实现了从无到有的突破性进展,但其存在通用性差、产量不高、结构不稳定等问题;不依赖酶切的NFL2P设计方法大大提高了Env三聚体在体外表达的效率和产量,但依然存在通用性不高的问题;UFO设计方法的出现弥补了这一缺点,不仅实现了类天然Env三聚体在体外的高效表达,并可以应用在多个亚型的HIV-1毒株上,其构象也更加稳定均一。三种Env三聚体改造策略优缺点比较如表 1所示。
| Name of construct | Design strategy | Advantages and disadvantages |
| SOSIP | ① Mutation: T332N, I559P, A501C, T605C, ② Delete MPER ③ REKR to RRRRRR in gp120 ④ Add Kozak sequence, the tissue plasm-inogen activator (tPA) signal peptide replaced the natural one ⑤ Codon-optimized |
① Advantages: A series of modifycational methods of systemic Env trimer design were proposed, which made the expression of Env trimer in vitro possible and showed good adaptability in BG505 strain ② Disadvantages: low versatility, low expression |
| NFL2P | ① Mutation: T332N, I559P, A501C, T605C, ② REKR to (G4S)2 Linker in gp120 ③ Add Kozak sequence, The CD5 signal peptide replaced the natural one ④ Codon-optimized ⑤ Delete MPER |
① Advantages: greatly improved the yield and stability of Env trimer expression in vitro ② Disadvantages: low universality, limited strains suitable for this method |
| UFO | ① Mutation: T332N, A501C, T605C, ② Delete MPER ③ REKR to (G4S) Linker in gp120 ④ Computational procedure used for ensemble-based de novo protein design of the HR1 region ⑤ Add Kozak sequence, The tissue plasm-inogen activator (tPA) signal peptide replaced the natural one ⑥ Codon-optimized |
① Advantages: strong versatility ②Disadvantages: Purification methods are too complex to be commercialized |
本实验室也运用了这几种主要的设计方法进行类天然Env抗原设计,其中SOSIP设计方法表达的Env三聚体在产量和形态均一性上均不如NFL2P和UFO的设计方法,3种方法设计的Env三聚体均可以通过使用His-tag标签进行镍柱纯化,并且适当延长His-tag标签(从6个组氨酸延伸至8–10个组氨酸)可以提高蛋白纯化的量和纯度。三种方法表达的Env三聚体均可以在小鼠体内产生较好的血清中和滴度;从抗体筛选的结果表明,以单型别Env三聚体蛋白进行免疫很难产生交叉中和抗体,采用多型别Env三聚体蛋白进行序贯免疫可产生交叉中和抗体。
这三种设计方法均是在原有的基础上一步一步改进,并都能在动物体内激起较好的抗体水平,为HIV-1疫苗设计提供了指导方向。然而,这些设计目前也是仅仅基于实验室阶段。由于需要经过抗体亲和层析粗纯化,再经过多次SEC纯化才能得到构象正确的Env三聚体,这样的纯化方法不适用于工业化大量生产制备。因此,在纯化方面还需要进一步的优化,以便大量获得HIV-1 Env三聚体。另外,现有的免疫原虽然能在动物体内激起较好的抗体应答,但从免疫的动物体内筛到VRC01类的广谱中和抗体的相关报道还比较少,因此,在免疫策略和免疫方法的设计上还需要进一步优化和改进。
| [1] |
Moore PL, Gorman J, Doria-Rose NA, et al. Ontogeny-based immunogens for the induction of V2-directed HIV broadly neutralizing antibodies. Immunol Rev, 2017, 275(1): 217-229. DOI:10.1111/imr.12501 |
| [2] |
Sanders RW, van Gils MJ, Derking R, et al. HIV-1 neutralizing antibodies induced by native-like envelope trimers. Science, 2015, 349(6244): aac4223. DOI:10.1126/science.aac4223 |
| [3] |
Wu XL, Kong XP. Antigenic landscape of the HIV-1 envelope and new immunological concepts defined by HIV-1 broadly neutralizing antibodies. Curr Opin Immunol, 2016, 42: 56-64. DOI:10.1016/j.coi.2016.05.013 |
| [4] |
Vijayan A, Garcia-Arriaza J, Raman SC, et al. A chimeric HIV-1 gp120 fused with vaccinia virus 14K (A27) protein as an HIV immunogen. PLoS ONE, 2015, 10(7): e0133595. DOI:10.1371/journal.pone.0133595 |
| [5] |
Frank S, Kammerer RA, Mechling D, et al. Stabilization of short collagen-like triple helices by protein engineering. J Mol Biol, 2001, 308(5): 1081-1089. DOI:10.1006/jmbi.2001.4644 |
| [6] |
Aldon Y, McKay PF, Allen J, et al. Rational design of DNA-expressed stabilized native-like HIV-1 envelope trimers. Cell Rep, 2018, 24(12): 3324-3338. DOI:10.1016/j.celrep.2018.08.051 |
| [7] |
Sundquist WI, Kräusslich HG. HIV-1 assembly, budding, and maturation. Cold Spring Harb Perspect Med, 2012, 2(7): a006924. |
| [8] |
Planès R, Serrero M, Leghmari K, et al. HIV-1 envelope glycoproteins induce the production of TNF-α and IL-10 in human monocytes by activating calcium pathway. Sci Rep, 2018, 8(1): 17215. |
| [9] |
Go EP, Ding HT, Zhang SJ, et al. Glycosylation benchmark profile for HIV-1 envelope glycoprotein production based on eleven env trimers. J Virol, 2017, 91(9): e02428-16. |
| [10] |
Hiener B, Horsburgh BA, Eden JS, et al. Identification of genetically intact HIV-1 proviruses in specific CD4+ T cells from effectively treated participants. Cell Rep, 2017, 21(3): 813-822. |
| [11] |
Shaik M, Peng HQ, Lu JM, et al. Structural basis of coreceptor recognition by HIV-1 envelope spike. Nature, 2019, 565(7739): 318-323. DOI:10.1038/s41586-018-0804-9 |
| [12] |
Sanders RW, Moore JP. Native-like Env trimers as a platform for HIV-1 vaccine design. Immunol Rev, 2017, 275(1): 161-182. DOI:10.1111/imr.12481 |
| [13] |
Huang JH, Kang BH, Pancera M, et al. Broad and potent HIV-1 neutralization by a human antibody that binds the gp41-gp120 interface. Nature, 2014, 515(7525): 138-142. DOI:10.1038/nature13601 |
| [14] |
Wu XL. HIV broadly neutralizing antibodies: VRC01 and beyond//Zhang LQ, Lewin SR, Eds. HIV Vaccines and Cure: The Path Towards Finding an Effective Cure and Vaccine. Singapore: Springer, 2018, 1075: 53-72.
|
| [15] |
LaBranche CC, McGuire AT, Gray MD, et al. HIV-1 envelope glycan modifications that permit neutralization by germline-reverted VRC01-class broadly neutralizing antibodies. PLoS Pathog, 2018, 14(11): e1007431. DOI:10.1371/journal.ppat.1007431 |
| [16] |
Duan HY, Chen XJ, Boyington JC, et al. Glycan masking focuses immune responses to the HIV-1 CD4-binding site and enhances elicitation of VRC01-class precursor antibodies. Immunity, 2018, 49(2): 301-311. DOI:10.1016/j.immuni.2018.07.005 |
| [17] |
Sanders RW, Derking R, Cupo A, et al. A next-generation cleaved, soluble HIV-1 Env trimer, BG505 SOSIP.664 gp140, expresses multiple epitopes for broadly neutralizing but not non-neutralizing antibodies. PLoS Pathog, 2013, 9(9): e1003618. DOI:10.1371/journal.ppat.1003618 |
| [18] |
Binley JM, Sanders RW, Clas B, et al. A recombinant human immunodeficiency virus type 1 envelope glycoprotein complex stabilized by an intermolecular disulfide bond between the gp120 and gp41 subunits is an antigenic mimic of the trimeric virion-associated structure. J Virol, 2000, 74(2): 627-643. DOI:10.1128/JVI.74.2.627-643.2000 |
| [19] |
Binley JM, Sanders RW, Master A, et al. Enhancing the proteolytic maturation of human immunodeficiency virus type 1 envelope glycoproteins. J Virol, 2002, 76(6): 2606-2616. DOI:10.1128/JVI.76.6.2606-2616.2002 |
| [20] |
Sanders RW, Vesanen M, Schuelke N, et al. Stabilization of the soluble, cleaved, trimeric form of the envelope glycoprotein complex of human immunodeficiency virus type 1. J Virol, 2002, 76(17): 8875-8889. DOI:10.1128/JVI.76.17.8875-8889.2002 |
| [21] |
Apellániz B, Rujas E, Carravilla P, et al. Cholesterol-dependent membrane fusion induced by the gp41 membrane-proximal external region-transmembrane domain connection suggests a mechanism for broad HIV-1 neutralization. J Virol, 2014, 88(22): 13367-13377. DOI:10.1128/JVI.02151-14 |
| [22] |
Klasse PJ, Depetris RS, Pejchal R, et al. Influences on trimerization and aggregation of soluble, cleaved HIV-1 SOSIP envelope glycoprotein. J Virol, 2013, 87(17): 9873-9885. DOI:10.1128/JVI.01226-13 |
| [23] |
Fu QS, Shaik MM, Cai YF, et al. Structure of the membrane proximal external region of HIV-1 envelope glycoprotein. Proc Natl Acad Sci USA, 2018, 115(38): E8892-E8899. DOI:10.1073/pnas.1807259115 |
| [24] |
Julien JP, Lee JH, Cupo A, et al. Asymmetric recognition of the HIV-1 trimer by broadly neutralizing antibody PG9. Proc Natl Acad Sci USA, 2013, 110(11): 4351-4356. DOI:10.1073/pnas.1217537110 |
| [25] |
Ringe RP, Pugach P, Cottrell CA, et al. Closing and opening holes in the glycan shield of HIV-1 envelope glycoprotein SOSIP trimers can redirect the neutralizing antibody response to the newly unmasked epitopes. J Virol, 2019, 93: 4. |
| [26] |
Joyce MG, Georgiev IS, Yang YP, et al. Soluble prefusion closed DS-SOSIP.664-env trimers of diverse HIV-1 strains. Cell Rep, 2017, 21(10): 2992-3002. DOI:10.1016/j.celrep.2017.11.016 |
| [27] |
Ringe RP, Ozorowski G, Rantalainen K, et al. Reducing V3 antigenicity and immunogenicity on soluble, native-like HIV-1 Env SOSIP trimers. J Virol, 2017, 91(15): e00677-17. |
| [28] |
Sullivan JT, Sulli C, Nilo A, et al. High-throughput protein engineering improves the antigenicity and stability of soluble HIV-1 envelope glycoprotein SOSIP trimers. J Virol, 2017, 91(22): e00862-17. |
| [29] |
Bianchi M, Turner HL, Nogal B, et al. Electron-microscopy-based epitope mapping defines specificities of polyclonal antibodies elicited during HIV-1 BG505 envelope trimer immunization. Immunity, 2018, 49(2): 288-300. DOI:10.1016/j.immuni.2018.07.009 |
| [30] |
Ozorowski G, Cupo A, Golabek M, et al. Effects of adjuvants on HIV-1 envelope glycoprotein SOSIP trimers in vitro. J Virol, 2018, 92(13): e00381-18. |
| [31] |
He LL, De Val N, Morris CD, et al. Presenting native-like trimeric HIV-1 antigens with self-assembling nanoparticles. Nat Commun, 2016, 7: 12041. DOI:10.1038/ncomms12041 |
| [32] |
Sharma SK, De Val N, Bale S, et al. Cleavage-independent HIV-1 Env trimers engineered as soluble native spike mimetics for vaccine design. Cell Rep, 2015, 11(4): 539-550. DOI:10.1016/j.celrep.2015.03.047 |
| [33] |
Yang LF, Sharma SK, Cottrell C, et al. structure-guided redesign improves NFL HIV Env trimer integrity and identifies an inter-protomer disulfide permitting post-expression cleavage. Front Immunol, 2018, 9: 1631. DOI:10.3389/fimmu.2018.01631 |
| [34] |
Dubrovskaya V, Guenaga J, De Val N, et al. Targeted N-glycan deletion at the receptor-binding site retains HIV Env NFL trimer integrity and accelerates the elicited antibody response. PLoS Pathog, 2017, 13(9): e1006614. DOI:10.1371/journal.ppat.1006614 |
| [35] |
Soldemo M, Àdori M, Stark JM, et al. Glutaraldehyde cross-linking of HIV-1 Env Trimers skews the antibody subclass response in mice. Front Immunol, 2017, 8: 1654. DOI:10.3389/fimmu.2017.01654 |
| [36] |
Bale S, Martiné A, Wilson R, et al. Cleavage-independent HIV-1 trimers from CHO cell lines elicit robust autologous Tier 2 neutralizing antibodies. Front Immunol, 2018, 9: 1116. DOI:10.3389/fimmu.2018.01116 |
| [37] |
Guenaga J, Garces F, De Val N, et al. Glycine substitution at helix-to-coil transitions facilitates the structural determination of a stabilized subtype C HIV envelope glycoprotein. Immunity, 2017, 46(5): 792-803. DOI:10.1016/j.immuni.2017.04.014 |
| [38] |
Kong L, He LL, de Val N, et al. Uncleaved prefusion-optimized gp140 trimers derived from analysis of HIV-1 envelope metastability. Nat Commun, 2016, 7: 12040. DOI:10.1038/ncomms12040 |
| [39] |
He LL, Kumar S, Allen JD, et al. HIV-1 vaccine design through minimizing envelope metastability. Sci Adv, 2018, 4(11): eaau6769. DOI:10.1126/sciadv.aau6769 |
| [40] |
Morris CD, Azadnia P, De Val N, et al. Differential antibody responses to conserved HIV-1 neutralizing epitopes in the context of multivalent scaffolds and native-like gp140 trimers. mBio, 2017, 8(1): e00036-17. |
 2020, Vol. 36
2020, Vol. 36