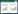中国科学院微生物研究所、中国微生物学会主办
文章信息
- 雷建林, 曹宏, 杨丽霞, 李茜, 王应强
- Lei Jianlin, Cao Hong, Yang Lixia, Li Qian, Wang Yingqiang
- 非洲猪瘟病毒的生物学特性与疫苗研制的难点
- Characteristics of African swine fever virus and difficulties in vaccine development
- 生物工程学报, 2020, 36(1): 13-24
- Chinese Journal of Biotechnology, 2020, 36(1): 13-24
- 10.13345/j.cjb.190144
-
文章历史
- Received: April 17, 2019
- Accepted: July 22, 2019
- Published: July 30, 2019
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种高度接触性、广泛出血性猪烈性传染病,强毒株感染的致死率高达100%[1]。世界动物卫生组织(OIE)将其列为法定报告动物疫病,我国将其列为一类动物疫病和重点防范的外来动物疫病之一。1921年肯尼亚首次确认发生ASF以来,疫情随后蔓延至撒哈拉以南的非洲地区及欧洲、美洲、亚洲等60多个国家和地区(OIE数据),且仍呈流行扩大趋势,目前尚无安全有效的疫苗用于该病的防控[1-3]。我国自2018年8月暴发首例ASF以来,截止2019年6月6日,已有32个省份累计暴发137起疫情(OIE和农业农村部统计数据),几乎席卷我国所有省份和地区。我国作为世界猪肉产量最大国(约占世界总产量的50%)[4],这场突如其来的ASF疫情对我国的养猪业构成巨大威胁。当前,有效控制ASF疫情扩散、研发安全有效的疫苗将是我国面临的最大挑战。
ASF疫苗研制始于20世纪60年代,由于ASFV生物学特性的复杂性,迄今未能研制出安全有效的疫苗[5-7]。本研究结合当前最新研究进展,就ASFV的结构、致病性、传播途径、基因及编码蛋白、入侵机制、免疫逃逸机制等生物学特性进行了概述,并分析了当前疫苗研制面临的难点,以期为我国有效防控ASF疫情及病原研究提供参考。
1 ASFV的结构及特性 1.1 形态与基本结构ASFV为有囊膜的双链DNA病毒,是非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的唯一成员,也是迄今发现的唯一DNA虫媒病毒。胞外病毒粒子直径约为200 nm,由内核(Internal core)、内核心壳(Core shell)、内膜(Inner envelope)、衣壳(Capsid)、囊膜(External envelope)形成的同心多层20面体对称结构组成(图 1)。内核由类核(Nucleoid)组成,包含病毒基因组和核蛋白、早期mRNAs合成所需的元件。内核心壳由pp220、pp62等多聚蛋白构成。内膜在电子显微镜下为单脂膜[6],主要来源于内质网膜,包含p54、p17、p12蛋白。衣壳由2 000多个六边形壳粒组成,主要为p72蛋白,占病毒粒子总量的33%。囊膜为ASFV出芽时获得于细胞的质膜。ASFV形态发生于细胞核及微管组织中心附近,该特殊区域称之为“病毒工厂”,不包括宿主蛋白,被内质网膜和波形蛋白支架包围。除内质网膜,线粒体也被招募至“病毒工厂”的外围[6, 8]。
1.2 传播途径猪科动物是ASFV的唯一易感动物,包括家猪Sus scrofa domesticus、欧洲野猪Sus scrofa ferus、疣猪Potamochoerus porcus、巨型森林猪Hylochoerus meinertzhageni等,其中家猪高度易感,无明显品种、年龄、性别差异[8-9]。
ASF是欧盟(EU)和OIE认定的高度接触性传染病。猪通过直接接触感染动物或经感染病毒的软蜱叮咬传播,也可直接或间接接触感染猪的粪便、血液、尿液、唾液等排泄物或分泌物,饲料、设备、衣物、鞋、运输工具等污染物传播(图 2)。另外,ASFV也能通过直接接触感染病毒的猪尸体或其产品传播[10-12] (图 2)。

|
| 图 2 猪感染ASFV的途径示意图 Fig. 2 The routes of ASFV infection in pigs. |
| |
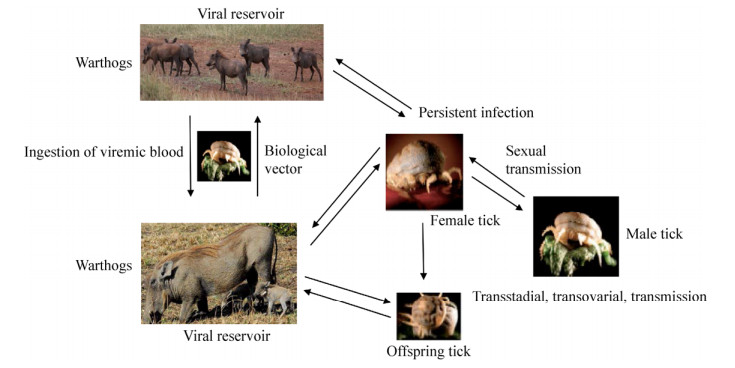
钝缘软蜱Ornithodoros moubata是ASFV的生物学传播媒介,通过叮咬家猪或野猪相互传播病毒。软蜱感染后成为储存宿主,病毒在其体内存活可长达数年,能通过卵及雌雄交配的方式将病毒传播给子代,导致ASFV在软蜱中持续循环[3] (图 3)。疣猪对ASFV具有一定的抵抗力,成年疣猪感染后既不排毒也不产生病毒血症,呈隐性感染,作为储存库使病毒在森林中循环(图 3)[3, 13]。新生疣猪感染ASFV后会引发严重的病毒血症,但无临床症状[14]。疣猪不能通过直接接触或水平和垂直的方式传播病毒,蜱是其唯一的传播媒介(图 3)[14-15]。其他非洲野猪(丛林猪、巨型森林猪)对ASFV的易感性和流行病学尚不清楚,但丛林猪在实验条件下能通过直接接触的方式将病毒传播给家猪[16-17]。ASFV在流行地区有3种循环模式:1)家猪-家猪循环;2)家猪-软蜱-野猪循环;3)家猪-软蜱循环[18-19]。这些循环模式使得ASFV在流行地区持续循环,导致疫情不断扩散。
|
| 图 3 ASFV在疣猪与软蜱之间传播示意图 Fig. 3 Transmission of ASFV between warthogs and ticks. |
| |
其他传播方式也有研究报道,如ASFV能通过短距离的气溶胶传播,但距离不超过2 m[20]。另外,猪舍内的螯蝇Stomoxys spp.作为机械的传播媒介也能将ASFV传播给猪,但病毒在其体外存活不超过2 d[17]。最新研究报道ASFV很容易通过饮水传播,其最小感染剂量为100 TCID50[21]。其他可能的传播媒介如鼠和鸟类目前还未得到证实[17]。目前,家猪能否通过交配或垂直的方式传播还未得到证实,但从感染猪的生殖器分泌物中能检测到ASFV[17]。
1.3 毒力与致病性ASFV按其毒力分为强、中、低毒力毒株。强毒株主要引发超急性或急性感染,感染4–9 d后发病率和死亡率高达100%。超急性感染在出现临床症状1–4 d后动物突然死亡,主要器官无明显病理变化。急性感染以皮肤出现红斑和紫绀为主要特征,并伴有高热、厌食、呕吐、腹泻或出血性腹泻、虚弱、嗜睡、呼吸窘迫、鼻腔及眼结膜粘液脓性分泌物、母猪流产等症状。病理剖检变化主要有脾脏充血性肿大、内脏淋巴结出血、腹腔积液等。强毒株引发ASF初期,主要以急性感染为主,持续一段时间后发展为亚临床症状。中等毒力毒株主要引发亚急性感染,仔猪死亡率高于成年猪,死亡率为30%–70%,感染3–4周后部分猪恢复健康,临床症状主要有持续或间歇性发热,致死性感染的临床症状与急性感染相似,病理剖检变化严重程度略低于急性感染。低毒力毒株主要引发慢性感染,死亡率低,无典型的ASF临床症状,一般出现间歇性发热或低热、皮肤溃烂、关节炎、食欲减退、精神沉郁、生长缓慢、消瘦、肺炎和流产等症状。潜伏期ASFV的感染力最强,临床症状出现48 h前开始体外排毒,康复猪在临床症状消失后仍能体外排毒持续1个月。产生抵抗力的猪成为ASFV储存库,导致病毒持续循环于流行地区[1, 3, 20]。
1.4 理化特性ASFV在环境中具有很强的生存能力,在pH 3.9–11.5的条件下活性不受影响,60 ℃条件下30 min可灭活。–70 ℃冷藏条件下,血液中的病毒能存活18个月,脾脏组织中ASFV感染力2年内不受影响。37 ℃条件下,血液中的ASFV能存活1个月。ASFV在猪的粪便中至少可存活11 d,尸体中长达1年,在未经烧煮或高温烟熏的火腿或香肠中能存活3–6个月,4 ℃保存的带骨肉中至少存活5个月,冷冻猪肉中能存活15周,半熟肉及泔水中也能长时间存活。多种消毒剂能有效灭活ASFV,饮用水或污水可用2%–3%次氯酸钠,车辆及用具可用碘化合物,猪舍、场地等用1%–2%氢氧化钠或3%邻苯基酚[1, 22-23]。
2 ASFV基因组及主要编码蛋白 2.1 基因组结构ASFV基因组为线性双链DNA分子,大小在170–190 kb之间,包含一个125 kb的保守中心区和两个由串联重复序列和多基因家族(Multigene families,MGF)构成的可变末端区,MGF基因拷贝数的增减导致不同毒株的基因组大小不同[6]。ASFV DNA包含151–167个开放阅读框(Open reading frames,ORFs),约编码68种结构蛋白和100多种非结构蛋白[1, 24]。基因组紧密排布,两条DNA编码链无内含子,末端有共价结合的发夹环结构,以彼此反转或互补两种形式存在[25-26]。ASFV mRNAs结构类似于真核细胞的mRNA分子,5'-UTR端有一个帽子结构,3'-UTR端有33个多聚核苷酸(polyA)尾,帽子结构主要为m7G (50) pppAm[27]。
2.2 DNA复制过程胞浆内的ASFV通过微管运输至细胞核周围区域开始复制,表达DNA复制所需的酶。早期转录利用病毒编码的RNA聚合酶、多聚腺苷酸化酶、转录因子等进行复制[28]。感染6 h后启动转录模式,两条DNA链均可作为编码链。ASFV约20%基因参与转录和mRNA的修饰,且转录相对独立,能精准控制基因表达的位置和时间。细胞核在病毒复制过程中的作用尚未研究清楚,但DNA复制早期,在细胞核内能检测到小DNA片段,晚期在胞浆中合成大分子片段。全长基因组在“病毒工厂”区域以“头对头”的串联体方式将基因组分为单位长度的ORFs完成复制。ASFV DNA复制及转录与痘病毒相似,不同的是痘病毒DNA复制在早期阶段不能在细胞核中进行[28]。
2.3 ASFV编码蛋白目前,ASFV基因编码蛋白的数量与功能仍未完全鉴定清楚。早期采用二维凝胶电泳技术在高度纯化的胞外病毒粒子中检测到54种蛋白,大小在10–150 kDa之间[29]。随后通过对ASFV基因组全序分析可编码的结构大约有113种蛋白,编码ORFs有151–167个[28, 30]。最近采用蛋白组学技术鉴定出68种结构蛋白和21种非结构蛋白,并对68种结构蛋白的功能进行了鉴定分析:结构及形态形成16种(24%)、病毒转录及RNA修饰13种(19%)、维持基因完整性4种(6%)、病毒入侵3种(4%)、免疫逃避2种(3%)、其他功能已知蛋白7种(10%)、功能未知蛋白23种(34%)[24, 28]。
3 ASFV的复制特性 3.1 主要靶细胞ASFV主要感染单核-巨噬细胞系统,包括高度分化的组织巨噬细胞和淋巴结、脾、肾、肝等器官的网状细胞的特定亚类。ASFV复制也见于内皮细胞、巨核细胞、血小板、中性粒细胞和肝细胞等细胞,但仅见于感染晚期阶段,在ASFV的病理过程中不起关键作用[6, 31]。
3.2 病毒入侵与脱壳ASFV入侵细胞依赖于温度、能量、胆固醇、低pH值,并需要肌动蛋白和网格蛋白参与[32-33]。早期研究证明ASFV入侵宿主机体通过受体介导的内吞作用,利用囊膜与内吞体膜融合机制将病毒粒子释放至胞浆中,但参与感染的病毒受体尚未完全阐明[34-35]。最新研究证实,ASFV入侵猪的巨噬细胞既可通过网格蛋白介导的内吞作用,也能通过肌动蛋白驱动的巨胞饮方式进入巨噬细胞,是两种可选择的入侵方式(图 4)。胞浆内的病毒粒子以早期核内体和胞饮体的形态结构运输至晚期多泡核内体中,在此受低pH的驱动逐渐分解装配,包括衣壳破裂、囊膜分离、病毒内膜与限制性内质膜融合[36]。随后,病毒粒子被运输至胞浆中进一步脱壳,释放可复制的病毒基因组[36-37] (图 4)。
3.3 “病毒工厂”的形成与病毒释放“病毒工厂”位于胞浆内细胞核周围的特定区域,属于微管组织中心的一个独立区,蛋白质、DNA在该位点聚集,完成病毒粒子的组装(图 4)。微管是“病毒工厂”形成的必需元件,其完整性、稳定性影响病毒的入侵。驱动蛋白将ASFV运输至“病毒工厂”是结构蛋白p54与马达分子相互作用的结果。“病毒工厂”周围的波形支架蛋白能聚集病毒组装的元件,阻止其游离至细胞质中。核衣壳和内核心壳在“病毒工厂”区域完成组装形成初期的病毒结构,DNA进一步衣壳化形成成熟的病毒粒子。驱动蛋白将成熟的病毒粒子运输至细胞膜附近,出芽释放至胞外(图 4)[38-40]。
4 ASFV免疫逃逸机制 4.1 主要靶向单核巨噬细胞系统吞噬细胞在吞噬、杀灭和清除病原的过程中起核心作用,主要包括单核-巨噬细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞等。当机体遇到病原感染后,吞噬细胞被迅速招募至感染部位,通过模式识别受体(Pattern recognition receptors,PRRs)识别病原相关分子模式(Pathogen associated molecular patterns,PAMP)吞噬病原微生物,还能吞噬病原感染的自身细胞以达到杀灭和清除病原体的作用。巨噬细胞在激活和调控机体免疫应答过程中发挥主要作用。ASFV主要靶向宿主的单核-巨噬细胞,并在其内进行复制,这种感染机制有利于ASFV抑制或控制宿主免疫应答。而且,ASFV入侵的首要前提需要跨越巨噬细胞本身具有消灭病原体的免疫防线。因此,ASFV可作为一个良好的模型用于研究病毒如何逃逸宿主免疫防御系统完成自我复制,抑制宿主免疫应答等感染机制[41-42]。
为了入侵巨噬细胞,ASFV利用细胞具有的内吞或巨胞饮的特性进入胞浆启动复制循环。巨噬细胞内的氧化环境具有杀灭ASFV功能,如诱导DNA损伤或突变,抑制病毒复制,但ASFV在胞浆中能适应性地获得碱基切除或DNA修复的酶系统,如DNA聚合酶Ⅹ、Ⅰ型DNA链接酶和脱嘌呤/脱嘧啶内切核酸酶,这种修复机制能及时修复DNA损伤,保证病毒在胞浆中完成复制。研究发现酶修复系统在巨噬细胞中具有保存病毒遗传信息的功能[43-44]。
4.2 控制宿主免疫防御系统ASFV复制通过程序性通路(Programmed pathways)破坏细胞死亡通路,包括细胞凋亡(Apoptosis)、细胞焦亡(Pyroptosis)和坏死(Necrosis)。这种破坏机制有利于ASFV在细胞内存活足够的时间完成子代病毒复制。而且,ASFV诱导的这些通路有利于细胞发生裂解,招募巨噬细胞[41, 45]。
4.2.1 抑制细胞死亡凋亡作为重要的先天性细胞免疫能抵抗病毒感染,多种病毒为了完成自身复制在感染的早期抑制细胞凋亡[46]。ASFV A179L基因编码抗凋亡蛋白Bcl-2的同源物,能抑制凋亡,该蛋白在病毒复制早期和晚期均可表达[47],也能抑制促凋亡蛋白(BH3-only促凋亡家族)的表达抑制细胞凋亡[47]。另外,A179L基因能与细胞自噬调控因子Beclin-1相互作用抑制细胞自噬[48]。A224L基因编码的凋亡抑制剂(凋亡样蛋白) (Apoptosis-like protein,IAP)能抑制caspase-3凋亡通路,激活NF-κB信号通路逃逸宿主免疫应答。同时,A224L基因能调控炎症因子、caspase-1及caspase-8信号通路引发的细胞焦亡[41, 49-50]。
4.2.2 控制蛋白合成ASFV与其他DNA病毒类似,通过调控翻译起始因子及劫持细胞翻译合成自身蛋白。ASFV DP71L基因编码蛋白含有一个能结合宿主蛋白磷酸酶1 (Host protein phosphatase 1,PP1)的催化亚基,该蛋白能与宿主PP1相互作用诱导eIF2α去磷酸化,促进ASFV蛋白合成。研究表明,删除ASFV DP71L基因感染细胞不能诱导eIF2α磷酸化增加,表明ASFV有其他补偿机制阻止eIF2α磷酸化[41-42]。
4.3 抑制宿主免疫应答 4.3.1 抑制Ⅰ型干扰素表达ASFV编码的一系列蛋白能抑制Ⅰ型干扰素、细胞因子、趋化因子、黏附分子和其他免疫调节基因的转录。干扰素在感染细胞与相邻细胞间被细胞表面受体识别,诱导干扰素刺激基因(Interferon-stimulated genes,ISGs)表达。干扰素能将病毒抗原呈递给CD8+细胞,激活自然杀伤细胞(Natural killer cells)抑制病毒复制[41-42, 51]。
ASFV强毒株感染巨噬细胞能抑制Ⅰ型干扰素和ISGs的表达。敲除多基因家族MGF360及MGF530基因病毒能抑制干扰素产生,影响STAT信号通路和抗病毒分子。ASFV编码的其他蛋白也通过复杂的作用机制调控宿主先天性免疫,如I329L (病毒Toll样受体同源物)、A528R基因通过调控NF-κB通路抑制干扰素产生。另外,ASFV也能靶向ISG抑制宿主免疫应答[41, 52-53]。
4.3.2 CD2v蛋白的免疫抑制作用ASFV CD2样蛋白(CD2-like protein,CD2v)与病毒粒子在细胞中表达的配体相互作用引发红细胞吸附,这种作用有利于病毒在宿主体内迅速扩散。同时,CD2v基因与病毒的致病性有关,删除CD2v基因导致宿主病毒血症和临床症状的显著延缓。CD2v也可通过抑制淋巴细胞增殖诱导免疫抑制[41, 54]。
5 ASF疫苗研制的难点与对策分析ASF疫苗研制始于1960年,由于ASFV生物学特性的复杂性,目前尚未研制出安全有效的商业化疫苗[55-56]。
5.1 遗传多样性ASFV基因组结构中两端可变区MGF基因易变、串联重复序列错配率高,导致ASFV在宿主、细胞、环境中容易发生变异。目前,依据p72基因(B646L)末端核苷酸的差异,可将ASFV分为24个基因型,基于病毒是否会引起红细胞吸附的特性,已鉴定出至少有8个血清群。此外,在不同流行地区已鉴定出有不同来源(非洲源、欧洲源)、毒力(高毒力、中毒力、低毒力)、宿主传代变异等多种毒株,这些毒株对宿主的致病性和免疫应答存在一定差异。因此,ASFV在流行地区容易发生适应性变异,不断进化,致使开发的各类疫苗不能完全提供交叉免疫保护。早期研究采用细胞传代、天然致弱等传统手段,研制的减毒活疫苗能抵抗同源毒株的攻击,但不能提供异源毒株的交叉保护,且存在安全隐患,迫使此类疫苗研发受阻[6-7, 57-58]。
5.2 免疫保护机制不清楚在特异性免疫应答中,体液免疫和细胞免疫各自有其独特的作用,相互配合,共同发挥免疫效应抵抗病原体的入侵。前期大量研究尝试各类疫苗的研制,但均未能获得理想的免疫保护效果。细胞传代减毒疫苗、灭活疫苗均能诱导机体产生特异性抗体,但不能提供攻毒保护,而且存在安全隐患。为了解决疫苗安全问题,研究开始转向核酸疫苗、亚单位疫苗、病毒活载体疫苗,此类疫苗主要选择递呈病毒单个或多个具有免疫保护的抗原蛋白,诱导机体产生特异性抗体。结果表明,该类疫苗能够诱导猪只产生特异性抗体和中和抗体,但仍不能完全抵抗强毒株的攻击,甚至ASFV存在抗体依赖性增强作用。据此有人认为,抗体介导的免疫保护可能不足以完全抵抗ASFV的攻击,这一结论一直备受争议,因为感染ASFV的康复猪能完全抵抗强毒的攻击,这也是科学界认为有可能研究出ASF疫苗的主要依据。同时,有人认为抗体介导的免疫保护可能依赖于ASFV复制,也可能是ASFV在细胞内外感染机制的不同导致特异性抗体不能有效中和病毒。因此,需要进一步研究细胞免疫在机体免疫保护中的作用[6-7, 57, 59-60]。
目前,大量研究证实细胞免疫在抗ASFV感染中发挥重要作用。如特异性的CD8+ T细胞能清除ASFV,参与机体的免疫保护。ASFV三种基因(CD2v/EP402R、p54/E183L、p30/CP204L)与细胞中的泛素基因共表达后,能诱导机体产生细胞毒性T淋巴细胞(CTL)的免疫应答,在无特异性抗体的情况下能提供部分免疫保护。另外,γ干扰素(Interferon-γ,IFN-γ)应答、自然杀伤细胞(NK细胞)等也在细胞免疫中发挥重要作用[6-7, 55-56]。
5.3 结构复杂ASFV结构复杂、基因组庞大,大部分基因功能未知,而且结构蛋白与非结构蛋白在病毒入侵、组装及对宿主免疫应答过程中的作用尚未完全阐明。因此,这种复杂的结构导致疫苗研制进程相对缓慢,如基因缺失疫苗具有较好的免疫效力,能完全抵抗同源强毒株的攻击,也具有交叉保护的免疫效力,但存在毒力返强的潜在危险。另外,ASFV基因编码的酶、转录因子在病毒转录、复制过程中的功能大部分不清楚,致使以酶为靶点开发抑制病毒转录或复制的抗病毒药物受阻[55-56]。
5.4 可选择的入侵方式ASFV可通过受体介导的内吞作用或非特异性的巨胞饮作用入侵靶细胞,且参与病毒吸附的受体尚未鉴定清楚,这种入侵机制表明受体结合不是决定细胞嗜性的唯一因素。同时,宿主非敏感细胞对ASFV的嗜性尚不清楚。因此,采用现代分子生物学手段,以病毒受体为靶标开发新型疫苗、抗病毒药物等阻断病毒入侵的策略受到极大限制[36, 56-57]。
5.5 免疫逃逸ASFV主要靶向单核-巨噬细胞系统,通过抑制细胞凋亡、宿主免疫应答等策略逃逸宿主免疫防御系统。目前,对于ASFV研究仅限于鉴定数种编码蛋白参与免疫逃逸,通过调控宿主细胞转录、凋亡、自噬、炎症应答、免疫抑制等通路完成自我复制,这些基因在病毒与宿主中功能尚未研究清楚,如是否存在更多结构或非结构蛋白参与免疫逃逸,以何种方式逃逸宿主免疫防御系统,删除该基因后是否影响病毒复制等。探索病毒跨越宿主免疫防线、破坏免疫系统是人类攻克各种病毒的难题,也是ASF疫苗研制的主要难题之一,深入研究ASFV免疫逃逸机制也可为预防或治疗其他病毒性疾病提供借鉴[41-42, 55-56, 61]。
5.6 疫苗开发面临的其他难题基因缺失疫苗被认为是短期内最有希望开发成功的疫苗,具有同源保护作用,也能抵抗异源毒株的攻击,但存在安全隐患,进一步鉴定及敲除毒力基因后具有很大应用前景[22, 55-56, 58]。然而,该类疫苗在商业化的进程也面临诸多挑战:1)需建立区别疫苗免疫与野毒感染的(Differentiating infected from vaccinated animals,DIVA)诊断方法;2)需构建病毒稳定表达的细胞系,原代单核-巨噬细胞仅限于实验室对ASFV生物特性与免疫原性的研究,不适合用于疫苗批量生产,其他易感细胞传代后病毒容易变异;3)需建设安全的病毒操作平台,ASFV致病性、攻毒模型、免疫效力评价需在动物生物安全三级(ABSL3)以上实验室进行;4)安全性及免疫原性评价周期较长,基因缺失疫苗专利申请及兽药证书的审批需要严格评估程序,确保毒株在宿主及环境中安全、遗传稳定,且免疫效力不受影响[6, 22, 56]。
5.7 对策与建议目前,鉴于我国ASF疫情现状,研制安全有效的疫苗刻不容缓。系统总结疫苗研制的失败经验、着力开展基础研究,为疫苗研制提供科学依据:1)解析我国流行毒株的分子特征、遗传变异特点,评价其致病力;2)采用基因重组、反向遗传操作、CRISPR/Cas9基因编辑等生物学技术,鉴定ASFV基因的致病性、病毒复制过程中的功能,使得能有效删除毒力基因,解决疫苗的安全问题;3)探究病毒与宿主的相互作用,鉴定参与病毒吸附的受体、结构蛋白与非结构蛋白在病毒复制、宿主免疫应答过程中的功能;4)研究宿主的免疫保护机制,细胞内外ASFV感染机制对免疫保护的影响,鉴定能提供免疫保护作用的抗原蛋白;5)借鉴感染人的病毒研究策略,揭示ASFV免疫逃逸机制,鉴定参与免疫抑制的蛋白与信号通路,探索非敏感细胞对ASFV的嗜性;6)加强国际合作与交流,建立病毒操作平台。联合国内外科研人员攻克难题,如揭示疣猪等非洲野猪抗ASFV感染的分子机制、感染ASFV后的康复猪能抵抗强毒感染的免疫机制等科学问题,为疫苗研制提供科学依据[6, 22, 55, 57-58, 62]。
6 结语与展望目前,ASF疫情在全球呈流行扩大趋势,几乎席卷我国所有地区,周边国家蒙古、越南、柬埔寨、朝鲜也相继暴发ASF疫情(OIE报告数据)[57]。疫情暴发后,我国立即通过封锁隔离、扑杀等应急措施有效减缓了ASF疫情的扩散,部分省份已解除封锁。然而,面对我国贸易全球化、跨国旅游及学习人员不断增加的国际环境,人流、猪流、物流、车流量大和猪肉产品消费量大的国内环境,ASF疫情卷土重来的风险极大。因此,需要结合我国国情和养猪业的现状,采用传统防控策略(诊断、隔离、扑杀)的同时,需要不断创新防控技术,如提升猪场的生物安全水平、进出口猪肉产品严格检疫、加强监测力度、设计安全的生猪调运车辆、妥善处理尸体与污染物等全面遏制疫情进一步扩散[22, 57, 63]。
野外生存的野猪群也是ASF最大的潜在传染源之一,由于其分布相对分散、活动范围难以控制的特点导致疫情扩散风险高、防控难度大[64]。我国目前流行的ASFV均能引发野外或人工圈养野猪的死亡[65]。目前,野猪与家猪相互传播ASFV的可能途径有蜱虫叮咬、直接接触、混种繁殖、误食感染病毒的肉类等。因此,调查我国野猪的分布与数量、监测感染率、隔离或扑杀、限制活动范围等对有效控制ASF疫情扩散也具有重要作用。
从目前疫苗研制进展分析,短期内基因缺失疫苗最具潜力,鉴定并敲除毒力基因、评价免疫原性及安全性、解决商业化生产面临的难点、加快疫苗审批进程是当前亟需解决的问题。从长远角度分析,未来研究需着力于ASFV的基础研究,为疫苗的研制提供可靠的科学依据。此外,以病毒复制、转录参与的酶或转录因子为靶点开发抗病毒的分子与药物,或培育抗ASFV感染的猪种等策略阻断病毒入侵宿主。
| [1] |
Gallardo MC, Reoyo ATDL, Fernández-Pinero J, et al. African swine fever: a global view of the current challenge. Porcine Health Manag, 2015, 1: 21. DOI:10.1186/s40813-015-0013-y |
| [2] |
Ge SQ, Li JM, Fan XX, et al. Molecular characterization of African swine fever virus, China, 2018. Emerg Infect Dis, 2018, 24(11): 2131-2133. DOI:10.3201/eid2411.181274 |
| [3] |
Brown VR, Bevins SN. A Review of African swine fever and the potential for introduction into the United States and the possibility of subsequent establishment in feral swine and native ticks. Front Vet Sci, 2018, 5: 11. DOI:10.3389/fvets.2018.00011 |
| [4] |
Vergne T, Cao CF, Li S, et al. Pig empire under infectious threat: risk of African swine fever introduction into the people's republic of China. Vet Rec, 2017, 181(5): 117. DOI:10.1136/vr.103950 |
| [5] |
Sánchez-Vizcaíno JM, Mur L, Martínez-López B. African swine fever: an epidemiological update. Transbound Emerg Dis, 2012, 59(S1): 27-35. |
| [6] |
Revilla Y, Pérez-Núñez D, Richt JA. African swine fever virus biology and vaccine approaches. Adv Virus Res, 2018, 100: 41-74. DOI:10.1016/bs.aivir.2017.10.002 |
| [7] |
Rock DL. Challenges for African swine fever vaccine development——"… perhaps the end of the beginning". Vet Microbiol, 2017, 206: 52-58. DOI:10.1016/j.vetmic.2016.10.003 |
| [8] |
Salas ML, Andrés G. African swine fever virus morphogenesis. Virus Res, 2013, 173(1): 29-41. DOI:10.1016/j.virusres.2012.09.016 |
| [9] |
Galindo I, Alonso C. African swine fever virus: a review. Viruses, 2017, 9(5): 103. DOI:10.3390/v9050103 |
| [10] |
Jurado C, Martínez-Avilés M, de La Torre A, et al. Relevant measures to prevent the spread of African swine fever in the European Union domestic pig sector. Front Vet Sci, 2018, 5: 77. DOI:10.3389/fvets.2018.00077 |
| [11] |
Sánchez-Cordón PJ, Montoya M, Reis AL, et al. African swine fever: a re-emerging viral disease threatening the global pig industry. Vet J, 2018, 233: 41-48. DOI:10.1016/j.tvjl.2017.12.025 |
| [12] |
Guinat C, Vergne T, Jurado-Diaz C, et al. Effectiveness and practicality of control strategies for African swine fever: what do we really know?. Vet Rec, 2017, 180(5): 97. |
| [13] |
Costard S, Mur L, Lubroth J, et al. Epidemiology of African swine fever virus. Virus Res, 2013, 173(1): 191-197. DOI:10.1016/j.virusres.2012.10.030 |
| [14] |
Penrith ML. African swine fever. Onderstepoort J Vet Res, 2009, 76: 91-95. |
| [15] |
Costard S, Wieland B, de Glanville W, et al. African swine fever: how can global spread be prevented?. Philos Trans Roy Soc B Biol Sci, 2009, 364(1530): 2683-2696. DOI:10.1098/rstb.2009.0098 |
| [16] |
Pejsak Z, Niemczuk K, Frant M, et al. Four years of African swine fever in Poland. New insights into epidemiology and prognosis of future disease spread. Pol J Vet Sci, 2018, 21(4): 835-841. |
| [17] |
Penrith ML, Vosloo W. Review of African swine fever: transmission, spread and control. J S Afr Vet Assoc, 2009, 80(2): 58-62. |
| [18] |
Jori F, Bastos ADS. Role of wild suids in the epidemiology of African swine fever. Ecohealth, 2009, 6(2): 296-310. DOI:10.1007/s10393-009-0248-7 |
| [19] |
Sánchez-Vizcaíno JM, Mur L, Gomez-Villamandos JC, et al. An update on the epidemiology and pathology of African swine fever. J Comp Pathol, 2015, 152(1): 9-21. |
| [20] |
Semerjyan AB, Tatoyan MR, Karalyan NY, et al. Cardiopathology in acute African swine fever. Ann Parasitol, 2018, 64(3): 253-258. |
| [21] |
Niederwerder MC, Stoian AMM, Rowland RRR, et al. Infectious dose of African swine fever virus when consumed naturally in liquid or feed. Emerg Infect Dis, 2019, 25(5): 891-897. DOI:10.3201/eid2505.181495 |
| [22] |
Wang T, Sun Y, Luo YZ, et al. Prevention, control and vaccine development of African swine fever: challenges and countermeasures. Chin J Biotech, 2018, 34(12): 1931-1942 (in Chinese). 王涛, 孙元, 罗玉子, 等. 非洲猪瘟防控及疫苗研发:挑战与对策. 生物工程学报, 2018, 34(12): 1931-1942. |
| [23] |
Plowright W, Parker J. The stability of African swine fever virus with particular reference to heat and pH inactivation. Arch Gesamte Virusforsch, 1967, 21(3/4): 383-402. |
| [24] |
Alejo A, Matamoros T, Guerra M, et al. A proteomic atlas of the African swine fever virus particle. J Virol, 2018, 92(23): e01293-18. |
| [25] |
Almazán F, Rodríguez JM, Andrés G, et al. Transcriptional analysis of multigene family 110 of African swine fever virus. J Virol, 1992, 66(11): 6655-6667. DOI:10.1128/JVI.66.11.6655-6667.1992 |
| [26] |
Almendral JM, Almazán F, Blasco R, et al. Multigene families in African swine fever virus: family 110. J Virol, 1990, 64(5): 2064-2072. DOI:10.1128/JVI.64.5.2064-2072.1990 |
| [27] |
Rodríguez JM, Salas ML. African swine fever virus transcription. Virus Res, 2013, 173(1): 15-28. |
| [28] |
Dixon LK, Chapman DAG, Netherton CL, et al. African swine fever virus replication and genomics. Virus Res, 2013, 173(1): 3-14. |
| [29] |
Esteves A, Marques MI, Costa JV. Two-dimensional analysis of African swine fever virus proteins and proteins induced in infected cells. Virology, 1986, 152(1): 192-206. |
| [30] |
Yáñez RJ, Rodrı́guez JM, Nogal ML, et al. Analysis of the complete nucleotide sequence of African swine fever virus. Virology, 1995, 208(1): 249-278. |
| [31] |
Franzoni G, Dei Giudici S, Oggiano A. Infection, modulation and responses of antigen-presenting cells to African swine fever viruses. Virus Res, 2018, 258: 73-80. DOI:10.1016/j.virusres.2018.10.007 |
| [32] |
Galindo I, Cuesta-Geijo MA, Hlavova K, et al. African swine fever virus infects macrophages, the natural host cells, via clathrin- and cholesterol-dependent endocytosis. Virus Res, 2015, 200: 45-55. DOI:10.1016/j.virusres.2015.01.022 |
| [33] |
Hernaez B, Alonso C. Dynamin- and clathrin-dependent endocytosis in African swine fever virus entry. J Virol, 2010, 84(4): 2100-2109. DOI:10.1128/JVI.01557-09 |
| [34] |
Alcamí A, Carrascosa AL, Viñuela E. The entry of African swine fever virus into Vero cells. Virology, 1989, 171(1): 68-75. |
| [35] |
Alcamí A, Carrascosa AL, Viñuela E. Interaction of African swine fever virus with macrophages. Virus Res, 1990, 17(2): 93-104. |
| [36] |
Hernáez B, Guerra M, Salas ML, et al. African swine fever virus undergoes outer envelope disruption, capsid disassembly and inner envelope fusion before core release from multivesicular endosomes. PLoS Pathog, 2016, 12(4): e1005595. DOI:10.1371/journal.ppat.1005595 |
| [37] |
Andrés G. African swine fever virus gets undressed: new insights on the entry pathway. J Virol, 2017, 91(4): e01906-16. |
| [38] |
Hernaez B, Escribano JM, Alonso C. Visualization of the African swine fever virus infection in living cells by incorporation into the virus particle of green fluorescent protein-p54 membrane protein chimera. Virology, 2006, 350(1): 1-14. |
| [39] |
Quetglas JI, Hernáez B, Galindo I, et al. Small rho GTPases and cholesterol biosynthetic pathway intermediates in African swine fever virus infection. J Virol, 2012, 86(3): 1758-1767. DOI:10.1128/JVI.05666-11 |
| [40] |
Stefanovic S, Windsor M, Nagata KI, et al. Vimentin rearrangement during African swine fever virus infection involves retrograde transport along microtubules and phosphorylation of vimentin by calcium calmodulin kinase Ⅱ. J Virol, 2005, 79(18): 11766-11775. DOI:10.1128/JVI.79.18.11766-11775.2005 |
| [41] |
Reis AL, Netherton C, Dixon LK. Unraveling the armor of a killer: evasion of host defenses by African swine fever virus. J Virol, 2017, 91(6): e02338-16. |
| [42] |
Dixon LK, Islam M, Nash R, et al. African swine fever virus evasion of host defences. Virus Res, 2019, 266: 25-33. DOI:10.1016/j.virusres.2019.04.002 |
| [43] |
Redrejo-Rodríguez M, Salas ML. Repair of base damage and genome maintenance in the nucleo-cytoplasmic large DNA viruses. Virus Res, 2014, 179: 12-25. DOI:10.1016/j.virusres.2013.10.017 |
| [44] |
Granja AG, Sabina P, Salas ML, et al. Regulation of inducible nitric oxide synthase expression by viral A238L-mediated inhibition of p65/RelA acetylation and p300 transactivation. J Virol, 2006, 80(21): 10487-10496. DOI:10.1128/JVI.00862-06 |
| [45] |
Sánchez EG, Quintas A, Nogal M, et al. African swine fever virus controls the host transcription and cellular machinery of protein synthesis. Virus Res, 2013, 173(1): 58-75. |
| [46] |
Benedict CA, Norris PS, Ware CF. To kill or be killed: viral evasion of apoptosis. Nat Immunol, 2002, 3(11): 1013-1018. DOI:10.1038/ni1102-1013 |
| [47] |
Galindo I, Hernaez B, Díaz-Gil G, et al. A179L, a viral Bcl-2 homologue, targets the core Bcl-2 apoptotic machinery and its upstream BH3 activators with selective binding restrictions for Bid and Noxa. Virology, 2008, 375(2): 561-572. |
| [48] |
Orvedahl A, Alexander D, Tallóczy Z, et al. HSV-1 ICP34.5 confers neurovirulence by targeting the Beclin 1 autophagy protein. Cell Host Microbe, 2007, 1(1): 23-35. DOI:10.1016/j.chom.2006.12.001 |
| [49] |
Arias M, Jurado C, Gallardo C, et al. Gaps in African swine fever: analysis and priorities. Transbound Emerg Dis, 2018, 65(S1): 235-247. |
| [50] |
Frączyk M, Woźniakowski G, Kowalczyk A, et al. Evolution of African swine fever virus genes related to evasion of host immune response. Vet Microbiol, 2016, 193: 133-144. DOI:10.1016/j.vetmic.2016.08.018 |
| [51] |
Golding JP, Goatley L, Goodbourn S, et al. Sensitivity of African swine fever virus to type Ⅰ interferon is linked to genes within multigene families 360 and 505. Virology, 2016, 493: 154-161. DOI:10.1016/j.virol.2016.03.019 |
| [52] |
Correia S, Ventura S, Parkhouse RM. Identification and utility of innate immune system evasion mechanisms of ASFV. Virus Res, 2013, 173(1): 87-100. |
| [53] |
Muñoz-Moreno R, Cuesta-Geijo MÁ, Martínez-Romero C, et al. Antiviral role of IFITM proteins in African swine fever virus infection. PLoS ONE, 2016, 11(4): e0154366. DOI:10.1371/journal.pone.0154366 |
| [54] |
Burmakina G, Malogolovkin A, Tulman ER, et al. Identification of T-cell epitopes in African swine fever virus CD2v and C-type lectin proteins. J Gen Virol, 2019, 100(2): 259-265. DOI:10.1099/jgv.0.001195 |
| [55] |
Sánchez EG, Pérez-Núñez D, Revilla Y. Development of vaccines against African swine fever virus. Virus Res, 2019, 265: 150-155. DOI:10.1016/j.virusres.2019.03.022 |
| [56] |
Zakaryan H, Revilla Y. African swine fever virus: current state and future perspectives in vaccine and antiviral research. Vet Microbiol, 2016, 185: 15-19. DOI:10.1016/j.vetmic.2016.01.016 |
| [57] |
Dixon LK, Sun H, Roberts H. African swine fever. Antiviral Res, 2019, 165: 34-41. DOI:10.1016/j.antiviral.2019.02.018 |
| [58] |
Arias M, de la Torre A, Dixon L, et al. Approaches and perspectives for development of African swine fever virus vaccines. Vaccines (Basel), 2017, 5(4): E35. DOI:10.3390/vaccines5040035 |
| [59] |
Pérez-Núñez D, Sunwoo SY, Sánchez EG, et al. Evaluation of a viral DNA-protein immunization strategy against African swine fever in domestic pigs. Vet Immunol Immunopathol, 2019, 208: 34-43. DOI:10.1016/j.vetimm.2018.11.018 |
| [60] |
Sunwoo SY, Pérez-Núñez D, Morozov I, et al. DNA-protein vaccination strategy does not protect from challenge with African swine fever virus Armenia 2007 strain. Vaccines (Basel), 2019, 7(1): 12. DOI:10.3390/vaccines7010012 |
| [61] |
Portugal R, Leitão A, Martins C. Modulation of type Ⅰ interferon signaling by African swine fever virus (ASFV) of different virulence L60 and NHV in macrophage host cells. Vet Microbiol, 2018, 216: 132-141. DOI:10.1016/j.vetmic.2018.02.008 |
| [62] |
Borca MV, Holinka LG, Berggren KA, et al. CRISPR-Cas9, a tool to efficiently increase the development of recombinant African swine fever viruses. Sci Rep, 2018, 8: 3154. DOI:10.1038/s41598-018-21575-8 |
| [63] |
Liu LH, Atim S, LeBlanc N, et al. Overcoming the challenges of pen-side molecular diagnosis of African swine fever to support outbreak investigations under field conditions. Transbound Emerg Dis, 2019, 66(2): 908-914. DOI:10.1111/tbed.13103 |
| [64] |
Barasona JA, Gallardo C, Cadenas-Fernández E, et al. First oral vaccination of Eurasian wild boar against African swine fever virus genotype Ⅱ. Front Vet Sci, 2019, 6: 137. DOI:10.3389/fvets.2019.00137 |
| [65] |
Li L, Ren ZW, Wang QH, et al. Infection of African swine fever in wild boar, China, 2018. Transbound Emerg Dis, 2019, 66(3): 1395-1398. DOI:10.1111/tbed.13114 |
 2020, Vol. 36
2020, Vol. 36