中国科学院微生物研究所、中国微生物学会主办
文章信息
- 周雪, 王怡, 何东, 曾文, 张翀, 薛正莲, 邢新会
- Zhou Xue, Wang Yi, He Dong, Zeng Wen, Zhang Chong, Xue Zhenglian, Xing Xinhui
- 口服肝素与小鼠肠道菌群的相互作用
- Interaction between orally administrated heparin and intestinal microbiota in mice
- 生物工程学报, 2019, 35(9): 1736-1749
- Chinese Journal of Biotechnology, 2019, 35(9): 1736-1749
- 10.13345/j.cjb.190148
-
文章历史
- Received: April 19, 2019
- Accepted: June 6, 2019
- Published: July 19, 2019
2. 清华大学 化学工程系生物化工研究所 工业生物催化教育部重点实验室 合成与系统生物学中心,北京 100084
2. Key Laboratory of Industrial Biocatalysis of Ministry of Education, Institute of Biochemical Engineering, Department of Chemical Engineering; Center for Synthetic and Systems Biology, Tsinghua University, Beijing 100084, China
肝素是一种天然存在于哺乳动物体内的线性多糖大分子,属于糖胺聚糖家族。其结构中含有3-O-硫酸基的特殊五糖结构,能特异性结合血液中的AT Ⅲ,从而使肝素具有抗凝活性[1-4]。肝素作为抗凝血药物应用于临床已有80多年的历史,目前低分子量肝素是临床上应用最广泛的抗凝血药物之一。在临床应用中,肝素类药物以静脉或皮下注射给药途径为主,尚未见口服肝素类药物上市。由于肝素口服制剂不仅能减少通过注射给药的疼痛和不适,而且还有可能减少住院时间,有更好的患者依从性,因此口服肝素类药物的开发具有重要的临床意义和应用价值。
通常认为肝素分子量大、带强负电、极性强等特性是导致肝素口服生物利用度低的主要原因[5]。根据这些特性,以往的研究者已经尝试使用多种药物递送剂改善口服肝素经胃肠道吸收困难的问题,包括制备肝素缀合脱氧胆酸形成复合物[6-7]、脂质体[8]、油-水乳剂以及与聚合物和纳米颗粒结合等修饰方式研制肠溶肝素制剂等[9-11]。但是有关口服肝素在体内的吸收代谢途径及其与肠道菌群的相互作用目前仍不明确。在大鼠静脉和动脉血栓形成模型中,肝素经口服给药后能在内皮细胞中发现肝素存在,并且检测到显著的抗血栓活性[12-13],表明口服肝素在体内能被内皮吸收发挥作用。关于口服肝素体内分布的研究中,通过口服给与小鼠荧光标记的牛磺胆酸(TCA)与肝素和多西紫杉醇(DTX)连接后的结合物,分析其在体内的分布发现该类肝素结合物能够到达小鼠结肠部位[7]。通过口服给予大鼠0.025–15 mg/kg的亭扎肝素后,未能在给药后24 h内的粪便中检测出肝素[14]。口服给予狗7.5 mg/kg的肝素胶囊24 h后,结果只在1只狗的粪便中检测到了肝素,而在实验组内的其他狗的粪便中均未检测到肝素[15]。关于口服肝素后粪便中未检测到肝素,与胃肠道对口服肝素的消化降解作用以及粪便中肝素检测方法灵敏度相关。因此考察消化道对口服肝素的影响,需要了解口服肝素在胃液、小肠液和结肠液环境中的稳定性以及肠道菌群对肝素的降解能力。
解析口服肝素的体内活性以及生物利用度面临的另一个关键问题是阐明肝素与肠道菌群的相互作用。由于肝素糖链结构复杂以及高度硫酸化特性使其不易被降解,目前已知肝素酶可以通过识别特定底物裂解位点破坏糖苷键降解肝素[16],定殖于人体的多形拟杆菌Bacteroides thetaiotaomicron能够利用自身编码的糖苷水解酶(GH)/多糖裂解酶(PL)和硫酸酯酶协同作用克服糖胺聚糖的硫酸化问题降解肝素[17],在厚壁菌门的大型基因组研究中发现存在一类可能有助于肝素代谢的GH或PL位点[18]。通过分析肠道菌群降解肝素的能力,考察肠道菌群对口服肝素稳定性和抗凝活性的影响,为进一步解析口服肝素在消化道内的代谢和吸收提供基础。关于肝素对肠道菌群影响的研究中,Duan等[19]利用变性梯度凝胶电泳(PCR-DGGE),探索了口服肝素两周后的小鼠肠道菌群变化,发现与口服生理盐水的小鼠相比,口服肝素的小鼠粪便菌群中的乳杆菌变多而肠球菌减少,暗示口服肝素会对肠道菌群结构产生影响。但是该研究仅采用PCR-DGGE进行了菌群解析,能得到的信息有限,无法全面揭示口服肝素对肠道菌群结构变化的影响。
综上所述,虽然目前的研究初步揭示了口服肝素在有些条件下能够进入体内循环系统的现象,但大部分研究尚处在探索阶段,仅就口服肝素在体内不同脏器内的分布进行了探索,而且不同研究采用的肝素形态和动物模型不同,远远没有获得面向口服药物研制的统一结论,对口服肝素在胃肠内的动态变化及其与肠道菌群的相互作用过程的系统研究还很初步。因此,需要不断建立全面解析肝素在动物体内分布及其作用机制的方法。为了系统地揭示口服肝素在胃肠道的变化及其与肠道菌群的互作,本研究采用健康小鼠作为动物模型,通过检测荧光肝素在小鼠体内的分布和在模拟胃肠液中的稳定性,建立体外检测肠道菌群对肝素降解作用的评价方法,并结合Illumina MiSeq测序技术研究口服肝素对健康小鼠肠道菌群结构的影响。
本研究的意义在于通过分析口服肝素在健康模式动物胃肠道内的稳定性,分析可能影响口服肝素发挥作用的因素,为未来进一步研究口服肝素递送药物增加肝素在体内的吸收提供参考。
1 材料与方法 1.1 实验材料肝素(河北常山生化药业股份有限公司,原料药级,Mw:(16 430±40) Da,抗Xa因子活性:(191.8±5.7) IU/mg)、厌氧肉汤培养基(青岛海博生物科技有限公司)、氯化血红素(上海阿拉丁试剂有限公司)、维生素K1 (上海阿拉丁试剂有限公司)、粪便基因组提取试剂盒(DP328-02,天根生化科技有限公司)、采用细菌基因组提取试剂盒(DP302-02,天根生化科技有限公司)、叠氮化钠(色谱纯,Biotopped公司)、无水硫酸钠(色谱纯,Sigma公司)、TSK-GEL G2000SWXL (TOSOH公司)、C57BL/6J小鼠(清华大学实验动物中心购买)。
1.2 方法 1.2.1 荧光肝素在体内代谢分布测定荧光肝素制备:将肝素溶液(100 mg/mL)、Texas Red酰肼(Thermo Fisher Scientific公司,100 mg/mL溶于DMSO)和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,20 mg/mL)按10︰3︰3比例混合后,室温避光孵育2 h,再添加少量EDC (总浓度1 mg/mL),过夜孵育,利用3.5 kDa透析袋彻底透析除盐并冻干后得到Texas Red标记的肝素。
C57BL/6J雄性小鼠(周龄:6–8周)购自清华大学实验动物中心,小鼠为无特定病原体(SPF)级,在清华大学实验动物中心的屏障环境中饲养,饲养环境为12 h光照/12 h黑暗循环,温度控制为(22.5±2.5) ℃,湿度控制为50%±5%。在C57BL/6J雄性小鼠禁食24 h后,口服给与荧光肝素溶液(25 mg/kg) 10 h后,眼眶取血并断颈处死小鼠后进行解剖,采集小鼠的心、肝、脾、肺、肾、胃、小肠和结肠组织样品,在4 ℃ PBS缓冲液中短暂储存,之后使用荧光体视镜观察上述组织中的荧光肝素分布情况,实验中使用锡箔纸封好的离心管以避光保存小鼠器官。
1.2.2 肝素胃肠液稳定性测定配制模拟胃液和模拟小肠液,模拟胃液(SGF):胃蛋白酶1.6 g,氯化钠2.0 g,HCl调至pH 1.2,用容量瓶定容至500 mL。模拟小肠液(SIF):肠液素10.0 g,磷酸二氢钾6.8 g,NaOH调pH至6.8,用容量瓶定容至500 mL。模拟结肠液:肠液素10.0 g,磷酸二氢钾6.8 g,NaOH调至pH 7.2,用容量瓶定容至500 mL。按30 mg/mL的终浓度称取适量肝素粉末,分别溶解于对应体积的模拟胃液、肠液和结肠液中,分别移取各溶液2 mL至标记好的离心管中,37 ℃孵育并在不同时间收获对应的离心管,100 ℃下水浴5 min后,10 000 r/min离心10 min取1.5 mL上清液,用0.45 μm滤头过滤,将滤液冷冻干燥后测定肝素分子量变化。
1.2.3 肝素分子量测定采用欧洲药典规定的凝胶渗透色谱法测肝素分子量。使用WATERS液相检测系统、紫外检测器和示差检测器串联、TSK-GELG2000SWXL (7.8 mm×300 mm,TOSOH,日本)进行检测。色谱条件如下,流速:0.5 mL/min,柱温:35 ℃,进样体积:20 μL,紫外检测波长:234 nm,时间:40 min,流动相:28.4 g/L无水硫酸钠溶液,pH 5.0±0.1。
1.2.4 粪便菌悬液制备向40 mL PBS溶液中加入20 mg半胱氨酸盐酸盐充分溶解后121 ℃灭菌15 min,配制成无菌预还原PBS溶液。在清华大学实验动物中心的超净工作台内取5粒新鲜小鼠粪便,迅速放入含有1 mL无菌预还原PBS溶液的离心管中,冰盒中带回实验室。用螺旋振荡器将粪便混匀制成菌悬液,4 ℃、1 000 r/min瞬时离心2次,取上清液作为接种菌悬液。
1.2.5 小鼠肠道菌群的体外培养称取60 g厌氧肉汤培养基(GAM)溶于1 000 mL蒸馏水中使其充分溶解后,按60 mL/ 250 mL分装于厌氧培养瓶中,121 ℃灭菌15 min,按0.05%的终浓度分别加入过滤除菌后的维生素K1溶液与氯化血红素溶液配制成厌氧肉汤培养基。向其中再加入过滤除菌的肝素溶液配制成含有0.5%的肝素厌氧肉汤培养基。在超净工作台中向厌氧瓶培养瓶中通氮气以去除瓶中的氧气,用无菌注射器按照0.5% (体积比)的接种量取接种菌悬液进行接种,在恒温摇床中,37 ℃、200 r/min下厌氧培养48 h。
1.2.6 体外培养肠道菌基因组DNA提取采用细菌基因组提取试剂盒提取肠道菌基因组,严格按照试剂盒里的实验步骤逐步操作,得到的核酸样品使用1%的琼脂糖凝胶电泳检测提取的基因组DNA完整性。
1.2.7 PCR扩增肠道菌群肝素酶基因在Brenda酶库搜索肝素酶并获取基因序列,根据基因序列信息设计了7对引物,以体外培养的肠道菌基因组为模板,以表 1中的引物进行PCR反应,通过琼脂糖电泳和Gel Extraction kit (D2500-01,OMEGA BIO-TEK公司)纯化回收序列大小正确的扩增序列,送至南京金唯智公司进行测序。
| Primer name | Primer sequence(5'–3') | Size (bp) |
| A-F | AGAAAAGCATCCTGCGTCTGAGTC | 24 |
| A-R | CTTGATCTGTGATGATAGTCGCACCT | 26 |
| B-F | ACGGGTAAACGTACAGGCTG | 20 |
| B-R | ACGGGAACGGTACTATCACCTAC | 23 |
| C-F | GACCGAACGGGTGAATGTT | 19 |
| C-R | ACCTATAGCATACCGGCACTGT | 22 |
| D-F | GCATTAATCACCCTCTGCCT | 20 |
| D-R | AGAGCCCCCTATTTCTCTGAGT | 22 |
| E-F | AAGCAGGCCAGAGGTTACCT | 20 |
| E-R | GCTATCTGTACGCCTACCACTTTC | 24 |
| F-F | CTGGCAAGAGATAGAGGGAGTTAAT | 25 |
| F-R | TGGCAAAAGTAACGACACGAT | 21 |
| G-F | GAGCAACCTGCCGTGATAAAGGT | 23 |
| G-R | GGTTTCGGTAAGGAATCAACCAGTCT | 26 |
肝素的抗凝血活性通过使用APTT活化部分凝血酶时间测定试剂盒(R3018,Sysmex公司)以及抗Xa活性测定试剂盒(82098539,Chromogenix公司,发色底物法)进行检测,具体方法参考欧洲药典药品标准EP7.0及叶逢春博士论文方法[20]。
1.2.9 肠道菌群体外共孵育肝素底物配制肝素底物缓冲液(100 mL):Tris 0.208 7 g、NaCl 0.257 4 g、无水氯化钙0.007 77 g,肝素1.0 g,HCl调至pH 7.0±0.1。
将厌氧培养48 h后的20 mL菌液移入离心管中,4 ℃、10 000 r/min离心15 min取沉淀,再用PBS缓冲液清洗菌体2次,将得到的菌体与肝素底物缓冲液在30 ℃下共孵育3 h,孵育完毕后13 000 r/min离心20 min,取上清低温冷冻干燥后,用高效液相色谱仪检测肝素分子量变化。
1.2.10 动物实验设计及粪便取样将C57BL/6J雄性小鼠(周龄:6–8周)随机分成两组即灌胃生理盐水组(WT组)和灌胃肝素组(HP组),每组10只。按30 mg/(kg·d)的肝素剂量连续给小鼠灌胃30 d,对照组小鼠灌胃生理盐水,实验过程中所有小鼠均可任意饮水与饮食。给药期间记录小鼠体重变化,在动物实验中心的超净工作台内采集每只小鼠灌胃后的第10、20、30天的新鲜粪便样本,每次采集粪便后迅速置入标记过的1.5 mL无菌离心管内置于冰盒中,在实验室–80 ℃冰箱中储存直至分析。
1.2.11 粪便样本基因组DNA提取使用粪便基因组提取试剂盒提取粪便菌群基因组,严格按照试剂盒里的实验步骤逐步操作,得到的核酸样品使用超微量分光光度计测定含量,并用1%的琼脂糖凝胶电泳检测提取的基因组DNA完整性。
1.2.12 16S rRNA微生物群落分析通过测定16S rRNA中的V3–V4区序列,对小鼠的肠道菌群结构进行分析。高通量测序文库构建和基于Illumina MiSeq平台的测序工作由GENEWIZ公司(苏州,中国)完成。经过质量过滤,去除嵌合体序列,最终得到的序列用于操作分类单元(Opetational taxonomic unit,OTU)分析,使用VSEARCH (1.9.6)进行序列聚类(序列相似性设为97%),用参考数据库Silva 132比对16S rRNA。然后用RDP classifier (Ribosomal Database Program)贝叶斯算法对OTU的代表性序列进行物种分类学分析,之后分析样本的Alpha多样性和Beta多样性,统计每个样本的群落组成。
1.2.13 结肠长度、脾重指数与组织学分析给药周期结束后,给予小鼠安乐死,并解剖小鼠获得全段结肠组织,用标尺测量小鼠结肠长度后,取一部分结肠组织置于10%福尔马林中固定,之后制作肠组织石蜡切片,再对切片进行苏木精-伊红染色,通过显微镜观察拍照。另取小鼠脾脏,在分析天平上测定湿重并记录,计算出脾重指数,即脾重指数=脾脏重量(mg)/体重(g)。结果以mg/10 g体重表示。
1.2.14 统计学分析所有实验均有生物学重复,所有数据均以平均值±标准偏差表示。生物统计学显著性差异使用Origin Lab软件(Origin Pro 8.0,Origin Lab Co,Northampton,MA,USA)进行单向方差分析(ANOVA),P < 0.05为差异有统计学意义。
2 结果与分析 2.1 口服荧光肝素的小鼠体内分布使用荧光体式镜分别观察口服灌胃荧光肝素10 h后,小鼠的心、肝、脾、肺、肾、胃、小肠和结肠的荧光肝素分布情况。如图 1所示,荧光肝素主要分布在小鼠的胃、小肠的食糜中以及结肠部位(图 1A);而在小鼠的心、肝、脾、肺、肾的剖面并未观察到荧光肝素的存在(图 1B),同时血清中也未检测到荧光肝素信号。表明口服肝素10 h后肝素主要集中存在于胃肠道中,未经血液循环进入到肠外其他脏器中。由此可以推测,小鼠口服肝素后,胃肠道环境是影响口服肝素代谢与稳定性的主要因素之一,因此需要了解口服肝素在胃肠道环境中的存在特性。

|
| 图 1 荧光肝素在小鼠体内不同组织中的分布 Fig. 1 Distribution of fluorescent heparin in tissues. (A) From the top to the bottom are the stomach, stomach section, small intestine and colon tissue. (B) From top to bottom are the heart, liver, spleen, lung and kidney tissue sections. The left side of the figure is the famous field, and the right side is the corresponding fluorescent picture. |
| |
实验使用的肝素为未分级肝素,是一种分子量不均一的混合物,色谱峰分布较宽,保留时间为13.8 min (图 2A)。通过灌胃给药肝素后肝素首先进入胃环境,其主要特点是酸性较强。结果发现在模拟胃液中消化12 h的肝素色谱峰的保留时间和峰面积均未变化(图 2B),说明肝素在模拟胃液环境中比较稳定,肝素分子量无明显变化。此外,在模拟小肠液条件下消化12 h的肝素色谱峰的保留时间和峰面积也没有变化(图 2C),表明肝素在模拟小肠液条件下稳定性较好。最后,肝素在模拟结肠液条件下消化24 h内的色谱峰的保留时间和峰面积没有改变(图 2D),表明肝素在模拟结肠液环境中稳定性高。以上实验结果表明,模拟胃液、小肠液和结肠液对肝素的稳定性影响较小,暗示口服肝素能够稳定到达结肠部位。

|
| 图 2 肝素在模拟胃肠液中的高效液相色谱图 Fig. 2 High performance liquid chromatogram of heparin in simulated gastrointestinal fluids for different time periods. (A) Standard heparin. (B) Heparin in simulates gastric fluid. (C) Heparin in simulates small intestine fluid. (D) Heparin in simulates colon fluid. |
| |
考虑到上述模拟胃肠液为无菌状态,而现实小鼠肠道特别是结肠段存在大量肠道菌群,因此探究口服肝素在小鼠肠道内的代谢,需要考察肝素与肠道菌群的互作关系。由于肠道内环境十分复杂,结肠内存在种类繁多且宿主难以消化的复杂多糖,会对低剂量肝素检测产生较大的影响,且目前尚未建立检测肠道内和粪便中肝素的有效分析方法。因此,我们通过体外培养粪便菌群的方法,间接推测结肠中肠道菌群对肝素的影响。在体外使用添加肝素的厌氧肉汤培养基培养粪便菌群,收集并测定培养0、2、6、24 h时培养液中的肝素,发现培养液中的肝素色谱峰保留时间一致。但是在同样的样品制备条件下,随着培养时间延长不同培养液中的肝素峰面积逐渐减小(图 3A),表明肝素能被厌氧瓶中培养的肠道菌群降解。与添加肝素的厌氧肉汤培养基培养的肠道菌群细胞体外共孵育后的肝素色谱图明显右移,保留时间增大,肝素分子量变小,出现与低分子肝素色谱图相似的寡糖色谱峰(图 3B ),进一步表明体外培养的肠道菌群可以利用肝素且能将大分子肝素降解为小分子肝素。由此推测,体外培养的小鼠肠道菌群中存在能够降解肝素的菌属,暗示肠道菌群会对口服肝素产生影响。
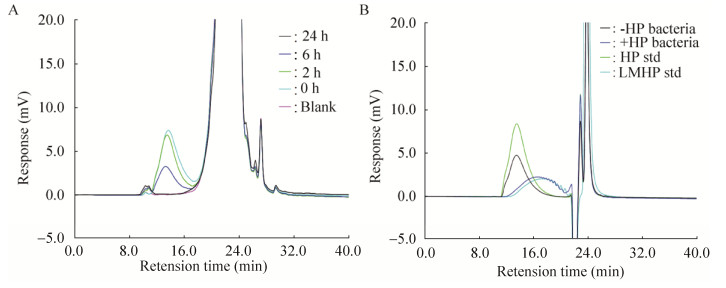
|
| 图 3 肝素体外降解色谱图 Fig. 3 Chromatogram of degradation heparin in vitro. (A) High-performance gel permeation chromatogram of heparin after fermented in vitro at different time points. Blank: Anaerobic broth medium. (B) Chromatogram of in vitro degradation of heparin substrate after culture of intestinal flora with (+HP bacteria) or without (-HP bacteria) heparin medium. |
| |
为了进一步获得培养菌群降解肝素的分子证据,进一步提取体外培养的肠道菌群基因组(图 4 A ),利用肝素酶引物对该基因组进行PCR扩增,通过琼脂糖凝胶电泳检测得到扩增后的DNA电泳条带(图 4B)。并对DNA进行回收、纯化与测序后,在NCBI中进行序列比对,其中A引物扩增得到的序列与多形拟杆菌Bacteroides thetaiotaomicron 7330编码的肝素酶Ⅱ(hep B)相似度达99% (Sequence ID: CP012937.1),G引物扩增得到的序列与解纤维素拟杆菌Bacteroides cellulosilyticus WH2编码的肝素酶Ⅱ(hep B)相似度达97% (Sequence ID: CP012801.1)。肝素酶Ⅱ是以肝素和硫酸乙酰肝素为底物,裂解2-O硫酸化的糖醛酸的典型肝素酶。上述结果进一步证明体外培养的肠道菌群中可能存在产生肝素酶Ⅱ的菌群,从而发挥了降解肝素的作用。此外,为研究肠道菌群降解后的肝素抗凝活性变化,检测了被体外培养的肠道菌群降解后肝素的活化部分凝血活酶时间(APTT)和抗Xa因子活性。结果发现,与原肝素相比,其抗凝活性没有明显下降趋势仍具有抗凝活性(表 2),说明培养肠道菌群降解后的肝素仍有抗凝活性,该结果为口服抗凝肝素研制提供了参考。

|
| 图 4 细菌基因组及PCR产物电泳图 Fig. 4 Electrophoresis of bacterial genome and PCR products. (A) Agarose gel electro-phoresis of bacterial genome. M: DNA marker; band 1 and 2: bacterial genome of two samples. (B) Agarose gel electrophoresis of PCR amplified. M: DNA marker; A–G: PCR amplification products by primer A–G (Table 1), respectively. |
| |
| Sample | APTT (IU/mg) | FL (%) | Anti Xa (IU/mg) | FL (%) |
| HP | 163.93 | 6.1 | 216.25 | 10.9 |
| Degraded HP | 158.69 | 10.4 | 184.64 | 9.4 |
| FL: fiducial limit. | ||||
本文通过测定粪便菌群的16S rRNA的V3–V4区,分析第10、20、30天的HP组与WT组小鼠的粪便菌群差异。在移除不合格序列后,每个样品平均获得约70 000–90 000万条序列信息。根据97%的序列相似性分析,在不同时间点的WT组和HP组中都鉴定出435个以上的OTUs,测序数据量相同时,在灌胃第10、20、30天时HP组OTUs数目均高于WT组(表 3)。对于不同组中的所有样品序列,Goods_coverage较高几乎完全覆盖(表 3),表明该测序方法可以表征肠道菌群的真实组成。分析Alpha多样性发现,在灌胃第10、20、30天时HP组与WT组相比差异不显著,但在灌胃第10天时与WT组相比HP组中Shannon和Simpson值显著下降(P < 0.05)。以上结果表明,灌胃肝素对健康小鼠的肠道菌群结构有影响。
| Richness | Diversity | ||||||
| Group | Ace | Chao1 | Shannon | Simpson | Goods_coverage | Reads | OTUs |
| 10d WT | 465±15 | 478±30 | 6.71±0.11 | 0.981±0.002 | 0.999±0.000 | 59781±10437 | 431±14 |
| 10d HP | 471±8 | 481±5 | 6.42±0.10* | 0.970±0.004* | 0.999±0.000 | 63457±3306 | 443±7 |
| 20d WT | 473±13 | 479±17 | 6.52±0.17 | 0.979±0.003 | 0.999±0.000 | 62239±12331 | 442±11 |
| 20d HP | 474±7 | 479±4 | 6.50±0.06 | 0.973±0.001 | 0.999±0.000 | 63837±1666 | 449±4 |
| 30d WT | 463±8 | 476±13 | 6.39±0.19 | 0.976±0.003 | 0.999±0.000 | 59555±3583 | 429±15 |
| 30d HP | 469±4 | 470±7 | 6.00±0.49 | 0.956±0.016 | 0.999±0.000 | 54940±5534 | 433±15 |
| WT: control; HP: heparin; data are expressed as x±s(n=3), *P < 0.05. | |||||||
为了进一步验证上述结果,应用了Venn图解分析,主坐标分析(PCoA)和聚类分析(图 5)。如图 5A所示,大部分OTUs是WT组和HP组共有的,少数是各自独特的OTUs,其中灌胃30 d后的小鼠特有的OTUs数最多。PCoA评分图揭示了HP组小鼠的肠道菌群与WT组相比存在差异,但相同处理不同天数的小鼠的微生物群差异较小(图 5B)。聚类分析也表明WT组和HP组微生物群之间存在差异性(图 5C)。这些结果进一步证实了灌胃肝素能在一定程度上调节健康C57BL/6J小鼠的肠道菌群结构。

|
| 图 5 灌胃肝素对小鼠肠道菌群结构影响 Fig. 5 Structural modulation of gut microbiota by heparin treatments. (A) Venn diagrams showing the unique and shared OTUs in the gut microbiota among the WT group and heparin group in different time points of oral administration. (B) Plots shown were generated using the unweighted version of the UniFrac-based PcoA. (C) Clustering analysis of variance from PCoA matrix scores; WT: control group; HP: heparin group. |
| |
为了分析HP灌胃后的小鼠肠道菌群结构变化,在门和属水平上比较了灌胃不同时间HP组和WT组小鼠的菌群结构差异。如图 6A所示,在门水平上,WT组和HP组小鼠肠道菌群中优势菌门组成无差异,主要由厚壁菌门、拟杆菌门、变形菌门、脱铁杆菌门和放线菌门等菌门构成。在第30天时HP组和WT组中拟杆菌门相对丰度均有增高趋势,但是差异不显著。在门水平上,相同时间点HP组与WT组间菌群没有显著差异,通过对3个时间点的WT组和HP组内样品进行LEfSe分析,在属水平上发现了两组中分别对肠道菌群结构差异性影响较大的微生物。图 6B、6C和6D中显示了灌胃后第10、20、30天时WT组和HP组内的样本基于LDA分值分析得到的柱状图,柱状图中展示了两个组别中分别对菌群结构差异贡献较大的标志性微生物。由图 6B所示,在灌胃第10天时WT组与HP组肠道菌群存在一定差异,HP组中对菌群结构差异影响较大的微生物主要是来自变形菌门Proteobacteria中的Parasutterella、疣微菌门Verrucomicrobia中的Akkermansia和Ruminococcaceae-UCG-014等,WT组中对菌群结构差异影响较大的微生物是Prevotellaceae_UCG_001、罗斯氏菌属Roseburia、Ruminiclostridium、颤杆菌克属Oscillibacter、厌氧棍状菌属Anaerotruncus和Lachnoclostridium;由图 6C所示,在灌胃20 d时HP组中对菌群结构差异影响较大的优势菌为丁酸弧菌属Butyricimonas、Ruminiclostridium、Ruminiclostridium_9、Oscillibacter和Intestinimonas,而WT组中的优势菌为Prevotellaceae_UCG_001、Lachnoclostridium以及Enterorhabdus;在灌胃30 d时发现(图 6D),在HP组对菌群结构差异影响较大的Butyricimonas和Parabacterioides等丰度升高,而Dubosiella、Lachnoclostridium和Candidatus_Saccharimonas等丰度降低。说明口服肝素能够改变小鼠肠道中某些菌属的相对丰度,对健康C57BL/6J小鼠肠道菌群结构有调节作用。

|
| 图 6 灌胃肝素在门和属水平对肠道菌群的影响 Fig. 6 Response of gut microbiota at the phylum and genus levels to heparin treatments. (A) Relative abundance of gut microbiota at the phylum level. LEfSe analysis identifies the gut microbiota phylotypes with the statistical difference in abundance between the WT and HP groups. (B) After 10 d. (C) After 20 d. (D) After 30 d. Only the phylotypes with LDA score higher than 2 were shown. |
| |
分别检测连续灌胃30 d肝素和灌胃生理盐水后健康小鼠的体重、结肠长度、脾重指数和结肠组织结构变化,初步分析口服肝素的生物安全性。如图 7A所示,HP组与WT组的小鼠体重变化趋势一致。通过测定WT组和HP组小鼠的结肠长度以及观察结肠组织结构HE染色切片,分析口服肝素对小鼠结肠的宏观结构影响。发现WT组与HP组小鼠的结肠长度无统计学差异(图 7B)。HP组与WT组小鼠的结肠结构相似,肠粘膜完整无脱落,隐窝结构正常,上皮细胞排列整齐,形态正常(图 7C),提示长期口服肝素对小鼠的结肠长度、结构无显著影响。脾重指数是粗略反映机体免疫能力强弱的指标,如图 7D所示,灌胃肝素30 d后HP组与WT组的脾重指数也无生物统计学差异,说明口服灌胃肝素30 d对小鼠的免疫功能无明显影响。以上结果均表明口服肝素对健康小鼠具有较高安全性。

|
| 图 7 口服肝素对小鼠生长的影响 Fig. 7 Effect of oral heparin on mouse growth. (A) The curve of body weight change in mice with heparin administered for 30 d. (B) Effect of gavage heparin 30 d on colon length in mice. (C) HE-stained of colon section of mice after heparin administration for 30 d. (D) Effects of gavage heparin 30 d on spleen weight index in mice. |
| |
本研究首先通过体外菌群培养和动物实验,结合高效液相色谱法等现代仪器分析手段以及Illumina高通量测序技术,对肝素和肠道菌群的相互作用过程进行分析,初步探究了肠道菌群对肝素的降解作用和口服肝素对小鼠肠道菌群的调节作用。体外实验结果表明,肝素在模拟胃肠液中的稳定性高,不易被降解。之前的研究也表明肝素中糖苷键不易被酸水解,其中的O-硫酸基对酸水解相当稳定,而在碱性条件下,N-硫酸基相当稳定[21-22]。实验证明肝素能够被体外培养的肠道菌群降解,目前相关代谢组学研究也发现粪便菌群能够编码丰富多样的复杂多糖降解酶,特别是拟杆菌门中的菌属[23]。通过检测体外培养的肠道菌群降解后的肝素的抗凝血活性,发现降解前后肝素抗凝活性变化较小,这与前人研究报道提及的经肝素酶Ⅱ和Ⅲ降解的肝素仍有抗凝活性的结果一致[24]。这一结果表明,尽管肠道菌群能够降解口服肝素,但其抗凝活性仍能够保持,为未来口服肝素药物递送策略的研究提供了参考。
体内动物实验表明口服荧光标记的肝素主要分布在小鼠胃肠道内,这与之前一项口服荧光肝素复合物在体内代谢研究结果一致,荧光肝素主要在回肠积累,在结肠中也有分布[7]。分析粪便菌群的16S rRNA序列发现,长期口服肝素的小鼠肠道菌群结构发生变化,与WT组相比灌胃肝素后小鼠的肠道菌群多样性降低;在属水平上,口服肝素使肠道菌群中的某些菌属,如Parasutterella、Akkermansia、Ruminiclostridium、Intestinimonas、Butyricimona和Parabacterioides的相对丰度增加。现在已经发现Parasutterella菌属能够产生琥珀酸,细菌来源的琥珀酸盐通过促进严格厌氧细菌的定殖,对宿主产生有益作用[25];其中的Intestinimonas和Butyricimonas菌属中的某些菌属被发现能够产生短链脂肪酸[26-28];而Akkermansia菌属中的Akkermansia muciniphila被认为是一种很有前景的益生菌,能够降解肠粘蛋白生成短链脂肪酸[29],与肥胖、糖尿病、心脏代谢疾病和低度炎症呈负相关[30-31],另外还有研究发现它能粘附于肠上皮细胞并在体外增强肠上皮单层细胞完整性,增强受损肠道的屏障功能[32]。口服肝素后Bilophila、Enterorhabdus菌属的相对丰度减少。其中Enterorhabdus被发现在前驱糖尿病患者体内丰度增高[33];Bilophila菌属中的沃氏嗜胆菌Bilophila wadsworthia是一种能够引起和加重炎症的致病菌[34-35]。
最后,在口服肝素生物安全性方面,本研究表明长时间口服肝素没有对小鼠的生长产生明显负面影响,表明口服肝素安全性高。这与Kim等[36]用低分子量肝素-脱氧胆酸盐结合物对小鼠口服毒性研究结果一致,该研究中没有造成小鼠的体征参数以及死亡率的变化,通过延长给药时间至4周小鼠也无死亡和体重下降现象。综上所述,口服灌胃肝素能够被肠道菌群降解,能够在一定程度上调节肠道菌群结构,这可能与口服肝素的生物利用度和体内生物活性的发挥有关,为未来口服肝素类药物的开发及药效解析提供参考。
| [1] |
Torri G, Naggi A. Heparin centenary - an ever-young life-saving drug. Int J Cardiol, 2016, 212(S1): S1-S4. |
| [2] |
Damus PS, Hicks M, Rosenberg RD. Anticoagulant action of heparin. Nature, 1973, 246(5432): 355-357. DOI:10.1038/246355a0 |
| [3] |
Rosenberg RD, Lam L. Correlation between structure and function of heparin. Proc Natl Acad Sci USA, 1979, 76(3): 1218-1222. DOI:10.1073/pnas.76.3.1218 |
| [4] |
Lever R, Page CP. Novel drug development opportunities for heparin. Nat Rev Drug Discov, 2002, 1(2): 140-148. DOI:10.1038/nrd724 |
| [5] |
Money SR, York JW. Development of oral heparin therapy for prophylaxis and treatment of deep venous thrombosis. Cardiovasc Surg, 2001, 9(3): 211-218. DOI:10.1016/S0967-2109(00)00144-7 |
| [6] |
Kim SK, Vaishali B, Lee E, et al. Oral delivery of chemical conjugates of heparin and deoxycholic acid in aqueous formulation. Thromb Res, 2006, 117(4): 419-427. DOI:10.1016/j.thromres.2005.03.027 |
| [7] |
Khatun Z, Nurunnabi M, Cho KJ, et al. Oral absorption mechanism and anti-angiogenesis effect of taurocholic acid-linked heparin-docetaxel conjugates. J Control Release, 2014, 177: 64-73. DOI:10.1016/j.jconrel.2013.12.034 |
| [8] |
Lavanya N, Muzib YI, Aukunuru J, et al. Preparation and evaluation of a novel oral delivery system for low molecular weight heparin. Int J Pharm Investig, 2016, 6(3): 148-157. DOI:10.4103/2230-973X.187351 |
| [9] |
Paliwal R, Paliwal SR, Agrawal GP, et al. Recent advances in search of oral heparin therapeutics. Med Res Rev, 2012, 32(2): 388-409. |
| [10] |
Hiebert LM. Oral heparins. Clin Lab, 2002, 48(3/4): 111-116. |
| [11] |
Zhu M, Li LA, Wang GB. Recent progress in research of oral low molecular weight heparin. Chin J Mod Appl Pharm, 2010, 27(2): 105-108 (in Chinese). 诸敏, 李立安, 王根宝. 低分子肝素口服制剂的国内外研究进展. 中国现代应用药学, 2010, 27(2): 105-108. |
| [12] |
Hiebert LM, Ping T, Wice SM. Repeated doses of oral and subcutaneous heparins have similar antithrombotic effects in a rat carotid arterial model of thrombosis. J Cardiovasc Pharmacol Ther, 2012, 17(1): 110-116. DOI:10.1177/1074248411405991 |
| [13] |
Hiebert LM, Ping T, Wice SM. Enhanced antithrombotic effects of unfractionated heparin in rats after repeated oral doses and its relationship to endothelial heparin concentration. Br J Pharmacol, 2010, 153(6): 1177-1184. |
| [14] |
Hiebert LM, Wice SM, Ping T. Tissue distribution of the low molecular weight heparin, tinzaparin, following administration to rats by the oral route. Biomed Pharmacother, 2004, 58(6/7): 372-380. |
| [15] |
Erickson M, Hiebert LM, Carr AP, et al. Effect of oral administration of unfractionated heparin (UFH) on coagulation parameters in plasma and levels of urine and fecal heparin in dogs. Can J Vet Res, 2014, 78(3): 193-201. |
| [16] |
Desai UR, Wang HM, Linhardt RJ. Specificity studies on the heparin lyases from Flavobacterium heparinum. Biochemistry, 1993, 32(32): 8140-8145. DOI:10.1021/bi00083a012 |
| [17] |
Cartmell A, Lowe EC, Baslé A, et al. How members of the human gut microbiota overcome the sulfation problem posed by glycosaminoglycans. Proc Natl Acad Sci USA, 2017, 114(27): 7037-7042. DOI:10.1073/pnas.1704367114 |
| [18] |
Sheridan PO, Martin JC, Lawley TD, et al. Polysaccharide utilization loci and nutritional specialization in a dominant group of butyrate-producing human colonic Firmicutes. Microb Genom, 2016, 2(2): e000043. |
| [19] |
Duan RS, Chen XE, Wang FS, et al. Oral administration of heparin or heparosan increases the Lactobacillus population in gut microbiota of rats. Carbohyd Polym, 2013, 94(1): 100-105. DOI:10.1016/j.carbpol.2013.01.075 |
| [20] |
Ye FC. Design of multifunctional fusion heparinase and its application in the production of low molecular weight Heparin[D]. Beijing: Tsinghua University, 2010 (in Chinese). 叶逢春.多功能融合肝素酶的设计及其制备低分子量肝素工艺[D].北京: 清华大学, 2010. |
| [21] |
张天民, 吴悟桐, 王发同. 动物生化制药学. 北京: 人民卫生出版社, 1981: 224-225.
|
| [22] |
左耀明, 刘智. 肝素的理化特性与药理作用. 中国生化药物杂志, 1990(3): 44-47. |
| [23] |
Koropatkin NM, Cameron EA, Martens EC. How glycan metabolism shapes the human gut microbiota. Nat Rev Microbiol, 2012, 10(5): 323-335. DOI:10.1038/nrmicro2746 |
| [24] |
Ji Y. Production of heparin derivatives using heparinases and their therapeutic effects on ulcerative colitis[D]. Beijing: Tsinghua University, 2018 (in Chinese). 季洋.酶解去抗凝肝素衍生物的制备及其治疗结肠炎的功效研究[D].北京: 清华大学, 2018. |
| [25] |
Ju TT, Kong JY, Stothard P, et al. Defining the role of Parasutterella, a previously uncharacterized member of the core gut microbiota. ISME J, 2019, 13(6): 1520-1534. DOI:10.1038/s41396-019-0364-5 |
| [26] |
Bui TPN, Ritari J, Boeren S, et al. Production of butyrate from lysine and the Amadori product fructoselysine by a human gut commensal. Nat Commun, 2015, 6(1): 10062. DOI:10.1038/ncomms10062 |
| [27] |
Engels C, Ruscheweyh HJ, Beerenwinkel N, et al. The common gut microbe Eubacterium hallii also contributes to intestinal propionate formation. Front Microbiol, 2016, 7: 713. |
| [28] |
Bui TPN, Shetty SA, Lagkouvardos I, et al. Comparative genomics and physiology of the butyrate-producing bacterium Intestinimonas butyriciproducens. Environ Microbiol Rep, 2016, 8(6): 1024-1037. DOI:10.1111/1758-2229.12483 |
| [29] |
de Vos WM. Microbe profile: Akkermansia muciniphila: a conserved intestinal symbiont that acts as the gatekeeper of our mucosa. Microbiology, 2017, 163(5): 646-648. DOI:10.1099/mic.0.000444 |
| [30] |
Cani PD, de Vos WM. Next-generation beneficial microbes: the case of Akkermansia muciniphila. Front Microbiol, 2017, 8: 1765. DOI:10.3389/fmicb.2017.01765 |
| [31] |
Schneeberger M, Everard A, Gómez-Valadés AG, et al. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci Rep, 2015, 5: 16643. DOI:10.1038/srep16643 |
| [32] |
Reunanen J, Kainulainen V, Huuskonen L, et al. Akkermansia muciniphila adheres to enterocytes and strengthens the integrity of the epithelial cell layer. Appl Environ Microbiol, 2015, 81(11): 3655-3662. DOI:10.1128/AEM.04050-14 |
| [33] |
Yang JP, Summanen PH, Henning SM, et al. Xylooligosaccharide supplementation alters gut bacteria in both healthy and prediabetic adults: a pilot study. Front Physiol, 2015, 6: 216. |
| [34] |
Zhou F, Long WM, Hao BH, et al. A human stool-derived Bilophila wadsworthia strain caused systemic inflammation in specific-pathogen-free mice. Gut Pathog, 2017, 9: 59. DOI:10.1186/s13099-017-0208-7 |
| [35] |
Schneeberger M, Everard A, Gómez-Valadés AG, et al. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci Rep, 2015, 5: 16643. DOI:10.1038/srep16643 |
| [36] |
Kim JY, Jeon OC, Moon HT, et al. Preclinical safety evaluation of low molecular weight heparin-deoxycholate conjugates as an oral anticoagulant. J Appl Toxicol, 2016, 36(1): 76-93. DOI:10.1002/jat.3146 |
 2019, Vol. 35
2019, Vol. 35




