中国科学院微生物研究所、中国微生物学会主办
文章信息
- 何峰容, 孙颖, 乐鑫, 刘勇, 刘梦元
- He Fengrong, Sun Ying, Yue Xin, Liu Yong, Liu Mengyuan
- 人IL-35单克隆抗体制备及其在定量ELISA检测方法中的应用
- Preparation of monoclonal antibodies against human interleukin-35 and their application in a quantitative ELISA for interleukin-35 detection
- 生物工程学报, 2019, 35(9): 1723-1735
- Chinese Journal of Biotechnology, 2019, 35(9): 1723-1735
- 10.13345/j.cjb.190129
-
文章历史
- Received: April 8, 2019
- Accepted: July 9, 2019
- Published: July 22, 2019
2. 武汉云克隆科技股份有限公司,湖北 武汉 430056;
3. 药物高通量筛选国家与地方联合工程研究中心,湖北 武汉 430062
2. Wuhan Coud-clone Science and Technology Co. Ltd, Wuhan 430056, Hubei, China;
3. National and Local Joint Engineering Research Center of High-throughput Drug Screening Technology, Wuhan 430062, Hubei, China
白细胞介素IL-35是最新发现的IL-12细胞因子家族的成员,是由IL-12家族α链p35 (IL-12p35)和一个β链EBI3组成的异源二聚体蛋白[1]。p35亚基在人体内广泛组成型表达,可与p40组成IL-12。EB病毒(Epstein-Barr virus,EBV)诱导基因3 (EBI3)是IL-12的p40亚基同源物,最初在被EB病毒感染的B细胞中发现,可与IL-12家族的p28组成IL-27,因而也称为IL-27EBI3。IL-35由调节性T细胞(Regulatory T cell,Treg)分泌,在T细胞分化中扮演着重要的角色[2],可刺激Treg的增殖,抑制效应性CD4+ T细胞和CD8+ T细胞的增殖,抑制CD4+ T细胞分化为Th17效应细胞,是继TGF-β、IL-10、IL-27之后发现的一个新型免疫抑制性细胞因子[3-4]。IL-35在肿瘤、自身免疫病和感染性疾病发挥着重要的免疫调节作用[5-9]。在肿瘤微环境中,IL-35可有效抑制T细胞对肿瘤的免疫应答,IL-35还可通过趋化髓源性抑制细胞(MDSC)在肿瘤内聚集并促进肿瘤的血管形成,从而促进肿瘤的生长和免疫逃逸[2, 10]。在自身免疫性疾病如类风湿关节炎(RA)中,IL-35通过扩增Tregs,抑制Th1和Th17效应细胞的分化和免疫应答,减少TNF-α和IL-17的分泌,有效减轻关节炎症[11-12]。在感染性疾病中,IL-35则发挥着双重作用,急性感染时,IL-35可明显诱导Th1细胞清除感染,同时扩增Tregs并抑制Th17细胞分化;慢性感染时,扩增的Tregs则表现为抑制效应性CD4+ T细胞,防止过度免疫损伤的发生[11]。越来越多的研究证实人血清IL-35的水平与多种疾病的发生、发展和预后相关。肿瘤患者血清中的IL-35升高而自身免疫疾病患者血清IL-35降低,提示IL-35可能成为相关疾病的诊断和监测标志物。事实上,IL-35是多种恶性肿瘤的早期诊断和预后标志物,也是多种恶性肿瘤潜在的治疗靶点[13-18]。类风湿关节炎(Rheumatoid arthritis,RA)RA患者血清IL-35水平显著低于健康人群,抗TNF-α治疗可有效诱导RA患者Tregs的增殖,上调血清IL-35的水平,血清IL-35水平的变化可作为监测RA病情和评价治疗效果的参考指标[19-20]。乙型肝炎病毒(HBV)感染可显著提升血清IL-35水平,有证据表明IL-35参与HBV导致的肝硬化形成,故IL-35水平可作为乙型肝炎疾病进展和药物疗效的重要评价指标[21-22]。这些资料表明,IL-35的定量检测不仅对其生物学功能的基础研究具有重要意义,而且对肿瘤、自身免疫疾病及感染性疾病的诊断、药物疗效和预后的评价同样具有重要的意义。
IL-35是一个新发现的细胞因子,市面上针对IL-35的检测工具很少,目前主要依赖进口。我们制备了IL-35两个亚基IL-12p35和IL-27EBI3的重组蛋白,通过单克隆抗体杂交瘤技术获得了针对IL-12p35和IL-27EBI3的单克隆抗体,建立了IL-35双抗夹心定量检测方法,并对该检测方法的各项性能进行了综合评价,为进一步组装成IL-35的定量检测试剂盒打下了基础。
1 材料与方法 1.1 质粒,菌株和细胞株原核表达载体pTS为本实验构建和保存。大肠杆菌Top10 (用于分子克隆和质粒保存),大肠杆菌BL21 star (DE3) (用于蛋白表达的宿主细胞)均购自天根生化科技(北京)有限公司。SP2/0购自中国典型培养物保存中心,并由实验室传代保存。人脐静脉内皮细胞(HUEVC)购自武汉原生原代生物科技有限公司。
1.2 试剂与动物重组人IL-35、IL-12、IL-23、IL-27、IL-6、IL-10及TNF-α购自Peprotech公司。限制性内切酶、T4 DNA连接酶、Pfu DNA多聚酶、AMV反转录酶、DNA回收试剂盒、RNA提取试剂盒购自大连宝生物(TaKaRa)。Ni-NTA亲和层析凝胶、A蛋白亲和层析凝胶购自Pharmacia公司。弗氏完全佐剂购自Sigma公司。单克隆抗体亚类鉴定试剂盒购自Proteintech公司。水溶性生物素化试剂N-羟基磺酸基琥珀生物素(Sulfo-NHS-Biotin)及亲和素标记的辣根过氧化物酶(Streptavidin-HRP)购自Thermo Fisher Scientific。雌性Balb/c小鼠购自湖北省疾病预防控制中心,用标准的啮齿动物饲料进行喂养,所有相关实验动物的操作严格按照国家科技部发布的《实验动物管理条例》进行。
1.3 细胞培养和RNA的提取用含10%小牛血清的ECM培养基(Sciencell) 37 ℃、5% CO2培养脐静脉内皮细胞(HUEVC),待细胞90%汇合时,加入1 ng/mL的TNF-α,继续培养12 h,胰酶消化,收集细胞。用RNA提取试剂盒提取HUEVC细胞总RNA,具体操作按照试剂盒说明书进行。
1.4 IL-27EBI3和IL-12p35基因的克隆根据GenBank中IL-27EBI3已知序列(GenBank Accession No. NM_005755.2)和IL-12p35已知序列(GenBank Accession No. NM_000882.3)设计扩增IL-27EBI3和IL-12p35编码基因的引物,引物如表 1所示。在PCR反应管中加入HUEVC细胞总RNA 5 μL,70 ℃作用5 min后冷却至0 ℃,依次加入超纯水9.5 μL,5×AMV缓冲液5 μL,dNTPs (10 mmol/L) 2.5 μL,RNasin 1 μL和AMV反转录酶1 μL,于50 ℃反转录60 min,95 ℃ 5 min灭活反转录酶。在PCR反应管中加入超纯水34 μL,10×PCR缓冲液5 μL,反转录产物2 μL,dNTPs(10 mmol/L) 1 μL,上游引物和下游引物各1 μL,25 mmol/L MgCl2 25 μL,Pfu DNA聚合酶1 μL,其中P1、P2扩增IL-27EBI3编码基因,P3、P4扩增IL-12p35编码基因。PCR反应条件为:95 ℃ 5 min;然后95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min,冷却至4 ℃保存。对扩增产物及质粒pTS分别进行XhoⅠ和BamHⅠ双酶切,将IL-27EBI3和IL-12p35编码基因分别连入载体pTS中,形成IL-27EBI3表达载体pTES和IL-12p35的表达载体pTPS,转化大肠杆菌Top10,进行载体的扩增,提取质粒进行序列测定,确保基因的连接和序列正确,表达载体分别转化大肠杆菌BL21 star (DE3),形成稳定表达IL-27EBI3和IL-12p35的基因工程重组菌株。
| Primers | Sequences (5′-3′) |
| P1 | Sense: CCGCTCGAGAGGAAAGGGCCCCCAGCAGCTCTGA |
| P2 | Anti-sense: AATGGATCCTCACTACTTGCCCAGGCTCATTGTGGCA |
| P3 | Sense: CCGCTCGAGCGACAAAGAAACCTCCCCGTGGCCACTC |
| P4 | Anti-sense: CTAGGATCCGGAAGCATTCAGATAGCTCG |
| Note: P1 and P2 are for the amplification of gene encoding IL-27EBI3, and P3 and P4 for the amplification of IL-12p35. Xho Ⅰ and BamH Ⅰ restriction sites (Underlined) were introduced to the primers for cloning purpose. The protective bases are marked with bold. | |
将含有表达载体IL-27EBI3/pTES和含有表达载体IL-12p35/pTPS的大肠杆菌BL21 star (DE3)接种25 mL含50 μg/mL卡那霉素的LB培养基,37 ℃摇动过夜,以1:40转接于1 L含50 μg/mL卡那霉素的LB培养基,置于5 L摇瓶中于37 ℃摇动培养至OD600为0.6,加入终浓度为0.4 mmol/L的IPTG,继续培养5 h,诱导IL-27EBI3和IL-12p35的表达。培养物于4 ℃、12 000×g离心20 min,收获菌体,重悬于超声缓冲液中,超声破碎菌体,12% SDS-PAGE检测,观察目标蛋白的表达情况。目标蛋白包涵体的变性及其在变性条件下的固定化Ni2+亲和层析纯化按常规方法进行,并经12% SDS-PAGE检测。将纯化的包涵体蛋白稀释到250 μg/mL,装入适当大小的透析袋,进行逐步移除变性剂尿素的透析复性。即对100倍体积分别含4、2、1及0 mmol/L尿素的硼酸缓冲液(0.9% (W/V)硼酸,0.3% (W/V) NaOH,pH 9.6)从高到低分步透析,每个尿素浓度透析4 h,并在含2、1、0 mmol/L尿素的硼酸缓冲液中加入0.5 mol/L L-精氨酸和GSH/GSSG (1 mmol/L/ 1 mmol/L)作为复性添加剂。最后,蛋白置于100倍体积20 mmol/L Tris-HCl (pH 8.0)中透析2次,每次4 h,彻底去除残留的尿素和其他杂质,并通过0.22 μm的滤膜过滤除菌,超滤浓缩,冻干备用。
1.6 动物免疫以纯化的重组蛋白IL-27EBI3和IL-12p35作为免疫原,背部皮下分别注射5只6周龄雌性Balb/c小鼠,免疫前取血作为阴性血清对照。初次免疫剂量为100 μg/只,与等体积的弗氏完全佐剂混合乳化后免疫小鼠,之后每隔2周以相同剂量免疫原与等体积弗氏不完全佐剂混合乳化后免疫。第4次加强免疫2周后,从小鼠尾静脉少量取血,经间接ELISA检测血清抗体效价,选效价较高的小鼠于细胞融合前3天经腹腔注射免疫原100 μg加强免疫。断颈处死小鼠,按文献方法分离小鼠脾细胞[23]。
1.7 细胞融合及杂交瘤细胞的筛选将增殖期的小鼠骨髓瘤细胞SP2/0和新鲜分离的免疫小鼠的脾细胞按5:1的比例混匀,离心弃上清后加入50%的聚乙二醇进行细胞融合,然后缓慢加入RPMI-1640培养基终止反应,离心弃上清,用HAT培养基重悬细胞,铺于96孔细胞培养板,置于37 ℃、5%的CO2培养箱中培养,7 d后改用HT培养基继续培养。用重组蛋白IL-27EBI3和IL-12p35作为抗原,以不含外源基因的空表达载体转化的大肠杆菌(BL21 star (DE3))裂解液作为阴性对照,采用间接ELISA对细胞培养上清进行筛选,将阳性反应孔的杂交瘤细胞进行有限稀释克隆化培养,经多次克隆化培养,直至筛选出由单个细胞繁殖而来且ELISA反应阳性的细胞克隆。
1.8 间接ELISA用间接ELISA方法进行血清抗体效价和杂交瘤细胞培养上清抗体效价的检测。具体方法如下:以重组IL-27EBI3和IL-12p35作为检测抗原,以空表达载体转化的大肠杆菌(BL21 star (DE3))裂解蛋白作为阴性对照抗原,包被96孔ELISA板,1 μg/mL,100 μL/孔,4 ℃过夜,PBST洗板3次,5%的脱脂奶粉100 μL/孔封闭2 h,PBST洗板3次,于每孔加入倍比稀释血清或杂交瘤细胞培养上清,每稀释度3个复孔,37 ℃孵育1 h,PBST洗板3次,于每孔中加入100 μL羊抗鼠IgG (1:5 000),37 ℃孵育1 h,PBST洗板3次,于每孔中加入100 μL显色液(1 mmol/L OPD,0.016% H2O2),37 ℃避光孵育10 min,加入硫酸终止反应,酶标仪读取每孔490 nm处吸收值(OD490)。
1.9 单克隆抗体的鉴定单克隆抗体亚型的鉴定按照试剂盒说明书进行。单克隆抗体的抗原结合特异性采用Western blotting检测,具体方法如下:将5 μg不同抗原分别点样于0.45 μm硝酸纤维滤膜(美国Pall Gelman),于25 ℃静置晾干,以重组蛋白IL-27EBI3和IL-12p35为阳性对照,以不含外源基因的空表达载体转化的大肠杆菌(BL21 star (DE3))裂解液作为阴性对照;将膜浸泡于5%的脱脂牛奶中4 ℃封闭过夜,1×PBS (pH 7.4)洗膜3次;将膜浸泡于含1 μg/mL单克隆抗体的1×PBS (pH 7.4)中,37 ℃孵育2 h,1×PBS洗膜3次;将膜浸泡于含HRP标记兔抗鼠IgG (1:1 000稀释)的1×PBS (pH 7.4)中,37 ℃孵育1 h,1×PBS洗膜3次;加入DAB显色剂,待显色到理想程度,自来水冲洗终止反应。
1.10 单克隆抗体的收集与纯化对筛选出的稳定分泌目标抗体的杂交瘤细胞采用RPMI-1640完全培养基扩大培养,收集细胞培养上清,离心去除沉渣,按常规方法用Protein A柱对单抗进行纯化,纯化后的抗体对20 mmol/L Tris-HCl (pH 8.0)透析换液,超滤浓缩备用。
1.11 生物素标记抗体的制备将待标记的抗体用0.1 mol/L的碳酸盐缓冲液(pH 8.0)稀释到1 mg/mL,于2 mL蛋白质溶液中加入Suf-NHS-Biotin,使其终浓度为120 μg/mL,于25 ℃持续搅拌24 h,向反应体系中加入9.6 μL 1 mmol/L NH4Cl,于25 ℃持续搅拌10 min,将反应体系转入透析袋中,于4 ℃对1×PBS (pH 7.4)透析4 h以除去游离的生物素,将样品上Sephadex G-25凝胶层析柱,1×PBS洗脱,收集蛋白质峰,超滤浓缩备用。
1.12 双抗夹心ELISA检测IL-35方法的建立建立双抗夹心ELISA方法,即以抗IL-27EBI3的单克隆抗体作为包被抗体,捕获样品中的IL-35,以生物素化的抗IL-12p35单克隆抗体作为检测抗体,加入亲和素化的辣根过氧化物酶(Streptavidin-HRP)进行偶联和信号放大,最后加入底物TMB显色,测定450 nm处的吸光值(OD450)。首先,基于棋盘法确定最优的抗体包被浓度和生物素化抗体的工作浓度。制备抗IL-27EBI3的单克隆抗体包被量不同的3种酶联板:1 μg/孔(10 μg/mL,100 μL)、500 ng/孔(5 μg/mL,100 μL)、100 ng/孔(1 μg/mL,100 μL)。每种包被量的酶联板中加入100 μL系列浓度的IL-35 (200 pg/mL、100 pg/mL、50 pg/mL、25 pg/mL、12.5 pg/mL、6.25 pg/mL、3.12 pg/mL)。每个浓度的IL-35检测孔分别采用3种不同浓度的生物素化抗IL-12p35单克隆抗体(500 ng/mL、100 ng/mL、50 ng/mL),100 μL/孔。按常规方法进行夹心ELISA的操作,以OD450值≥0.2为阳性cutoff值,观察上述不同组合方式检测IL-35的灵敏度,确定包被抗体的最佳使用量和生物素抗体的最佳工作浓度。
1.13 定量曲线的构建以确定的最佳用量包被抗IL-27EBI3的单克隆抗体于96孔ELISA板,每孔于100 μL 0.1 mol/L碳酸盐缓冲液中,4 ℃过夜。PBST洗板3次,5%的脱脂奶粉100 μL/孔,37 ℃封闭2 h,PBST洗板3次,加入100 μL /孔系列浓度的IL-35 (400 pg/mL、200 pg/mL、100 pg/mL、50 pg/mL、25 pg/mL、12.5 pg/mL、6.25 pg/mL、3.12 pg/mL、1.56 pg/mL、0 pg/mL),37 ℃孵育2 h。PBST洗板3次,加入100 μL/孔最佳工作浓度的生物素化抗IL-12p35单克隆抗体,37 ℃孵育2 h。PBST洗板3次,加入100 μL/孔亲和素化的辣根过氧化物酶(Streptavidin-HRP),37 ℃孵育1 h。PBST洗板3次,加入100 μL/孔TMB显色液,37 ℃避光孵育10 min。加入50 μL/孔2 mol/L H2SO4终止反应,酶标仪测定450 nm吸收值(OD450),每个IL-35浓度3复孔,取平均OD450。以OD450为纵坐标,IL-35浓度为横坐标,绘制标准曲线,用GraphPad Prism进行标准曲线的拟合,确定检测的线性范围和定量方程。
1.14 灵敏度、特异性、精密度和准确度评价将各种待检细胞因子用样品稀释液(1×PBS)稀释为1 µg/mL的标准品,蛋白定量采用Bradford法。然后根据下述实验要求分别稀释成相应的质控品。用上述建立的夹心ELISA方法测定20个空白样品即样品稀释液(1×PBS)的OD450值,将测定的平均值加上2倍标准差所得的值代入定量方程,所得到的样品浓度值即为该检测方法的最低检测下限(灵敏度)。于7份样品稀释液(1×PBS)中分别添加重组IL-12p35、重组IL-27EBI3、IL-12、IL-23、IL-27、IL-6、IL-10,终浓度为20 pg/mL,每种待检细胞因子3复孔,用上述建立的夹心ELISA方法分别测定上述细胞因子浓度,取平均值,特异性用交叉反应率来表示,即实际测定浓度与实际添加浓度的比值(%)。用该方法测定IL-35的高(200 pg/mL)、中(50 pg/mL)、低(5 pg/mL) 3个浓度的质控品,每个质控品测定15次,分3批测定,每批测定5次,计算检测数据的批内相对标准偏差(Relative stardard deviation,RSD(%))和批间RSD(%),评价检测方法的精密度(重复性)。在含3.6 pg/mL IL-35的稀释样品中分别添加高、中、低浓度的IL-35,使其终浓度分别为13.6 pg/mL、43.6 pg/mL和123.6 pg/mL,用该方法对样品中的IL-35进行测定,每个浓度3个复孔,准确度用添加回收率表示,即实测浓度平均值减去原稀释品浓度的差与实际添加浓度的比值(%)。
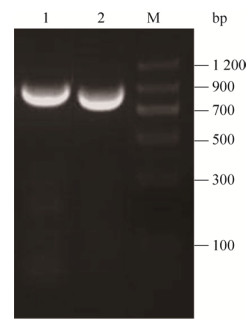
2 结果与分析 2.1 IL-27EBI3和IL-12p35的基因克隆、表达与制备如图 1所示,RT-PCR从TNF-α刺激的人脐静脉内细胞(HUVEC)扩增出IL-12p35和IL-27EBI3的编码基因,大小分别为816 bp和759 bp。扩增产物经XhoⅠ和BamHⅠ双酶切克隆至原核表达载体pTS,获得IL-27EBI3表达载体pTES和IL-12p35的表达载体pTPS (图 2A)。IL-27EBI3和IL-12p35的编码基因在强启动子T7的控制之下,经IPTG诱导在大肠杆菌中获得了高效表达,SDS-PAGE显示表达产物以包涵体的形式存在于大肠杆菌的超声沉淀中,分子质量大约为25 kDa和29 kDa,与理论大小一致(图 2B、2C)。在变性条件下,重组蛋白通过固定化的Ni2+亲和层析一步纯化可达到95%以上的纯度(图 2B、2C)。通过缓慢去除变性剂尿素的透析复性以及超滤浓缩,可以从1 L大肠杆菌培养物中获得25–30 mg的目的蛋白,浓度可达1 mg/mL。
|
| 图 1 IL-27EBI3和IL-12p35编码基因的RT-PCR克隆 Fig. 1 RT-PCR cloning of the gene encoding IL-27EBI3 and IL-12p35. M: DNA marker (bp); 1: IL-27EBI3; 2: IL-12p35. |
| |

|
| 图 2 IL-27EBI3和IL-12p35的表达与纯化 Fig. 2 Expression and purification of IL-27EBI3 and IL-12p35. (A) The construction scheme of the expression vector of IL-27EBI3 and IL-12p35. The gene encoding IL-27EBI3 and IL-12p35 was cloned into vector pTS via Xho Ⅰ and BamH Ⅰ sites, resulting in expression vectors pTES and pTPS, respectively. (B) SDS-PAGE analysis of the expression and purification of IL-27EBI3. The arrows indicate IL-27EBI3. 1: IL-27EBI3 expressed as inclusion bodies in the cytoplasm of BL21 star (DE3); 2: purification of IL-27EBI3 by Ni2+ affinity chromatograph; M: molecular mass standards (kDa). (C) SDS-PAGE analysis of the expression and purification of IL-12p35. The arrows indicate IL-12p35. 1: IL-12p35 expressed as inclusion bodies in the cytoplasm of BL21 star (DE3); 2: purification of IL-12p35 by Ni2+ affinity chromatograph; M: molecular mass standards (kDa). |
| |
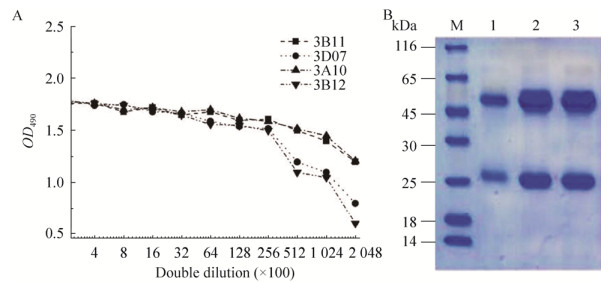
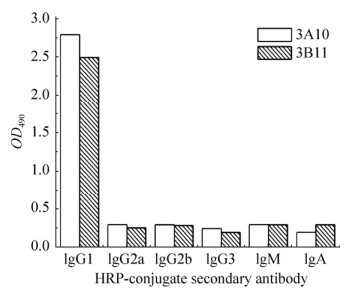
用纯化制备的重组IL-27EBI3和IL-12p35分别免疫5只雌性Balb/C小鼠,选择其中3只血清抗体效价较高的小鼠的脾细胞与SP2/0进行细胞融合,获得杂交瘤细胞。以重组IL-27EBI3和IL-12p35分别作为抗原,同时以空表达载体转化的大肠杆菌(BL21 star (DE3))裂解液作为阴性对照,用间接ELISA对杂交瘤细胞培养上清进行筛选,经多轮检测和有限稀释法克隆3次后,获得了3个稳定分泌抗IL-27EBI3单克隆抗体的细胞株3B11、3D07、3E10和3个稳定分泌抗IL-12p35单克隆抗体的细胞株3A10、3B09、3B12。在后续研究中,各单克隆抗体以其来源的细胞株命名。以重组IL-27EBI3和IL-12p35作为阳性对照,以空表达载体转化的大肠杆菌(BL21 star (DE3))裂解液作为阴性对照,Western blotting对上述细胞株分泌抗体的抗原特异性进行了鉴定(表 2)。结果表明,单抗3B11、3D07、3E10都能与重组IL-27EBI3发生免疫反应,3B11和3D07同样能与含有EBI3亚基的IL-27和IL-35发生免疫反应,与不含EBI3亚基的IL-12和IL-23不发生免疫反应,同时也不具备与IL-6和IL-10的免疫反应性,而3E10与IL-12和IL-23都具有交叉反应。单抗3A10、3B09、3B12都能与重组IL-12p35发生免疫反应,3A10和3B12同样能与含有p35亚基的IL-12和IL-35发生免疫反应,与不含p35亚基的IL-12家族成员IL-23和IL-27不发生免疫反应,同时也不具备与IL-6和IL-10的免疫反应性,而3B09与IL-23具有交叉反应。对抗原特异性较好的3B11、3D07、3A10和3B12细胞株分泌抗体的效价进行了测定(图 3A),发现单抗3B11效价高于3D07,3A10效价高于3B12,因而选取单抗3B11和3A10进行后续研究。用Protein A柱对单抗3B11和3A10进行纯化制备,通过一步亲和层析纯化,纯度可达到95%以上(图 3B)。对纯化样品进行超滤浓缩,蛋白浓度可达到2 mg/mL。依照单克隆抗体亚类鉴定试剂盒的说明,以HRP标记的羊抗鼠IgG1、IgG2a、IgG2b、IgG3、IgM和IgA的单抗为二抗,用夹心ELISA对单抗3A10和3B11进行了亚类鉴定,发现两株单抗均为IgG1 (图 4)。
| mAbs | IL-27EBI3 | IL-12p35 | IL-12 | IL-23 | IL-27 | IL-35 | IL-6 | IL-10 | BL21(DE3) lysates |
| 3B11 | + | - | - | - | + | + | - | - | - |
| 3D07 | + | - | - | - | + | + | - | - | - |
| 3E10 | + | - | + | + | + | + | - | - | - |
| 3A10 | - | + | + | - | - | + | - | - | - |
| 3B09 | - | + | + | + | - | + | - | - | - |
| 3B12 | - | + | + | - | - | + | - | - | - |
| Note: “+” means there is immunoreactivity between the mAb and antigens. “-” means there is no immunoreactivity between the mAb and antigens. Recombinant IL-27EBI3 and IL-12p35 were used as positive control and the cell lysates of BL21(DE3) transformed with the blank vector was used as negative control. | |||||||||
|
| 图 3 单克隆抗体的效价及纯化 Fig. 3 ELISA titers and purification of the mAbs. (A) The culture supernatant titers of mAbs 3B11, 3D07, 3A10 and 3B12. (B) Reduced SDS-PAGE showing purification of mAbs 3B11 and 3A10. 1: control IgG; 2: 3B11; 3: 3A10; M: molecular weight mass standards (kDa). The two bands correspond to the H chain and L chain of IgG, respectively. |
| |
|
| 图 4 单抗3A10和3B11的亚类鉴定 Fig. 4 Subtype identification of mAb 3A10 and 3B11. |
| |
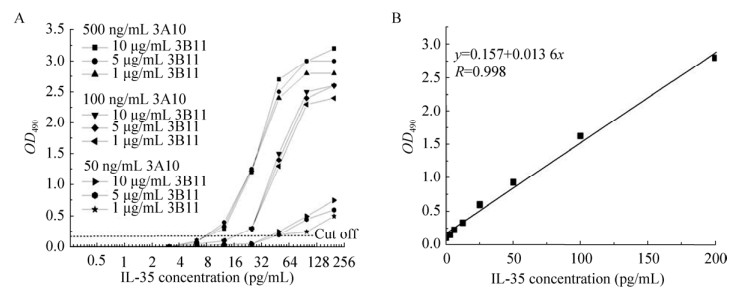
以抗IL-27EBI3的单抗3B11作为包被抗体,捕获样品中的IL-35,以生物素化的抗IL-12p35单抗3A10作为检测抗体,用Streptavidin-HRP及其底物TMB作为显色手段,建立双抗夹心检测IL-35的方法。首先,我们确定了该检测方法中包被抗体3B11和生物素化抗体3A10的最佳用量,如图 5A所示,用3种不同包被浓度的单抗3B11和3种不同浓度的生物素化单抗3A10进行组合,对系列浓度的IL-35进行了夹心ELISA检测。以IL-35浓度为横坐标,OD450为纵坐标,曲线明显分为3个群,刚好代表了生物素化单抗3A10的工作浓度,工作浓度越高,OD450越大,其对OD450值的影响远远大于单抗3B11的包被浓度。以OD450值≥0.2为阳性cutoff值,图中曲线与直线OD450为0.2交点所对应的X轴的数据即为相应条件下IL-35的最低检测浓度,可见生物素化单抗3A10的工作浓度为500 ng/mL时IL-35的检测灵敏度最高。而在同一生物素化单抗3A10用量的条件下,单抗3B11的包被浓度10 μg/mL、5 μg/mL及1 μg/mL检测的敏感性差异不大,说明单抗3B11包被浓度为1 μg/mL已足够。以确定的最佳抗体使用浓度建立标准的夹心ELISA,并对序列浓度的重组IL-35进行检测。当IL-35浓度在200 pg/mL浓度以下时,检测呈现出较好的线性,在400 pg/mL和800 pg/mL时测定值偏离线性,比理论线性值偏小,可能与IL-35在200 pg/mL时的结合达到饱和有关。选择200 pg/mL及其以下浓度与对应的OD450值作图并进行线性回归,得到了回归曲线和线性方程(图 5B),该检测方法的线性范围在1.56–200 pg/mL。
|
| 图 5 IL-35 ELISA检测方法的建立 Fig. 5 Establishment of the sandwich ELISA assay for IL-35 detection. (A) Determination of the optimal usage of 3A10 and 3B11. (B) Linear regression of IL-35 concentrations and the corresponding OD450 values obtained by the established ELISA assay. Mean values from three independent experiments are showed by the line. |
| |
按照灵敏度的测定方法,我们测定了20个空白样品即样品稀释液的OD450值,测定的平均值加上2倍标准差所得的值为0.174,代入回归方程,计算出最低检测下限为1.26 pg/mL。同时,以重组1L-12p35、重组IL-27EBI3、IL-12、IL-23、IL-27以及2个非IL-12家族细胞因子IL-6、IL-10作为待检物对该检测方法的特异性进行了评定,结果表明该检测方法与IL-12家族成员1L-12p35、IL-27EBI3、IL-12、IL-23、IL-27的交叉反应率均为0.1%,与IL-6和IL-10的交叉反应率为0.1%。最后,我们对该检测方法的精密度(重复性)和准确度进行了评定,用该方法对高(200 pg/mL)、中(50 pg/mL)、低(5 pg/mL))浓度的IL-35进行分批多次检测,计算了测定的批内差和批间差,结果见表 3,批内RSD为5.1%–5.6%,批间RSD为5.6%–7.2%,完全可以满足生物样品中IL-35的快速定量检测。用添加回收率作为准确性的评定指标,对终浓度为高(123.6 pg/mL)、中(43.6 pg/mL)、低(13.6 pg/mL)的IL-35添加品进行检测,计算出该检测方法的添加回收率(表 4)分别为103%、90%及92%。以上实验结果表明,该检测方法的各项指标都达到了定量分析的要求。
| Sample | Concentration (pg/mL) | Batch | Measured concentration (pg/mL)(n=5) | RSD (%) | |
| Intra-batch | Inter-batch | ||||
| Control materials | 200 | 1 | 196±11 | 5.6 | 7.2 |
| 2 | 189±10 | 5.3 | |||
| 3 | 193±10 | 5.2 | |||
| 50 | 1 | 48.5±2.5 | 5.2 | 6.5 | |
| 2 | 47.7±2.6 | 5.4 | |||
| 3 | 44.3±2.5 | 5.6 | |||
| 5 | 1 | 4.76±0.26 | 5.5 | 5.6 | |
| 2 | 4.68±0.25 | 5.3 | |||
| 3 | 4.80±0.24 | 5.1 | |||
| Sample concentration(pg/mL) | Added concentration(pg/mL) | Final concentration (pg/mL) | Measured concentration(pg/mL) | Recovery concentration(pg/mL) | Recovery (%) |
| 3.6 | 10 | 13.6 | 14.0±0.7 | 10.4 | 104 |
| 40 | 43.6 | 39.6±2.0 | 36.0 | 90 | |
| 120 | 123.6 | 114.0±6.6 | 110.4 | 92 |
IL-35是IL-12家族的一个新型细胞因子,由Collison等于2007年最先发现并确认[1]。IL-12家族一共有4个成员,即IL-12、IL-23、IL-27和IL-35。这4个细胞因子均为异质二聚体,均由一个螺旋束样细胞因子亚单位(p35、p19、p28)和一个可溶性细胞因子受体样亚单位(p40和EBI3)组成。
35、p19、p28具有同源性,EBI3和p40具有同源性,其中p35和p40组成IL-12,p19和p40组成IL-23,p28和EBI3组成IL-27,p35和EBI3组成IL-35[3]。IL-12家族成员的这种结构特征和同源性决定了它们在免疫检测上的复杂性,如果用完整的细胞因子进行免疫制备单克隆抗体,很有可能筛选到抗同一亚单位的两株抗体,而这一亚单位可能会在两种细胞因子同时存在(如p40、EBI3),因而应用这两株单抗进行夹心ELISA检测时会出现两种细胞因子的交叉反应。为了降低出现交叉反应的可能性,我们采用了细胞因子亚单位分别进行免疫的策略,用基因工程方法,制备了IL-35两个亚单位IL-27EBI3和IL-12p35的重组蛋白,以重组蛋白作为免疫原,制备各自的单克隆抗体,再用抗EBI3和抗p35的单抗进行夹心ELISA检测IL-35,这就在很大程度上避免了IL-12家族中其他成员的交叉反应。但是,我们还要考虑到p35、p19、p28之间的同源性和p40、EBI3之间的同源性,如EBI3与p40具有27%的氨基酸同源性,而且空间结构极为相似,两者具有相似的空间抗原表位,EBI3刺激产生的抗体有可能与p40发生交叉反应。因而在本研究中,对用重组EBI3和p35作为抗原筛选出的单克隆抗体株还需作进一步的特异性鉴定,以确定其是否与IL-12家族的其他成员之间具有交叉反应。我们发现抗EBI3的单抗3E10与IL-12和IL-23都具有交叉反应,抗p35的单抗3B09与IL-23具有交叉反应,这种交叉反应的单抗在筛选的3株抗p35和3株抗EBI3单抗中各有1株,所占比率不小,但是否确实是与p40亚基或p19亚基发生交叉反应还有待进一步证实。利用鉴定出的特异性较好的单抗3A10和3B11建立的夹心ELISA与IL-12家族的另外3个成员IL-12、IL-23、IL-27的交叉反应率均为0.1%,在检测上能有效地排除同家族中其他3个细胞因子成员的干扰,说明用IL-12家族的其他细胞因子成员对制备单抗的特异性作进一步鉴定显得尤为重要,是筛选出特异性检测抗体的关键。本研究制备IL-12家族细胞因子的特异性检测抗体的思路和方法可为其他家族细胞因子检测抗体的制备提供一定的借鉴和参考。
IL-35结构上与其他IL-12家族成员相似,但其表达和分泌方式却不同,小鼠IL-35组成型表达于CD4+CD25+Foxp3+Treg,而人类CD4+CD25+ Foxp3+Treg却不能组成型表达IL-35,其表达需要炎症信号的刺激[4, 24]。不仅如此,人类胸腺、淋巴结、扁桃体及外周血来源的T细胞亚群,包括效应性T细胞,幼稚或记忆CD4+ T细胞及γδT细胞均不组成型表达IL-35[25]。IL-35的这种表达方式给其两个亚基p35和EBI3的基因克隆带来了困难。最近Li等[25]的研究表明,IL-35除了表达于炎症信号刺激的T细胞系外,还可表达于炎性因子(TNF-α、IL-1β、IFN-γ)刺激的血管内皮细胞、主动脉平滑肌细胞及单核细胞等非T细胞系。本研究中,在体外培养了人脐静脉内皮细胞(HUEVC),用TNF-α进行刺激,利用RT-PCR成功克隆了IL-35两个亚基p35和EBI3的编码基因,为后续p35和EBI3的重组蛋白和单抗的制备提供了有力保障。HUEVCs可通过胰酶灌注新生儿脐带制备单细胞悬液而获得,来源较为丰富,容易获得。其次,HUEVCs在体外容易进行原代培养,用ECM培养基常规培养就可以获得大量细胞。尽管目前还没有在炎性刺激的HUEVCs细胞中克隆IL-35编码基因的报道,但HUEVCs的获得和培养比CD4+CD25+Foxp3+ Treg的获得和培养更为容易。我们认为,炎症因子刺激的HUEVCs可作为IL-35编码基因来源的一个重要模式细胞。
目前,国内还没有自主研发的IL-35检测试剂盒,主要依赖于进口。鉴于IL-35生物学功能以及其与多种疾病的相互关系还有待进一步的深入研究,研发其检测试剂盒显得尤为重要。我们用单抗杂交瘤技术制备了IL-35的单克隆抗体,建立了双抗夹心的ELISA检测方法,该方法的灵密度、特异性、精密度和准确度都达到了定量分析的要求,为组装成IL-35 ELISA检测试剂盒打下了坚实的基础。我们将进一步寻求维持该检测方法中涉及到的各种试剂和蛋白的稳定性及有效保存方法,并在临床和科研标本中进行大批量的预试和性能评定,力争组装成具有自主知识产权的IL-35检测试剂盒。该方法不仅操作简便,检测成本低,而且可较短时间内完成IL-35的定量分析,值得在高校、科研院所和医疗单位推荐使用。
| [1] |
Collison LW, Workman CJ, Kuo TT, et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function. Nature, 2007, 450(7169): 566-569. DOI:10.1038/nature06306 |
| [2] |
Collison LW, Chaturvedi V, Henderson AL, et al. IL-35-mediated induction of a potent regulatory T cell population. Nat Immunol, 2010, 11(12): 1093-1101. DOI:10.1038/ni.1952 |
| [3] |
Collison LW, Vignali DAA. Interleukin-35: odd one out or part of the family?. Immunol Rev, 2008, 226(1): 248-262. |
| [4] |
Chaturvedi V, Collison LW, Guy CS, et al. Cutting edge: human regulatory T cells require IL-35 to mediate suppression and infectious tolerance. J Immunol, 2011, 186(12): 6661-6666. DOI:10.4049/jimmunol.1100315 |
| [5] |
Teymouri M, Pirro M, Fallarino F, et al. IL-35, a hallmark of immune-regulation in cancer progression, chronic infections and inflammatory diseases. Int J Cancer, 2018, 143(9): 2105-2115. DOI:10.1002/ijc.31382 |
| [6] |
Xue WH, Yan D, Kan QC. Interleukin-35 as an emerging player in tumor microenvironment. J Cancer, 2019, 10(9): 2074-2082. DOI:10.7150/jca.29170 |
| [7] |
Su LC, Liu XY, Huang AF, et al. Emerging role of IL-35 in inflammatory autoimmune diseases. Autoimmun Rev, 2018, 17(7): 665-673. DOI:10.1016/j.autrev.2018.01.017 |
| [8] |
Vieyra-Lobato MR, Vela-Ojeda J, Montiel-Cervantes L, et al. Description of CD8+ regulatory T lymphocytes and their specific intervention in graft-versus-host and infectious diseases, autoimmunity, and cancer. J Immunol Res, 2018, 2018: 3758713. |
| [9] |
Branchett WJ, Lloyd CM. Regulatory cytokine function in the respiratory tract. Mucosal Immunol, 2019, 12(3): 589-600. DOI:10.1038/s41385-019-0158-0 |
| [10] |
Wang ZH, Liu JQ, Liu ZZ, et al. Tumor-derived IL-35 promotes tumor growth by enhancing myeloid cell accumulation and angiogenesis. J Immunol, 2013, 190(5): 2415-2423. DOI:10.4049/jimmunol.1202535 |
| [11] |
Niedbala W, Wei XQ, Cai BL, et al. IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells. Eur J Immunol, 2007, 37(11): 3021-3029. DOI:10.1002/eji.200737810 |
| [12] |
Kochetkova I, Golden S, Holderness K, et al. IL-35 stimulation of CD39+ regulatory T cells confers protection against collagen Ⅱ-induced arthritis via the production of IL-10. J Immunol, 2010, 184(12): 7144-7153. DOI:10.4049/jimmunol.0902739 |
| [13] |
Nishino R, Takano A, Oshita H, et al. Identification of Epstein-Barr virus-induced gene 3 as a novel serum and tissue biomarker and a therapeutic target for lung cancer. Clin Cancer Res, 2011, 17(19): 6272-6286. DOI:10.1158/1078-0432.CCR-11-0060 |
| [14] |
Zeng JC, Zhang Z, Li TY, et al. Assessing the role of IL-35 in colorectal cancer progression and prognosis. Int J Clin Exp Pathol, 2013, 6(9): 1806-1816. |
| [15] |
Gu XB, Tian T, Zhang B, et al. Elevated plasma interleukin-35 levels predict poor prognosis in patients with non-small cell lung cancer. Tumour Biol, 2015, 36(4): 2651-2656. DOI:10.1007/s13277-014-2887-8 |
| [16] |
Zhang YQ, Sun H, Wu H, et al. Interleukin 35 is an independent prognostic factor and a therapeutic target for nasopharyngeal carcinoma. Contemp Oncol (Pozn), 2015, 19(2): 120-124. |
| [17] |
Liang YF, Chen QQ, Du WJ, et al. Epstein-Barr virus-induced gene 3 (EBI3) blocking leads to induce antitumor cytotoxic T lymphocyte response and suppress tumor growth in colorectal cancer by bidirectional reciprocal-regulation STAT3 signaling pathway. Mediators Inflamm, 2016, 2016: 3214105. |
| [18] |
Jin P, Ren H, Sun W, et al. Circulating IL-35 in pancreatic ductal adenocarcinoma patients. Hum Immunol, 2014, 75(1): 29-33. DOI:10.1016/j.humimm.2013.09.018 |
| [19] |
Ning XW, Jian ZJ, Wang W. Low serum levels of interleukin 35 in patients with rheumatoid arthritis. Tohoku J Exp Med, 2015, 237(2): 77-82. DOI:10.1620/tjem.237.77 |
| [20] |
Boissier MC, Assier E, Biton J, et al. Regulatory T cells (Treg) in rheumatoid arthritis. Joint Bone Spine, 2009, 76(1): 10-14. DOI:10.1016/j.jbspin.2008.08.002 |
| [21] |
Cheng ST, Yuan D, Liu Y, et al. Interleukin-35 level is reduced in patients with chronic Hepatitis B virus infection. Int J Med Sci, 2018, 15(2): 188-194. DOI:10.7150/ijms.21957 |
| [22] |
Tsuda M, Zhang WC, Yang GX, et al. Deletion of interleukin(IL)-12p35 induces liver fibrosis in dominant-negative TGF-β receptor type Ⅱ mice. Hepatology, 2013, 57(2): 806-816. DOI:10.1002/hep.25829 |
| [23] |
Sharafi SM, Shirzad H, Khanahmad H, et al. Monoclonal antibodies production against a 40 kDa band of hydatid cyst fluid. Recent Pat Biotechnol, 2018, 12(1): 57-64. |
| [24] |
Bardel E, Larousserie F, Charlot-Rabiega P, et al. Human CD4+CD25+Foxp3+ regulatory T cells do not constitutively express IL-35. J Immunol, 2008, 181(10): 6898-6905. DOI:10.4049/jimmunol.181.10.6898 |
| [25] |
Li XY, Mai JT, Virtue A, et al. IL-35 is a novel responsive anti-inflammatory cytokine—a new system of categorizing anti-inflammatory cytokines. PLoS ONE, 2012, 7(3): e33628. DOI:10.1371/journal.pone.0033628 |
 2019, Vol. 35
2019, Vol. 35




