中国科学院微生物研究所、中国微生物学会主办
文章信息
- 肖芳斌, 刘瑞, 占忠旭, 张干, 吴鑫, 许恒毅
- Xiao Fangbin, Liu Rui, Zhan Zhongxu, Zhang Gan, Wu Xin, Xu Hengyi
- 生物传感器在食源性致病菌检测中应用的研究进展
- Research progress of biosensors in the detection of foodborne pathogens
- 生物工程学报, 2019, 35(9): 1581-1589
- Chinese Journal of Biotechnology, 2019, 35(9): 1581-1589
- 10.13345/j.cjb.190048
-
文章历史
- Received: January 24, 2019
- Accepted: April 23, 2019
- Published: April 28, 2019
2. 江西省食品检验检测研究院,江西 南昌 330001
2. Jiangxi Institute For Food Control, Nanchang 330001, Jiangxi, China
据世界卫生组织(World health organization,WHO)调查结果显示,食源性疾病是世界范围内发病率和死亡率都较高的疾病,每年造成数百万次感染,给社会经济发展造成重大障碍。引起食源性疾病的主要原因是食源性致病菌[1],它们在生长代谢过程中会将其代谢产物甚至毒素分泌到环境中,在食品加工、储存、运输和销售过程中均能够造成食品污染,从而导致人类患病。因此,检测食源性致病菌对降低食源性疾病发病率具有重要意义。然而传统的食源性致病菌检测方法步骤繁琐、耗时长,难以在短时间内得出结果[2]。为了有效预防食源性致病菌引起的疾病、保证食品安全,快速有效的食源性致病菌检测方法亟需建立。生物传感器是一种便携、小型的分析装置,具备分析速度快、可在线检测和简单易操作等优点[3],是食源性致病菌快速检测方法的重要发展方向之一。本文综述了生物传感器技术的基本原理及其在食源性致病菌检测中应用的研究进展,以期为研发基于生物传感器技术的食源性致病菌检测方法提供参考。笔者团队在前期工作中,建立了多种食源性致病菌检测方法[4-6],并取得了积极的研究进展。
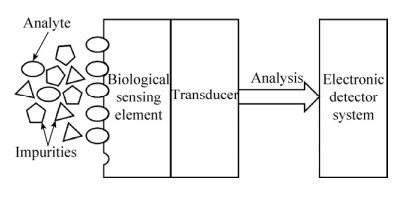
1 生物传感器简介生物传感器是一类用于检测特定分析物的分析设备,通常由生物识别元件、换能器和电子检测器系统组成。生物识别元件是生物传感器的关键,其主要可以分为6类,包括抗原/抗体、酶、核酸、细胞受体、仿生受体和噬菌体[7-9],其作用是识别并捕获目标分析物。换能器是一种基于电化学、光学、压电、磁力和温度等一种或多种技术结合而设计成的信号转换器,用于将生物识别元件捕获目标分析物后产生的生物信号转换为可测量的电子信号。电子检测器系统的作用是将换能器转换成的信号进行处理和分析,从而得到实验分析数据。生物传感器的原理如图 1所示,首先生物识别元件识别目标分析物,然后通过换能器将生物识别元件捕获目标分析物后发生的反应转换成等效的电子信号,最后由电子检测器系统将信号进行处理和分析,从而得到分析结果[10]。在诸多生物传感器中,电化学生物传感器(Electrochemical biosensor)、表面等离子体共振生物传感器(Surface plasmon resonance biosensor,SPR biosensor)、荧光生物传感器(Fluorescence biosensor)、生物发光生物传感器(Bioluminescence biosensor)、表面增强拉曼散射生物传感器(Surface-enhanced raman scattering biosensor,SERS biosensor)和化学发光生物传感器(Chemiluminescence biosensor)等广泛用于食源性致病菌的检测。表 1概括了常见的生物传感器在食源性致病菌检测中的应用。
|
| 图 1 生物传感器原理示意图 Fig. 1 Schematic diagram of biosensor. |
| |
| Method | Target pathogen | Samples | Detection limit | Reference |
| Electrochemical biosensor based on nanoporous gold and EIS | Salmonella typhimurium | PBS | 1 CUF/mL | [11] |
| Microfluidic-based electrochemical sensor | Escherichia coli | Water | 50 CUF/mL | [12] |
| SPR-pCBAA biosensor | Escherichia coli O157:H7 | Cucumber | 57 CUF/mL | [13] |
| SPR imaging biosensor | Salmonella | Chicken | 7.6×106 CUF/mL | [14] |
| Fluorescence biosensor based on SDA and silver nanocluster | Salmonella typhimurium | PBS | 50 CUF/mL | [15] |
| Fluorescence biosensor based on magnetic separation and QDs | Escherichia coli O157:H7 | PBS | 14 CUF/mL | [16] |
| Phage-mediated bioluminescence biosensor | Bacillus anthracis | Beef | 3.2×102 CFU/g | [17] |
| Microfluidic-based ATP bioluminescence biosensor | Escherichia coli O157:H7 | Water | 1×104 CUF/mL | [18] |
| SERS biosensor based on DNA-assembled gold nanodimers | Salmonella typhimurium | Broth medium | 35 CUF/mL | [19] |
| SERS aptasensor based on spiny gold nanoparticles | Salmonella typhimurium | PBS | 4 CUF/mL | [20] |
| Electrochemiluminscence immunosensor based on GO | Vibrio parahaemolyticus | Seafood | 5 CFU/g | [21] |
| Sandwich chemiluminescence biosensor | Streptococcus mutans | Buffer | 23 CUF/mL | [22] |
| QCM biosensor based on DNA aptamers | Escherichia coli | PBS | 1.46×103 CUF/mL | [23] |
| Label-free fiber optic biosensor | Salmonella typhimurium | PBS | 2.47×102 CFU/mL | [24] |
| EIS is electrochemical impedance spectroscopy, PBS is phosphate buffer saline, pCBAA is poly(carboxybetaine acrylamide), SDA is strand displacement amplification, QDs is quantum dots, ATP is adenosine triphosphate, GO is graphene oxide, QCM is quartz crystal microbalance. | ||||
电化学生物传感器是应用于食源性致病菌检测中较为广泛的一类生物传感器,其原理是生物识别元件捕获目标分析物后引起生物传感器表面发生电流、电位、阻抗或电导变化,通过监测这些参数的变化来定量目标分析物的浓度。电化学生物传感器具有便携、体型小和成本低的特点,能够实现目标物的简单、灵敏和高选择性分析[25],已成为食源性致病菌快速检测的重要手段。Zhang等[25]设计了一种基于16S rDNA的纳米间隙网络电化学生物传感器用于快速检测大肠杆菌,采用非天然的核酸类似物(肽核酸)与大肠杆菌的16S rDNA杂交,再加入辣根过氧化物酶(Horseradish peroxidase,HRP)修饰的核酸探针与16S rDNA杂交,形成类似于双抗夹心模式,从而将HRP固定在电极表面。加入苯胺/H2O2缓冲液,再用氯化氢蒸汽进行掺杂处理,通过聚苯胺沉积引起电导变化,从而实现大肠杆菌的定量检测。结果表明该方法的检测时间小于3 h,在缓冲溶液中的检测限为1×102 CFU/mL。Ranjbar等[26]建立了金纳米粒子/碳纳米粒子/纤维素纳米纤维复合材料(Au nanoparticles/carbon nanoparticles/cellulose nanofibers nanocomposite,AuNPs/CNPs/CNFs)结合适配体的电化学生物传感器用于超灵敏检测金黄色葡萄球菌,适配体是一种经体外筛选得到的单链DNA或RNA分子,通过缠绕目标物形成独特的三维结构来特异性地识别和捕获目标分析物[27]。将AuNPs/CNPs/CNFs纳米复合材料覆盖在玻碳电极(Glassy carbon electrode,GCE)表面,在Au-S键作用下将适配体修饰在AuNPs/CNPs/CNFs/GCE的表面。适配体捕获金黄色葡萄球菌后,引起电极表面的阻抗发生变化,通过监测阻抗变化从而实现对金黄色葡萄球菌的定量检测。该生物传感器对PBS中金黄色葡萄球菌的检测限低至1 CFU/mL,在人体血清样品中回收率达87.5%– 113.3%。电化学生物传感器是目前发展较为迅速的一类生物传感器,与其他生物传感器相比,具有样品浊度限制小和操作简单的优势,面对复杂的食品样品依然具有优异的分析能力,结合芯片实验室技术可将装置小型化[28]。
2.2 表面等离子体共振生物传感器SPR是一种基于金属薄膜的物理光学现象,当光在棱镜与金属膜表面上发生全反射时,形成的消逝波与介质表面等离子波发生共振,从而引起反射光强度的大幅度减弱。这种光学现象会受到介质界面折射率的影响,SPR生物传感器正是基于这一原理,将生物识别分子结合在金属表面,通过影响SPR现象来实现检测的目的[29]。SPR生物传感器具有免标记、灵敏度高和检测速度快等优点,在食源致病菌检测领域具有较好的应用前景。Zhou等[30]建立了一种基于纳米银-还原氧化石墨烯(Silver nanoparticles-reduced graphene oxide,AgNPs-rGO)结合抗菌肽(Antimicrobial peptides,AMP)的SPR生物传感器用于检测水和果汁中大肠杆菌O157:H7,AMP是一种具有抗菌活性的多肽物质,它可以选择性地识别大肠杆菌O157:H7生物膜表面的脂多糖,并结合在其表面。通过化学方法在AgNPs-rGO表面覆盖一层薄金膜,以增强SPR信号,并通过Au-S键的作用将AMP固定在光纤膜上用于捕获大肠杆菌O157:H7。当大肠杆菌O157:H7被捕获时,光纤表面的等离子体吸收峰发生移动,通过对吸收峰变化的监测来实现对大肠杆菌O157:H7的检测。该方法对肉汤培养液中大肠杆菌O157:H7的检测限为5×102 CFU/mL,在加标(未污染的样品中加入特定浓度的细菌)的水和果汁中大肠杆菌O157:H7的回收率为88%–110%。Liu等[31]采用抗体功能化的免疫磁珠(Immunomagnetic beads,IMNB)建立了一种夹心免疫测定法来检测蛋壳中的肠炎沙门氏菌,功能化的免疫磁珠既可特异性识别肠炎沙门氏菌,又可以增强表面等离子体检测信号。通过外部磁场的作用富集肠炎沙门氏菌,将肠炎沙门氏菌-IMNB复合物直接流过经抗体修饰的金芯片表面,复合物与芯片上的抗体结合形成双抗夹心模式捕获肠炎沙门氏菌,免疫磁珠通过影响金片的折射率而引起SPR信号变化。该方法在PBS中检测限低至14 CFU/mL,在蛋壳样品提取液中的回收率为92.76%–113.25%。SPR生物传感器是食源性致病菌检测中应用较多的一类生物传感器,然而细菌细胞质与水的折射率相似,在一定程度上限制了检测的准确性,且SPR生物传感器在实验室测试中仍需要大型的设备,后期研究可与微流控技术相结合来减小设备尺寸和降低检测的复杂性[32]。
2.3 荧光生物传感器荧光生物传感器是指通过荧光染料、QDs或其他具有荧光效应的材料“标记”被检测物体,并以荧光信号为检测信号的一类生物传感器。相比电化学生物传感器,荧光生物传感器设备简单且响应速度快,结合新型纳米材料能消除背景荧光,提升信噪比[33]。Wang等[34]运用多色镧系元素掺杂的时间分辨荧光(Time-resolved fluorescence,TRFL)生物传感器用于检测金黄色葡萄球菌和鼠伤寒沙门氏菌,将针对金黄色葡萄球菌和鼠伤寒沙门氏菌特异性的适配体修饰在NaYF4:Ce/Tb和NaGdF4:Eu纳米材料上用于识别金黄色葡萄球菌和鼠伤寒沙门氏菌,并将两种适配体修饰在纳米磁珠上用于捕获金黄色葡萄球菌和鼠伤寒沙门氏菌。加入样品后,适配体与菌结合从而形成既带有荧光纳米材料又带有磁性纳米颗粒的复合物,经过磁分离作用后,对复合物的荧光进行检测以实现对这两种致病菌的定量检测。结果表明该方法对PBS中金黄色葡萄球菌和鼠伤寒沙门氏菌的检测限分别为20 CFU/mL和15 CFU/mL,在加标的牛奶样品中的检测也显示出了优异的分析性能。Hu等[35]设计了一种纳米荧光微球的双抗夹心模式用于快速检测大肠杆菌O157:H7,通过化学方法将荧光素固定于SiO2纳米微球内,并将针对大肠杆菌O157:H7特异性的抗体修饰于磁珠和SiO2纳米微球表面,从而用于识别和捕获大肠杆菌O157:H7。通过磁分离富集后加入NaOH以释放SiO2微球中的荧光素来反映大肠杆菌O157:H7的浓度。在最优条件下该方法在PBS中的检测限低至3 CFU/mL,且检测时间可在75 min内完成,牛奶、橙汁和水中的加标回收率为90.47%–117.32%。荧光生物传感器功能强大、灵敏度较高,适用于检测浓度较低的分析物,实际检测应用中常以试剂盒和试纸条的形式存在。
2.4 生物发光生物传感器生物发光是指生物体内的物质在酶的作用下将化学能转化为光能的现象,其中应用较广泛且灵敏度较高的是ATP生物发光。微生物在特定的生长阶段ATP含量是稳定的,ATP生物发光传感器正是在这一基础上建立的一种通过荧光信号来测定微生物ATP含量从而定量微生物的方法。该方法的核心是荧光素在Mg2+和O2的作用下被荧光素酶催化并氧化成激发态,产生荧光[36],根据此设计的ATP生物传感器具有灵敏度高和在线检测的特点。Zhang等[37]建立一种ATP生物发光生物传感器用于检测食品基质中的大肠杆菌,抗体修饰的纳米磁珠特异性识别大肠杆菌,在外部磁场的作用下富集,加入细胞裂解试剂分解细胞壁以释放ATP,并在荧光反应试剂(Fluorescence reaction reagent,FRR)作用下产生荧光实现检测,该方法可在20 min内实现检测,在PBS中的检测限为3×102 CFU/mL。同时,该生物传感器适用于各种食品样品,液体样品直接过滤,固体样品经粉碎后过滤,加入生物传感器中即可自动检测。Kim等[38]建立了光热裂解ATP生物发光生物传感器用于快速、灵敏地检测多种致病菌,在金纳米棒上修饰不同的抗体,用于识别不同致病菌,然后运用近红外辐射(Near-infrared irradiation,NIR)技术引起的局部加热选择性地靶向裂解致病菌以释放ATP,最后通过便携式发光计测量发光强度来实现对多种致病菌的检测。相比上述ATP生物发光法,该方法经过NIR技术处理后灵敏度显著提高,对PBS中大肠杆菌O157:H7、鼠伤寒沙门氏菌和单增李斯特菌的检测限分别为12.7、70.7、5.9 CFU/mL,并且在人工接种的塑料砧板上成功检测到细菌,具有较大的应用潜力。生物发光生物传感器具有检测速度快、灵敏度高的特点,然而实际样品基质复杂,一定程度上影响了准确性。通过磁分离技术预富集细菌,降低杂质的影响,将改善检测的准确性。
2.5 表面增强拉曼散射生物传感器拉曼光谱是指单色光照射在一些物质上时,光子与物质分子发生碰撞,光在散射后频率发生变化而产生的散射光谱,而SERS是指将物质分子吸附在金属或纳米粒子表面时,拉曼信号增强的现象,SERS比普通的拉曼散射具有更高的灵敏度,可实现单分子检测[39]。Zhang等[40]运用SERS技术同时检测鼠伤寒沙门氏菌和金黄色葡萄球菌,将针对两种致病菌的适配体和不同的拉曼信号分子修饰于金纳米粒子表面,同时将两种适配体修饰在纳米磁珠上作为捕获元件。当加入待测菌后,适配体与目标菌特异性结合,形成夹心结构,经过磁分离富集后,通过读取不同的拉曼信号来定量检测两种致病菌。该方法可在3 h内完成检测,对PBS中鼠伤寒沙门氏菌和金黄色葡萄球菌的检测限分别为15 CFU/mL和35 CFU/mL,在加标的猪肉样品中的回收率为94.12%–108.33%。Duan等[41]建立了基于金核银壳纳米材料结合SERS技术用于检测鼠伤寒沙门氏菌,将适配体同时修饰在金核银壳纳米粒子和X-罗丹明上用于结合鼠伤寒沙门氏菌。当反应体系中鼠伤寒沙门氏菌逐渐增加时,金核银壳纳米粒子和X-罗丹明更多地结合鼠伤寒沙门氏菌,信号探针增加,从而拉曼散射强度增强。通过对拉曼散射信号的监测来实现对鼠伤寒沙门氏菌的定量检测,结果表明该方法在结合缓冲溶液中的检测限为15 CFU/mL,在牛奶样品中的加标回收率为96.7%–99.8%。SERS是拉曼光谱和纳米技术的结合,已有研究报道通过金属阳离子与细菌表面的静电相互作用作为沉积纳米粒子的驱动力,可在10 min内完成细菌检测[42]。目前SERS生物传感器存在的问题是缺乏简单和小型化的仪器,后期研究可结合微流控技术来达到缩小设备尺寸的目的。
2.6 化学发光生物传感器化学发光是指在化学反应过程中,物质分子吸收化学能而产生光辐射的现象,由于能量是通过化学反应产生的,并且样品辐射不需要激发,所以化学发光法可以避免光散射、光源不稳定和高背景的干扰[43]。因此,以化学发光反应为换能反应的化学发光生物传感器倍受欢迎。Hao等[43]设计了基于滚环扩增(Rolling circle amplification,RCA)的化学发光生物传感器用于检测金黄色葡萄球菌,实验中采用特异性的适配体作为生物识别元件,用于识别金黄色葡萄球菌,Co2+增强的异鲁米诺(N-(aminohexyl)-N-(ethylisoluminol),ABEI)功能性花状金纳米颗粒(Co2+/ABEI-AuNF)作为化学发光供体。金黄色葡萄球菌与RCA引物竞争结合适配体,从而释放RCA引物,引发RCA反应,生成大量单链DNA与信号探针(Co2+/ABEI– AuNFs-cDNA)结合,从而使大量的信号探针脱离WS2纳米片,减弱了WS2纳米片金纳米颗粒化学发光的猝灭。结果表明该方法对PBS中金黄色葡萄球菌的检测限为15 CFU/mL,在猪肉样品中的加标回收率为94.7%–102.0%。Xiong等[44]构建了一种基于免疫球蛋白G (Immunoglobulin G,IgG)与葡萄球菌蛋白A (Staphylococcal protein A,SPA)特异性识别的化学发光生物传感器用于金黄色葡萄球菌的检测,SPA修饰的磁珠与携带SPA的金黄色葡萄球菌竞争结合HRP标记的IgG,通过竞争性结合和磁分离后,加入H2O2与磁珠上的HRP反应,通过磁珠上的化学发光信号定量金黄色葡萄球菌。该方法可在50 min内完成对金黄色葡萄球菌的检测,在PBS中的检测限低至6 CFU/mL,在苹果汁中的加标回收率为85%– 107%。化学发光作为一种强大的分析技术,具备建立小型化分析设备的潜力,已有研究报道化学发光生物传感器用于单增李斯特菌的检测,然而灵敏度有待提高[45],后期研究可结合纳米技术来提高检测的灵敏度。
2.7 其他生物传感器随着生物技术的不断发展,越来越多新型生物传感器应用到食源性致病菌的检测。压电生物传感器是指基于压电效应设计的生物传感器,其典型代表是QCM。将抗体或抗原结合在QCM传感器表面,目标物与抗原或抗体结合,引起晶体的质量增加,根据晶体沉积质量与其振动频率响应之间的线性关系,即可灵敏地检测微量分析物。Masdor等[46]设计纳米粒子增强的QCM生物传感器用于检测空肠弯曲杆菌,通过晶体表面固定的抗体来特异性识别空肠弯曲杆菌,并与之结合,再加入抗体修饰的金纳米粒子与目标菌结合,形成双抗夹心模式,从而增加了晶体表面结合物的质量,该方法在PBS中的空肠弯曲杆菌的检测限为1.5×102 CFU/mL。基于压电效应设计的生物传感器具有较高的灵敏度,但目前在食源性致病菌检测领域应用较少。
光纤生物传感器是由光纤衍生出来的装置,通过光纤传导和收集光信号进行生物检测。Kaushik等[24]建立了一种无标记光纤生物传感器用于检测鼠伤寒沙门氏菌,当鼠伤寒沙门氏菌样品通过固定有抗体的传感器平台时,由于特异性抗体-抗原复合物的形成导致样品的折射率发生改变,多模干涉受到影响,透射光谱的衰减峰强度和波长发生变化,通过测量中心波长的改变来实现鼠伤寒沙门氏菌的检测。该方法可在20 min内完成对鼠伤寒沙门氏菌的检测,在PBS中的检测限达2.47×102 CFU/mL。光纤生物传感器能快速检测食源性致病菌,但在长期稳定性和设备小型化方面,仍需进一步研究。
3 讨论生物传感器技术经过几十年的发展,已经成为一种有效的分析工具,在食源性致病菌检测领域发挥着越来越重要的作用。生物传感器各有特点,如检测速度快、灵敏度高和操作简单。然而,生物传感器技术仍然存在一些问题需要进一步改进:1)生物识别元件的稳定性方面:生物传感器表面的生物识别元件易失活,在设计生物传感器时,改善生物识别元件易变性(如提高热稳定性、防止酶失活和防止核酸降解等)一直是研究的热点。采用一些新型的生物识别元素如分子印迹聚合物、纳米材料将改善生物识别元件的稳定性。2)生物识别的特异性方面:生物传感器是建立在生物分子特异性识别的基础上,然而某些非特异性吸附会影响检测结果的准确性。目前使用的生物识别元件种类有限,开发多样化的生物受体有利于提高生物识别的特异性。3)生物传感器的功能性方面:区分活细胞和死细胞是生物传感器的一个关键点,食源性致病菌的危害性与其在食物和人体中的增长潜力有关,目前只有少数研究工作注意到了此问题,采用细胞受体或噬菌体作为生物识别元件可以有效地区分活细胞和死细胞。4)生物传感器的适用性方面:不同的工作条件(如样品的温度、pH、离子强度和粘度等)对生物传感器的应用将产生较大的影响,且实际食品样品基质复杂,细菌的数量通常为低水平。运用免疫磁珠和噬菌体分离技术可去除基质干扰,富集细菌,对提高生物传感器的适用性具有重要意义。
4 展望食源性致病菌是影响食品安全的重要因素,如何简便、高效和灵敏地检测食品中的食源性致病菌一直是研究者们关注的热点。理想的生物传感器应具备检测时间短、设备小巧易携带、特异性强、灵敏度高、可重复使用和操作简单等特点。相信随着技术水平的不断提高,将生物传感器与纳米技术或其他学科技术相结合,将大大提高生物传感器的可靠性,使生物传感器技术得到更广泛和实际的应用。
| [1] |
Scallan E, Hoekstra RM, Angulo FJ, et al. Foodborne illness acquired in the United States—major pathogens. Emerg Infect Dis, 2011, 17(1): 7-15. DOI:10.3201/eid1701.P11101 |
| [2] |
Yamada K, Choi W, Lee I, et al. Rapid detection of multiple foodborne pathogens using a nanoparticle-functionalized multi-junction biosensor. Biosens Bioelectron, 2016, 77: 137-143. DOI:10.1016/j.bios.2015.09.030 |
| [3] |
Cardoso AR, Cabral-Miranda G, Reyes-Sandoval A, et al. Detecting circulating antibodies by controlled surface modification with specific target proteins: application to malaria. Biosens Bioelectron, 2017, 91: 833-841. DOI:10.1016/j.bios.2017.01.031 |
| [4] |
Yu S, Tang YZ, Yan MY, et al. A fluorescent cascade amplification method for sensitive detection of Salmonella based on magnetic Fe3O4 nanoparticles and hybridization chain reaction. Sens Actuators B: Chem, 2019, 279: 31-37. DOI:10.1016/j.snb.2018.09.091 |
| [5] |
Li FL, Li F, Luo D, et al. Biotin-exposure-based immunomagnetic separation coupled with nucleic acid lateral flow biosensor for visibly detecting viable Listeria monocytogenes. Anal Chim Acta, 2018, 1017: 48-56. DOI:10.1016/j.aca.2018.02.009 |
| [6] |
Yu B, Li FL, Zhao TC, et al. Hybridization chain reaction-based flow cytometric bead sensor for the detection of emetic Bacillus cereus in milk. Sens Actuators B: Chem, 2018, 256: 624-631. DOI:10.1016/j.snb.2017.09.199 |
| [7] |
Yao CY, Zhu TY, Qi YZ, et al. Development of a quartz crystal microbalance biosensor with aptamers as bio-recognition element. Sensors, 2010, 10(6): 5859-5871. DOI:10.3390/s100605859 |
| [8] |
Vlăsceanu GM, Amărandi RM, Ioniță M, et al. Versatile graphene biosensors for enhancing human cell therapy. Biosens Bioelectron, 2018, 117: 283-302. DOI:10.1016/j.bios.2018.04.053 |
| [9] |
Syshchyk O, Skryshevsky VA, Soldatkin OO, et al. Enzyme biosensor systems based on porous silicon photoluminescence for detection of glucose, urea and heavy metals. Biosens Bioelectron, 2015, 66: 89-94. DOI:10.1016/j.bios.2014.10.075 |
| [10] |
Rubab M, Shahbaz HM, Olaimat AN, et al. Biosensors for rapid and sensitive detection of Staphylococcus aureus in food. Biosens Bioelectron, 2018, 105: 49-57. DOI:10.1016/j.bios.2018.01.023 |
| [11] |
Ranjbar S, Shahrokhian S, Nurmohammadi F. Nanoporous gold as a suitable substrate for preparation of a new sensitive electrochemical aptasensor for detection of Salmonella typhimurium. Sens Actuators B: Chem, 2018, 255: 1536-1544. DOI:10.1016/j.snb.2017.08.160 |
| [12] |
Altintas Z, Akgun M, Kokturk G, et al. A fully automated microfluidic-based electrochemical sensor for real-time bacteria detection. Biosens Bioelectron, 2018, 100: 541-548. DOI:10.1016/j.bios.2017.09.046 |
| [13] |
Vaisocherová-Lísalová H, Víšová I, Ermini ML, et al. Low-fouling surface plasmon resonance biosensor for multi-step detection of foodborne bacterial pathogens in complex food samples. Biosens Bioelectron, 2016, 80: 84-90. DOI:10.1016/j.bios.2016.01.040 |
| [14] |
Chen J, Park B. Label-free screening of foodborne Salmonella using surface plasmon resonance imaging. Anal Bioanal Chem, 2018, 410(22): 5455-5464. DOI:10.1007/s00216-017-0810-z |
| [15] |
Zhang P, Liu H, Li XC, et al. A label-free fluorescent direct detection of live Salmonella Typhimurium using cascade triple trigger sequences-regenerated strand displacement amplification and hairpin template-generated-scaffolded silver nanoclusters. Biosens Bioelectron, 2017, 87: 1044-1049. DOI:10.1016/j.bios.2016.09.037 |
| [16] |
Xue L, Zheng LY, Zhang HL, et al. An ultrasensitive fluorescent biosensor using high gradient magnetic separation and quantum dots for fast detection of foodborne pathogenic bacteria. Sens Actuators B: Chem, 2018, 265: 318-325. DOI:10.1016/j.snb.2018.03.014 |
| [17] |
Sharp NJ, Vandamm JP, Molineux IJ, et al. Rapid detection of Bacillus anthracis in complex food matrices using phage-mediated bioluminescence. J Food Prot, 2015, 78(5): 963-968. DOI:10.4315/0362-028X.JFP-14-534 |
| [18] |
Ngamsom B, Truyts A, Fourie L, et al. A microfluidic device for rapid screening of E. coli O157:H7 based on IFAST and ATP bioluminescence assay for water analysis. Chemistry, 2017, 23(52): 12754-12757. DOI:10.1002/chem.v23.52 |
| [19] |
Xu XM, Ma XY, Wang HT, et al. Aptamer based SERS detection of Salmonella Typhimurium using DNA-assembled gold nanodimers. Microchim Acta, 2018, 185(7): 325. DOI:10.1007/s00604-018-2852-0 |
| [20] |
Ma XY, Xu XM, Xia Y, et al. SERS aptasensor for Salmonella Typhimurium detection based on spiny gold nanoparticles. Food Control, 2018, 84: 232-237. DOI:10.1016/j.foodcont.2017.07.016 |
| [21] |
Sha YH, Zhang X, Li WR, et al. A label-free multi-functionalized graphene oxide based electrochemiluminscence immunosensor for ultrasensitive and rapid detection of Vibrio parahaemolyticus in seawater and seafood. Talanta, 2016, 147: 220-225. DOI:10.1016/j.talanta.2015.09.058 |
| [22] |
Yang SJ, Wang MY, Wang L, et al. A sandwich protocol for chemiluminescent detection of Streptococcus mutans utilizing dual-site recognition by rat IgG2a and vancomycin. Sens Actuators B: Chem, 2017, 252: 1003-1009. DOI:10.1016/j.snb.2017.06.106 |
| [23] |
Yu XF, Chen F, Wang RH, et al. Whole-bacterium SELEX of DNA aptamers for rapid detection of E. coli O157: H7 using a QCM sensor. J Biotechnol, 2018, 266: 39-49. DOI:10.1016/j.jbiotec.2017.12.011 |
| [24] |
Kaushik S, Pandey A, Tiwari UK, et al. A label-free fiber optic biosensor for Salmonella Typhimurium detection. Opt Fiber Technol, 2018, 46: 95-103. DOI:10.1016/j.yofte.2018.09.012 |
| [25] |
Zhang JL, Wang JJ, Zhang XQ, et al. Rapid detection of Escherichia coli based on 16S rDNA nanogap network electrochemical biosensor. Biosens Bioelectron, 2018, 118: 9-15. DOI:10.1016/j.bios.2018.07.041 |
| [26] |
Ranjbar S, Shahrokhian S. Design and fabrication of an electrochemical aptasensor using Au nanoparticles/carbon nanoparticles/cellulose nanofibers nanocomposite for rapid and sensitive detection of Staphylococcus aureus. Bioelectrochemistry, 2018, 123: 70-76. DOI:10.1016/j.bioelechem.2018.04.018 |
| [27] |
Choi SJ, Ban C. Crystal structure of a DNA aptamer bound to PvLDH elucidates novel single-stranded DNA structural elements for folding and recognition. Sci Rep, 2016, 6: 34998. DOI:10.1038/srep34998 |
| [28] |
Lafleur JP, Jönsson A, Senkbeil S, et al. Recent advances in lab-on-a-chip for biosensing applications. Biosens Bioelectron, 2016, 76: 213-233. DOI:10.1016/j.bios.2015.08.003 |
| [29] |
Zhang DC, Yan YR, Li Q, et al. Label-free and high-sensitive detection of Salmonella using a surface plasmon resonance DNA-based biosensor. J Biotechnol, 2012, 160(3/4): 123-128. |
| [30] |
Zhou C, Zou HM, Li M, et al. Fiber optic surface plasmon resonance sensor for detection of E. coli O157: H7 based on antimicrobial peptides and AgNPs-rGO. Biosens Bioelectron, 2018, 117: 347-353. DOI:10.1016/j.bios.2018.06.005 |
| [31] |
Liu X, Hu YX, Zheng S, et al. Surface plasmon resonance immunosensor for fast, highly sensitive, and in situ detection of the magnetic nanoparticles-enriched Salmonella Enteritidis. Sens Actuators B: Chem, 2016, 230: 191-198. DOI:10.1016/j.snb.2016.02.043 |
| [32] |
Singh P. SPR biosensors: historical perspectives and current challenges. Sens Actuators B: Chem, 2016, 229: 110-130. DOI:10.1016/j.snb.2016.01.118 |
| [33] |
Bhardwaj N, Bhardwaj SK, Nayak MK, et al. Fluorescent nanobiosensors for the targeted detection of foodborne bacteria. TrAC Trends Anal Chem, 2017, 97: 120-135. DOI:10.1016/j.trac.2017.09.010 |
| [34] |
Wang XL, Huang YK, Wu SJ, et al. Simultaneous detection of Staphylococcus aureus and Salmonella typhimurium using multicolor time-resolved fluorescence nanoparticles as labels. Int J Food Microbiol, 2016, 237: 172-179. DOI:10.1016/j.ijfoodmicro.2016.08.028 |
| [35] |
Hu RR, Yin ZZ, Zeng YB, et al. A novel biosensor for Escherichia coli O157:H7 based on fluorescein-releasable biolabels. Biosens Bioelectron, 2016, 78: 31-36. DOI:10.1016/j.bios.2015.11.018 |
| [36] |
Shama G, Malik DJ. The uses and abuses of rapid bioluminescence-based ATP assays. Int J Hyg Environ Health, 2013, 216(2): 115-125. DOI:10.1016/j.ijheh.2012.03.009 |
| [37] |
Zhang ZJ, Wang CX, Zhang LR, et al. Fast detection of Escherichia coli in food using nanoprobe and ATP bioluminescence technology. Anal Methods, 2017, 9(36): 5378-5387. DOI:10.1039/C7AY01607G |
| [38] |
Kim SU, Jo EJ, Noh Y, et al. Adenosine triphosphate bioluminescence-based bacteria detection using targeted photothermal lysis by gold nanorods. Anal Chem, 2018, 90(17): 10171-10178. DOI:10.1021/acs.analchem.8b00254 |
| [39] |
Rodriguez RD, Sheremet E, Nesterov M, et al. Aluminum and copper nanostructures for surface-enhanced Raman spectroscopy: a one-to-one comparison to silver and gold. Sens Actuators B: Chem, 2018, 262: 922-927. DOI:10.1016/j.snb.2018.02.006 |
| [40] |
Zhang H, Ma XY, Liu Y, et al. Gold nanoparticles enhanced SERS aptasensor for the simultaneous detection of Salmonella Typhimurium and Staphylococcus aureus. Biosens Bioelectron, 2015, 74: 872-877. DOI:10.1016/j.bios.2015.07.033 |
| [41] |
Duan N, Chang BY, Zhang H, et al. Salmonella Typhimurium detection using a surface-enhanced Raman scattering-based aptasensor. Int J Food Microbiol, 2016, 218: 38-43. DOI:10.1016/j.ijfoodmicro.2015.11.006 |
| [42] |
Zhou HB, Yang DT, Ivleva NP, et al. SERS detection of bacteria in water by in situ coating with Ag nanoparticles. Anal Chem, 2014, 86(3): 1525-1533. DOI:10.1021/ac402935p |
| [43] |
Hao LL, Gu HJ, Duan N, et al. An enhanced chemiluminescence resonance energy transfer aptasensor based on rolling circle amplification and WS2 nanosheet for Staphylococcus aureus detection. Anal Chim Acta, 2017, 959: 83-90. DOI:10.1016/j.aca.2016.12.045 |
| [44] |
Xiong J, Wang WW, Zhou YL, et al. Ultra-sensitive chemiluminescent detection of Staphylococcus aureus based on competitive binding of Staphylococcus protein A-modified magnetic beads to immunoglobulin G. Microchim Acta, 2016, 183(4): 1507-1512. DOI:10.1007/s00604-016-1769-8 |
| [45] |
Liu FF, Zhang CS. A novel paper-based microfluidic enhanced chemiluminescence biosensor for facile, reliable and highly-sensitive gene detection of Listeria monocytogenes. Sens Actuators B: Chem, 2015, 209: 399-406. DOI:10.1016/j.snb.2014.11.099 |
| [46] |
Masdor NA, Altintas Z, Tothill IE. Sensitive detection of Campylobacter jejuni using nanoparticles enhanced QCM sensor. Biosens Bioelectron, 2016, 78: 328-336. DOI:10.1016/j.bios.2015.11.033 |
 2019, Vol. 35
2019, Vol. 35




