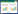中国科学院微生物研究所、中国微生物学会主办
文章信息
- 车路平, 栗永华, 杨斌, 徐智凯, 廖瑛, 仇旭升, 谭磊, 孙英杰, 宋翠萍, 丁铲, 姚刚, 王金泉, 孟春春
- Che Luping, Li Yonghua, Yang Bin, Xu Zhikai, Liao Ying, Qiu Xusheng, Tan Lei, Sun Yingjie, Song Cuiping, Ding Chan, Yao Gang, Wang Jinquan, Meng Chunchun
- 基于萤火虫荧光素酶报告基因检测凋亡的系统构建及鉴定
- Construction and identification of an apoptosis detection system based on firefly luciferase reporter gene
- 生物工程学报, 2019, 35(8): 1557-1565
- Chinese Journal of Biotechnology, 2019, 35(8): 1557-1565
- 10.13345/j.cjb.180276
-
文章历史
- Received: July 2, 2018
- Accepted: September 17, 2018
2. 中国农业科学院 上海兽医研究所,上海 200241
2. 2 Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China
细胞凋亡,又称细胞程序性死亡(Programmed cell death,PCD),由病理学家Kerr于1972年提出,是指细胞为了更好地适应生存环境而采取的主动死亡过程[1]。细胞凋亡受基因调控,贯穿于生物体生命活动的全部过程,它不仅在胚胎和大脑的发育及机体免疫等过程中扮演重要角色,而且在心血管疾病、神经性病变及肿瘤的发生发展过程中起到至关重要的作用[4]。比如,当凋亡受到抑制,会导致肿瘤的发生和病毒感染,而不适当的细胞凋亡激活,是中风、心肌梗死、早老性痴呆、帕金森病、艾滋病、造血系统疾病等发生的重要原因。
研究表明,Caspase家族在细胞凋亡的调节与执行过程中的作用至关重要[2-3]。因此建立一个快速检测Caspase蛋白酶活性的方法,有利于尽早判断细胞的凋亡状态,且可以为筛选干预细胞凋亡状态来治疗疾病的药物提供方便快捷的途径。
细胞凋亡主要分为:内源性凋亡途径(Intrinsic pathway),主要由诸多应激条件、化学治疗试剂和药物所导致;外源性凋亡途径(Extrinsic pathway),由死亡受体如TNF、FasL等介导[1]。其中Caspase-3蛋白是内源性凋亡途径与外源性凋亡途径的汇集点,且在凋亡早期被激活,晚期细胞和死亡细胞中Caspase-3的活性下降,因此Caspase-3可被作为细胞凋亡的早期判断指标之一[4]。而通过定量检测Caspase-3活性,从而监测细胞凋亡的水平,最终为筛选适宜的抗肿瘤药物提供最佳途径。为建立一种快速高效检测鉴定细胞凋亡的方法,之前已有研究者将Caspase-3作用的底物与荧光共振能量转移肽对[5]或D-荧光素[6]进行连接用以检测Caspase-3的活性,但是这种检测方法的灵敏度较差且实验过程较为繁琐。本研究选用萤火虫荧光素酶作为报告基因用以构建含有Caspase-3识别基序的真核表达质粒,当凋亡现象发生,Caspase-3激活后将质粒中的DEVD剪切出来,之后萤火虫荧光素酶基因(Fluc)的N端和C端相互靠近激活发出荧光,最后通过检测萤火虫荧光素酶基因的表达情况进而判定细胞的凋亡情况。该方法可在96孔板中进行,灵敏度高、操作简便且省时高效,有望成为筛选抗肿瘤药物的新方法。
1 材料与方法 1.1 细胞、载体及主要试剂真核表达载体pCI-neo、HeLa及A549细胞由本实验室保存。限制性内切酶EcoRⅠ、SalⅠ以及MluⅠ,In-Fusion HD Cloning Plus (638909)购自TaKaRa公司;脂质体转染试剂Fugene、Dual-Luciferase Reporter Assay System购自普洛麦格(Promega)公司;大肠杆菌DH5α、DNA凝胶回收试剂盒、质粒DNA小提中量试剂盒及无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司;Phanta EVO Super-Fidelity DNA Polymerase购自南京诺唯赞生物科技有限公司;DMEM培养基和胎牛血清购自西格玛奥德里奇(Sigma)公司;Anti-Luciferase mAb (货号M095-3)购自北京博尔迈生物技术有限公司;Caspase-3 (货号9665,单抗)和PARP (货号9542,多抗)购自Cell Signaling Technology公司;二抗鼠抗(货号115-035-003)和兔抗(货号111-035-003)购自Jackson ImmunoResearch Laboratories公司;其他试剂均为国产分析纯产品。
1.2 方法 1.2.1 引物设计及合成应用Primer Premier 5.0基因分析软件,根据GenBank上公布的萤火虫荧光素酶基因(Firefly luciferase gene)序列(GenBank登录号:DS235862.1)设计两对引物(图 1),第一对引物的上游引物Fluc-NF-VD,下游引物Fluc-NR (表 1),扩增萤火虫荧光素酶基因N端(2–416 aa),并在上游引物的5′端引入4个氨基酸DEVD (Caspase-3识别基序),在下游引物的5′端引入MluⅠ酶切位点,产物大小为1 279 bp,由于第一对引物扩增的是萤火虫荧光素酶基因的N端,且在上游引物的5′端引入了DEVD序列,因而将其分别命名为Fluc-NF-VD及Fluc-NR。第二对引物的上游引物Fluc-CF,下游引物Fluc-CR-VD (表 1)。用以扩增萤火虫荧光素酶基因的C端(399–550 aa),并在上游引物的5′端引入MluⅠ酶切位点,在下游引物的5′端引入4个氨基酸DEVD,产物大小为487 bp,由于第二对引物扩增的是萤火虫荧光素酶基因的C端,且在下游引物的5′端引入了DEVD序列,因而将其分别命名为Fluc-CF及Fluc-CR-VD。引物由生工生物工程(上海)股份有限公司合成。
|
| 图 1 引物设计模式图 Fig. 1 Diagram of primer design |
| |
| Primer name | Sequence (5′–3′) | Size (bp) |
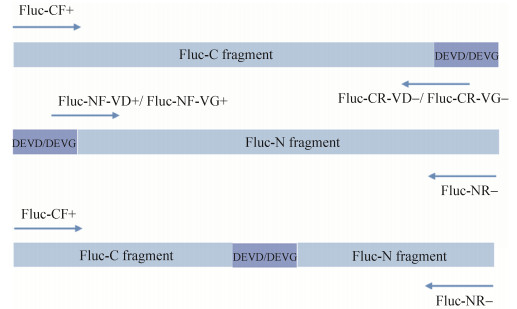
| Fluc-NF-VD+ | GCC GTG GAT GAA GTT GAT ATG GAA GAC GCC AAA AAC ATA AAG AAA GG | 47 |
| Fluc-NF-VG+ | 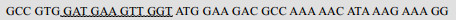 |
47 |
| Fluc-NR– |  |
40 |
| Fluc-CF+ | 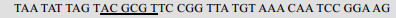 |
41 |
| Fluc-CR-VD– | CAT ATC AAC TTC ATC CAC GGC GAT CTT TCC GCC CTT CTT | 39 |
| Fluc-CR-VG– |  |
39 |
| Annotation: Single undersore, Amino acid DEVD; Waveline, Amino acid DEVG; Double underscore, MluⅠ restriction site; Fluc, Firefly luciferase gene. | ||
PCR扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸5 min;16 ℃结束反应。以扩增出来的萤火虫荧光素酶基因的N端及C端基因为模板,Fluc-CF、Fluc-NR为引物利用融合PCR的方法扩增完整的带有DEVD的Fluc,产物大小为1 766 bp。同理扩增带有DEVG (只与DEVD有1个氨基酸不同,作为阴性对照)的Fluc片段。
PCR扩增程序为:95 ℃预变性3 min;95 ℃变性15 s,64 ℃退火15 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸7 min;16 ℃结束反应。
1.2.2 DnaEC-DnaEN-PEST片段的合成由生工生物工程(上海)股份有限公司合成带有DnaEC-DnaEN-PEST片段的pUC质粒,并在片段两端预留EcoRⅠ、SalⅠ酶切位点,DnaEC与DnaEN之间预留MluⅠ酶切位点。DnaEN及DnaEC分别为分裂型内含肽的N端及C端,其功能是使外源表达的Fluc的N端与C端重新连接形成成熟蛋白。PEST为一段富含脯氨酸、谷氨酸、丝氨酸和苏氨酸的多肽,它的作用是水解剪接不完全的萤火虫荧光素酶蛋白。
1.2.3 真核表达质粒pFluc-DEVD及pFluc-DEVG的构建分别用限制性核酸内切酶EcoRⅠ、SalⅠ酶切带有DnaEC-DnaEN-PEST片段的pUC质粒以及空载pCI-neo质粒,将DnaEC-DnaEN-PEST片段与pCI-neo进行连接,PCR筛选获得阳性菌液并提取质粒。用限制性核酸内切酶MluⅠ酶切带有DnaEC-DnaEN-PEST片段的pCI-neo重组阳性质粒,再采用In-Fusion HD Cloning Plus的方法将其与Fluc-DEVD或Fluc-DEVG片段进行融合,构建质粒pFluc-DEVD及pFluc-DEVG。鉴定结果为阳性者提取质粒,并送生工生物工程(上海)股份有限公司进行测序,测序结果正确后,按照无内毒素质粒大提试剂盒说明书提取质粒备用。
1.2.4 脂质体转染HeLa及A549细胞将HeLa及A549细胞分为pFluc-DEVD质粒组(第一组)和pFluc-DEVG组(第二组),将细胞以每孔1×106个细胞接种到6孔板内,37 ℃温箱中培养12至18 h。待细胞生长密度达70%–80%时,弃掉培养基,PBS清洗2遍后,每孔补加900 μL的Opti-MEM。按照普洛麦格公司Fugene试剂的使用说明书进行质粒转染,于37 ℃、50 mL/L CO2培养箱中培养6 h后弃掉转染混合物,加入1 mL含有10%胎牛血清的DMEM培养液。
1.2.5 Western blotting检测Fluc、Caspase-3及PARP的表达脂质体转染48 h后,弃掉培养液。PBS洗涤2次,使用200 μL 1×loading buffer裂解细胞收取样品,100 ℃金属浴10 min。10% SDS-PAGE分离蛋白,转移至PVDF膜,10%脱脂乳封闭1 h,以1:1 000稀释Fluc一抗,4 ℃孵育过夜。TBST洗涤3次,每次5 min,之后用1:8 000稀释的二抗于37 ℃孵育1 h。最后再用TBST洗涤3次,每次5 min,用化学发光法检测并拍照记录。
1.2.6 萤火虫荧光素酶和海肾荧光素酶活性检测阳性质粒pFluc-DEVD、阴性质粒pFluc- DEVG分别与Rluc质粒共转染HeLa及A549细胞48 h,每组设置3个重复孔,弃掉培养液,PBS洗涤2次后,按照双荧光报告基因检测试剂盒说明书,收集6孔板中的细胞裂解液。随后用GloMax发光仪检测Fluc和Rluc的活性,即每20 μL裂解液的上清加入100 μL的LARⅡ,检测Fluc的活性。之后每孔加入100 μL Stop Buffer检测Rluc的活性,记录两次分别测得的数值。
2 结果与分析 2.1 质粒构建模式图设计的凋亡检测质粒主要包括DnaE-C端、切割开的Fluc-C、DEVD片段、Fluc-N、DnaE-N端、PEST序列,具体如图 2所示。
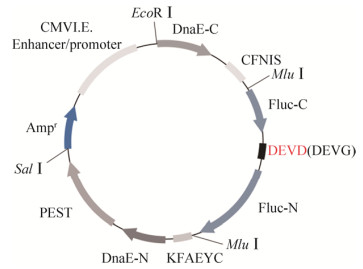
|
| 图 2 凋亡检测质粒的结构示意图 Fig. 2 The plasmid map of pFluc-DEVD/pFluc-DEVG |
| |
将Fluc的N端及C端进行融合PCR,并使用1%琼脂糖凝胶电泳检测PCR产物,结果显示在1 700 bp大小的位置有清晰的条带,与预期结果一致(图 3)。

|
| 图 3 Fluc全长基因融合PCR扩增结果 Fig. 3 Amplification of full length of firefly luciferase gene. M: DNA marker; 1: no sample; 2: full length of firefly luciferase gene with DEVD; 3: full length of firefly luciferase gene with DEVG |
| |
使用限制性核酸内切酶EcoRⅠ、SalⅠ酶切带有的pUC质粒以及空载pCI-neo质粒,并进行1%琼脂糖凝胶电泳鉴定,回收小片段即DnaEC- DnaEN-PEST片段,并将其与pCI-neo载体连接,构建的质粒进行菌液PCR鉴定,条带大小正确。
使用限制性内切酶MluⅠ酶切构建好带有DnaEC-DnaEN-PEST片段的pCI-neo质粒,并使用1%琼脂糖凝胶电泳进行回收,与扩增好的Fluc-DEVD或Fluc-DEVG片段进行重组。挑选重组质粒的菌液进行菌液PCR鉴定及质粒的酶切鉴定。由图 4可知,构建的pFluc-DEVD及pFluc- DEVG质粒经菌液PCR扩增得到大小为2 301 bp的目的片段,经EcoRⅠ、SalⅠ双酶切鉴定可获得大小为2 301 bp的目的条带,测序结果与预期一致。

|
| 图 4 pFluc-DEVD及pFluc-DEVG质粒的双酶切鉴定 Fig. 4 Identification of pFluc-DEVD and pFluc-DEVG plasmid using restriction endonuclease digestion. M: DNA marker; 1: pFluc-DEVD plasmid; 2: pFluc-DEVG plasmid |
| |
在HeLa细胞中转染阴性对照质粒pFluc- DEVG、阳性质粒pFluc-DEVD以及空载质粒pCI-neo,48 h后加入促凋亡试剂STS作用2 h,收集细胞蛋白进行Western blotting检测。由图 5可见,转染pFluc-DEVD组能够产生活化的Fluc蛋白,条带大约为61 kDa,与预期结果一致。而pFluc-DEVG组分裂的N端及C端Fluc蛋白相互靠近时能形成少量活化的Fluc蛋白,但总体上明显少于pFluc-DEVD组,空白组及转染空载质粒组均没有条带产生。

|
| 图 5 Western blotting检测萤火虫荧光素酶在HeLa细胞中的表达 Fig. 5 Western blotting analysis detected the experssion of Fluc protein in HeLa cells. M: protein marker; 1: pFluc-DEVG plasmid; 2: PCI-neo vector; 3: blank control; 4: pFluc-DEVD plasmid |
| |
将pFluc-DEVD或pFluc-DEVG质粒转染HeLa细胞48 h,加入STS促凋亡试剂作用2 h后,收集细胞蛋白进行Western blotting检测。由图 6可知,只加入pFluc-DEVG质粒或pFluc-DEVD质粒,并不能引起细胞发生凋亡,排除了质粒及转染试剂的干扰。而加入1:1 000稀释的STS试剂后,pFluc-DEVD质粒组及pFluc-DEVG质粒组均产生PARP的裂解及Caspase-3的活化现象,与预期结果一致。该结果表明,促凋亡试剂STS进行1 000倍稀释时能够诱导细胞发生凋亡,且不会受到转染质粒的影响,因而该试剂可作为用于后续实验中细胞凋亡的诱导剂。
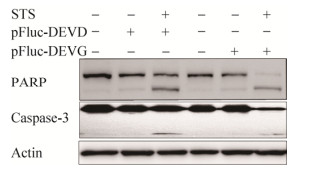
|
| 图 6 Western blotting检测Caspase-3和PARP的表达 Fig. 6 Western blotting analysis of Caspase-3 and PARP expression in HeLa cells |
| |
将pFluc-DEVD或pFluc-DEVG质粒与Rluc质粒共转染HeLa及A549细胞48 h后,STS促凋亡试剂以1:1 000稀释加入培养基中,37 ℃培养箱放置2 h,检测Rluc和Fluc的活性。结果发现,当细胞发生凋亡时,pFluc-DEVD质粒的RLU值(即relative light unit,RLU=LF/LR)是pFluc- DEVG质粒的3倍(图 7),差异显著;而未加凋亡刺激药物的两组质粒的RLU值无统计学差异。
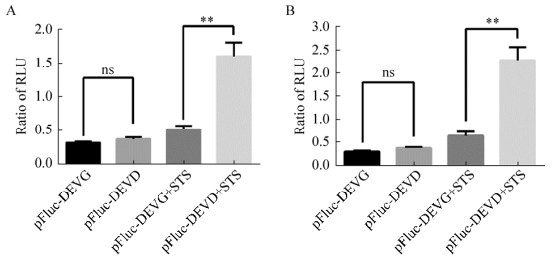
|
| 图 7 萤火虫荧光素酶和海肾荧光素酶活性检测结果 Fig. 7 Detection the activity of firefly luciferase and sea kidney luciferase. ns: no significantly different; **: P < 0.05. (A) HeLa cell. (B) A549 cell |
| |
凋亡(Apoptosis)又被称作细胞程序性死亡,是指为了维持内环境的稳定,由基因控制的细胞自主有序的死亡[1, 7]。目前已经发现凋亡在许多疾病的发生和发展过程中扮演着重要的角色[8-10]。而随着分子生物学技术的发展及人们对于细胞凋亡的过程和分子机制的了解逐渐加深,用于检测细胞凋亡的一系列实验方法也应运而生,例如镜下观察细胞形态的变化、细胞活力检测、DNA片段检测等[11–12]。但是这些方法大多数只能用于数量较少的样本的检测且操作过程繁琐,做不到快速高效地进行大批量样本的检测。目前已知有通过微流控芯片技术[13]以及荧光共振能量转移技术[14]进行细胞凋亡的高通量检测。而本实验通过构建Luciferase基底的质粒(生物传感器),将其转染特定细胞系并结合双荧光素酶报告基因的实验方法,使得检测可在96孔板中进行,操作简便且快速可行,有望成为新型高通量检测细胞凋亡的方法。
研究表明[15],Caspase-3能够特异性识别DEVD-x,并水解D-x之间的肽段。针对这一特性,我们建立了pFluc-DEVD Luciferase和双荧光素酶报告基因系统的检测方法。将Caspase-3的酶切底物DEVD插入萤火虫荧光素酶基因(Firefly luciferase,Fluc)的N端和C端之间,并将两者进行偶联。为确保DEVD被切割之后,Fluc基因能够顺利激活,在Fluc基因的N端和C端分别添加一段内含肽(Intein)序列。内含肽是一段宿主蛋白的氨基酸序列,与宿主蛋白基因存在于同一个开放阅读框内,具有自我剪接的功能。本实验使用的是分离型内含肽DnaE,来自于集胞蓝细菌属的DNA聚合酶Ⅲ的α亚单位,编码的基因包括DnaE-N和DnaE-C[16]。有研究表明[17],通过将分裂型内含肽的N端与C端前后颠倒,可以用于外源表达蛋白的连接且内含肽自身可以从成熟的蛋白中自我剪切出来。利用内含肽这一特性,将DnaE的N端与C端前后颠倒后分别连接于Fluc-N端的末端及C端的开端,从而使其利于Fluc的N端与C端外显肽连接起来形成成熟蛋白。同时,为了提高内含肽的蛋白剪接效率,在DnaE-C端与Fluc-C端之间插入CFNIS,以及在DnaE-N端与Fluc-N端之间插入了KFAEYC氨基酸序列。此外,质粒中还插入了一段PEST序列。PEST是指一段富含脯氨酸(P)、谷氨酸(E)、丝氨酸(S)和苏氨酸(T)的多肽,它的作用是使未剪接完全的萤火虫荧光素酶蛋白序列水解,从而减少未切割的Fluc蛋白带来的干扰[18]。
当细胞处于正常状态时,因为细胞内的Caspase-3处于非活性状态,萤火虫荧光素酶报告基因的N端与C端蛋白被DEVD间隔开,所以萤火虫荧光素酶报告基因不具备活性,因而无法发出荧光;而当使用STS试剂诱导细胞发生凋亡时,内含肽DnaE-C与DnaE-N相互连接形成完整的DnaE,之后DnaE将萤火虫荧光素酶报告基因N端和C端相连接,并将自身剪切下来,紧接着细胞内活化的Caspase-3能够特异性剪切DEVD,最终使得萤火虫荧光素酶基因恢复活性,从而发出荧光(图 8)。从Western blotting检测Fluc的结果来看,pFluc-DEVD质粒正常工作,能够明显检测到激活后的线性Fluc蛋白(下方条带较粗的),以及少量未激活的环状Fluc蛋白(上方颜色较浅的)。而转染pFluc-DEVG质粒组也检测到少量的线性Fluc蛋白,后期可以通过对PEST序列进行优化以及插入其他序列,确保未活化的Fluc序列被彻底降解,从而将干扰降到最低。而后检测PARP及Caspase-3蛋白,进一步证实了在加入STS后,转染两种质粒后都发生了凋亡现象。之后通过双荧光素酶报告实验来印证质粒检测凋亡的能力,结果发现转染pFluc-DEVD质粒的HeLa及A549细胞的RLU值比阴性对照(转染pFluc-DEVG质粒)要高出近3倍,再次表明Fluc基因成功激活,萤火虫荧光素酶能够发出较高的荧光值。
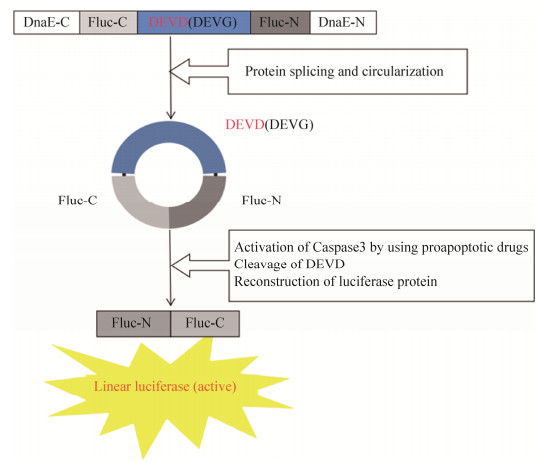
|
| 图 8 凋亡质粒工作原理示意图 Fig. 8 Schematic illustration of working principle of apoptosis detection plasmid |
| |
综上所述,本研究建立的pFluc-DEVD Luciferase和双荧光素酶报告基因检测细胞凋亡的方法,能够准确有效地检测细胞内Caspase-3的活化从而了解细胞的凋亡情况,为将来进行凋亡的高通量检测,进而筛选适宜的凋亡干预药物提供了一个便利条件。
| [1] |
Martinez MM, Reif RD, Pappas D. Detection of apoptosis: a review of conventional and novel techniques. Anal Methods, 2010, 2(8): 996-1004. DOI:10.1039/c0ay00247j |
| [2] |
Logue SE, Martin SJ. Caspase activation cascades in apoptosis. Biochem Soc Trans, 2008, 36(1): 1-9. |
| [3] |
Mcstay GP, Green DR. Measuring apoptosis: caspase inhibitors and activity assays. Cold Spring Harb Protoc, 2014, 2014(8): 799-806. |
| [4] |
Didonna A, Sussman J, Benetti F, et al. The role of Bax and caspase-3 in doppel-induced apoptosis of cerebellar granule cells. Prion, 2012, 6(3): 309-316. DOI:10.4161/pri.20026 |
| [5] |
Spencer SL, Sorger PK. Measuring and modeling apoptosis in single cells. Cell, 2011, 144(6): 926-939. DOI:10.1016/j.cell.2011.03.002 |
| [6] |
Godinat A, Budin G, Morales AR, et al. A biocompatible "Split Luciferin" reaction and its application for non-invasive bioluminescent imaging of protease activity in living animals. Curr Protoc Chem Biol, 2014, 6(3): 169-189. |
| [7] |
Sun Y, Liu WZ, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis. J Recep Signal Transduct, 2015, 35(6): 600-604. DOI:10.3109/10799893.2015.1030412 |
| [8] |
Cerella C, Grandjenette C, Dicato M, et al. Roles of apoptosis and cellular senescence in cancer and aging. Curr Drug Targets, 2016, 17(4): 405-415. DOI:10.2174/1389450116666150202155915 |
| [9] |
Koff JL, Ramachandiran S, Bernal-Mizrachi L. A time to kill: targeting apoptosis in cancer. Int J Mol Sci, 2015, 16(2): 2942-2955. DOI:10.3390/ijms16022942 |
| [10] |
Zhang X, Li CF, Zhang L, et al. TRAF6 restricts p53 mitochondrial translocation, apoptosis, and tumor suppression. Mol Cell, 2016, 64(4): 803-814. DOI:10.1016/j.molcel.2016.10.002 |
| [11] |
Blankenberg FG. In vivo detection of apoptosis. J Nucl Med, 2008, 49(Suppl 2): 81S-95S. |
| [12] |
Wlodkowic D, Skommer J, Darzynkiewicz Z. Cytometry of apoptosis. Historical perspective and new advances. Exp Oncol, 2012, 34(3): 255-262. |
| [13] |
Kilianski A, Mielech AM, Deng XF, et al. Assessing activity and inhibition of Middle East respiratory syndrome coronavirus papain-like and 3C-like proteases using luciferase-based biosensors. J Virol, 2013, 87(21): 11955-11962. DOI:10.1128/JVI.02105-13 |
| [14] |
Dai W, Zheng YZ, Luo KQ, et al. A prototypic microfluidic platform generating stepwise concentration gradients for real-time study of cell apoptosis. Biomicrofluidics, 2010, 4(2): 024101. DOI:10.1063/1.3398319 |
| [15] |
Yun NR, Kim C, Cha H, et al. Caspase-3-mediated cleavage of PICOT in apoptosis. Biochem Biophys Res Commun, 2013, 432(3): 533-538. DOI:10.1016/j.bbrc.2013.02.017 |
| [16] |
Zettler J, Schutz V, Mootz HD. The naturally split Npu DnaE intein exhibits an extraordinarily high rate in the protein trans-splicing reaction. FEBS Lett, 2009, 583(5): 909-914. DOI:10.1016/j.febslet.2009.02.003 |
| [17] |
Muralidharan V, Muir TW. Protein ligation: an enabling technology for the biophysical analysis of proteins. Nat Methods, 2006, 3(6): 429-438. DOI:10.1038/nmeth886 |
| [18] |
Uversky VN, Dunker AK. Understanding protein non-folding. Biochim Biophys Acta, 2010, 1804(6): 1231-1264. DOI:10.1016/j.bbapap.2010.01.017 |
 2019, Vol. 35
2019, Vol. 35