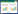中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王旭东, 刘涛, 薛闯, 王子璇, 孙旭东
- Wang Xudong, Liu Tao, Xue Chuang, Wang Zixuan, Sun Xudong
- 基于近红外光谱实时监测乙醇发酵过程多组分参数
- On-line monitoring of multiple component parameters during ethanol fermentation by near-infrared spectroscopy
- 生物工程学报, 2019, 35(8): 1491-1499
- Chinese Journal of Biotechnology, 2019, 35(8): 1491-1499
- 10.13345/j.cjb.190012
-
文章历史
- Received: January 6, 2019
- Accepted: March 7, 2019
2. 大连理工大学 生命科学与技术学院,辽宁 大连 116024
2. School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, Liaoning, China
发酵工程广泛用于生物质转化、食品、医药等生物制造行业[1-2]。发酵过程的参数主要分为化学参数(如pH值、溶解氧浓度等)、物理参数(如发酵温度、搅拌转速等)和生物参数(基质浓度、生物质浓度和产物浓度等)。工程应用中主要通过调控这些参数对发酵过程进行控制和优化。目前多数发酵过程主要对一些化学参数和物理参数可以实现在线测量,然而对于生物参数仍主要采用离线的测量技术,耗时较长,难以进行实时调控优化[3-4]。
近红外光谱技术具有对不同物质组分的敏感性较好、非侵入检测等优点,近年来越来越多地用于发酵过程不同组分和生物量的检测[5-6]。目前,少量文献介绍了利用近红外光谱技术对发酵过程的生物参数进行检测,但基本上是采用离线的方法对单一生物参数进行检测,如文献[7]基于近红外光谱技术离线检测乳酸链球菌发酵过程的还原糖浓度、乳酸链球菌效价、细胞浓度和pH。文献[8]采用近红外光谱仪对1, 3-丙二醇发酵过程的生物量给出了一个实时测量方法,但不能同时对发酵底物和产物的含量进行检测。文献[9]针对丝状真菌发酵过程给出了基于近红外光谱技术实时检测生物量的方法,亦不能同时对其他组分进行测量。
在乙醇发酵过程中,葡萄糖、生物量和乙醇分别为发酵过程的基质、生物质和产物。现已发展了一些对这些参数的离线检测方法[10-12],如采用葡萄糖氧化酶法和高效液相色谱法对葡萄糖浓度进行测量,使用气相色谱仪法和酶学方法等测量乙醇浓度,以及使用酶标仪等测量光密度(Optical density, OD)表示生物量。葡萄糖在酿酒酵母菌的作用下发生糖酵解过程[13],一分子葡萄糖产生两分子丙酮酸,然后丙酮酸转化成乙醇。乙醇发酵过程为生长偶联型发酵过程,发酵过程中的基质浓度和生物量变化都会对产物浓度带来影响,因此需要对乙醇发酵过程中葡萄糖浓度、生物量和乙醇浓度建立联合标定同时进行实时检测。然而目前对乙醇发酵过程各组分同时在线测量的研究成果很少。现有研究[7-9]主要采用偏最小二乘法(PLS)对发酵过程各种组分分别建立近红外光谱标定模型,以用于离线或实时检测,未考虑采用近红外光谱同时对多种组分进行建模和预测。然而近期研究[14]指出,采用多输出支持向量机回归(MLS-SVR)方法对多变量输出建立联合标定模型,能有效利用多变量输出之间的相关性,达到更好的检测可靠性和测量精度。
文中针对乙醇发酵过程,建立基于近红外光谱仪对葡萄糖浓度、生物量及乙醇浓度原位在线测量的实验平台,基于MLS-SVR算法对乙醇发酵过程中生葡萄糖浓度、生物量以及乙醇浓度建立联合标定定量分析模型。通过实验测试,验证说明针对近红外光谱基于MLS-SVR建立的多变量标定模型能够有效地对乙醇发酵过程葡萄糖浓度、生物量以及乙醇浓度进行实时测量。
1 材料与方法 1.1 乙醇发酵过程在线监测实验平台与数据采集为本文研究工作建立的乙醇发酵过程在线监测实验平台如图 1所示。其中发酵罐容量为2.5 L,罐中的温度、pH值、搅拌桨转速等由发酵控制设备控制。利用铂金温度计PT100测量发酵罐中温度,通过加热装置及循环冷却水进行控温。通过NaOH溶液调节发酵液酸碱度,由pH计实时检测发酵罐内pH值。通过电动搅拌桨对发酵罐中溶液进行均匀搅拌。考虑到在发酵初期和发酵末期中产气量较少,直接使用尾气分析仪测量尾气可能会造成测量不准确,因此如图所示进行循环通气检测发酵过程中O2和CO2浓度,以保证实时尾气检测的可靠性。将近红外光谱分析仪的浸入式探头采用酒精清洁除菌后插入发酵罐中,进行实时采集发酵罐中溶液组分对近红外光谱的吸光度,所有检测信号由监控电脑进行实时显示。
|
| 图 1 乙醇发酵过程在线监测实验平台 Fig. 1 On-line monitoring experimental platform for ethanol fermentation process. |
| |
本研究采用ABB公司制造的TALYS-AS531傅里叶近红外光谱分析仪以及配套的浸入式漫反射探头采集近红外光谱,并由Horizon MB软件进行光谱参数设置和数据预处理。光谱采集设置:测量波数范围为4 000-12 000 cm-1,仪器分辨率为16 cm-1,光谱扫描次数为64次,检测器增益为237.84,采集近红外光谱以空气为参考背景。发酵过程控制设备型号为(KoBioTech KBT-2.5L)。采用液相色谱仪(Waters)测量发酵液葡萄糖浓度,采用气相色谱仪(Agilent 6890 Series GC System)测量发酵液的乙醇浓度,采用Multiskan Ascent酶标仪测量发酵液的生物量(采用OD表示)。使用西安智琦公司制造的尾气分析仪检测发酵过程产生的尾气,其中IRME-M红外气体分析仪可对CO2浓度进行检测,电化学式氧分析仪可对O2浓度进行检测。通过监控计算机监视对发酵液实时采集的近红外光谱数据。
1.2 实验材料配置本实验所用的菌种为酿酒酵母Saccharomyces cerevisiae 4126菌种,由大连理工大学生命科学与技术学院提供及保藏。发酵实验前需要对种子进行培养。在种子活化培养阶段,接种100 μL菌种到活化培养基中,然后将培养基放入摇床中,于30 ℃、150 r/min条件下进行24 h的活化。将活化后的菌种接入种子培养基,同样在上述摇床条件下进行12 h的培养。种子培养基和活化培养基由葡萄糖(20 g/L)、蛋白胨(20 g/L)和酵母菌提取粉(10 g/L)组成。
菌种经过活化培养后,接种到发酵培养基中进行发酵实验。发酵开始前使用空气泵对发酵罐通入空气,直到尾气分析仪中显示发酵罐中气体组分浓度和空气一致时,停止空气泵。发酵过程中发酵罐内温度设置为30 ℃,pH值维持在5,电动搅拌桨的转速设置为150 r/min,以保证发酵液为均相状态。发酵培养基由葡萄糖(60 g/L)、蛋白胨(3 g/L)和酵母菌提取粉(5 g/L)组成。
1.3 参考数据与光谱数据分析利用上述实验平台采集5批发酵过程数据用于建立近红外光谱标定模型,每个取样时间点采集3次光谱数据和3组样本做离线检测参考数据。按照3:1的比例分为校正集和验证集,如表 1所示,这里将离线检测参考数据的最大值和最小值归入校正集中,用于建立模型,以保证用于建立光谱标定模型的参考数据范围大于验证集,从而确保以模型内插方式实现可靠的预测。
| Sample set | Number of samples | Analyte | Minimum | Maxmum |
| Calibration set | Glucose | 0 | 66.000 0 | |
| 279 | Ethanol | 0 | 28.760 0 | |
| OD | 0.051 0 | 4.806 7 | ||
| Validation set | Glucose | 0 | 60.000 0 | |
| 90 | Ethanol | 0 | 26.380 0 | |
| OD | 0.550 | 4.556 7 |
图 2示例给出了对其中一个批次乙醇发酵过程采集的近红外光谱吸光度数据。由图 2可以看出,在波数段5 500-6 500 cm-1及8 000- 12 000 cm-1范围内的近红外光谱相较于其他波段具有明显的变化特征。需要说明,生物反应器的结构差异(例如搅拌桨和挡板的尺寸和方向等)会改变培养基中的物理特性,从而会影响光谱吸收特性[15]。随着发酵过程的进行,生物量的增加不仅会影响发酵罐中各物质成分含量,还会影响罐中颜色、密度和粘度等物理特性,当然也会影响细胞的生理代谢特性。图 2中最明显的变化为基线漂移,造成基线漂移是由于发酵过程的物理特性变化(例如气泡)使光源散射。通气、搅拌速度、温度、pH等都会造成一定程度的光谱变化。为了消除环境条件变化对光谱测量带来的扰动,文中采用了一阶导数的光谱预处理方法,用于消除基线和背景漂移对光谱造成的影响,增强光谱的差异,从而提高检测精度和可靠性[16-17]。

|
| 图 2 乙醇发酵过程近红外光谱图 Fig. 2 The spectra of ethanol fermentation process. |
| |
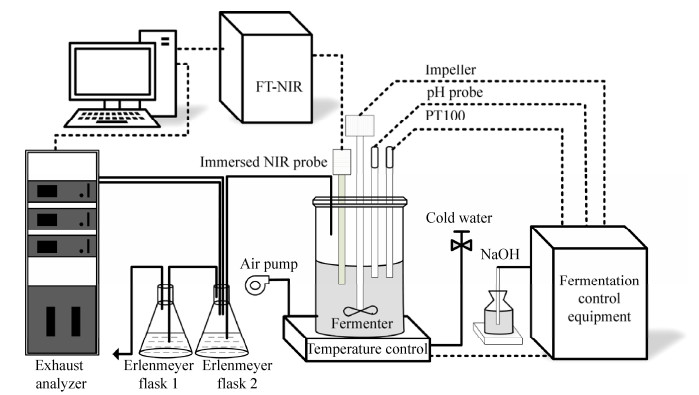
考虑到乙醇发酵过程属于生长偶联型发酵过程的特性,葡萄糖浓度、生物量以及乙醇浓度之间存在相互关联性,因此这里采用多变量MLS-SVR方法对它们建立联合标定模型。为了建立标定模型输入——近红外光谱向量(记为x∈Rp)与多变量输出——生物参数(记为y∈Rm)之间的联合映射关系,其中p为光谱变量个数,这里取为选定波段中的936个波数;m为需要监测的生物参数的个数,这些生物参数为葡萄糖浓度、生物量和乙醇浓度,所以m取为3。设校正集为{(x1,y1),(x2,y2),…,(xn,yn)},n为采集的光谱数据个数(也即对应的离线检测参考数据个数),根据前述采集数据划分取建模集个数为n=279。令wi=w0+vi,其中w0表示各个生物参数的共性信息,vi表示各个生物参数的个性信息。基于MLS-SVR的光谱标定建模算法如下:
构建如下形式的映射函数:
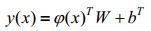
|
(1) |
其中φ(·)为低维空间到高维空间的映射,W=(w0+v1,w0+v2,…,w0+vm),b为常值偏差向量。
为求解上式中w0,V=(v1,v2,…,vm)和b=(b1,b2,…,bm),建立如下约束优化目标:

|
(2) |
其中E=(e1,e2,…,em)∈Rn×m,em为待优化的第m个生物参数的松弛因子,Z=(φ(x1),φ(x2),…,φ(xn)),B=(bT;…;bT)∈Rn×m,γ和λ为两个惩罚参数。
取对应的Lagrange函数为

|
(3) |
由KKT条件[18]可建立下列线性方程组进行求解:

|
(4) |
其中A=(α1,α2,…,αm)∈Rm×n为拉格朗日乘子矩阵。记上述方程组的解为α*={(α1*T,α2*T,…,αn*T)T}和b*。
根据上述方程组的求解,确定多输出的拟合函数为

|
(5) |
其中
需要说明,上式(5)中的核函数选取为常用的径向基核(RBF)函数[19-20]:

|
(6) |
其中核函数参数p和前述两个惩罚参数γ 和λ采用网格搜索、5折交叉验证方法确定[21-22]。
1.5 模型评价指标为了评估近红外光谱标定模型对葡萄糖浓度、生物量和乙醇浓度的预测性能,这里采用预测集均方根误差RMSEP (Root-mean-square error of prediction)、相关系数R2 (Correlation coefficient)和范围误差比RPD (Ration of performance to standard deviate)评价指标[23-24],其计算公式分别为:

|
(7) |

|
(8) |
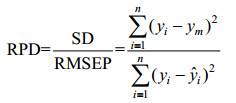
|
(9) |
其中yi为验证集的第i个样本参考值,
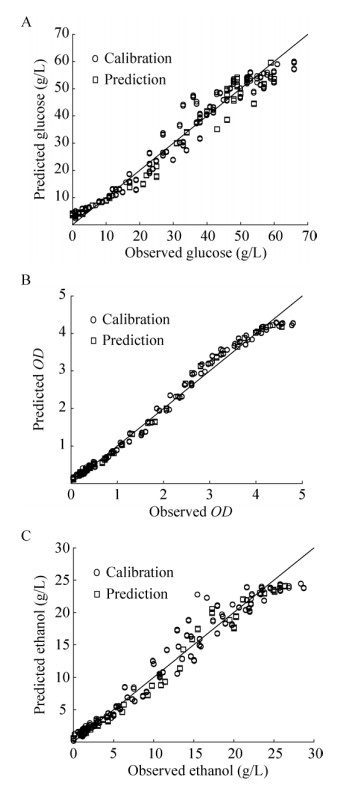
分别用多输出MLS-SVR算法和单输出PLS算法建立光谱标定模型,然后使用已知的验证集数据对这两种标定模型进行验证。图 3和图 4分别表示了这两种标定模型的预测效果,其中横坐标为离线仪器检测的参考值,纵坐标为基于近红外光谱数据的预测值。可以看出,多输出MLS-SVR光谱标定模型对葡萄糖浓度、生物量和乙醇浓度的预测比较准确地拟合验证集数据,建模样本和验证集数据在参考线附近分布比较紧致。相较之下,单输出PLS光谱标定模型的预测结果和校正集数据拟合较为松散。
|
| 图 3 PLS标定模型预测值与参考值相关关系 Fig. 3 Correlation between predicted values and reference values of PLS model. (A) Glucose. (B) OD. (C) Ethanol. |
| |

|
| 图 4 MLS-SVR标定模型预测值与参考值相关关系 Fig. 4 Correlation between predicted values and reference values of MLS-SVR model. (A) Glucose. (B) OD. (C) Ethanol. |
| |
两种光谱标定模型的预测性能评价如表 2所示。可以看到,多输出MLS-SVR光谱标定模型对于葡萄糖浓度、生物量和乙醇浓度预测的RMSEP都较小,由此验证说明联合标定模型的预测准确性相对于PLS建立的独立标定模型有明显提高。而且该联合标定模型对应的R2亦相对较大,说明模型对于验证集的预测值同测量参考值相关性更高。尤其指出,对于生物量(OD)预测,联合标定模型对应的RPD为18.593 3,相较于PLS独立标定模型有显著提高,可用于过程实时控制和优化。同时,联合标定模型对于葡萄糖浓度和乙醇浓度的RPD亦都大于5,说明由此建立的定量分析模型能可靠地用于质量预测。
| Method | Analyte | RMSEP | R2 | RPD |
| PLS | Glucose | 4.137 6 | 0.954 1 | 4.692 1 |
| OD | 0.150 9 | 0.989 6 | 9.869 3 | |
| Ethanol | 1.349 8 | 0.975 6 | 6.434 1 | |
| MLS-SVR | Glucose | 3.309 1 | 0.991 9 | 5.866 9 |
| OD | 0.080 1 | 0.998 9 | 18.593 3 | |
| Ethanol | 1.346 9 | 0.991 3 | 6.447 8 |
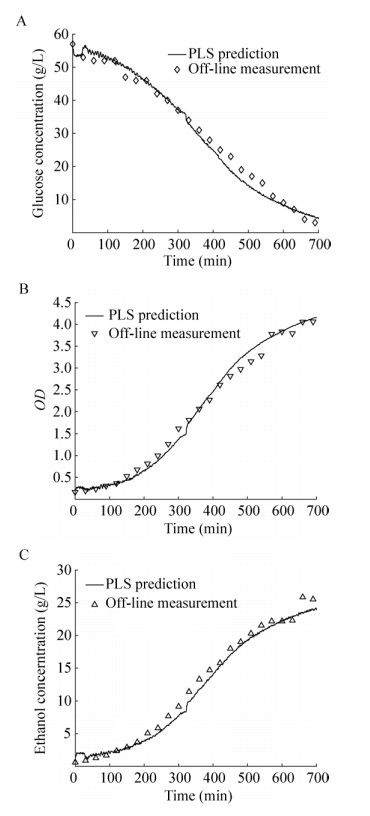
通过另外一个单独批次的乙醇发酵实验对于上述联合标定模型进行验证。采用PLS独立标定模型和MLS-SVR联合标定模型的监测结果如图 5、6所示,其中线条数据为基于近红外光谱采集数据实时预测结果,散点数据为采样离线检测参考值。可以看出,联合标定模型的实时预测结果同离线检测参考值更为贴近,然而PLS独立标定模型的预测结果相对偏差较大,进一步验证了联合标定模型具有更好的预测准确性。需要说明,上述实验中基于近红外光谱技术建立的在线监测联合标定模型可以对葡萄糖浓度、生物量和乙醇浓度进行实时监测,定时1 min给出一次测量结果,然而传统的离线检测方法需要取样,并且使用多个仪器对3种生物参数分别进行测量,耗时约30-60 min。
|
| 图 5 PLS模型预测值与实测值对比 Fig. 5 Comparison between PLS model prediction and the real measurement. (A) Glucose. (B) OD. (C) Ethanol. |
| |

|
| 图 6 MLS-SVR模型预测值与实测值对比 Fig. 6 Comparison between MLS-SVR model prediction and the real measurement. (A) Glucose. (B) OD. (C) Ethanol. |
| |
文中提出了一个基于近红外光谱技术原位实时检测乙醇发酵过程葡萄糖浓度、生物量以及乙醇浓度的方法。考虑到乙醇发酵过程为生长偶联型发酵过程,文中采用多变量输出预测的MLS-SVR方法来建立上述关键过程参数的联合标定模型。通过对乙醇发酵过程葡萄糖浓度、生物量和乙醇浓度进行在线监测的实验,并且与现有的PLS独立标定建模方法进行实验对比,验证了联合标定模型相对于独立标定模型有更好的预测精度和可靠性,且相较于传统的离线检测方法具有更好的实时性。由于近红外光谱对发酵过程中存在含氢基团的物质(如丙酮、丁酮、乙醇、蛋白、油脂等)具有较好的敏感性,因此文中方法对这类生物质发酵过程在线检测多组分参数具有很好的应用优势。当然,对于更为复杂的发酵过程,有待于进一步探讨如何基于近红外光谱分析有效和准确地同时检测相近组分的含量及其实时变化率,以及发酵过程质量预测和异常检测。
| [1] |
Zhang SL. Principles of Fermentation Engineering. Beijing: Higher Education Press, 2013: 1-5 (in Chinese). 张嗣良. 发酵工程原理. 北京: 高等教育出版社, 2013: 1-5. |
| [2] |
Zhuang YP, Chen HZ, Xia JY, et al. Progress in industrial bioprocess engineering in China. Chin J Biotech, 2015, 31(6): 778-796 (in Chinese). 庄英萍, 陈洪章, 夏建业, 等. 我国工业生物过程工程研究进展. 生物工程学报, 2015, 31(6): 778-796. |
| [3] |
Simon LL, Pataki H, Marosi G, et al. Assessment of recent process analytical technology (PAT) trends: A multiauthor review. Org Process Res Dev, 2015, 19(1): 3-62. DOI:10.1021/op500261y |
| [4] |
Yu Y, Zhang XH. Online parametric monitoring technique for biological fermentation reactor. Pharm Eng Des, 2011, 32(2): 41-47 (in Chinese). 于颖, 张小惠. 发酵类生物反应器参数在线监控技术. 医药工程设计, 2011, 32(2): 41-47. DOI:10.3969/j.issn.1008-455X.2011.02.012 |
| [5] |
Lu WZ, Yuan HF, Chu XL. Near Infrared Spectroscopy Instrument. Beijing: Chemical Industry Press, 2010: 14-17 (in Chinese). 陆婉珍, 袁洪福, 褚小立. 近红外光谱仪器. 北京: 化学工业出版社, 2010: 14-17. |
| [6] |
Chu XL, Lu WZ. Research and application progress of near infrared spectroscopy analytical technology in China in the past five years. Spectrosc Spect Anal, 2014, 34(10): 2595-2605 (in Chinese). 褚小立, 陆婉珍. 近五年我国近红外光谱分析技术研究与应用进展. 光谱学与光谱分析, 2014, 34(10): 2595-2605. DOI:10.3964/j.issn.1000-0593(2014)10-2595-11 |
| [7] |
Guo WL, Du YP, Zhou YC, et al. At-line monitoring of key parameters of nisin fermentation by near infrared spectroscopy, chemometric modeling and model improvement. World J Microbiol Biotechnol, 2012, 28(3): 993-1002. DOI:10.1007/s11274-011-0897-x |
| [8] |
Wang L, Liu T, Chen Y, et al. On-line monitoring of biomass in 1, 3-propanediol fermentation by Fourier-transformed near-infrared spectra analysis. Chin J Biotech, 2017, 33(1): 68-78 (in Chinese). 王路, 刘涛, 陈洋, 等. 基于傅里叶变换近红外光谱实时分析1, 3-丙二醇发酵过程生物量的在线监测方法. 生物工程学报, 2017, 33(1): 68-78. |
| [9] |
Rodrigues LO, Vieira L, Cardoso JP, et al. The use of NIR as a multi-parametric in situ monitoring technique in filamentous fermentation systems. Talanta, 2008, 75(5): 1356-1361. DOI:10.1016/j.talanta.2008.01.048 |
| [10] |
Wahjudi PN, Patterson ME, Lim S, et al. Measurement of glucose and fructose in clinical samples using gas chromatography/mass spectrometry. Clin Biochem, 2010, 43(1/2): 198-207. |
| [11] |
Wang ML, Wang JT, Choong YM. Simultaneous quantification of methanol and ethanol in alcoholic beverage using a rapid gas chromatographic method coupling with dual internal standards. Food Chem, 2004, 86(4): 609-615. DOI:10.1016/j.foodchem.2003.10.029 |
| [12] |
Chen M, Wang ZW, Hu CY, et al. Rapid evaluating of antimicrobial activity of vanillin with the microplate reader in 96-cell plate. Food Ferment Ind, 2009, 35(5): 63-66 (in Chinese). 陈默, 王志伟, 胡长鹰, 等. 酶标仪法快速评价香兰素的抑菌活性. 食品与发酵工业, 2009, 35(5): 63-66. |
| [13] |
Wang JY, Zhu SG, Xu CF. Biochemistry. 3rd ed. Beijing: Higher Education Press, 2002: 63-83 (in Chinese). 王镜岩, 朱圣庚, 徐长法. 生物化学. 3版. 北京: 高等教育出版社, 2002: 63-83. |
| [14] |
Xu S, An X, Qiao XD, et al. Multi-output least-squares support vector regression machines. Pattern Recogn Lett, 2013, 34(9): 1078-1084. DOI:10.1016/j.patrec.2013.01.015 |
| [15] |
Tamburini E, Vaccari G, Tosi S, et al. Near-infrared spectroscopy: a tool for monitoring submerged fermentation processes using an immersion optical-fiber probe. Appl Spectrosc, 2003, 57(2): 132-138. DOI:10.1366/000370203321535024 |
| [16] |
Chu XL, Yuan HF, Lu WZ. Progress and application of spectral data pretreatment and wavelength selection methods in NIR analytical technique. Proc Chem, 2004, 16(4): 528-542 (in Chinese). 褚小立, 袁洪福, 陆婉珍. 近红外分析中光谱预处理及波长选择方法进展与应用. 化学进展, 2004, 16(4): 528-542. DOI:10.3321/j.issn:1005-281X.2004.04.008 |
| [17] |
Rinnan Å, Van Den Berg F, Engelsen SB. Review of the most common pre-processing techniques for near-infrared spectra. TrAC Trends Anal Chem, 2009, 28(10): 1201-1222. DOI:10.1016/j.trac.2009.07.007 |
| [18] |
Zhang YJ, He BD, Fu XH, et al. Raman spectra combined with PSO-LSSVM algorithm for detecting the components in ternary blended edible oil. Spectrosc Spect Anal, 2017, 37(8): 2440-2445 (in Chinese). 张燕君, 何宝丹, 付兴虎, 等. 拉曼光谱结合PSO-LSSVM算法检测三组分食用调和油含量. 光谱学与光谱分析, 2017, 37(8): 2440-2445. |
| [19] |
Balakrishna P, Raman S, Trafalis TB, et al. Support vector regression for determining the minimum zone sphericity. Int J Adv Manuf Technol, 2008, 35(9/10): 916-923. |
| [20] |
Debruyne M, Serneels S, Verdonck T. Robustified least squares support vector classification. J Chemom, 2010, 23(9): 479-486. |
| [21] |
Rácz A, Vass A, Héberger K, et al. Quantitative determination of coenzyme Q10 from dietary supplements by FT-NIR spectroscopy and statistical analysis. Anal Bioanal Chem, 2015, 407(10): 2887-2898. DOI:10.1007/s00216-015-8506-8 |
| [22] |
Chen HZ, Chen F, Xu LL, et al. Grid search parameter optimization applied to near infrared LSSVM modeling quantitative analysis of fishmeal ash. J Anal Sci, 2016, 32(2): 198-202 (in Chinese). 陈华舟, 陈福, 许丽莉, 等. 基于网格搜索的参数优化方法用于鱼粉灰分的近红外LSSVM定量分析. 分析科学学报, 2016, 32(2): 198-202. |
| [23] |
Yan YL, Chen B, Zhu DZ, et al. Near Infrared Spectroscopy-Principles, Technologies and Applications. Beijing: China Light Industry Press, 2013: 162-177 (in Chinese). 严衍禄, 陈斌, 朱大洲, 等. 近红外光谱分析的原理、技术与应用. 北京: 中国轻工业出版社, 2013: 162-177. |
| [24] |
Blanco M, Peguero A. Influence of physical factors on the accuracy of calibration models for NIR spectroscopy. J Pharm Biomed Anal, 2010, 52(1): 59-65. DOI:10.1016/j.jpba.2009.12.009 |
| [25] |
Inagaki T, Schwanninger M, Kato R, et al. Eucalyptus camaldulensis density and fiber length estimated by near-infrared spectroscopy. Wood Sci Technol, 2012, 46(1/3): 143-155. |
 2019, Vol. 35
2019, Vol. 35