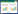中国科学院微生物研究所、中国微生物学会主办
文章信息
- 盛晓丹, 黄迪海, 郭卉, 刘霞, 秦卓明
- Sheng Xiaodan, Huang Dihai, Guo Hui, Liu Xia, Qin Zhuoming
- 融合蛋白TAT-RIG-I-GFP的原核表达及其跨膜递送
- Prokaryotic expression and transmembrane transfer of fusion protein TAT-RIG-I-GFP
- 生物工程学报, 2019, 35(8): 1463-1468
- Chinese Journal of Biotechnology, 2019, 35(8): 1463-1468
- 10.13345/j.cjb.190110
-
文章历史
- Received: March 24, 2019
- Accepted: June 3, 2019
- Published: June 20, 2019
2. 山东省农业科学院家禽研究所,山东 济南 250100
2. Institute of Poultry Science, Shandong Academy of Agricultural Science, Jinan 250100, Shandong, China
视黄酸诱导基因蛋白I (Retinoic acid induced gene I,RIG-I)作为RLRs家族的一员,是细胞内重要的病原识别受体,由两个串联的N-端半胱天冬酶募集结构域(CARD)、DExD/H解旋酶结构域和C端调节结构域(CTD)构成[1]。RIG-I在天然免疫反应中起关键作用,通过识别细胞质中的病毒ssRNA和dsRNA,激活下游Ⅰ型IFN的抗病毒反应。
近年来,诸多学者在鸭、鹅等水禽体内克隆到RIG-I基因和蛋白,并发现其介导IFN-Ⅰ型天然免疫反应,如激活IRF-3、IFN-α/γ、Mxl、PKR等的表达,在抵抗禽流感病毒(Avian influenza virus,AIV)、新城疫病毒(Newcastle disease virus,NDV)、鸭坦布苏病毒(Tembusu virus,TMV)等病原感染和清除病毒方面发挥着重要作用[2-3]。由于鸡体内缺失RIG-I受体,而鸭源、鹅源RIG-I基因均可在DF-1细胞中稳定表达,并可识别H5N1等病毒核酸[4],因此,RIG-I基因在鸡源细胞中的信号通路研究成为家禽抗病育种和抗病毒药物筛选的焦点。
反式激活蛋白(Transactivator,TAT)是蛋白质转导结构域(PTD)超家族的成员,其与人免疫缺陷病毒-1 (HIV-1) RNA 5′端LTR结合后能够提高HIV基因的转录水平。TAT核心结构域(YGRKKRRQRRR)能够携带蛋白质、多肽、DNA等外源性大分子穿透生物膜和生物屏障进入不同的细胞[5]。研究表明,TAT核心结构域不仅能够促进大肠杆菌中的异源蛋白质表达,还能提高异源蛋白质的产量和溶解度[6]。本研究构建RIG-I、GFP与TAT重组蛋白,探讨其在DF-1细胞的跨膜递送功能,为家禽抗病毒药物的研制提供基础。
1 材料与方法 1.1 细胞、质粒和实验动物DF-1细胞、DH5α由山东省农业科学院家禽研究所惠赠,pCD513B由本实验室保存,健康绿头鸭Anas platyrhynchos购自济南黄台农贸市场。
1.2 试剂Tks Gflex DNA Polymerase、In-Fusion® HD Cloning Kit、限制性内切酶XhoⅠ、NheⅠ、pET28a (+)载体、DL5000 DNA marker、His60 Ni Gravity Columns (镍亲和层析柱)、DMEM培养基、胶回收试剂盒购自TaKaRa公司;LipofectamineTM2000转染试剂购自Invitrogen公司;质粒小量提取试剂盒购自天根公司;PCR引物由北京六合华大基因科技有限公司合成。
1.3 引物设计根据绿头鸭Anas platyrhynchos RIG-1基因(GenBank登录号:EU363349)设计含有TAT核心结构域序列的RIG-I特异性引物P1、P2(下划线部分为TAT序列);按照In-Fusion®HD Cloning Kit说明书要求,分别设计TAT-RIG-I和GFP的原核表达引物P3、P4和P5、P6。同时,根据序列特点设计两端带接头的RIG-I-GFP原核表达引物P7和P8 (表 1)。
| Primer | Primer sequence (5′–3′) | Size (bp) |
| P1 | CACATATGTACGGCCGCAAGAAACGCCGCCAGCGCCGCCGCATGACGGCGG | 2 832 |
| P2 | GCCTCGAGCTAAAATGGTGGGTACAAGTTGG | |
| P3 | CGCGGCAGCCATATTACGGCCGCAAGAAACG | 2 892 |
| P4 | TTCTCCTTTGCCCATAAATGGTGGGTACAAGTTGGAC | |
| P5 | TTGTACCCACCATTTATGGGCAAAGGAGAAGAACTT | 774 |
| P6 | GTGGTGGTGCTCGAGTTTGTATAGTTCATCCATGCC | |
| P7 | GTGGCGGCCGCTCGAGATGACGGCGGACGAGAAGCG | 3 513 |
| P8 | GCCCTCTAGACTCGAGTTATTTGTATAGTTCATCCATGCCA | |
| Note: the underlined part of the primer sequence is the Transactivator (TAT). | ||
提取健康绿头鸭的脾脏组织,按Chen等[2]方法制备其cDNA,并以其为模板,使用特异性引物P1、P2扩增TAT-RIG-I片段。扩增条件:94 ℃预变性1 min;98 ℃ 10 s,63 ℃ 15 s,68 ℃ 1.5 min,30个循环。将扩增出的PCR产物,经琼脂糖凝胶电泳检测并纯化回收,同时将其转化至pET28a,挑选阳性克隆,获得重组质粒pET-TAT-RIG-I。
1.5 融合蛋白表达载体pET-TAT-RIG-I-GFP和pET-RIG-I-GFP的构建 1.5.1 pET-TAT-RIG-I-GFP的构建以pET-TAT-RIG-I重组质粒为模板,利用P3、P4为引物扩增TAT-RIG-I片段;以pCD513B为模板,利用P5、P6为引物扩增GFP。将扩增出的产物片段经琼脂糖凝胶电泳鉴定后回收,按照In-Fusion® HD Cloning Kit说明书要求与含有Xho Ⅰ、NheⅠ双酶切的pET-28a(+)载体连接,构建pET-TAT-RIG-I-GFP。连接产物转化感受态细胞DH5α,挑取阳性克隆,进行增菌培养,提取质粒DNA,进行PCR鉴定并测序。
1.5.2 pET-RIG-I-GFP的构建以pET-TAT-RIG-I-GFP为模板,P7、P8为引物扩增RIG-I-GFP,构建pET-RIG-I-GFP,方法同上。重组质粒转化、PCR鉴定和测序同1.5.1。
1.6 重组载体的蛋白表达、纯化和SDS-PAGE将pET-TAT-RIG-I-GFP和pET-RIG-I-GFP转化感受态细胞DE3 (大肠杆菌BL21),接种于含卡那霉素的LB平板上37 ℃培养过夜,划取单菌落至5 mL LB培养基中,37 ℃、200 r/min振摇过夜;次日按1︰100的体积比接种至20 mL LB液体培养基中,37 ℃、200 r/min振摇1 h后添加IPTG使其浓度为0.5 mmol/L,诱导16 h后,离心收集菌体,PBS漂洗2次,超声波裂解菌体(超声破碎3 s,间隔4 s,超声30次,功率为200 W),4 ℃、10 000 r/min离心25 min,收集上清,采用His60镍亲和层析柱分别对TAT-RIG-I-GFP和RIG-I-GFP的融合蛋白进行纯化和SDS-PAGE分析。同时,设未诱导的和未纯化的菌体上清(同上处理)作为对照。
1.7 融合蛋白的跨膜递送将纯化后的TAT-RIG-I-GFP和RIG-I-GFP蛋白脱盐处理,加入适量无血清DMEM稀释。培养DF-1细胞至铺满单层,弃上清,清洗后分别加入1 mL TAT-RIG-I-GFP、RIG-I-GFP和无血清DMEM孵育1 h,用PBS清洗3遍后置于荧光显微镜下观察荧光信号。
2 结果与分析 2.1 重组质粒pET-TAT-RIG-I的构建以绿头鸭的cDNA为模板,扩增含TAT序列的RIG-I基因并转化至pET28a,构建原核表达载体pET-TAT-RIG-I。经PCR鉴定和测序结果显示,扩增出的TAT-RIG-I片段,全长为2 832 bp,其中的RIG-I基因片段与绿头鸭RIG-I基因(GenBank登录号:EU363349)同源性为100% (图 1)。
|
| 图 1 重组质粒TAT-RIG-I基因的PCR鉴定 Fig. 1 PCR identification of TAT-RIG-I gene. M: DNA marker DL2000; 1: PCR identification of TAT-RIG-I gene. |
| |
按照1.5.1和1.5.2方法分别构建带有荧光标记的pET-TAT-RIG-I-GFP和pET-RIG-I-GFP融合蛋白表达载体,转化至DH5α进行扩增,提取其质粒DNA,进行PCR鉴定和测序,扩增出的目的基因片段长度分别为3 546 bp和3 513 bp,结果符合预期。这表明TAT-RIG-I-GFP和RIG-I-GFP均已成功克隆至pET28a (+)载体(图 2)。

|
| 图 2 重组质粒TAT-RIG-I-GFP和RIG-I-GFP的PCR鉴定 Fig. 2 PCR identifications of TAT-RIG-I-GFP and RIG-I-GFP. M: DNA marker DL5000; 1: control group of pET28a; 2: PCR identification of pET-RIG-I-GFP; 3: PCR identification of pET-TAT-RIG-I-GFP. |
| |
将pET-TAT-RIG-I-GFP和pET-RIG-I-GFP两种重组载体同时转化DE3感受态细胞,增菌培养,分别进行IPTG诱导和非诱导的蛋白表达。结果发现,该两种重组载体在IPTG诱导后,其蛋白表达量明显增高,且与IPTG未诱导组相比,在116.0–200.0 kDa之间明显多出一个蛋白条带,且经过His60镍亲和层析柱纯化后更加明显,相对分子量约在130 kDa,二者的大小差异不大(图 3)。
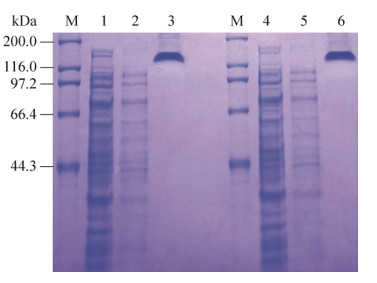
|
| 图 3 pET-TAT-RIG-I-GFP和pET-RIG-I-GFP的SDS-PAGE分析和比较 Fig. 3 Analysis and comparison of pET-TAT-RIG- I-GFP and pET-RIG-I-GFP of SDS-PAGE. M: protein marker 200 kDa; 1: the expressed unpurified protein of pET-TAT-RIG-I-GFP; 2: the uninduced expressed protein of pET-TAT-RIG-I-GFP; 3: the expressed purified protein of TAT-RIG-I-GFP; 4: the expressed unpurified protein of pET-RIG-I-GFP; 5: the uninduced expressed protein of pET-RIG-I-GFP; 6: the expressed purified protein of RIG-I-GFP. |
| |
利用纯化和脱盐处理的TAT-RIG-I-GFP和RIG-I-GFP两种融合蛋白孵育DF-1细胞1 h后清洗,置于荧光显微镜下观察。结果发现:TAT-RIG-I-GFP孵育的DF-1细胞内出现显著的绿色荧光信号(200×),而RIG-I-GFP、DMEM和DF-1细胞的空白对照组,其细胞内均无绿色荧光。这表明携带TAT的融合蛋白可跨膜递送进入DF-1细胞,而未携带TAT的融合蛋白则不能进入细胞(图 4)。

|
| 图 4 DF-1细胞不同组别处理的荧光显微观察(200×) Fig. 4 Fluorescence microscopy of different groups in DF-1 cells (200×). (A) Negative (Bright, DF-1). (B) Negative (DMEM). (C) Negative (RIG-I-GFP). (D) Positive (TAT-RIG-I-GFP). |
| |
RIG-I基因在水禽抗病毒天然免疫反应中发挥识别病毒核酸、激活Ⅰ型IFN的重要作用,并可识别内源性RNA,如miR-136、miR-145和内源性逆转录病毒等。此外,RIG-I基因还参与抗菌免疫反应、细胞发育分化等过程[7-9]。
在禽类RIG-I基因的相关研究中发现AIV、NDV等感染水禽后主要被RIG-I基因的受体识别,而该基因在鸡体内缺失,尽管鸡体内的MDA5和LGP2可以识别某些侵入鸡源细胞的病毒,但该基因在进化过程中受到负向净化选择,因此RIG-I基因的缺失可能成为鸡对禽流感、新城疫等病毒抵抗力低的主要原因之一[10]。研究表明,鸭源RIG-I基因可在DF-1细胞内稳定表达,并显著抑制AIV活性[11]。利用Piggy Bac转座系统可构建稳定表达鹅源RIG-I基因的鸡传代细胞系,为研究鸡源细胞抗病毒机制提供了良好的模型[12]。尽管RIG-I基因对提高鸡源细胞抗病毒能力的研究已有较大进展,但该蛋白不能进入细胞,导致其在临床上应用受限。TAT作为研究最多的细胞穿膜肽,富含碱性氨基酸残基的结构特性使其具有较高正电荷,能与细胞表面带负电荷的分子结合, 并激活携带TAT的肽或蛋白质经细胞摄取和内体逃逸进入细胞质[13-14]。TAT不仅可与抗体或功能性蛋白质结合进入细胞内抑制病毒增殖,还可以与抗原结合以增强其免疫性[15-17]。与其他转运载体相比,TAT跨越生物膜的转运效率较高,且不受所携带的物质大小影响,可转导分子量超过100 kDa的蛋白,且不会改变所携带蛋白的活性和功能,更不会改变原有的细胞基因组结构。TAT以其无细胞毒性和优异的生物安全特性,而成为新型黏膜免疫佐剂和治疗性蛋白质药物的研究热点[18-19]。
此外,GFP作为报告基因,因其荧光信号稳定、生物安全性好、便于观察和检测等优势,被广泛用于分子标记、药物筛选和融合抗体等研究。
本研究首次构建了pET-TAT-RIG-I-GFP重组表达载体,并在DE3中稳定表达,其表达产物(TAT-RIG-I-GFP融合蛋白)的相对分子质量约为130 kDa,与预期的结果一致。经过纯化和脱盐处理,其能够进入DF-1细胞,并在荧光显微镜下观察到其细胞内具有明显的绿色荧光,而未携带TAT的RIG-I-GFP融合蛋白则不能进入DF-1细胞。这表明,TAT在跨膜递送过程中发挥了关键作用。
下一步的工作重点是对构建的携带有TAT的表达蛋白及其抗病毒的生物学活性进行系统性的研究,进而为家禽的抗病毒药物筛选和转基因抗禽流感品种鸡的培育奠定良好的基础。
| [1] |
Yoneyama M, Onomoto K, Jogi M, et al. Viral RNA detection by RIG-I-like receptors. Curr Opin Immunol, 2015, 32: 48-53. DOI:10.1016/j.coi.2014.12.012 |
| [2] |
Chen Y, Zhang Y, Huang ZY, et al. Molecular characterization, expression patterns, and subcellular localization of RIG-I in the Jinding Duck (Anas platyrhynchos domesticus). Developmental & Comparative Immunology, 2013, 41(4): 766-771. |
| [3] |
Fu GH, Chen CT, Huang Y, et al. Comparative analysis of transcriptional profiles of retinoic-acid- induced gene I-like receptors and interferons in seven tissues from ducks infected with avian Tembusu virus. Arch Virol, 2016, 161(1): 11-18. DOI:10.1007/s00705-015-2621-x |
| [4] |
Barber MRW, Aldridge JR Jr, Fleming-Canepa X, et al. Identification of avian RIG-I responsive genes during influenza infection. Mol Immunol, 2013, 54(1): 89-97. |
| [5] |
He HC, Liu ST, Pan JR, et al. Possible mecanism of transmembrane of TAT-PTD fusion protein. Chin J Biochem Mol Biol, 2006, 22(9): 704-710 (in Chinese). 何火聪, 刘树滔, 潘剑茹, 等. TAT-PTD融合蛋白可能存在的跨膜递送作用机制. 中国生物化学与分子生物学报, 2006, 22(9): 704-710. DOI:10.3969/j.issn.1007-7626.2006.09.004 |
| [6] |
Wu YH, Ren CH, Gao Y, et al. A novel method for promoting heterologous protein expression in Escherichia coli by fusion with the HIV-1 TAT core domain. Amino Acids, 2010, 39(3): 811-820. DOI:10.1007/s00726-010-0534-2 |
| [7] |
Zeng M, Hu ZP, Shi XL, et al. MAVS, cGAS, and endogenous retroviruses in T-independent B cell responses. Science, 2014, 346(6216): 1486-1492. DOI:10.1126/science.346.6216.1486 |
| [8] |
Karlsen TA, Brinchmann JE. Liposome delivery of microRNA-145 to mesenchymal stem cells leads to immunological off-target effects mediated by RIG-I. Mol Ther, 2013, 21(6): 1169-1181. DOI:10.1038/mt.2013.55 |
| [9] |
Zhao LZ, Zhu JP, Zhou HB, et al. Identification of cellular microRNA-136 as a dual regulator of RIG-I-mediated innate immunity that antagonizes H5N1 IAV replication in A549 cells. Sci Rep, 2015, 5: 14991. DOI:10.1038/srep14991 |
| [10] |
Liu YR. Neutral selection analysis and genetic differentiation analysis of coding sequence of MDA5 and LGP2 in chickens[D]. Guangzhou: South China Agricultural University, 2016 (in Chinese). 刘怡然.鸡MDA5、LGP2基因编码区的中性选择分析与遗传分化分析[D].广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923108.htm |
| [11] |
Zhang YC, Hu WJ, Wang JC, et al. Detection of RIG-1 expression in duck tissues and its anti-avian influenza virus activity in vitro. Chin J Prev Vet Med, 2013, 35(12): 955-959 (in Chinese). 张雅春, 胡卫杰, 王建超, 等. 鸭RIG-1基因的组织表达及体外抗禽流感病毒活性研究. 中国预防兽医学报, 2013, 35(12): 955-959. |
| [12] |
Hu Y, Sun YY, Wang XX, et al. Construction of chicken embryo fibroblast cell line DF-1 stably expressing goose RIG-I through piggyBac transposon system. Chin J Anim Infect Dis, 2014, 22(3): 53-60 (in Chinese). 胡跃, 孙英杰, 王晓旭, 等. 利用PiggyBac转座系统构建稳定表达鹅RIG-I的DF-1细胞系. 中国动物传染病学报, 2014, 22(3): 53-60. |
| [13] |
Kim JS, Choi DK, Park SW, et al. Quantitative assessment of cellular uptake and cytosolic access of antibody in living cells by an enhanced split GFP complementation assay. Biochem Biophys Res Commun, 2015, 467(4): 771-777. DOI:10.1016/j.bbrc.2015.10.066 |
| [14] |
Milech N, Longville BAC, Cunningham PT, et al. GFP-complementation assay to detect functional CPP and protein delivery into living cells. Sci Rep, 2015, 5: 18329. DOI:10.1038/srep18329 |
| [15] |
Zhang XM, Jing J, Li WL, et al. Porcine Mx1 fused to HIV Tat protein transduction domain (PTD) inhibits classical swine fever virus infection in vitro and in vivo. BMC Vet Res, 2015, 11: 264. DOI:10.1186/s12917-015-0577-4 |
| [16] |
Kim HJ, Kim MH Kim JT, et al. Intracellular transduction of TAT-Hsp27 fusion protein enhancing cell survival and regeneration capacity of cardiac stem cells in acute myocardial infarction. J Control Release, 2015, 215: 55-72. DOI:10.1016/j.jconrel.2015.07.026 |
| [17] |
Li LL, Guo YT, Li ZL, et al. Protein transduction domain can enhance the humoral immunity and cross-protection of HPV16L2 peptide vaccines. Biomed Rep, 2016, 4(6): 746-750. DOI:10.3892/br.2016.647 |
| [18] |
Van Den Berg A, Dowdy SF. Protein transduction domain delivery of therapeutic macromolecules. Curr Opin Biotechnol, 2011, 22(6): 888-893. DOI:10.1016/j.copbio.2011.03.008 |
| [19] |
Shim BS, Cheon IS, Lee E, et al. Development of safe and Non-Self-immunogenic mucosal adjuvant by recombinant fusion of cholera toxin A1 subunit with protein transduction domain. J Immunol Res, 2018, 2018: 9830701. |
 2019, Vol. 35
2019, Vol. 35