中国科学院微生物研究所、中国微生物学会主办
文章信息
- 徐佳, 关越琪, 于芷懿, 张成帅, 关凤英, 刘芬
- Xu Jia, Guan Yueqi, Yu Zhiyi, Zhang Chengshuai, Guan Fengying, Liu Fen
- 基因敲除技术及其在研究线粒体动力学与胰岛素抵抗关系中的应用进展
- Gene knockout technology and its application in the study of the relationship between mitochondrial dynamics and insulin resistance
- 生物工程学报, 2019, 35(8): 1382-1390
- Chinese Journal of Biotechnology, 2019, 35(8): 1382-1390
- 10.13345/j.cjb.190121
-
文章历史
- Received: April 3, 2019
- Accepted: June 10, 2019
- Published: June 27, 2019
2. 吉林大学 临床医学院,吉林 长春 130021
2. College of Clinical Sciences, Jilin University, Changchun 130021, Jilin, China
基因敲除在20世纪80年代后期出现,是指通过特定的措施使生物体内特定的基因失活或缺失的基因重组技术。一般而言,基因敲除是依据DNA同源重组的原理,用设计的同源序列替换靶基因序列进而达到敲除的目的[1]。
近20年来,随着对分子生物学实验技术的需求不断加强,位点特异性重组(Site-specific recombination)技术的发展也日渐兴盛,它是目前基因敲除技术中应用最方便和广泛的一项技术。该项技术利用位点特异性重组酶(Site-specific recombinase,SSR)对特异性位点(Secombination target site,RTS)识别,在基因组上完成外源基因的倒置、置换和删除等操作,具有重组效率高、靶向性好、操作简单、重复性好等优点[2],目前广泛应用于实验动物领域,主要通过干预目的基因进行相关疾病发病机制及治疗的研究[3]。本文拟从基因敲除技术的发展、线粒体动力学与胰岛素抵抗关系的研究进展及基因敲除鼠在胰岛素抵抗中的研究进展三方面进行综述。
1 位点特异性重组系统在实验动物研究中的发展位点特异性重组系统通常由SSR及RTS两种组分构成。在研究比较成熟的SSR系统中,按照SSR序列的同源性可分成两个家族:酪氨酸家族和丝氨酸家族。其中来自酪氨酸家族的Cre/lox P、FLP/FRT和Dre/Rox是目前研究最深入应用最广泛的位点特异性重组系统[4]。
1.1 Cre/lox P系统Cre (Causes recombination)重组酶于1981年从P1噬菌体中发现,编码由343个氨基酸组成的38 kDa单体蛋白[5]。它具备一定的催化活性,并且类似于限制性核酸内切酶,识别的特异性位点称为lox P,能同时使2个lox P位点间的基因特异性缺失。lox P的长度为34 bp,由2个13 bp的反向回文序列和1个8 bp核心序列组成。Cre重组酶具有高达70%的重组效率,并且可作用于各种结构的DNA底物(如环状、线性甚至超螺旋DNA)而不需要额外的重组辅助因子[6],因此它被公认为是基因组工程的最佳SSR。目前正在研究和开发各种类型的Cre,例如与荧光分子融合的荧光Cre、经过优化的高表达Cre和在N-末端和C-末端具有不同启动子的Cre。1998年Sauer和Henderson创建了表达Cre的小鼠细胞系,并提示由Cre介导的位点特异性重组发生在小鼠体内,表明原核Cre/lox P系统可在哺乳动物细胞中起作用,是一种强大的哺乳动物基因编辑技术[7]。
这一系统操作非常简单,在待敲除的一段目的基因序列的侧翼各设置1个lox P序列,经过Cre的切除得到Flox P (Flanked by lox P)小鼠。当Flox P小鼠在与表达Cre的小鼠杂交时,目的基因正常表达,从而避免全基因敲除期间可能发生的严重发育缺陷或胚胎致死。为了实现更精准的基因敲除,可将Cre基因置于诱导型启动子或增强子控制下,通过诱导Cre重组酶的表达来敲除2个lox P位点间的靶基因,使目的基因在小鼠发育的特定阶段和特定组织中失活,而该基因在其他组织中正常表达,从而实现对目的基因时间和空间的双重调控[8-9],目前的诱导型Cre重组酶系统主要有他莫昔芬(TAM)和四环素(TET)。
Cre/lox P系统普遍应用于各种生物的遗传重组。Wesam等[10]使用Cre/lox P系统产生了条件性白细胞介素-1受体1 (IL-1R1)小鼠突变体;Yuki等[11]应用Cre/lox P系统第一次构建出莱茵衣藻Chlamydomonas reinhardtii无标记的转基因菌株。Chen等[12]通过组合使用CRISPR/Cas9和Cre/lox P系统在秀丽隐杆线虫中进行了靶向染色体重排。
敲除效率是Cre/lox P系统特异性敲除的一个重要问题。效率由几个因素决定,包括Cre重组酶的活性、Flox P的性质以及Flox P在细胞增殖或存活中的功能。组织特异性Cre的表达水平由调控元件的活性所限制,而调控元件也控制内源性特异性基因。如果Cre表达水平不足以介导重组,则可以在构建载体的过程中修饰这些调节元件(例如去除沉默子),然而这些修饰也可能导致Cre表达中组织或细胞特异性丧失。人源化Cre (hCre或iCre)在哺乳动物细胞中表现出比常规Cre更高的活性,已被用于提高敲除效率[13]。另一个需要注意的问题是当Cre高水平表达时,Cre具有细胞毒性[14]。为了最小化Cre毒性,最好以诱导方式控制Cre的表达或活性,或者诱导Cre自身失活,即Cre基因侧翼各放置一个lox P位点。
1.2 FLP/FRT系统1980年Hartley等对酿酒酵母的2 μm双链环状DNA质粒的序列进行了测序,发现其结构上存在2个599 bp的反向重复序列[15]。这两个重复序列之间能重组的特性,使酵母中2 μm环状质粒存在两种不同的构型[16-18]。经过更深入的研究,发现在2 μm环状质粒内发生的DNA重组属于位点特异性重组。Broach等将催化这一重组反应的重组酶命名为“FLP” (Flippase recombination enzyme)[19]。
FLP的特异性识别序列FRT长度为48 bp,包含3个13 bp的重复序列和1个8 bp的非对称间隔区[20-21]。其中2个13 bp的重复序列与8 bp间隔区相邻,同时也是重组酶识别和结合的位点,而FLP介导的DNA链断裂、倒置、重接等重组过程都发生在8 bp间隔区[22]。FLP/FRT系统广泛应用于微生物和高等真核生物,如大肠杆菌、丝状真菌、玉米、秀丽隐杆线虫、蚕、小鼠等[23-26]。
Cre和FLP重组酶都属于酪氨酸位点SSR,但是FLP介导的基因敲除效率较低。后来意识到FLP的效率之所以低于Cre,是因为哺乳动物细胞的最适温度不合适。FLP重组酶的最适反应温度是30 ℃,而不是一般细胞培养所需要的37 ℃[27]。因此,开发了增强形式的FLP——FLPe和FLPo,这使FLPe/FRT系统替代了Cre/lox P系统。Raymond等[28]的研究表明,FLPe和FLPo在小鼠ES细胞和转基因小鼠中的重组效率达到了Cre重组酶的水平。如今,Cre/lox P和FLPe/FRT系统经常组合使用来制备靶向重组体,FLPe/FRT系统负责去除标记物,而Cre/lox P系统负责DNA片段的研究。国际基因敲除小鼠协会(The international knockout mouse consortium, IKMC)经常利用这种组合策略来生产新的基因敲除小鼠系。
1.3 Dre/Rox系统Cre重组酶的毒性以及FLP的较弱特性使寻找新的SSR工具迫在眉睫。因此,最近出现了Cre样SSR——Dre,经研究它是一种与Cre同样出色的重组酶。Dre在肠杆菌噬菌体D6的研究中被确定为Cre样酶,特异的识别位点是Rox[29]。
在大肠杆菌和中国仓鼠卵巢细胞中测试了Dre/Rox系统,结果良好[30]。Anastassiadis等[31]在小鼠中已经成功应用了Dre/Rox系统。Joon等[32]提出Dre/Rox的重组作为一种新的有效的方法,可用于斑马鱼时间和空间的双重调节。
Dre/Rox的进一步应用包括基因组工程,如染色体易位、重组[33]。目前Dre/Rox系统研究较少,期待未来有关Dre/Rox系统的更多研究,为基因敲除技术的发展增添新的生机。
1.4 小结位点特异性重组不仅可以避免传统基因敲除技术导致的严重发育不足和胚胎致死,还可以对目的基因的表达从时空两方面进行调控。其中Cre/lox P系统和FLP/FRT系统由于重组效率较高、操作简单,已经广泛应用于各种生物的基因重组特别是高等真核生物的研究中,实现了各种常规技术难以实施的操作,如基因敲除、点突变、染色体易位、染色体组的大片段删除等[34]。三种系统的优缺点比较如表 1所示。
| Systems | Origin | Advantages | Disadvantages |
| Cre/lox P | P1 phage | High reorganization efficiency | Cre is cytotoxic |
| FLP/FRT | Saccharomyces cerevisiae | Wide range of applications | Low reorganization efficiency |
| Dre/Rox | Enterobacteriaceae phage D6 | High reorganization efficiency | Narrow range of applications |
胰岛素抵抗(Insulin resistance,IR)是指靶组织在正常的血浆胰岛素水平无法发挥正常降糖作用而产生的病理变化及临床表现[35]。IR被公认为是糖尿病、高血压、高血脂、肥胖和动脉硬化等代谢性疾病的共同土壤,同时,也是2型糖尿病及各种并发症发生发展的重要因素。人类前瞻性研究认为IR是未来诊断2型糖尿病最好的预测指标[36]。而最新研究发现IR与线粒体动力学失衡密切相关,但两者之间的因果关系尚不明晰。
2.1 线粒体动力学线粒体的形态并不是一成不变的,相反在不同的生理条件下,线粒体经历高度动态变化以适应细胞能量需求。通过线粒体融合和裂变的连续循环发生,细胞内线粒体充分均匀分布,维持其网络的动态平衡,称为线粒体动力学(Mitochondrial dynamics)。线粒体融合/分裂周期可以平衡线粒体的生物能量、减少轻微受损的线粒体、去除严重受损的线粒体[37]。融合和裂变过程对于维持正常的细胞功能至关重要,例如线粒体呼吸活动、线粒体DNA (mtDNA)分布、细胞凋亡、细胞存活和钙信号传导,而该过程由融合/分裂相关蛋白精确调控。
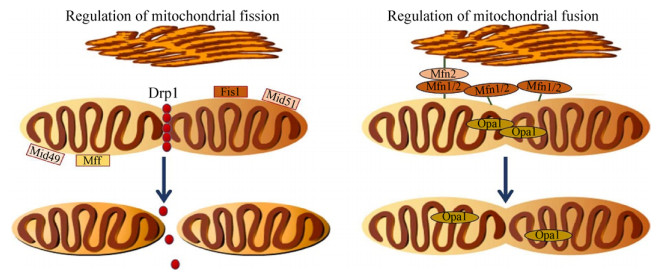
目前发现参与哺乳动物线粒体动力学的GTPase家族成员蛋白有:线粒体融合执行分子,包括定位于内膜的optic atrophy 1 (Opa1)和定位于外膜的Mitofusin 1/2 (Mfn1/2),两个线粒体融合时,首先寻找合适的平面进行外膜的融合,该过程由Mfn1/2介导,然后在Opa1的介导下进行内膜的融合,同时Opa1参与维持线粒体的嵴结构;线粒体分裂执行分子,包括跨膜蛋白fission protein 1 (Fis1)、胞质中的dynamin-related protein 1 (Drp1)和介导Drp1募集的外膜蛋白mitochondrial fission factor (Mff),线粒体分裂时,Drp1组装成环状结构以GTP依赖性方式收缩线粒体膜,而Fis1锚定于外膜使线粒体分裂。线粒体分裂因子49 kDa (MiD49)和51 kDa (MiD51)还可以在没有Fis1和Mff的情况下介导裂变[38]。线粒体融合分裂过程见图 1。线粒体融合被认为是有益的,因为它与线粒体功能和ATP的产生增加有关。相反,过度的线粒体分裂是有害的,因为它影响线粒体功能并使ROS增加[39]。总之,线粒体动力学是调节线粒体功能和形态的主要方式,对正常的生命活动具有非常重要的生理意义,而上述融合/分裂关键蛋白发生异常即可引发线粒体动力学失衡,进而诱发各种疾病状态。
|
| 图 1 线粒体融合/分裂的调控过程 Fig. 1 Regulation of mitochondrial fusion and fission. |
| |
虽然有很多类型的体细胞表达胰岛素受体,但是肝脏、骨骼肌和白色脂肪组织是胰岛素产生生物学效应的主要器官,在能量代谢中直接发挥作用,与葡萄糖稳态密切相关,因此IR也主要在这3种组织中发生。
肝脏是机体能量代谢的枢纽,在糖脂代谢中发挥着决定性作用。作用于肝脏的胰岛素是其他组织的2–3倍,而胰岛素能快速有效地降低肝脏葡萄糖输出(Hepatic glucose production,HGP),因此肝胰岛素抵抗是2型糖尿病发病机制的重要因素。IR状态下,胰岛素抑制HGP的能力显著下降,表现为肝糖异生和糖原分解增加,从而使肝葡萄糖输出增多,进一步加重高血糖。目前已有证据显示,在肥胖的db/db小鼠存在着肝细胞ATP水平下降、线粒体功能紊乱、肝脏线粒体呼吸作用和脂肪酸氧化能力减弱的表型。而蛋白表达方面,介导线粒体分裂的Drp1有不同程度的增多,而介导线粒体融合的Mfn2表达降低了45%[40]。
骨骼肌是一种耗能的组织,它负责高达80%的胰岛素作用下的葡萄糖消耗[41],IR状态下,骨骼肌对葡萄糖的摄取和利用降低,肌糖原生成减少。在胰岛素抵抗患者的肌肉活检中发现,线粒体呼吸链生物氧化能力下降,同时电镜观察到线粒体密度和数目明显降低,提示骨骼肌在IR状态下线粒体动力学失衡[42]。电镜观察Zucker大鼠骨骼肌细胞显示线粒体网络结构降低了近25%,且融合执行分子Mfn2表达水平显著下降[43]。Jheng等[44]发现高脂诱导骨骼肌细胞可以增加线粒体分裂蛋白Drp1和Fis1的表达,促进氧化应激,减少ATP生成,抑制胰岛素刺激下的葡萄糖摄取和利用。
脂肪组织是一个巨大的内分泌器官,它分泌多种脂肪因子如脂联素、瘦素和TNF-α,以调节其他组织如肝脏和肌肉中的葡萄糖代谢,进而维持葡萄糖的体内平衡,而且它对胰岛素非常敏感。在IR状态下,胰岛素抑制脂肪分解作用减弱,从而使血液中的游离脂肪酸増多[45]。Chun等[46]发现用高浓度的游离脂肪酸处理已分化的3T3-L1脂肪细胞,线粒体分裂蛋白Drp1表达升高,而线粒体融合蛋白Mfn2表达下降。Li等[47]报道二甲双胍和白藜芦醇通过抑制Drp1的活性来保护线粒体完整性,并通过抑制内质网应激阻止了NLRP3炎性体激活,从而保护脂肪组织免受高葡萄糖损伤。
以上研究发现线粒体动力学失衡即线粒体融合/分裂蛋白异常与IR密切相关,为进一步研究线粒体动力学失衡与IR的因果关系,编码融合/分裂相关蛋白的基因敲除鼠被大量应用于相关研究当中。
3 基因敲除鼠在研究线粒体动力学与胰岛素抵抗关系中的应用 3.1 肝脏特异性敲除drp1(drp1LKO)小鼠drp1LKO (drp1-Liver-KO)小鼠是drp1lox P/lox P小鼠和Alb-Cre小鼠杂交产生的。
高脂饮食喂养时,与对照小鼠相比,drp1LKO小鼠的肝脏和附睾白色脂肪重量减少,胰岛素敏感性升高、葡萄糖耐量显著改善,但血浆胰岛素水平没有显著差异。分析糖酵解关键酶(丙酮酸激酶[PK1]、葡萄糖激酶[GCK])、糖异生关键酶(磷酸烯醇式丙酮酸羧激酶[PEPCK]、葡萄糖-6-羧酸酶[G6pase])和过氧化物酶体增殖激活受体γ共激活因子1α (PGC-1α)的mRNA水平,发现GCK、G6pase和PGC-1α在禁食的drp1LKO小鼠的肝脏中显著下调[48]。显示肝脏特异性敲除drp1可以抑制高脂饮食诱导的肥胖,故drp1可能是干预代谢性疾病如肥胖症和糖尿病的潜在靶点。
3.2 肝脏特异性敲除mfn1(mfn1LKO)小鼠mfn1LKO小鼠是mfn1lox P/lox P小鼠与白蛋白启动子控制下表达Cre重组酶的C57BL/6小鼠杂交产生的。经过Western blotting验证,mfn1LKO小鼠肝脏中Mfn1表达完全消失。肝脏中MFN1表达的缺失伴随着Mfn2和线粒体动力学其他蛋白的补偿性增加,例如Opa1、Drp1和MFF,这提示肝脏线粒体动力学的改变。肝脏中的Mfn1缺乏导致优先使用脂质作为能量来源且线粒体生物合成增加。在高脂饮食条件下,相比于对照小鼠,mfn1LKO小鼠表现出较低的空腹血糖及显著降低的循环胰岛素水平,且保持更高的胰岛素敏感性。这可能与高脂饮食喂养时mfn1LKO小鼠中TCA活性较高和氧化磷酸化水平偶联作用更强有关,从而防止可能损害胰岛素作用的酰基肉碱类的积累。此外,mfn1LKO小鼠经二甲双胍处理后肝脏显示出高AMPK活化,与对照小鼠相比降血糖作用更为明显[49]。故降低Mfn1水平可提供一种新的治疗2型糖尿病的策略,以改善二甲双胍耐药人群对药物的敏感性。
3.3 肝脏特异性敲除mfn2(mfn2LKO)小鼠mfn2LKO小鼠是由mfn2lox P/lox P小鼠和Alb-Cre小鼠杂交产生。在高脂饮食条件下,mfn2LKO小鼠肝脏葡萄糖分泌增多,葡萄糖耐量受损,血浆胰岛素水平升高,出现IR。mfn2LKO小鼠的葡萄糖耐量损伤是由糖异生所导致的肝葡萄糖升高和糖异生关键酶(丙酮酸羧化酶[PC]、G6pase、PEPCK)的编码基因的表达升高造成的[50]。
3.4 褐色脂肪组织特异性敲除mfn2(BAT-mfn2-KO)小鼠BAT-mfn2-KO小鼠是mfn2lox P/lox P小鼠和Ucp1-Cre转基因小鼠杂交而产生的。
BAT中mfn2的缺失使BAT中脂质增加,但高脂饮食喂养的BAT-mfn2-KO小鼠与对照小鼠相比空腹血糖水平和肝脂肪变性没有显著性差异,然而胰岛素敏感性得到改善,葡萄糖耐量降低,并且BAT的糖酵解能力也升高[51]。
3.5 非特异性敲除mfn2(mfn2-KO)小鼠mfn2-KO小鼠是mfn2lox P/lox P小鼠与MEF2C启动子控制下表达Cre重组酶(MEF2C-73K-Cre)的小鼠品系杂交,产生mfn2-KO小鼠。
在骨骼肌、心脏和大脑中,mfn2-KO的MFN2蛋白表达减少了80%,在脂肪组织、肾脏和肝脏中表达减少了近50%。免疫荧光分析表明,mfn2-KO小鼠的肌肉纤维中,Mfn2明显减少。此外,mfn2-KO小鼠的骨骼肌表现为线粒体分裂增加。
高脂饮食喂养的mfn2-KO小鼠与对照组相比葡萄糖耐量受损、血浆胰岛素水平升高,产生IR,但胰岛素敏感性并没有显著性差异。mfn2敲除后损害了肝脏、骨骼肌的胰岛素信号通路;另外肝脏和肌肉中线粒体功能紊乱、过氧化氢浓度增高[50]。以上融合/分裂基因敲除小鼠与IR关系总结如表 2所示。
| Gene knockout mice | The relationship of gene knockout mice and IR |
| drp1LKO | Improve insulin sensitivity |
| mfn1LKO | Improve insulin sensitivity |
| mfn2LKO | Show impaired glucose tolerance, high insulin levels, and insulin resistance |
| BAT-mfn2-KO | Improve insulin sensitivity |
| Non-specific mfn2-KO | Impair insulin signaling in liver and skeletal muscle |
笔者课题组综述报道融合/分裂的关键蛋白异常引起的线粒体动力学失衡与糖尿病外周胰岛素抵抗密切相关,但线粒体动力学失衡究竟是胰岛素抵抗的起因还是结果尚有待深入探究[52]。本文综述线粒体融合/分裂相关基因敲除鼠研究结果表明,肝脏特异性敲除drp1、mfn1可使胰岛素的敏感性升高,抑制高脂饮食诱导的肥胖;全身非特异性或肝脏特异性敲除mfn2可引发IR,但褐色脂肪组织特异性敲除mfn2却可以改善IR;笔者课题组未发表的数据显示,对Opa1进行沉默干扰,线粒体复合物Ⅰ的表达下降,分裂蛋白Drp1的表达上升,糖异生关键酶PEPCK表达上升,诱发肝胰岛素抵抗。这些结果说明融合/分裂基因敲除鼠的基因缺陷特异性与靶组织的选择性均会对机体产生不同的影响,对于研究线粒体动力学与胰岛素抵抗相互关系具有非常重要的价值,也为糖尿病及肥胖症的发病机制与药物治疗的信号转导研究提供了稳定、可靠的模型。笔者课题组长期从事糖尿病研究,先后报道了人参皂苷Compound K可通过激活AMPK改善高脂联合STZ诱导的糖尿病小鼠的肝糖异生[53];MiR-27a通过直接抑制PPARγ刺激巨噬细胞浸润和极化来调节高脂诱导的肥胖小鼠的胰岛素抵抗[54];通过2型糖尿病大鼠模型发现H6PDH与11β-HSD1之间的相互作用与2型糖尿病的发病机制有关[55]。后续利用融合/分裂相关基因敲除动物模型对上述信号传导通路的研究将进一步揭示胰岛素抵抗的分子机制,为糖尿病胰岛素抵抗的研究提供了可靠的工具和潜在方向。以上基因敲除小鼠所使用的皆为Cre/lox P系统,利用该系统不仅能有效地克服外源基因在染色体中随机整合所带来的不确定性,缩短模型动物建立的时间,还可以实现目标基因在时间和空间上的精确表达调控,为研究类似IR等代谢性疾病的发病机制及治疗提供了一种全新的手段,而其他的基因敲除技术也有待新的发掘与发展。
| [1] |
Capecchi MR. Altering the genome by homologous recombination. Science, 1989, 244(4910): 1288-1292. DOI:10.1126/science.2660260 |
| [2] |
Gu X, Li Y. The development of site-specific recombination. Lett Biotechnol, 2005, 16(4): 417-419 (in Chinese). 谷欣, 黎燕. 位点特异性重组技术研究进展. 生物技术通讯, 2005, 16(4): 417-419. DOI:10.3969/j.issn.1009-0002.2005.04.020 |
| [3] |
Olorunniji FJ, Rosser SJ, Stark WM. Site-specific recombinases: molecular machines for the genetic revolution. Biochem J, 2016, 473(6): 673-684. DOI:10.1042/BJ20151112 |
| [4] |
Zhang L, Zhao GP, Ding XM. Site-specific recombination systems: mechanisms and applications. Sci Sin Vitae, 2011, 40(12): 1090-1111 (in Chinese). 张霖, 赵国屏, 丁晓明. 位点特异性重组系统的机理和应用. 中国科学:生命科学, 2011, 40(12): 1090-1111. |
| [5] |
Nagy A. Cre recombinase: the universal reagent for genome tailoring. Genesis, 2000, 26(2): 99-109. DOI:10.1002/(SICI)1526-968X(200002)26:2<99::AID-GENE1>3.0.CO;2-B |
| [6] |
Abi-Ghanem J, Samsonov SA, Pisabarro MT. Insights into the preferential order of strand exchange in the Cre/loxP recombinase system: impact of the DNA spacer flanking sequence and flexibility. J Comput Aided Mol Des, 2015, 29(3): 271-282. DOI:10.1007/s10822-014-9825-0 |
| [7] |
Sauer B, Henderson N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proc Natl Acad Sci USA, 1998, 85(14): 5166-5170. |
| [8] |
Bouabe H, Okkenhaug K. Gene targeting in mice: a review. Methods Mol Biol, 2013, 1064: 315-336. |
| [9] |
Lan C, Ren LN, Wu M, et al. Deletion of marker gene in transgenic goat by Cre/loxP system. Chin J Biotech, 2013, 29(12): 1847-1854 (in Chinese). 兰翀, 任丽娜, 吴敏, 等. 利用Cre/lox P系统删除转基因山羊体内的选择标记基因. 生物工程学报, 2013, 29(12): 1847-1854. |
| [10] |
Abdulaal WH, Walker CR, Costello R, et al. Characterization of a conditional interleukin-1 receptor 1 mouse mutant using the Cre/loxP system. Eur J Immunol, 2016, 46(4): 912-918. DOI:10.1002/eji.201546075 |
| [11] |
Kasai Y, Harayama S. Construction of marker-free transgenic strains of chlamydomonas reinhardtii using a Cre/loxP -mediated recombinase system. PLoS ONE, 2016, 11(8): e161733. |
| [12] |
Chen XY, Liao SM, Huang XY, et al. Targeted chromosomal rearrangements via combinatorial use of CRISPR/Cas9 and Cre/LoxP technologies in Caenorhabditis elegans. Gen Genom Genet, 2018, 8(8): 2697-2707. |
| [13] |
Kanayama M, Nakao K, Horie S, et al. Generation of transgenic mouse line with prostate-specific expression of codon-improved Cre recombinase. Prostate Int, 2018, 6(3): 99-103. DOI:10.1016/j.prnil.2018.04.003 |
| [14] |
Loonstra A, Vooijs M, Beverloo HB, et al. Growth inhibition and DNA damage induced by Cre recombinase in mammalian cells. Proc Natl Acad Sci USA, 2001, 98(16): 9209-9214. DOI:10.1073/pnas.161269798 |
| [15] |
Hartley JL, Donelson JE. Nucleotide sequence of the yeast plasmid. Nature, 1980, 286(5776): 860-864. DOI:10.1038/286860a0 |
| [16] |
Li ZW, Li YR, Gu ZH, et al. Development and verification of an FLP/FRT system for gene editing in Bacillus licheniformis. Chin J Biotech, 2019, 35(3): 458-471 (in Chinese). 李宗文, 李由然, 顾正华, 等. 地衣芽胞杆菌FLP/FRT基因编辑系统的构建及验证. 生物工程学报, 2019, 35(3): 458-471. |
| [17] |
Jayaram M, Li YY, Broach JR. The yeast plasmid 2μ circle encodes components required for its high copy propagation. Cell, 1983, 34(1): 95-104. DOI:10.1016/0092-8674(83)90139-3 |
| [18] |
Volkert FC, Broach JR. Site-specific recombination promotes plasmid amplification in yeast. Cell, 1986, 46(4): 541-550. DOI:10.1016/0092-8674(86)90879-2 |
| [19] |
Broach JR, Hicks JB. Replication and recombination functions associated with the yeast plasmid, 2μ circle. Cell, 1980, 21(2): 501-508. DOI:10.1016/0092-8674(80)90487-0 |
| [20] |
Senecoff JF, Bruckner RC. The FLP recombinase of the yeast 2-micron plasmid: characterization of its recombination site. Proc Natl Acad Sci USA, 1985, 82(21): 7270-7274. DOI:10.1073/pnas.82.21.7270 |
| [21] |
Sadowski PD. The FLP double cross system a simple efficient procedure for cloning DNA fragments. BMC Biotechnol, 2003, 3: 9. DOI:10.1186/1472-6750-3-9 |
| [22] |
Kilby NJ, Snaith MR, Murray JAH. Site-specific recombinases: tools for genome engineering. Trends Genet, 1993, 9(12): 413-421. DOI:10.1016/0168-9525(93)90104-P |
| [23] |
Kopke K, Hoff B, Kück U. Application of the Saccharomyces cerevisiae FLP/FRT recombination system in filamentous fungi for marker recycling and construction of knockout strains devoid of heterologous genes. Appl Environ Microbiol, 2010, 76(14): 4664-4674. DOI:10.1128/AEM.00670-10 |
| [24] |
Li B, Li N, Duan XG, et al. Generation of marker-free transgenic maize with improved salt tolerance using the FLP/FRT recombination system. J Biotechnol, 2010, 145(2): 206-213. DOI:10.1016/j.jbiotec.2009.11.010 |
| [25] |
Long DP, Lu WJ, Hao ZZ, et al. Highly efficient and inducible DNA excision in transgenic silkworms using the FLP/FRT site-specific recombination system. Transgenic Res, 2016, 25(6): 795-811. DOI:10.1007/s11248-016-9970-4 |
| [26] |
Hubbard EJA. FLP/FRT and Cre/lox recombination technology in C. elegans. Methods, 2014, 68(3): 417-424. DOI:10.1016/j.ymeth.2014.05.007 |
| [27] |
Buchholz F, Ringrose L, Angrand PO, et al. Different thermostabilities of FLP and Cre recombinases: implications for applied site-specific recombination. Nucleic Acids Res, 1996, 24(21): 4256-4262. DOI:10.1093/nar/24.21.4256 |
| [28] |
Raymond CS, Soriano P. High-efficiency FLP and ФC31 site-specific recombination in mammalian cells. PLoS ONE, 2007, 2(1): e162. DOI:10.1371/journal.pone.0000162 |
| [29] |
Anastassiadis K, Fu J, Patsch C, et al. Dre recombinase, like Cre, is a highly efficient site-specific recombinase in E. coli, mammalian cells and mice. Dis Model Mech, 2009, 2(9/10): 508-515. |
| [30] |
Sauer B, McDermott J. DNA recombination with a heterospecific Cre homolog identified from comparison of the pac-c1 regions of P1-related phages. Nucleic Acids Res, 2004, 32(20): 6086-6095. DOI:10.1093/nar/gkh941 |
| [31] |
Plummer NW, de Marchena J, Jensen P. A knock-in allele of En1 expressing Dre recombinase. Genesis, 2016, 54(8): 447-454. DOI:10.1002/dvg.22954 |
| [32] |
Park JT, Leach SD. TAILOR: transgene activation and inactivation using lox and rox in zebrafish. PLoS ONE, 2013, 8(12): e85218. DOI:10.1371/journal.pone.0085218 |
| [33] |
van der Weyden L, Bradley A. Mouse chromosome engineering for modeling human disease. Annu Rev Genomics Hum Genet, 2006, 7: 247-276. DOI:10.1146/annurev.genom.7.080505.115741 |
| [34] |
Teng Y, Yang X. Gene targeting: the beginning of a new era in genetics. Hereditas (Beijing), 2007, 29(11): 1291-1298 (in Chinese). 滕艳, 杨晓. 基因打靶技术:开启遗传学新纪元. 遗传, 2007, 29(11): 1291-1298. DOI:10.3321/j.issn:0253-9772.2007.11.002 |
| [35] |
Ding MG, Feng N, Tang DS, et al. Melatonin prevents Drp1- mediated mitochondrial fission in diabetic hearts through SIRT1-PGC1α pathway. J Pineal Res, 2018, 65(2): e12491. DOI:10.1111/jpi.12491 |
| [36] |
Wang LX, Zhao XZ, Qiao WW, et al. Amelioration effect of duodenal-jejunal bypass surgery on insulin-resistance in Goto-Kakizaki rats. Acta Lab Animal Sci Sin, 2015, 23(2): 159-164 (in Chinese). 王龙霞, 赵先哲, 乔伟伟, 等. 十二指肠-空肠转流手术对2型糖尿病大鼠胰岛素抵抗的改善作用. 中国实验动物学报, 2015, 23(2): 159-164. DOI:10.3969/j.issn.1005-4847.2015.02.011 |
| [37] |
Liesa M, Shirihai OS. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metab, 2013, 17(4): 491-506. DOI:10.1016/j.cmet.2013.03.002 |
| [38] |
Rovira-Llopis S, Bañuls C, Diaz-Morales N, et al. Mitochondrial dynamics in type 2 diabetes: pathophysiological implications. Redox Biol, 2017, 11: 637-645. DOI:10.1016/j.redox.2017.01.013 |
| [39] |
Jia WP. Role of insulin resistance in the pathogenesis of type 2 diabetes mellitus. Diagnost Theory Pract, 2009, 8(3): 233-236 (in Chinese). 贾伟平. 胰岛素抵抗在2型糖尿病发病机制中的作用. 诊断学理论与实践, 2009, 8(3): 233-236. |
| [40] |
Holmström MH, Iglesias-Gutierrez E, Zierath JR, et al. Tissue-specific control of mitochondrial respiration in obesity-related insulin resistance and diabetes. Am J Physiol Endocrinol Metabo, 2012, 302(6): E731-E739. DOI:10.1152/ajpendo.00159.2011 |
| [41] |
Tomas E, Kelly M, Xiang XQ, et al. Metabolic and hormonal interaction between muscal and adipose tissue. Proc Nutr Soc, 2004, 63(2): 381-385. DOI:10.1079/PNS2004356 |
| [42] |
Morino K, Petersen KF, Dufour S, et al. Reduced mitochondrial density and increased IRS-1 serine phosphorylation in muscle of insulin-resistant offspring of type 2 diabetic parents. J Clin Investigat, 2005, 115(12): 3587-3593. DOI:10.1172/JCI25151 |
| [43] |
Bach D, Pich S, Soriano FX, et al. Mitofusin-2 determines mitochondrial network architecture and mitochondrial metabolism. A novel regulatory mechanism altered in obesity. J Biol Chemi, 2003, 278(19): 17190-17197. DOI:10.1074/jbc.M212754200 |
| [44] |
Jheng HF, Tsai PJ, Guo SM, et al. Mitochondrial fission contributes to mitochondrial dysfunction and insulin resistance in skeletal muscle. Mol Cell Biol, 2012, 32(2): 309-319. DOI:10.1128/MCB.05603-11 |
| [45] |
Wang CH, Wang CC, Wei YH. Mitochondrial dysfunction in insulin insensitivity: implication of mitochondrial role in type 2 diabetes. Ann N Y Acad Sci, 2010, 1201: 157-165. DOI:10.1111/j.1749-6632.2010.05625.x |
| [46] |
Gao CL, Zhu C, Zhao YP, et al. Mitochondrial dysfunction is induced by high levels of glucose and free fatty acids in 3T3-L1 adipocytes. Mol Cell Endocrinol, 2010, 320(1/2): 25-33. |
| [47] |
Li AY, Zhang SH, Li J, et al. Metformin and resveratrol inhibit Drp1-mediated mitochondrial fission and prevent ER stress-associated NLRP3 inflammasome activation in the adipose tissue of diabetic mice. Mol Cell Endocrinol, 2016, 434: 36-47. DOI:10.1016/j.mce.2016.06.008 |
| [48] |
Wang LX, Ishihara T, Ibayashi Y, et al. Disruption of mitochondrial fission in the liver protects mice from diet-induced obesity and metabolic deterioration. Diabetologia, 2015, 58(10): 2371-2380. DOI:10.1007/s00125-015-3704-7 |
| [49] |
Kulkarni SS, Joffraud M, Boutant M, et al. Mfn1 Deficiency in the liver protects against diet-Induced insulin resistance and enhances the hypoglycemic effect of metformin. Diabetes, 2016, 65(12): 3552-3560. DOI:10.2337/db15-1725 |
| [50] |
Sebastián David S, Hernández-Alvarez María I, Segalés Jessica S, et al. Mitofusin 2 (Mfn2) links mitochondrial and endoplasmic reticulum function with insulin signaling and is essential for normal glucose homeostasis. Proc Natl Acad Sci USA, 2012, 109(14): 5523-5528. DOI:10.1073/pnas.1108220109 |
| [51] |
Mahdaviani K, Benador IY, Su S, et al. Mfn2 deletion in brown adipose tissue protects from insulin resistance and impairs thermogenesis. EMBO Rep, 2017, 18(7): 1123-1138. DOI:10.15252/embr.201643827 |
| [52] |
Chen L, Guan FY, Yu Y. Mitochondrial dynamics in type 2 diabetes mellitus and diabetes complications. Chin J Pharmacol Toxicol, 2015, 29(3): 339-347 (in Chinese). 陈立, 关凤英, 于洋. 线粒体动力学与2型糖尿病和糖尿病并发症关系的研究进展. 中国药理学与毒理学杂志, 2015, 29(3): 339-347. DOI:10.3867/j.issn.1000-3002.2015.03.001 |
| [53] |
Wei SN, Li W, Yu Y, et al. Ginsenoside Compound K suppresses the hepatic gluconeogenesis via activating adenosine-5'monophosphate kinase: A study in vitro and in vivo. Life Sci, 2015, 139: 8-15. DOI:10.1016/j.lfs.2015.07.032 |
| [54] |
Yao F, Yu Y, Feng LJ, et al. Adipogenic miR-27a in adipose tissue upregulates macrophage activation via inhibiting PPARγ of insulin resistance induced by high-fat diet-associated obesity. Exp Cell Res, 2017, 355(2): 105-112. |
| [55] |
Yao F, Chen L, Fan Z, et al. Interplay between H6PDH and 11β-HSD1 implicated in the pathogenesis of type 2 diabetes mellitus. Bioorgan Medic Chem Lett, 2017, 27(17): 4107-4113. DOI:10.1016/j.bmcl.2017.07.043 |
 2019, Vol. 35
2019, Vol. 35