中国科学院微生物研究所、中国微生物学会主办
文章信息
- 朱记平, 刘媛, 骆茹梦, 冯小婷, 李毅
- Zhu Jiping, Liu Yuan, Luo Rumeng, Feng Xiaoting, Li Yi
- 可调控表达人博卡病毒1型非结构蛋白NS1稳定细胞系的建立及其反式转录激活作用初探
- Establishment of stable cell line expressing human bocavirus type 1 non-structural protein NS1 and its trans-transcriptional activation
- 生物工程学报, 2019, 35(6): 1126-1134
- Chinese Journal of Biotechnology, 2019, 35(6): 1126-1134
- 10.13345/j.cjb.180503
-
文章历史
- Received: December 4, 2018
- Accepted: March 26, 2019
人博卡病毒1型(Human bocavirus 1,HBoV1)主要感染2岁以下婴幼儿,引起急性哮喘等严重呼吸系统疾病,是婴幼儿呼吸道疾病的重要病原之一,引起人们广泛关注。2005年,Allander等首次在幼儿呼吸道患者的样本中发现了HBoV1[1]。随后,在不同国家和地区的呼吸道患者的样本中均相继检出HBoV1,感染率为2%–19%,其中在2岁以下婴幼儿呼吸道的感染率达到2%–22%。人博卡病毒经常与其他呼吸道病毒共同感染,混合感染率高达83%[2-6]。
HBoV1属于细小病毒科博卡病毒属[7],其基因组为5.5 kb左右的单链线状DNA,含3个开放阅读框(ORF),分别编码衣壳蛋白VP1–3、NP1和非结构蛋白NS1–4[8]。非结构蛋白NS1是HBoV1复制必需基因,而NS2–4是病毒DNA复制非必需基因[9]。值得注意的是,经过可变剪接的NS1转录本较大,编码约100 kDa的NS1蛋白(NS1-100),而未经过可变剪接的NS1转录本较小,编码约70 kDa的NS1蛋白(NS1-70)[8, 10]。
来自不同属的细小病毒均可编码非结构蛋白NS1,其作为多功能蛋白,参与了病毒复制、转录激活及诱导细胞凋亡、周期阻滞等过程。NS1的反式激活作用可显著提高病毒基因组转录水平,促进病毒在细胞内的增殖。人细小病毒B19 5′端P6启动子启动病毒所有mRNA转录,表达的NS1蛋白又能反式激活P6启动子活性,这种反式激活作用依赖于启动子TATA box上游富含GC的2个串联重复序列,且启动子的100–160 nt序列对该反式激活作用极其重要[11-14]。小鼠细小病毒MVM的NS1蛋白的表达能反式激活P4启动子的活性,P4启动子又能促进非结构蛋白NS1的表达[15]。此外,有报道显示,B19 NS1的反式激活作用可能与病毒感染后宿主特定基因的异常表达及宿主致病有关[16-18]。
本研究通过构建NS1重组慢病毒质粒(含可调控启动子和绿荧光标签蛋白),应用转染试剂将NS1重组慢病毒质粒转染至HEK 293T细胞。通过嘌呤霉素筛选抗性细胞,多西环素诱导NS1表达,建立可稳定表达NS1-100、NS1-70蛋白的HEK 293T细胞系,利用荧光标记蛋白和Western blotting检测,确定NS1蛋白的表达。并在稳定表达NS1细胞系中转染HBoV1启动子-荧光素酶基因的质粒,分析NS1的反式转录激活活性。结果表明NS1蛋白可在建立的细胞系中稳定表达,且稳定表达NS1蛋白对HBoV1启动子有较强的激活活性。可调控表达HBoV1 NS1蛋白的稳定细胞系,可有效控制NS1蛋白对细胞的毒性,为深入研究NS1蛋白的功能奠定良好基础,并对进一步深入研究HBoV1复制机理具有重要意义。
1 材料与方法 1.1 质粒、细胞及主要试剂HBoV1武汉株近全长质粒pWHL-1 (GenBank登录号:GU139423.1)由本实验室保存;分别含HBoV1启动子和CMV启动子的重组质粒pGL3-HBoV1、pGL3-CMV由本实验室构建并保存,RL-TK由本实验室保存;NS1-100、NS1-70真核表达质粒pCAGGS-NS1-100、pCAGGS-NS1-70由本实验室构建并保存;NS1-100、NS1-70特异性抗体为本实验室制备并保存的兔源多克隆抗体,工作浓度为稀释1 000倍;可调控慢病毒载体pLVX-TRE3G-ZsGreen1 (含可调控启动子,可表达绿荧光标签蛋白GFP)购于生物风公司,慢病毒包装质粒psPAX2、pMD2.G由武汉生物工程学院赖晓晶老师惠赠;人类胚胎肾细胞HEK 293T由本实验室保存,胎牛血清、DMEM、Opti-MEM购自Gibco公司,胰酶-EDTA细胞消化液购自上海源培生物科技股份有限公司;NeofectTM转染试剂购自零客创智(北京)生物科技有限公司,LipofectamineTM 2000转染试剂购自美国英杰生命技术有限公司(Invitrogen);多西环素(DOX)、嘌呤霉素(Puro)、polybrene (聚凝胺)购自美国Selleck生物科技有限公司;CCK-8试剂盒购自上海翊圣生物科技有限公司;PCR高保真酶、Easy Ⅱ Protein Quantitative Kit (BCA)购自北京全式金生物技术有限公司;Gel Extraction Kit、DNA快速纯化回收试剂盒、质粒小量提取试剂盒购自Omega Bio-Tek公司;ECL显色液购自Thermo Fisher scientific公司;双荧光素酶检测试剂盒购于普洛麦格(北京)生物技术有限公司。
1.2 重组慢病毒质粒pLVX-NS1-100和pLVX- NS1-70的构建以pWHL-1为模板,应用引物NS1-100-F和NS1-100-Ar扩增ns1-100 N端A片段,应用引物NS1-100-Bf和NS1-100-R扩增ns1-100 C端B片段。将回收的A和B片段混合液作为模板,利用引物NS1-100-F和NS1-100-R扩增获得ns1-100基因ORF序列。以pWHL-1为模板,应用引物NS1-70-F、NS1-70-R扩增获得人博卡病毒ns1-70基因ORF序列。将ns1-100、ns1-70的ORF序列克隆至pLVX-TRE3G-ZsGreen1,获得重组质粒pLVX-NS1-100和pLVX-NS1-70。
1.3 CCK-8测定细胞活性在96孔板中,每孔接种100 µL细胞悬液,细胞量不低于2 500个/孔。待细胞贴壁后,每孔加入10 µL CCK-8溶液,避光孵育1–4 h,测定每孔OD450吸光值。
在96孔板中,每孔接种100 µL细胞悬液,培养24 h后,每孔加入10 µL不同稀释度待测药物,继续培养一段时间后,每孔加入10 µL CCK-8溶液,避光孵育1–4 h,测定每孔OD450吸光值。
应用如下公式计算细胞存活率或药物对细胞毒性:
细胞存活率%=(待测药物组OD450−空白对照组OD450)/(正常细胞对照组OD450−空白对照组OD450)×100%。
待测药物组:细胞中添加了CCK-8溶液、待测药物;空白对照组:无细胞,含培养基、CCK-8溶液;正常细胞对照组:细胞中添加了CCK-8溶液。
1.4 重组慢病毒的包装取10 µg重组慢病毒质粒pLVX-NS1-100或pLVX-NS1-70、6 µg psPAX2质粒、4 µg pMD2.G质粒采用转染试剂NeofectTM进行共转染HEK 293T细胞,转染72 h后,收集细胞上清液3 000 r/min离心10 min,去除细胞碎片,上清液中加入等倍体积20% PEG 8 000,之后每30 min混合1次,共混合3–5次,然后将混合液置于4 ℃沉淀过夜;次日取出,于4 ℃、3 000 r/min离心30 min,弃上清;沉淀用500 µL 1×PBS重悬,将500 µL 20%蔗糖溶液轻轻缓慢地加入到病毒重悬液的下面,使蔗糖垫底,4 ℃、15 000 r/min离心4 h;离心后,弃去上清,留下少量沉淀,用100 µL 1×PBS重悬即可获得浓缩的重组慢病毒pLVX-NS1-100或pLVX-NS1-70。
1.5 病毒滴度的测定将HEK 293T细胞接种至96孔板,培养至细胞量达到80%–90%进行病毒滴度的检测。将重组慢病毒悬液进行连续10倍梯度稀释,分别稀释成10–1–10–10,将病毒稀释液感染细胞,每一稀释度感染8孔,每孔加入1 µL聚凝胺(储存浓度为10 µg/µL),设未感染病毒的正常细胞为对照组。次日吸弃细胞培养上清液,添加2%细胞维持液,之后于荧光显微镜下逐日观察并记录表达GFP的细胞数量,连续观察2–5 d,计算病毒滴度(表达GFP的细胞数×其相应的病毒稀释倍数,滴度单位TU/mL)。
1.6 嘌呤霉素(Puro)工作浓度的确定将HEK 293T细胞按照每孔5×104–10×104个细胞量铺于24孔板,过夜培养,待细胞密度达70%–80%时,弃去孔内旧的细胞培养基,1×PBS洗涤1次,向24孔板中加入Puro筛选培养基,Puro浓度分别为2、4、6、8、10 µg/mL;每个筛选浓度平行做4孔重复,未加药物的细胞作为阴性对照;连续培养7 d,每隔2–3 d更换新鲜筛选培养基;每天观察细胞形态、存活率,一周后,有效杀死所有细胞的Puro最低浓度,确定为Puro抗性筛选最佳工作浓度。
1.7 稳定表达NS1-100和NS1-70细胞系的筛选将重组慢病毒pLVX-NS1-100或pLVX-NS1- 70感染HEK 293T细胞,6–8 h后加入适量完全培养基继续培养;第3天弃去旧培养基,加入含Puro的筛选培养基继续培养,每隔2–3 d更换新鲜筛选培养基,筛选10–14 d;每天观察细胞形态、存活率,计数表达GFP的细胞数量,两周后几乎所有细胞都表达GFP,将阳性细胞扩大培养,之后进行冻存保种,即建立了稳定表达细胞系。
1.8 NS1-100和NS1-70的反式转录激活活性检测HEK 293T细胞接种于96孔板,过夜培养至细胞密度达70%–80%,将pCAGGS-NS1-100或pCAGGS-NS1-70分别与pGL3-HBoV1或pGL3-CMV进行共转染,RL-TK为内参质粒。转染后48 h,应用双荧光素酶检测试剂盒进行启动子活性检测。稳定表达NS1-100或NS1-70的HEK 293T细胞系接种于96孔板,过夜培养至细胞密度达70%–80%,将pGL3-HBoV1、pGL3-CMV分别转染两种细胞,RL-TK为内参质粒。转染后6 h,添加合适浓度DOX,诱导NS1-100或NS1-70的表达。转染后48 h,应用双荧光素酶检测试剂盒进行启动子活性检测。
双荧光素酶检测试剂盒检测方法具体如下:弃去细胞孔中旧的培养基,PBS漂洗1–2次,每孔滴加20 μL 1×PLB裂解液,置于摇床振摇20–30 min;收集裂解后的细胞悬液,4 000 r/min离心1 min后,置于室温待检。于EP管中先后加入50 μL LAR Ⅱ、10 μL待测样品,轻轻吹打混匀;置于检测仪中检测萤火虫荧光素酶活性(RLU1);检测结束后,向EP管中加入50 μL Stop & Glo Reagent,轻轻吹打混匀;再次置于检测仪中,检测海肾荧光素酶活性(RLU2);RLU1/RLU2即为启动子活性。每个样品重复3次。
2 结果与分析 2.1 重组质粒pLVX-NS1-70和pLVX-NS1-100的构建及鉴定以pWHL-1为模板,分别扩增ns1-100 N端A片段1 912 bp和C端B片段526 bp,然后将A和B片段分别纯化回收后混合作为模板,扩增获得ns1-100基因ORF序列,连接至pLVX-TRE3G- ZsGreen1载体,构建重组慢病毒质粒pLVX-NS1- 100。以pWHL-1为模板,特异性引物扩增ns1-70,酶切后连接至载体,构建重组慢病毒质粒pLVX-NS1-70。重组质粒经MluⅠ、EcoRⅠ双酶切鉴定,可获得1 920 bp (ns1-70)和2 346 bp (ns1-100)的目的片段,测序结果显示,目的基因正确插入载体。
2.2 药物对HEK 293T细胞活性影响在96孔板中培养不同密度的HEK 293T细胞,加入CCK-8试剂后继续培养1–4 h,不同时间点检测每孔吸光值,结果显示细胞数量(5×103、1×104、2×104、4×104、8×104)与细胞增殖呈正相关(图 1),且2.5 h后细胞孔吸光值趋于稳定,表明细胞增殖达到最大,基于此确定96孔板适宜的细胞接种量为2×104个/孔,加入CCK-8试剂后2.5 h为最佳测定时间。

|
| 图 1 CCK8检测HEK 293T细胞活性 Fig. 1 Detection of HEK 293T cell viability by CCK8. |
| |
以2×104个/100 µL细胞悬液接种96孔板,培养24 h后,加入10 µL的DOX或Puro,DOX浓度梯度依次为1、2、3、4、5 µg/mL,Puro浓度梯度为2、4、6、8、10 µg/mL。每个浓度重复4孔,分别培养6、12、24、48 h时,向每孔加入10 µL CCK-8溶液,不加药物溶液正常细胞为对照组,只含培养基孔为空白对照组。将细胞避光孵育2.5 h,测定OD值,根据公式计算细胞存活率。如表 1所示,DOX浓度为1 µg/mL或2 µg/mL时,对细胞毒性最低,确定DOX最适工作浓度为2 µg/mL。如表 2所示,Puro浓度为2 µg/mL或4 µg/mL时,对细胞毒性最低,确定Puro最适工作浓度为4 µg/mL。
| Concentration of DOX (µg/mL) |
Cell viability (%) | |||
| 6 h | 12 h | 24 h | 48 h | |
| 1 | 100 | 100 | 100 | 99 |
| 2 | 98 | 99 | 100 | 98 |
| 3 | 94 | 95 | 86 | 83 |
| 4 | 90 | 96 | 85 | 80 |
| 5 | 86 | 91 | 75 | 73 |
| Concentration of puro (µg/mL) | Cell viability (%) | |||
| 6 h | 12 h | 24 h | 48 h | |
| 2 | 98 | 90 | 62 | 84 |
| 4 | 98 | 81 | 56 | 75 |
| 6 | 81 | 61 | 26 | 21 |
| 8 | 77 | 68 | 27 | 21 |
| 10 | 74 | 60 | 24 | 17 |
将重组质粒pLVX-NS1-100、pLVX-NS1-70分别转染HEK 293T细胞,6 h后加入2 µg/mL DOX诱导NS1的表达,不同时间点在显微镜下观察NS1蛋白表达对细胞活性的影响。结果表明(图 2),加入DOX诱导NS1蛋白表达后,HEK 293T细胞在48 h内形态基本正常,但生长减缓,随着时间推移,大部分细胞形态变化,边缘不清晰,慢慢变圆直至死亡。
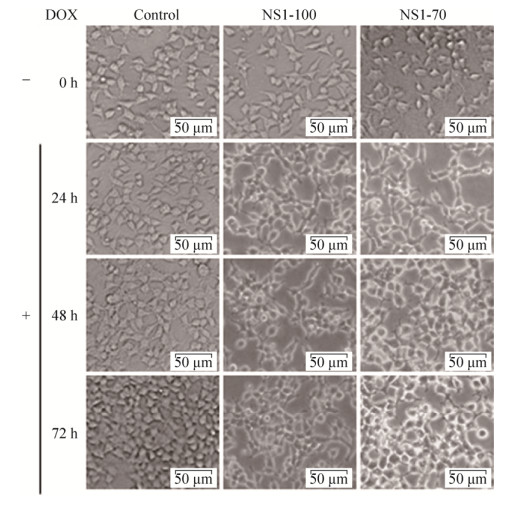
|
| 图 2 DOX诱导NS1表达后细胞形态变化 Fig. 2 Cell morphology changes after expression of NS1 induced by DOX. |
| |
根据1.4的方法包装慢病毒。重组慢病毒滴度为1×105 TU/mL,取100 µL重组慢病毒感染HEK 293T细胞,感染后48 h,用4 µg/mL Puro筛选培养基培养10–14 d,几乎所有细胞都表达GFP,将细胞扩大培养,继续用Puro筛选培养基培养,细胞冻存后复苏传代培养3代,经DOX诱导后,仍表达GFP (图 3),即成功建立了稳定表达NS1-70或NS1-100细胞系。

|
| 图 3 稳定表达NS1-70、NS1-100细胞系 Fig. 3 Stable cell line expressing NS1-70 or NS1-100. |
| |
Western blotting检测稳定表达细胞系中NS1的表达,结果显示(图 4),在100 kDa、70 kDa分别出现特异性条带,与预期相符,表明构建的细胞系可表达HBoV1的NS1-100或NS1-70蛋白。

|
| 图 4 Western blotting检测稳定表达细胞系中NS1蛋白的表达 Fig. 4 Detection of NS1 protein expression in the stable cell line by Western blotting. |
| |
将pCAGGS-NS1-100、pCAGGS-NS1-70分别与pGL3-HBoV1或pGL3-CMV进行共转染,RL-TK为内参质粒。转染后48 h,检测启动子活性。结果显示,瞬时表达NS1-100 (图 5A)或NS1-70 (图 5B)后,HBoV1启动子活性显著高于CMV启动子和阴性对照。

|
| 图 5 NS1蛋白对HBoV1启动子的反式激活活性 Fig. 5 Transactivation activity of NS1 protein to HBoV1 promoter. (A) Transactivation activity of transient expressed NS1-100. (B) transactivation activity of transient expressed NS1-70. (C) Transactivation activity of stable expressed NS1-100 or NS1-70. (D) Expression and transactivation activity of NS1-100 or NS1-70 at different time points. |
| |
分别在稳定表达NS1-100、NS1-70的HEK 293T细胞系中,转染pGL3-HBoV1或pGL3-CMV,RL-TK为内参质粒。转染后6 h,添加2 µg/mL DOX,诱导NS1-100或NS1-70的表达。转染后48 h,检测启动子活性。结果显示,表达NS1-100或NS1-70细胞系中,HBoV1启动子活性与CMV启动子活性差异显著,且均显著高于阴性对照pGL3-Basic (图 5C),表明稳定表达NS1对HBoV1启动子有更强的反式激活作用。同时,还发现NS1蛋白的表达量与其反式激活作用成正相关(图 5D),随着时间的推移,NS1的表达量逐渐增高,其反式激活作用也逐渐增强。
3 讨论HBoV1属于细小病毒科博卡病毒属[7],其靶向性感染呼吸道,常被发现与其他呼吸道病毒共感染宿主,是呼吸道疾病的重要病原体之一,对人类健康有具大威胁[1]。细小病毒的非结构蛋白NS1,因其在病毒感染、复制及损伤细胞过程中均扮演重要角色而被广泛研究[9, 15-17]。在病毒复制过程中,NS1的反式激活作用促进病毒在细胞内的增殖。研究HBoV1的NS1蛋白反式转录激活作用,有助于进一步解析HBoV1复制机理。
细小病毒NS1蛋白的表达,对细胞具有一定的毒性。小鼠细小病毒(MVM)磷酸化位点(T585或S588)的突变,分别降低或增强NS1对细胞的毒性[19]。B19感染细胞后,NS1通过招募细胞蛋白Bax和Bad,导致caspase-3和caspase-9高度活化,引发细胞凋亡[12]。B19 NS1蛋白通过激活ATR CDC25C-CDK1通路诱导G2期细胞周期阻滞,诱导DNA损伤[20]。黑胸大蠊浓核病毒(PfDNV)感染昆虫细胞后,NS1可抑制宿主细胞基因表达,共表达PfDNV的3种非结构蛋白可诱导细胞坏死[21]。
由于瞬时表达NS1的不稳定性及其对细胞的毒性,不利于深入探索NS1的相关功能,文中构建了可调控表达HBoV1 NS1蛋白的HEK 293T稳定细胞系,经DOX诱导表达的NS1,对HBoV1启动子有较强的激活作用。相比较于瞬时表达NS1,稳定表达NS1-70或NS1-100细胞对HBoV1启动子活性更强,其原因可能是由于随时间的推移,瞬时表达NS1蛋白对细胞的毒性有累积效应,诱导细胞死亡,导致检测反式激活作用时的不稳定。而稳定细胞系中NS1蛋白表达时相可调控,且表达量更高,因此有更强更稳定的反式激活作用。
HBoV1的NS蛋白是病毒复制必不可少的成分,当缺失ns,HBoV1的病毒核酸无法复制。基于此,Yan等构建了HBoV1和AAV病毒的嵌合基因治疗载体[22],该载体含有不完整的HBoV1 ns基因,因此必须回补NS的表达,才能获得重组嵌合病毒[22-23]。可调控表达HBoV1 NS1稳定细胞系的建立,将有助于HBoV1基因治疗载体深入研究和研发。
文中建立了可调控表达HBoV1 NS1蛋白的HEK 293T稳定细胞系,为深入探索NS1蛋白的功能提供体外细胞实验模型,有助于全面认识HBoV1非结构蛋白的作用机制。
| [1] | Allander T, Tammi MT, Eriksson M, et al. Cloning of a human parvovirus by molecular screening of respiratory tract samples. Proc Natl Acad Sci USA, 2005, 102(36): 12891–12896. DOI: 10.1073/pnas.0504666102 |
| [2] | Zhou JY, Peng Y, Peng XY, et al. Human bocavirus and human metapneumovirus in hospitalized children with lower respiratory tract illness in Changsha, China. Infl Other Respir Viruses, 2018, 12(2): 279–286. DOI: 10.1111/irv.12535 |
| [3] | Silva PE, Figueiredo CA, Luchs A, et al. Human bocavirus in hospitalized children under 5 years with acute respiratory infection, Sao Paulo, Brazil, 2010. Arch Virol, 2018, 163(5): 1325–1330. DOI: 10.1007/s00705-017-3694-5 |
| [4] | Salvo M, Lizasoain A, Castells M, et al. Human bocavirus:detection, quantification and molecular characterization in sewage and surface waters in uruguay. Food Environ Virol, 2018, 10(2): 193–200. DOI: 10.1007/s12560-017-9334-0 |
| [5] | Chen AX, Xie GC, Pan D, et al. Three-dimensional culture of human airway epithelium in matrigel for evaluation of human rhinovirus C and bocavirus infections. Biomed Environ Sci, 2018, 31(2): 136–145. |
| [6] | Abdel-Moneim AS, Mahfouz ME, Zytouni DM. Detection of human bocavirus in Saudi healthy blood donors. PLoS ONE, 2018, 13(2): e0193594. DOI: 10.1371/journal.pone.0193594 |
| [7] | Cotmore SF, Agbandje-McKenna M, Chiorini JA, et al. The family Parvoviridae. Arch Virol, 2014, 159(5): 1239–1247. DOI: 10.1007/s00705-013-1914-1 |
| [8] | Shen WR, Deng XF, Zou W, et al. Analysis of cis and trans requirements for DNA replication at the right-end hairpin of the human bocavirus 1 genome. J Virol, 2016, 90(17): 7761–7777. DOI: 10.1128/JVI.00708-16 |
| [9] | Liu QS, Zhang ZF, Zheng ZH, et al. Human bocavirus NS1 and NS1-70 proteins inhibit TNF-α-mediated activation of NF-κB by targeting p65. Sci Rep, 2016, 6: 28481. DOI: 10.1038/srep28481 |
| [10] | Li JJ, Yang YB, Dong YM, et al. Key elements of the human bocavirus type 1(HBoV1) promoter and its trans-activation by NS1 protein. Virol J, 2013, 10: 315. DOI: 10.1186/1743-422X-10-315 |
| [11] | Morita E, Nakashima A, Asao H, et al. Human parvovirus B19 nonstructural protein (NS1) induces cell cycle arrest at G1 phase. J Virol, 2003, 77(5): 2915–2921. DOI: 10.1128/JVI.77.5.2915-2921.2003 |
| [12] | Hsu TC, Wu WJ, Chen MC, et al. Human parvovirus B19 non-structural protein (NS1) induces apoptosis through mitochondria cell death pathway in COS-7 cells. Scand J Infect Dis, 2004, 36(8): 570–577. DOI: 10.1080/00365540410016230 |
| [13] | Tzang BS, Chen DY, Tsai CC, et al. Human parvovirus B19 nonstructural protein NS1 enhanced the expression of cleavage of 70 kDa U1-snRNP autoantigen. J Biomed Sci, 2010, 17: 40. DOI: 10.1186/1423-0127-17-40 |
| [14] | Sanchez JL, Romero Z, Quinones A, et al. Dna binding and cleavage by the human parvovirus B19 NS1 nuclease domain. Biochemistry, 2016, 55(47): 6577–6593. DOI: 10.1021/acs.biochem.6b00534 |
| [15] | Willwand K, Moroianu A, H rlein R, et al. Specific interaction of the nonstructural protein NS1 of minute virus of mice (MVM) with[ACCA]2 motifs in the centre of the right-end MVM DNA palindrome induces hairpin-primed viral DNA replication. J Gen Virol, 2002, 83: 1659–1664. DOI: 10.1099/0022-1317-83-7-1659 |
| [16] | Sheu MJ, Chiu CC, Yang DJ, et al. The root extract of Gentiana macrophylla pall.Alleviates B19-NS1-exacerbated liver injuries in NZB/W F1 mice. J Med Food, 2017, 20(1): 56–64. |
| [17] | Wu JQ, Chen X, Ye HY, et al. Nonstructural protein (NS1) of human parvovirus B19 stimulates host innate immunity and blunts the exogenous type Ⅰ interferon signaling in vitro. Virus Res, 2016, 222: 48–52. DOI: 10.1016/j.virusres.2016.06.004 |
| [18] | Chen DY, Chen YM, Chen HH, et al. Human parvovirus B19 nonstructural protein NS1 activates NLRP3 inflammasome signaling in adultonset Still's disease. Mol Med Rep, 2018, 17(2): 3364–3371. |
| [19] | Daeffler L, H rlein R, Rommelaere J, et al. Modulation of minute virus of mice cytotoxic activities through site-directed mutagenesis within the NS coding region. J Virol, 2003, 77(23): 12466–12478. DOI: 10.1128/JVI.77.23.12466-12478.2003 |
| [20] | Xu P, Zhou Z, Xiong M, et al. Parvovirus B19 NS1 protein induces cell cycle arrest at G2-phase by activating the ATR-CDC25C-CDK1 pathway. PLoS Pathog, 2017, 13(3): e1006266. DOI: 10.1371/journal.ppat.1006266 |
| [21] | Yang B, Cai DW, Yu PR, et al. Non-structural proteins of Periplaneta fuliginosa densovirus inhibit cellular gene expression and induce necrosis in Sf9 cell cultures. Virus Genes, 2009, 38(3): 478–486. |
| [22] | Yan ZY, Keiser NW, Song Y, et al. A novel chimeric adenoassociated virus 2/human bocavirus 1 parvovirus vector efficiently transduces human airway epithelia. Mol Ther, 2013, 21(12): 2181–2194. DOI: 10.1038/mt.2013.92 |
| [23] | Wang ZK, Deng XF, Zou W, et al. Human bocavirus 1 is a novel helper for adeno-associated virus replication. J Virol, 2017, 91(18): e00710–17. |
 2019, Vol. 35
2019, Vol. 35




