中国科学院微生物研究所、中国微生物学会主办
文章信息
- 廖卫芳, 付春华, 刘志国, 缪礼鸿, 余龙江
- Liao Weifang, Fu Chunhua, Liu Zhiguo, Miao Lihong, Yu Longjiang
- 中国红豆杉羟化酶基因TcCYP725A22的亚细胞定位及过表达作用分析
- Sub-cellular localization and overexpressing analysis of hydroxylase gene TcCYP725A22 of Taxus chinensis
- 生物工程学报, 2019, 35(6): 1109-1116
- Chinese Journal of Biotechnology, 2019, 35(6): 1109-1116
- 10.13345/j.cjb.190008
-
文章历史
- Received: January 4, 2019
- Accepted: April 24, 2019
- Published: June 5, 2019
2. 华中科技大学 生命科学与技术学院,湖北 武汉 430074
2. School of Life Science and Technology, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China
紫杉醇(Taxol)是一种具有显著抗癌活性的二萜类化合物。但其在红豆杉属(Taxus)植物中的含量极低,天然来源的紫杉醇难以满足临床药用需求[1-3]。利用合成生物学技术,通过微生物发酵生产紫杉醇是解决其供需矛盾的重要手段[4-6]。目前,紫杉醇生物合成路径中的大部分相关酶基因已被鉴定出,但其母核有效羟基化途径的分子机制解析仍是当今的研究热点与难点[7]。
Eisenreich等[8]证实紫杉醇母核上所有羟化修饰均由CYP450单加氧酶催化完成。在植物中,CYP450普遍为膜结合蛋白,广泛参与萜类、黄酮类、植物激素、生物碱类、甾醇类等的合成与代谢途径[9-11]。CYP450是一个庞大的超基因家族,在CYP450的分类中,为了和其他物种区分开,植物CYP450被归为CYP71–CYP99和CYP701–CYP999家族[12]。
紫杉醇母核(紫杉二烯)到最终形成紫杉醇需要经过C1、C2、C4、C5、C7、C9、C10、C13八个位点的有效羟化[13]。目前已有C2、C5、C7、C10和C13位对应的羟化酶基因被解析[14-19],但母核上尚有较多CYP450羟化酶基因及其功能未被确认,尤其是母核上C1、C4和C9位对应的CYP450羟化酶基因尚未发现,是彻底解析紫杉醇生物合成路径的主要瓶颈[7]。系统分析已从红豆杉属植物中鉴定出紫杉醇生物合成羟化酶的基因,可以发现它们均隶属于CYP725家族。
本研究基于前期从中国红豆杉转录组中分析获得的1个新的羟化酶基因TcCYP725A22[20],拟对其进行克隆及亚细胞定位分析,并进一步将其在中国红豆杉细胞中过表达,探究该基因与紫杉醇生物合成的关系,为进一步彻底解析紫杉醇生物合成路径奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料中国红豆杉Taxus chinensis细胞系由中国红豆杉嫩茎诱导的愈伤组织建立,由本实验室保存。于62#培养基中[21],25 ℃、黑暗培养。
1.1.2 菌种与质粒农杆菌Agrobacterium tumefaciens LBA4404、大肠杆菌Escherich coli DH5α由本实验室保存;农杆菌GV3101感受态购于TaKaRa公司;植物表达载体pCAMBIA1303、pBI121、质粒pm-ck CD3-1001均由本实验室保存;pMD18-T克隆载体购于TaKaRa公司。
1.1.3 试剂质粒小提、琼脂糖凝胶DNA回收等试剂盒均购自天根生化科技有限公司;限制性内切酶均购自Fermentas公司;KOD-Plus-Neo购自TOYOBO公司;In-fusion试剂盒购自Clontech公司;T4 DNA ligase购自Thermo公司;乙酰丁香酮(AS)、头孢菌素(Cef)、卡那霉素(Kan)均购自Biosharp公司;引物由奥科鼎盛生物科技有限公司合成;其他试剂购于国药集团。
1.2 方法 1.2.1 TcCYP725A22基因的克隆根据中国红豆杉TcCYP725A22基因序列(GenBank登录号:MF448646.1),采用软件Primer Premier 5.0设计特异性引物(表 1),以cDNA为模板,使用KOD-Plus-Neo进行PCR扩增。
| Primer name | Primer sequence (5′–3′) |
| TcCYP725A22- pCAMIBA1303-F | GGTAGATCTGACTAGTATGC AAATCGAAATGGATACCT |
| TcCYP725A22- pCAMIBA1303-R | CCTTGCTCACACTAGTAAGT CTGGGAAAAAGTTTTAT |
| pm-ck-F | TCTAGAATGGCAAAGGATG TGGAAGC |
| pm-ck-R | GGATCCGACGTTGGCAGCA CTTCTGA |
| EGFP-F | ATGGTGAGCAAGGGCGAG |
| EGFP-R | TTACTTGTACAGCTCGTCC |
| TcCYP725A22-PBI121-F | GGATCCATGCAAATCGAAAT GGATACCT |
| TcCYP725A22-PBI121-R | GAGCTCTCAAAGTCTGGGAA AAAGTTTTAT |
| dlTcCYP725A22-F | AGGAAGGCAGGCATGTGG |
| dlTcCYP725A22-R | GGGGTCAACTGGGATGTAGC |
| dlTS-F | ATGCGTTGGAGGGTCTT |
| dlTS-R | CACAGGCAGTGGAGGC |
| dlT2αH-F | TCATTCCAGTGGGCTCT |
| dlT2αH-R | ACCCGTCAGTTTCGCT |
| dlT5αH-F | GCGCTGCAGAGTTACATTG |
| dlT5αH-R | AGACGATCCTGTTCCTGCTT |
| dlT7βH-F | ATTATTGTGCTCCTCGTCA |
| dlT7βH-R | ACAGTTTTTCCTCGTTGG |
| dlT10βH-F | GCCTGCGGGAAACAA |
| dlT10βH-R | AGTGCGTAAGATGCGATG |
| dlT13αH-F | CGAGCACTCCACAGCA |
| dlT13αH-R | CGGCAGGTCCACAGA |
| Actin-F | GGTATCCACGAGACGA |
| Actin-R | ACCCTCCAATCCAGAC |
PCR扩增反应体系(20 μL)为:KOD-Plus-Neo 0.5 μL、10×KOD缓冲液2 μL、dNTP混合物2 μL (2.5 mmol/L)、上下游引物各0.8 μL (10 μmol/L)、Mg2+缓冲液2 μL、模板适量,用ddH2 O补至20 μL。反应程序为:94 ℃预变性2 min;98 ℃变性30 s,55 ℃退火30 s,68 ℃延伸1 min,34个循环;最后68 ℃延伸10 min。胶回收纯化目的基因,末端加A后连接至pMD18-T载体中并转化大肠杆菌E. coli DH5α感受态细胞,菌落PCR鉴定阳性克隆,并进行测序验证。
1.2.2 TcCYP725A22亚细胞定位载体的构建及洋葱表皮瞬时表达以构建好的质粒pMD18-T-TcCYP725A22为模板,设计引入酶切位点SpeⅠ的引物(表 1),使用KOD-Plus-Neo进行扩增。PCR产物通过凝胶电泳检测后回收,回收产物用SpeⅠ进行酶切,同时用SpeⅠ对亚细胞定位载体pCAMIBA1303进行酶切,于37 ℃反应10 min。分别回收酶切产物,用In-fusion法将TcCYP725A22基因连接到pCAMIBA 1303载体上,得到pCAMIBA1303- TcCYP725A22-EGFP融合表达载体,转入大肠杆菌DH5α。菌落PCR鉴定阳性克隆,并提取阳性克隆单菌落质粒,酶切验证后测序。将测序结果正确的质粒,及阳性对照植物细胞质膜的marker质粒pm-ck CD3-1001和阴性对照pCAMIBA-1303空载体,分别转入农杆菌GV3101。
将含有目标基因质粒(pCAMIBA1303-Tc CYP725A22-EGFP)、阳性对照质粒(pm-ck CD3-1001)、阴性对照质粒(pCAMIBA-1303)的农杆菌GV3101分别活化,侵染预处理过的洋葱表皮,1/2 MS固体平板培养基上,25 ℃、光周期16 h/8 h培养2 d。用无菌水洗涤附着的农杆菌,压片法制片,于共聚焦显微镜下观察,激发光为488 nm。
1.2.3 TcCYP725A22在中国红豆杉细胞中的过表达以构建好的质粒pMD18-T-TcCYP725A22为模板,设计引入酶切位点BamHⅠ和SacⅠ酶切位点的引物(表 1),使用KOD-Plus-Neo进行PCR扩增。胶回收纯化目的基因,然后利用BamHⅠ和SacⅠ进行双酶切,将所得酶切目的基因片段与同样经BamHⅠ和SacⅠ双酶切的载体pBI121使用T4 DNA连接酶连接后,转化大肠杆菌感受态细胞,获得表达重组质粒pBI121-TcCYP725A22。阳性克隆经菌落PCR、酶切鉴定后测序。将测序结果正确的质粒及阴性对照pBI121空载体,分别转入农杆菌LBA 4404。
将LBA 4404阳性克隆接种到10 mL含有Kan抗性的LB液体培养基中,28 ℃、180 r/min恒温培养1–2 d;再取500 μL菌液至50 mL含有Kan抗性的LB液体培养基中,28 ℃、180 r/min恒温培养5–8 h,至菌液OD600达到0.8–1.0;4 ℃、6 000 r/min离心收集菌体。用0.5 mL 62#培养基将菌体重悬,将悬浮的农杆菌接到50 mL 1/6 62#培养基中(蔗糖浓度改为5 g/L),再加入20 μL 1 mol/L的乙酰丁香酮(AS),混匀后加入约5 g红豆杉细胞,25 ℃、125 r/min黑暗条件下共培养2 d。用真空泵将共培养的红豆杉细胞和农杆菌通过砂芯漏斗分离,用无菌水洗3次,洗掉红豆杉细胞中残留的农杆菌。挑取0.3 g红豆杉细胞快速冻存,放于−80 ℃冰箱,用于超表达后基因表达量分析。将剩余的红豆杉细胞接种至新的50 mL 62#液体培养基中(含有300 μg/mL Cef,100 μg/mL Kan);25 ℃、125 r/min黑暗条件下培养10 d后,用砂芯漏斗抽滤,收集细胞,−80 ℃保存,用于紫杉烷含量的测定。以转入pBI121空载体的LBA4404菌株介导的转化作为对照。
1.2.4 TcCYP725A22过表达鉴定及紫杉醇合成关键酶基因的qRT-PCR分析农杆菌介导的瞬时转化培养2 d后的红豆杉细胞用来提取总RNA,并检测关键酶基因的表达水平。利用特定引物对TcCYP725A22以及紫杉醇生物合成途径的关键酶基因紫杉二烯合酶基因(TS)、紫杉烷2α-羟化酶基因(T2αH)、紫杉烷5α-羟化酶基因(T5αH)、紫杉烷7β-羟化酶基因(T7βH)、紫杉烷10β-羟化酶基因(T10βH)和紫杉烷13α-羟化酶基因(T13αH)进行qRT-PCR分析,以actin作为内参,使用引物如表 1所示。
1.2.5 TcCYP725A22过表达红豆杉细胞中紫杉烷含量的检测将培养10 d后的红豆杉细胞取出,50 ℃烘干,充分研磨,均称取0.15 g粉末于洁净的10 mL锥形瓶中,加入冰冷的10 mL/g二氯甲烷和10 mL/g甲醇,冰水中超声助溶30 min,4 ℃提取过夜后,9 000 r/min离心10 min,取上清,用氮吹仪吹干,再加入预冷的5 mL/g超纯水和5 mL/g二氯甲烷,充分振荡混匀。4 ℃、6 000 r/min离心15 min,吸取下层二氯甲烷相,氮吹仪吹干,最后用500 μL色谱纯乙腈溶解,过0.22 μm滤膜,使用安捷伦液质联用仪1100 LC/MSD XCD Trap检测紫杉醇、巴卡亭Ⅲ、10-去乙酰基-巴卡亭Ⅲ、10-去乙酰-紫杉醇、7-表-10-去乙酰紫杉醇、三尖杉宁碱和7-表-紫杉醇7种紫杉烷物质的含量。
色谱条件:色谱柱为Agilent Zorbax SB-Phenyl (4.6 mm×250 mm×5 μm),柱温为30 ℃;流动相为乙腈和水,时间与梯度(乙腈含量)变化具体为T (min)/%B:0/5,10/10,11/50,20/60,30/70,40/90,45/100。流速为1 mL/min;进样量为20 μL;紫外检测波长为227 nm。
质谱条件:ESI正离子源,电压为3.5 kV,氮气40 psi,辅助气流10 L/min,毛细管电流10 nA,毛细管温度325 ℃,离子碎片分析范围为100–1 000 m/z。
2 结果与分析 2.1 TcCYP725A22基因的克隆以中国红豆杉细胞cDNA为模板,以特异性引物扩增TcCYP725A22基因全长,经琼脂糖凝胶电泳检测后,在1 500 bp左右处出现单一条带,与目的基因大小一致。片段连接载体pMD18-T测序后,经Clustal软件分析与NCBI中的序列一致。
2.2 TcCYP725A22蛋白的亚细胞定位将测序成功的pCAMIBA1303-TcCYP725A22- EGFP重组载体转入GV3101感受态中,菌落PCR进行阳性克隆鉴定,电泳检测在1 500 bp左右处出现单一条带,符合目的基因大小,证明载体构建成功。并成功将pm-ck CD3-1001及pCAMIBA1303空载体转入GV3101中,菌落PCR结果为阳性。
农杆菌介导的洋葱表皮细胞瞬时表达结果表明,pCAMIBA1303空载体对照组细胞内各部分均可见绿色荧光(图 1)。融合表达蛋白TcCY P725A22-EGFP在质膜上有荧光信号,其他部位几乎没有荧光,在EGFP-pm-ck-Overlay组图中,可看到绿色荧光与蓝色荧光位置重合,即目的基因蛋白的表达位置与细胞膜的位置重合(图 2),可确定TcCYP725A22定位于细胞膜。
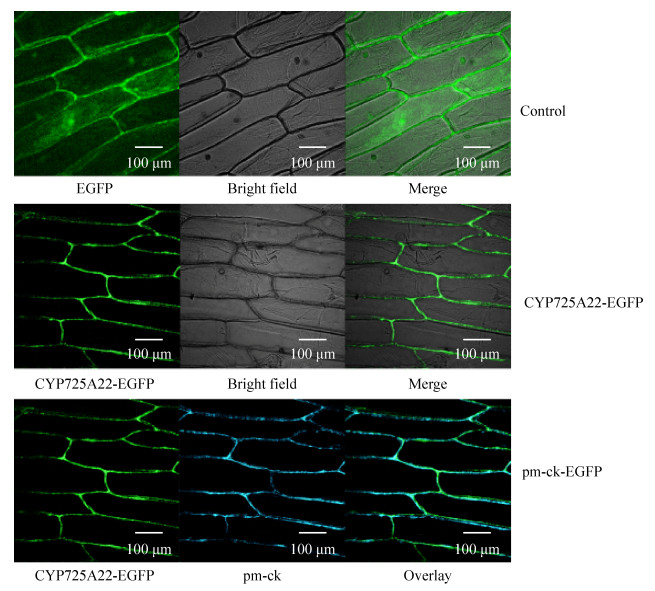
|
| 图 1 TcCYP725A22蛋白在洋葱表皮细胞的定位 Fig. 1 The location of TcCYP725A22 in onion epidermal cells. |
| |
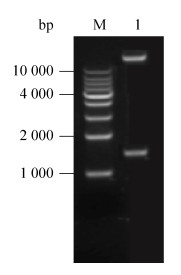
|
| 图 2 重组载体pBI121-TcCYP725A22的酶切验证 Fig. 2 Restriction enzyme digestion of recombinant vector pBI121-TcCYP725A2. M: 1kb DNA marker, 1: BamHⅠ and SacⅠ digestion of pBI121-TcCYP725A22. |
| |
分别对pMD18T-TcCYP725A22和植物表达载体pBI121用BamHⅠ和SacⅠ进行双酶切,分别回收酶切产物,用T4 DNA连接酶进行连接后转化大肠杆菌DH5α。提取阳性克隆质粒,双酶切产物电泳结果显示在1 500 bp和13 000 bp左右处出现了两条特异性条带,分别与目的基因及pBI121载体大小一致,表明TcCYP725A22基因已被成功克隆到pBI121质粒中(图 2)。
将构建好的重组质粒pBI121-TcCYP725A22转入农杆菌LBA4404中,利用菌落PCR鉴定阳性克隆子。使用特异性引物扩增,在1 500 bp处产生特异条带,与TcCYP725A22基因大小一致,说明重组质粒成功转入农杆菌LBA 4404中。
2.4 TcCYP725A22过表达促进红豆杉细胞中紫杉醇合成途径关键酶基因的表达将转入pBI121-TcCYP725A22的农杆菌扩大培养后,侵染红豆杉细胞2 d后,收集细胞提取RNA,采用qRT-PCR法检测了TcCYP725A22及紫杉醇生物合成相关关键酶基因TS、T2αH、T5αH、T7βH、T10βH和T13αH的响应情况。以转入pBI121空载体的农杆菌侵染为对照组,且每实验重复3次。
结果表明,实验组中TcCYP725A22的相对表达量是对照组的30.95倍,说明TcCYP725A22基因在红豆杉细胞中成功过表达。且TcCYP725A22的过表达诱导了紫杉醇生物合成路径中相关酶基因的表达(图 3)。其中,TS的表达量略微上调,为对照组的1.3倍;T7βH和T13αH上调了2倍;T2αH上调3.42倍;T5αH上调3.67倍;T10βH的响应最为显著,上调了20倍。
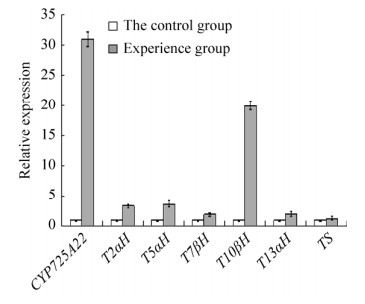
|
| 图 3 TcCYP725A22过表达红豆杉细胞中基因的qRT-PCR分析 Fig. 3 Gene expressions in overexpression TcCYP725A22 Taxus cells. Error bars indicate the mean (SEM). Three independent biological samples were tested by Student's t test. |
| |
采用LC-MS检测TcCYP725A22过表达后,红豆杉细胞中10-去乙酰基-巴卡亭Ⅲ (DAB)、巴卡亭Ⅲ (B-Ⅲ)、10-去乙酰-紫杉醇(DAT)、三尖杉宁碱(CEP)、7-表-10-去乙酰紫杉醇(EDT)、紫杉醇(Taxol)和7-表-紫杉醇(ETOL) 7种紫杉烷物质的含量变化。对照这7种紫杉烷物质标准品液相色谱的出峰时间和质谱的分子离子峰可以确定它们的保留时间依次为15.6 min、17.0 min、19.0 min、20.7 min、21.4 min、21.5 min和24.3 min,根据峰面积计算出TcCYP725A22过表达红豆杉细胞系中这7种紫杉烷的含量分别为5.54、6.57、4.22、15.19、15.13、9.04、5.62 μg/g,均高于对照组(图 4),其中DAB的含量增加最为显著,含量为对照组的1.5倍。说明TcCYP725A22基因的过表达促进了紫杉醇的合成。

|
| 图 4 TcCYP725A22过表达细胞系的紫杉烷含量分析 Fig. 4 Taxane content analysis in overexpression TcCYP725A22 Taxus cells. Error bars indicate the mean (SEM). Three independent biological samples were tested by Student's t test. |
| |
紫杉醇(Taxol)是一种具有显著抗肿瘤活性的三环二萜类化合物,结构十分复杂,其生物合成路径中母核的羟基化修饰过程至今尚未完全解析。本研究对新羟化酶基TcCYP725A22进行了亚细胞定位和过表达功能分析,发现该基因极可能与紫杉醇生物合成相关。
随着功能基因组学的研究,蛋白质亚细胞定位、蛋白质与蛋白质相互作用以及蛋白质的动态变化等成为生物学家们关注的热点。其中,蛋白质的亚细胞定位研究对于系统地理解蛋白的动态变化、蛋白行使功能的原理及蛋白与蛋白间的相互作用是不可或缺的环节,也是功能基因组学的重要内容。植物基因的编码蛋白是由其自身的序列所含有的定位信息制导定位到细胞的特定部位。本研究中TcCYP725A22基因编码蛋白定位在细胞膜,这与先前报道的植物CYP450普遍为膜结合蛋白一致[10]。
目前,研究植物CYP450酶基因功能的主要方法之一是通过转基因技术,将目的基因进行本体或异源过表达后,分析性状或化学成分的差异来探究其生物学功能[22-23]。Zheng等[24]在拟南芥中过表达大豆GmCYP707A1可降低对ABA的敏感性,起到ABA 8′-羟化酶的功能。Han等[25]将苹果类黄酮3′-羟化酶基因(F3′H)在烟草中过表达,转基因烟草的花红色加深。在青蒿中,过量表达黄烷酮3-羟化酶基因(AaF3H),青蒿素合成相关紫穗槐-4, 11-二烯氧化酶基因(AaCYP71AV1)、紫穗槐-4, 11-二烯合成酶基因(AaADS)等表达量显著提高,且提高了青蒿素的含量[26]。本研究发现,将TcCYP725A22在中国红豆杉细胞中过表达后,紫杉醇合成途径中的关键酶基因TS、T2αH、T5αH、T7βH、T10βH和T13αH的表达量在转基因红豆杉细胞中均有所提高。此外,在TcCYP725A22过表达细胞系中,多种紫杉烷物质的含量均增加,可以推测TcCYP725A22羟化酶基因在紫杉醇的合成中有重要作用。这些结果为彻底解析紫杉醇生物合成路径奠定了基础。
| [1] | de Furia MD. Paclitaxel (Taxol®):a new natural product with major anticancer activity. Phytomedicine, 1997, 4(3): 273–282. DOI: 10.1016/S0944-7113(97)80081-5 |
| [2] | Ketchum RE, Wherland L, Croteau RB. Stable transformation and long-term maintenance of transgenic Taxus cell suspension cultures. Plant Cell Rep, 2007, 26(7): 1025–1033. DOI: 10.1007/s00299-007-0323-x |
| [3] | Julsing MK, Koulman A, Woerdenbag HJ, et al. Combinatorial biosynthesis of medicinal plant secondary metabolites. Biomol Eng, 2006, 23(6): 265–279. DOI: 10.1016/j.bioeng.2006.08.001 |
| [4] | Ajikumar PK, Xiao WH, Tyo KEJ, et al. Isoprenoid pathway optim ization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70–74. DOI: 10.1126/science.1191652 |
| [5] | Zhou K, Qiao KJ, Edgar S, et al. Distributing a metabolic pathway among a microbial consortium enhances production of natural products. Nat Biotech, 2015, 33(4): 377–383. |
| [6] | Biggs BW, Lim CG, Sagliani K, et al. Overcoming heterologous protein interdependency to optimize P450-mediated Taxol precursor synthesis in Escherichia coli. Proc Natl Acad Sci USA, 2016, 113(12): 3209–3214. DOI: 10.1073/pnas.1515826113 |
| [7] |
Chen QP, Liao WF, Fu CH, et al. Research progress in hydroxylase in taxol biosynthetic pathway.
Chin J Biotech, 2016, 32(5): 554–564.
(in Chinese). 陈清浦, 廖卫芳, 付春华, 等. 紫杉醇生物合成途径中羟化酶的研究进展. 生物工程学报, 2016, 32(5): 554-564. |
| [8] | Eisenreich W, Menhard B, Lee MS, et al. Multiple oxygenase reactions in the biosynthesis of taxoids. J Am Chem Soc, 1998, 120(37): 9694–9695. DOI: 10.1021/ja981353p |
| [9] | Korte F, Kvesitadze G, Ugrekhelidze D, et al. Organic toxicants and plants. Ecotox Environ Saf, 2000, 47(1): 1–26. DOI: 10.1006/eesa.2000.1929 |
| [10] | Schuler MA. Plant cytochrome P450 monooxygenases. Crit Rev Plant Sci, 1996, 15(3): 235–284. DOI: 10.1080/07352689609701942 |
| [11] | Hannemann F, Bichet A, Ewen KM, et al. Cytochrome P450 systems-biological variations of electron transport chains. Biochim Biophys Acta, 2007, 1770(3): 330–344. DOI: 10.1016/j.bbagen.2006.07.017 |
| [12] | Paquette SM, Bak S, Feyereisen R. Intron-exon organization and phylogeny in a large superfamily, the paralogous cytochrome P450 genes of Arabidopsis thaliana. DNA Cell Biol, 2000, 19(5): 307–317. DOI: 10.1089/10445490050021221 |
| [13] | Croteau R, Ketchum REB, Long RM, et al. Taxol biosynthesis and molecular genetics. Phytochem Rev, 2006, 5(1): 75–97. |
| [14] | Jennewein S, Long RM, Williams RM, et al. Cytochrome P450 taxadiene 5α-hydroxylase, a mechanistically unusual monooxygenase catalyzing the first oxygenation step of taxol biosynthesis. Chem Biol, 2004, 11(3): 379–387. DOI: 10.1016/j.chembiol.2004.02.022 |
| [15] | Schoendorf A, Rithner CD, Williams RM, et al. Molecular cloning of a cytochrome P450 taxane 10β-hydroxylase cDNA from Taxus and functional expression in yeast. Proc Natl Acad Sci USA, 2001, 98(4): 1501–1506. DOI: 10.1073/pnas.98.4.1501 |
| [16] | Jennewein S, Rithner CD, Williams RM, et al. Taxol biosynthesis:taxane 13α-hydroxylase is a cytochrome P450-dependent monooxygenase. Proc Natl Acad Sci USA, 2001, 98(24): 13595–13600. DOI: 10.1073/pnas.251539398 |
| [17] | Chau M, Croteau R. Molecular cloning and characterization of a cytochrome P450 taxoid 2α-hydroxylase involved in taxol biosynthesis. Arch Biochem Biophys, 2004, 427(1): 48–57. |
| [18] | Chau M, Jennewein S, Walker K, et al. Taxol biosynthesis:molecular cloning and characterization of a cytochrome P450 taxoid 7β-hydroxylase. Chem Biol, 2004, 11(5): 663–672. |
| [19] | Guerra-Bubb J, Croteau R, Williams RM. The early stages of taxol biosynthesis:an interim report on the synthesis and identification of early pathway metabolites. Nat Prod Rep, 2012, 29(6): 683–696. DOI: 10.1039/c2np20021j |
| [20] | Liao WF, Zhao SY, Zhang, M, et al. Transcriptome assembly and systematic identification of novel cytochrome P450s in Taxus chinensis. Front Plant Sci, 2017, 8: 1468. DOI: 10.3389/fpls.2017.01468 |
| [21] | Zhang CH, Mei XG, Liu L, et al. Enhanced paclitaxel production induced by the combination of elicitors in cell suspension cultures of Taxus chinensis. Biotechnol Lett, 2000, 22(19): 1561–1564. DOI: 10.1023/A:1005684901329 |
| [22] | Lee MH, Jeong JH, Seo JW, et al. Enhanced triterpene and phytosterol biosynthesis in Panax ginseng overexpressing squalene synthase gene. Plant Cell Physiol, 2004, 45(8): 976–984. DOI: 10.1093/pcp/pch126 |
| [23] | Kim OT, Kim SH, Ohyama K, et al. Upregulation of phytosterol and triterpene biosynthesis in Centella asiatica hairy roots overexpressed ginseng farnesyl diphosphate synthase. Plant Cell Rep, 2010, 29(4): 403–411. DOI: 10.1007/s00299-010-0831-y |
| [24] | Zheng Y, Huang YY, Xian WH, et al. Identification and expression analysis of the glycine max cyp707a gene family in response to drought and salt stresses. Ann Botany, 2012, 110(3): 743–756. DOI: 10.1093/aob/mcs133 |
| [25] | Han YP, Vimolmangkang S, Soria-Guerra RE, et al. Ectopic expression of apple F3ʹH genes contributes to anthocyanin accumulation in the arabidopsis tt7 mutant grown under nitrogen stress. Plant Physiol, 2010, 153(2): 806–820. DOI: 10.1104/pp.109.152801 |
| [26] |
Zhang TT, Ma JW, Wang LY, et al. Improving artemisinin content of Artemisia annua L.through overexpression of flavanone 3-hydroxylase gene (AaF3H).
Curr Biotech, 2018, 8(1): 55–62.
(in Chinese). 张婷婷, 马嘉伟, 王路尧, 等. 过量表达黄烷酮3-羟化酶基因(AaF3H)提高青蒿中青蒿素的含量. 生物技术进展, 2018, 8(1): 55-62. |
 2019, Vol. 35
2019, Vol. 35




