中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王金明, 徐慧淼, 闫子鹏, 杨镓蓉, 朱雅雅, 成小芳, 王俊东
- Wang Jinming, Xu Huimiao, Yan Zipeng, Yang Jiarong, Zhu Yaya, Cheng Xiaofang, Wang Jundong
- 氟中毒及补钙干预大鼠骨骼差异蛋白的分离与鉴定
- Separation and identification of differential protein in rat's bone with fluorosis and calcium supplementation intervention
- 生物工程学报, 2019, 35(6): 1097-1108
- Chinese Journal of Biotechnology, 2019, 35(6): 1097-1108
- 10.13345/j.cjb.180497
-
文章历史
- Received: November 29, 2018
- Accepted: March 4, 2019
- Published: March 20, 2019
2. 山西农业大学 文理学院,山西 太谷 030801
2. College of Arts and Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi, China
氟中毒是全世界广泛存在的一种人畜共患地方性中毒病,该病危害严重、分布广泛、难以治愈。过量的氟可导致组织和细胞损伤,骨骼和牙齿是受其威胁的主要靶器官和组织,主要临床表现是氟骨症和氟斑牙[1-2]。
高氟不仅可使骨硬化、骨软化,还可引起骨质疏松及骨周围软组织化骨。近年来对氟骨症的骨组织形态结构研究表明,中毒后的骨骼结构松散、着色不均,Havers氏系统受损[3]。Yan等对大鼠饲喂含有NaF的去离子水120 d后,取胫骨和股骨进行结构观察后发现,中毒后的骨小梁数目、体积均降低,形状不规则,且骨组织中胶原纤维断裂、肿胀、排列紊乱,网状结构受损[4]。Zhang等发现,高剂量的氟还可影响骨细胞DNA的合成并诱导骨细胞凋亡[5]。有研究发现,钙或含钙化合物对一定条件下的氟中毒能起到适当的预防和治疗作用[6],可明显缓解氟中毒带来的骨质损伤和内质网应激[7]。关于钙对氟中毒的缓解机制,可能会通过影响氟的吸收、骨转换、氧化应激、细胞凋亡等过程,从而改变氟对机体的损伤作用[8]。
蛋白质是生命活动的重要体现者,是生命的物质基础。随着后基因组时代的到来,蛋白组学技术已经广泛应用到科学研究的各个领域。其中蛋白质双向电泳(Two-dimensional electrophoresis,2-DE)是蛋白质组学研究中应用最广泛的分离和鉴定技术手段,能有效地查找差异蛋白[9-10]。基质辅助质量飞行时间质谱技术(Matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF MS)具有灵敏度高、准确度高和分辨率高等特点[11-12],可与多种蛋白质分离方法相结合。目前,2-DE和MALDI-TOF MS已成为许多研究者对差异蛋白质进行比较和鉴定的常用方法。
因此本研究以试验周期为120 d的正常组(C)、染氟组(F)、染氟补钙组(F+Ca) SD大鼠的股骨组织提取的蛋白质为样本,采用蛋白质2-DE和MALDI-TOF MS技术以及生物信息学分析,从蛋白组学水平研究氟和钙对骨组织蛋白表达的影响,分析差异蛋白的功能及关系,在蛋白水平解释钙对骨骼氟中毒缓解的作用机制,为进一步的研究提供理论依据。
1 材料与方法 1.1 实验动物和材料30只SD雄性大鼠,体重120 g左右,购自山西医科大学实验动物中心。氟化钠(NaF)、浓盐酸、溴酚蓝和氢氧化钠均为分析纯,购自北京化工厂;RIPA蛋白裂解液和蛋白酶抑制剂(PMSF)购自碧云天(Beyotime)公司;IPG胶条购自Bio-Rad公司;胰酶购自Promega公司;快速蛋白银染试剂盒购自中科瑞泰(北京)生物科技有限公司。VersaDoc™成像系统(德国Bio-Rad)、电泳槽(GE ETTAN DALTsix)、等电聚焦仪(GE ETTAN IPGPHOR3)、UltrafleXtreme MALDI TOF/TOF质谱仪(德国布鲁克Bruker Dalton)。
1.2 动物模型30只大鼠购买后饲喂普通饲料,自由饮水,一周适应性饲养后随机分为3组,分别为C组、F组、F+Ca组,每组10只。动物模型建立按表 1进行处理[13]。试验期间所有大鼠均以自由采食和自由饮水的方式饲养,每只每天喂食30 g,采用12 h光照和12 h黑暗,温度控制在22 ℃–25 ℃,湿度控制在55%–60%范围内,定期更换垫料,保证良好的饲养环境,试验周期为120 d[14]。
| Group | NaF concentration(mg/L) | CaCO3 content(%) |
| Control(C) | – | – |
| Fluorisos(F) | 150 | – |
| Fluorisos and Calcium(F+Ca) | 150 | 1 |
取1–1.5 g的股骨中段置于坩埚中,马弗炉灰化后研碎。取研碎的骨灰20–25 mg置于25 mL容量瓶内,加入0.25 mol/L盐酸溶液5 mL使其溶解,然后加一滴溴酚蓝,用0.5 mol/L氢氧化钠溶液中和至刚显蓝色(pH 4),加入12.5 mL总离子强度缓冲溶液(TISAB),定容[14]。倒出溶液至聚乙烯塑料杯中,待电位平衡后用氟离子电极测定其浓度。用此方法首先建立标准曲线,同时进行样本测定。通过下列公式计算出股骨的氟含量。
X=C/m ×25
式中:X表示股骨中氟的含量(μg/g);C为胫骨样品待测液中氟的浓度(μg/mL;m为股骨湿重(g);25为待测液总量(mL)。骨氟结果采用GraphPad Prism 5统计软件的One-way analysis of variance(ANOVA)方法进行,数据表示使用平均值±标准差表示,组间比较使用LSD进行显著性检验,P < 0.05表示差异显著,P < 0.01表示差异极显著。
| Spot number | Accession number | Score | Mr | pI | Protein name | Function |
| A12 | TGM2_MOUSE | 94 | 78 153 | 4.98 | Protein-glutamine gamma-glutamyltransferase 2 | Catalyzes conjugate cross-linking of proteins and polyamines |
| A23 | TXD12-RAT | 54 | 19 178 | 5.25 | Thioredoxin domain-containing protein 12 | Possesses significant protein thiol-disulfide oxidase activity |
| A45 | KPYM_RAT | 107 | 58 294 | 6.63 | Pyruvate kinase isozymes M1/M2 | Catalyzes the transfer of a phosphoryl group from PEP to ADP |
| A47 | K6PF_RAT | 216 | 86 361 | 8.23 | 6-phosphofructokinase, muscle type | The first committing step of glycolysis |
| A53 | CO1A1_RAT | 129 | 138 895 | 5.71 | Collagen alpha-1(I) chain | One of the structural components of the extracellular matrix |
| A74 | NGAL_RAT | 61 | 22 716 | 8.41 | Neutrophil gelatinase-associated lipocalin | Involved in multiple processes such as apoptosis, innate immunity |
| A76 | MYL1_RAT | 396 | 20 781 | 4.99 | Myosin light chain 1/3, skeletal muscle isoform | Regulatory light chain of myosin, does not bind calcium |
| A82 | MLRS_RAT | 486 | 19 071 | 4.82 | Myosin regulatory light chain 2, skeletal muscle isoform | Regulates ATPase activity, binds calcium |
| A85 | RABP1_RAT | 329 | 15 753 | 5.3 | Cellular retinoic acid-binding protein 1 | Regulate the access of retinoic acid to its nuclear receptors |
| B38 | ILEUA_RAT | 268 | 42 871 | 5.92 | Leukocyte elastase inhibitor A | Regulates the activity of the neutrophil proteases |
| B72 | ACTB_RAT | 84 | 42 052 | 5.29 | Actin, cytoplasmic 1 | Participate in the movement of various cells |
| B77 | DDX3Y_PONAB | 100 | 73 454 | 7.24 | ATP-dependent RNA helicase DDX3Y | ATP-dependent RNA helicase and plays a role in spermatogenesis |
| B84 | ANXA5_RAT | 271 | 35 779 | 4.93 | Annexin A5 | Involved in the blood coagulation cascade. |
| B94 | GSTO1_RAT | 224 | 27 936 | 6.25 | Glutathione S-transferase omega-1 | Exhibits glutathione-dependent thiol transferase and dehydroascorbate reductase activities |
| B99 | CLIC1_RAT | 76 | 27 306 | 5.09 | Chloride intracellular channel protein 1 | Can insert into membranes and form chloride ion channels |
| B106 | CT011_HUMAN | 82 | 26 789 | 4.92 | Protein C20orf11 | Unkown |
| B125 | RET4_RAT | 218 | 23 547 | 5.69 | Retinol-binding protein 4 | Delivers retinol from the liver stores to the peripheral tissues |
参照王簕等对兔骨总蛋白的提取方法[15],用骨钳截取适量的靠近股骨头近端的大鼠股骨并迅速放入预冷并加有液氮的研钵中,快速研磨至粉末状,然后将粉末状的股骨放入含有RIPA裂解液(按每50 mg骨组织加入200 μL裂解液)的1.5 mL EP管中,加入与RIPA体积比为99:1的蛋白酶抑制剂(PMSF)。振荡2–3 min,然后将EP管置于冰上,静置裂解30 min。4 ℃、12 000 r/min离心15 min,吸取上清用Bradford法定量测定蛋白含量[16],然后取其上清液分装并置于−80 ℃保存。
1.5 双向电泳等电聚焦:沿着聚焦盘中槽的边缘至左而右线性加入250 μg样品。将IPG胶条(24 cm pH 4–7)放入聚焦盘,并一起放入等电聚焦仪中,设置等电聚焦程序。聚焦程序为:无电压水化12 h(20 ℃);250 V线性升压30 min;500 V快速升压1 h;1 000 V快速升压1 h;10 000 V线性升压5 h;10 000 V快速升压,整个聚焦过程中最终累积增压达到90 000 V/h,完成等电聚焦。该过程结束后胶条进行平衡。
SDS-PAGE:分离胶浓度为12%,电泳条件为10 mA/gel 1 h,20 mA/gel 10–12 h,直到溴酚蓝迁移至分离胶底部。每个样本重复3次。凝胶染色方法为硝酸银染色。
1.6 图像采集及分析图像采集采用VersaDoc™成像系统,用PDQuest图像软件分析与参考胶相比有特异表达、表达量上调或者下调2.5倍以上的差异蛋白点。
1.7 MALDI-TOF-MS分析将2.5倍以上的差异蛋白点挖出,用胰酶进行胶内消化后将样品与基质液CHCA(a-氰基-4羟基肉桂酸)按照1:1进行混合,取1 μL样品点靶后用UltrafleXtreme MALDI TOF/TOF质谱仪对差异表达的蛋白点进行质谱分析,质荷比(m/z)检测范围设定为350–1 300 m/z,采用正离子和自动获取数据的模式进行数据采集,将所得到的肽片段质量数据通过MASCOT搜索引擎检索,用UniProt数据库检索蛋白质功能。
1.8 GO注释GO(Gene ontology)可标准化地统一描述生物体系中基因及其产物的生物学功能。GO共有三级结构(Ontology),包括描述基因的分子功能(Molecular function)、所处的细胞组分(Cellular component)以及参与的生物过程(Biological process)。采用DAVID分析系统对差异蛋白进行GO富集分析[17]。
1.9 差异蛋白的pathway富集分析差异蛋白ID号导入DAVID分析系统,找出显著性富集的KEGG pathway。通过pathway显著性富集确定差异蛋白参与的最主要生化路径和信号转导途径[17]。
1.10 蛋白质互作网络分析釆用STRING-Known and Predicted Protein- Protein Interactions数据库进行蛋白质-蛋白质相互作用分析。STRING数据库使用最短的枝干将因子间进行连接,欧氏距离较近说明两个因子性质较近,距离较远说明关联较远。
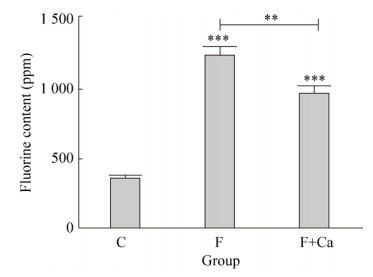
2 结果与分析 2.1 大鼠生长状况及骨氟含量对照组大鼠生长状态正常,精神状态良好,被毛正常有光泽,反应灵敏,牙齿完整。染氟组大鼠生长状态较差,精神状态异常,有些出现过度亢奋,被毛暗淡无光泽,牙齿出现白垩样不透明性改变。染氟补钙组大鼠状态均较染氟组状态好,牙齿白垩样不透明状态也有所改善。提示氟中毒对骨相组织有明显的损伤,而补充钙可一定程度上缓解氟对硬组织的毒性作用。各组大鼠骨氟含量见图 1,与对照组相比,试验期120 d氟中毒大鼠骨氟含量显著升高(P < 0.001)。与氟中毒组相比,氟中毒补钙组大鼠骨氟含量显著降低(P < 0.001)。表明补钙对骨骼氟含量的沉积有明显的缓解作用。
|
| 图 1 各实验组大鼠骨氟含量 Fig. 1 Fluoride content in rats of each experimental group. **P < 0.01, *** P < 0.001, compared with control group and Fluorosis group. |
| |
经过等电聚焦、SDS-PAGE分离、硝酸银染色以及图像扫描后,分析不同组别差异蛋白的2-DE凝胶图谱(图 2、3、4、5)。经Image Master 2D Platinum software对2-DE胶分析后,以对照组为参考胶,蛋白表达量在F组和F+Ca组都有差异的蛋白点共鉴定出17种。以C组为参考,其中蛋白表达量在F和F+Ca组均上调且F组上调程度大于F+Ca组的蛋白点为A47(E135)、A53(E178)、A76(E225)、A82(E243)、A85(E252);在F组上调且在F+Ca组下调的蛋白点为A12(E26)、A23、A45(E115)、A74(E224),这9种差异蛋白点为氟可使蛋白表达显著上调,而钙可以缓解氟中毒所致蛋白表达的上调。在F组下调且在F+Ca组上调的蛋白点为B84(F61)、B94(F67)、B125(F106);在F组和F+Ca组均下调且F组下调程度大于F+Ca组的蛋白点为B38(F28)、B72(F46)、B77(F56)、B99(F72)、B106(F76),这8种差异蛋白点为氟中毒可使蛋白表达显著下调,而补钙可以抑制氟引起的蛋白表达量下降。括号内为重复点。

|
| 图 2 F组上调的差异蛋白 Fig. 2 Different upregulated proteins in group F. |
| |

|
| 图 3 F组下调的差异蛋白 Fig. 3 Different downregulated proteins in group F. |
| |
|
| 图 4 F+Ca组上调的差异蛋白 Fig. 4 Different upregulated proteins in group F+Ca. |
| |

|
| 图 5 F+Ca组下调的差异蛋白 Fig. 5 Different downregulated proteins in group F+Ca. |
| |
对这17种差异2.5倍以上的蛋白点进行质谱鉴定后,通过MASCOT、NCBI数据库检索和Uniprot蛋白质功能和分类查询,对差异蛋白点进行功能注释和分类(表 2)。蛋白点A53为Ⅰ型胶原蛋白(Col1a1)、A76为肌球蛋白L链1或3(MYL1)、A82是肌球蛋白调节L链2(MLRS、Mylpf)、B72是肌动蛋白(Actb),这4种蛋白质与细胞骨架有关。蛋白点A45为丙酮酸激酶同工酶M1/M2(KPYM,Pkm)、A47为6-磷酸果糖激酶(K6PF,Pfkm),二者是能量代谢相关的酶。与细胞凋亡和氧化应激有关的差异蛋白有5种,分别为A12蛋白质谷氨酰胺转移酶2(Tgm2)、B84膜联蛋白A5(Annexin A5)、B99胞内氯离子通道蛋白1(CLIC1)、B94谷胱甘肽S转移酶ω-1(GSTO1)和A23硫氧还蛋白域蛋白12(Txndc12)。A74为脂质运载蛋白2(NGAL)、A85为细胞视黄酸结合蛋白1(RABP1)、B125为视黄醇结合蛋白4(RET4),这3种蛋白与物质转运有关。另外B38为白细胞弹性蛋白酶抑制剂A(ILEUA,Serpinb1a),参与炎症免疫抑制。B106为CT011蛋白未鉴定出来,其功能仍需进一步研究。以上结果表明,氟中毒主要影响骨组织中细胞骨架的形成、能量代谢及细胞的应激与凋亡,同时影响到物质转运及免疫抑制,而补充钙可以缓解氟的骨骼毒性作用。
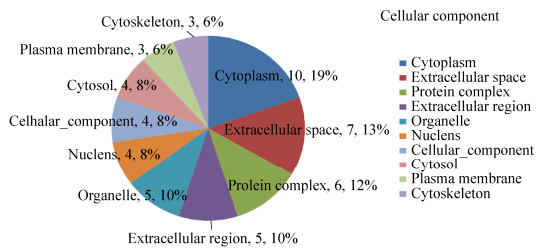
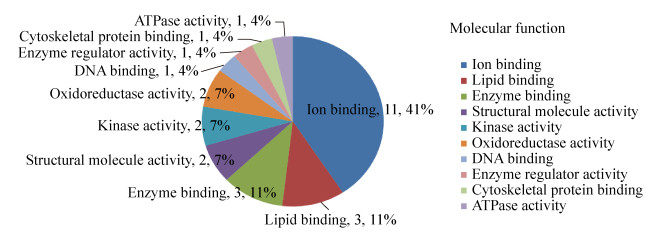
2.4 显著差异蛋白的生物信息学分析 2.4.1 GO注释将17种显著差异蛋白提交至DAVID分析系统,得到差异蛋白质中显著富集的GO条目。按蛋白的富集度进行排序,排名前6位的生物过程中依次有内稳定过程(13%)、解剖结构的发展(11%)、小分子代谢过程(11%)、运输(11%)、蛋白质复合体组装(11%)、应激反应(图 6);在细胞成分中依次是细胞质(19%)、细胞外空隙(13%)、蛋白质复合体(12%)、胞外区(10%)、细胞器(10%)、细胞核(8%)、细胞成分(8%)、和细胞溶质(8%)(图 7);在分子功能中依次为离子结合(41%)、脂质结合(11%)、酶结合(11%)、结构分子活性(7%)、激酶活性(7%)、氧化还原酶活性(7%)(图 8)。结合差异蛋白质谱鉴定的结果,表明氟中毒重点通过应激反应引起骨骼产生氧化应激、破坏细胞骨架、引起骨细胞炎症反应、细胞内物质转运过程紊乱,最终导致细胞凋亡,而补充钙对氟的骨骼毒性有显著的缓解作用。

|
| 图 6 骨骼差异蛋白参与的生物过程 Fig. 6 Biological process involved by skeletal differential proteins. |
| |
|
| 图 7 骨骼差异蛋白包含的细胞成分 Fig. 7 Cellular component contained by skeletal differential proteins. |
| |
|
| 图 8 骨骼差异蛋白包含的分子功能 Fig. 8 Molecular function of skeletal differential proteins. |
| |
基于KEGG数据库对差异蛋白基因进行通路注释,得到差异蛋白基因所参与的所有通路。筛选出差异蛋白所参与的38条与骨代谢相关的通路(表 3)。与骨代谢相关的38条通路所涉及到的9种差异蛋白分别为Col1a1、Mylpf、Actb、Pkm、Pfkm、Serpinb1a、Tgm2、Txndc12和Gsto1。有部分差异蛋白参与了多种通路的代谢,如Actb同时参与16条通路,Pkm和Pfkm分别参与了8条通路,Col1a1参与了骨代谢的3条通路。但也有部分差异蛋白只涉及一种骨代谢通路,如Tgm2、Txndc12和Gsto1。在本实验中,Col1a1参与了黏着斑(Focal adhesion,FA)、PI3K-Akt信号通路和ECM-receptor interaction这3条通路,FA是细胞与细胞外基质(ECM)的主要连接方式,整合蛋白的集聚可以造成黏着斑激酶(FAK)的集合与磷酸化,由此激活整条PI3K/Akt信号通路,维持对细胞及ECM粘附能力,改变细胞骨架,阻止细胞凋亡[18]。氟中毒发生时,影响ECM的形成,导致细胞骨架发生改变,提示钙可能通过这3条通路调节Col1a1缓解骨骼氟中毒。Pfkm参与了AMP-activatedproteinkinase(AMPK)信号通路,同时调节细胞内能量和代谢平衡,其激活后可以增加ATP的生成。在本实验中,Pfkm在氟中毒中表达量增加,可能会激活AMPK通路,补钙后通过抑制AMPK信号通路中Pfkm的表达缓解氟中毒使Pfkm的表达量降低。
| KEGG ID | KEGG pathways | Protein number | Protein name |
| rno04510 | Focal adhesion | 3 | Col1a1/Mylpf/Actb |
| rno04810 | Regulation of actin cytoskeleton | 2 | Mylpf/Actb |
| rno01230 | Biosynthesis of amino acids | 2 | Pkm/Pfkm |
| rno01200 | Carbon metabolism | 2 | Pkm/Pfkm |
| rno05146 | Amoebiasis | 2 | Col1a1/Serpinb1a |
| rno01100 | Metabolic pathways | 2 | Pkm/Pfkm |
| rno04530 | Tight junction | 2 | Actb/Mylpf |
| rno04611 | Platelet activation | 2 | Actb/Col1a1 |
| rno04670 | Leukocyte transendothelial migration | 2 | Actb/Mylpf |
| rno00010 | Glycolysis/Gluconeogenesis | 2 | Pkm/Pfkm |
| rno04390 | Hippo signaling pathway | 1 | Actb |
| rno04919 | Thyroid hormone signaling pathway | 1 | Actb |
| rno05164 | Influenza A | 1 | Actb |
| rno04974 | Protein digestion and absorption | 1 | Colia1 |
| rno05203 | Viral carcinogenesis | 1 | Pkm |
| rno05416 | Viral myocarditis | 1 | Actb |
| rno05412 | Arrhythmogenic right ventricular cardiomyopathy(ARVC) | 1 | Actb |
| rno00052 | Galactose metabolism | 1 | Pfkm |
| rno05132 | Salmonella infection | 1 | Actb |
| rno05016 | Huntington’s disease | 1 | Tgm2 |
| rno04520 | Adherens junction | 1 | Actb |
| rno04930 | Type Ⅱ diabetes mellitus | 1 | Pkm |
| rno00480 | Glutathione metabolism | 2 | Txndc12/Gsto1 |
| rno00030 | Pentose phosphate pathway | 1 | Pfkm |
| rno00051 | Fructose and mannose metabolism | 1 | Pfkm |
| rno04921 | Oxytocin signaling pathway | 1 | Actb |
| rno04151 | PI3K-Akt signaling pathway | 1 | Col1a1 |
| rno00620 | Pyruvate metabolism | 1 | Pkm |
| rno04152 | AMPK signaling pathway | 1 | Pfkm |
| rno05100 | Bacterial invasion of epithelial cells | 1 | Actb |
| rno04971 | Gastric acid secretion | 1 | Actb |
| rno05414 | Dilated cardiomyopathy | 1 | Actb |
| rno05410 | Hypertrophic cardiomyopathy(HCM) | 1 | Actb |
| rno05205 | Proteoglycans in cancer | 1 | Actb |
| rno00230 | Purine metabolism | 1 | Pkm |
| rno04512 | ECM-receptor interaction | 1 | Col1a1 |
| rno04015 | Rap1 signaling pathway | 1 | Actb |
| rno04145 | Phagosome | 1 | Actb |
采用STRING 10.5检索17种显著差异蛋白质相互作用并建立蛋白互相作用网络图(图 9),除去DDX3Y和CT011这2种孤立蛋白,显示15种差异蛋白存在相互作用,可以形成网络代谢图。

|
| 图 9 差异蛋白质网络分析 Fig. 9 Network analysis of differentially expressed proteins. |
| |
氟中毒作为全世界广泛存在的一种地方病,主要表现为氟骨症和氟斑牙。有文献报道,氟可能是通过mTOR自噬通路、凋亡通路、PI3K/Akt通路、p38MAPK信号通路、Sema4D/Plexin-B1信号通路和刺猬(Hh)信号通路等引起机体氟中毒[19-21]。研究报道,钙作为氟的一种拮抗剂,可能通过调节内质网应激、线粒体通路和Wnt信号通路等缓解氟中毒[7, 22]。本实验通过2-DE和MALDI-TOF MS筛选分析F及Ca对骨组织蛋白的差异表达。结合UniProt数据库、GO注释、KEGG pathway与STRING蛋白互作网络分析,鉴定出17种差异蛋白,38条骨代谢信号通路,且对17种差异蛋白的功能进行分析,发现氟中毒及钙对骨组织的作用机制可能与细胞骨架、能量代谢、物质转运、离子通道及细胞凋亡等有关。
骨组织由多种骨细胞和ECM构成,研究表明氟可以影响软骨和骨骼的胶原代谢[4, 23]。Col1a1是ECM中重要的结构蛋白,具有调控胶原纤维形成、组织分化、损伤修复、为骨基质提供矿化支架等多种功能[24]。Actb是一种高度保守的细胞骨架蛋白,参与多种代谢通路,也是细胞骨架重塑引起细胞分裂的关键[25],所以在细胞分泌、吞噬、移动、胞质流动和胞质分离、神经的形成和细胞凋亡等过程中起重要作用。Mylpf也是细胞骨架的组成成分,并参与细胞质流动、细胞器运动、物质运输、有丝分裂、胞质分裂等过程并为细胞的顶端生长等提供所需的力[26]。黏着斑(FA)可以保持细胞正常结构和正常功能的稳定和发挥[27],也可以连接细胞与ECM,而黏着斑激酶(FAK)的集合与磷酸化可以激活整条PI3K/Akt信号通路,维持对细胞及ECM粘附能力,阻止细胞凋亡[19]。在本研究中氟影响ECM的形成,导致细胞骨架发生改变,引起Col1a1和Mylpf上调、Actb表达量降低;加钙后,细胞骨架得以修复,Col1a1和Mylpf表达量上升、Actb下调。有研究显示,PI3K/Akt信号通路可改变破骨细胞的骨架、分化、游走和存活[20],而氟化钠可以通过P13K/Akt信号转导系统对人成骨细胞进行调控[28],与本研究的结果一致。提示钙可能通过调节P13K/Akt通路中Col1a1、Mylpf及Actb的表达缓解骨骼氟中毒。
Tgm2可通过诱导蛋白质之间发生交联、转氨基和脱氨基等作用催化Ca2+依赖蛋白的转录后修饰[29-30],参与机体伤口愈合、自身免疫性疾病、肿瘤生长和氧化应激反应等诸多病理反应[31-32],在炎症病变组织和炎症刺激下细胞中的Tgm2表达升高。另外Tgm2表达可以激活酪氨酸激酶FAK,活化抗凋亡信号通路如P13/AKT等,促进细胞增殖[33]。在本实验中,氟中毒导致Tgm2显著上调,加钙后Tgm2表达量显著下降,这与PI3K-Akt信号通路中Tgm2表达激活酪氨酸激酶FAK的研究结果相一致[33]。提示钙可能通过调控Tgm2激活P13/AKT等通路缓解氟中毒,具体机制需进一步验证。
GSTO1在谷胱甘肽循环中具有单甲基砷酸(MMA5+)还原酶、硫醇转移酶和谷胱甘肽依赖的脱氢抗坏血酸还原酶活性[34]。Board等[35]和Menon等[36]分别在小鼠抗辐射细胞内和炎症反应、结肠炎和肥胖症模型中发现GSTO1表达显著升高,表明GSTO1在氧化应激中有非常重要的作用。本课题组在前期体外研究沉默GSTO1基因后低剂量氟对成骨细胞自噬增强,凋亡减少[37],与本实验结果不一致,其原因可能是低剂量氟的刺激作用和高剂量氟的毒性作用正好相反,具体机制有待进一步研究。
Serpinb1a是由白细胞受到炎症刺激而释放出的一种保护性的抗炎免疫调节剂,参与了阿米巴病(Amoebiasis)的代谢途径。有研究指出缺乏Serpinb1a(Sb1a-/-)的小鼠肺部感染的敏感性增加[38]。在本实验中,Serpinb1a在氟组表达量显著降低,加钙后表达量有所上升。Ashida等发现前列腺上皮内瘤变(PIN)和前列腺癌的全基因组基因表达谱中Serpinb1a显著下调[39],这与本研究结果相一致。提示氟可能通过调节Serpinb1a引起感染,而钙可以抑制Serpinb1a蛋白的表达减轻骨骼炎症反应从而缓解氟中毒。
综上所述,17种差异蛋白参与不同的骨代谢信号通路,钙可能通过这些途径进而缓解氟对骨组织细胞的损伤。由于目前的研究仅仅是蛋白质组学初筛试验,这些差异表达蛋白与其相关的信号转导通路还需要进一步深入研究。
| [1] | Patil MM, Lakhkar BB, Patil SS. Curse of fluorosis. Indian J Pediatr, 2018, 85(5): 375–383. DOI: 10.1007/s12098-017-2574-z |
| [2] | Daiwile AP, Sivanesan S, Tarale P, et al. Role of fluoride induced histone trimethylation in development of skeletal fluorosis. Environ Toxicol Pharmacol, 2018, 57: 159–165. DOI: 10.1016/j.etap.2017.12.015 |
| [3] |
Yu YN, Yang D, Zhu ZH, et al. Expression of mRNA and protein of p38, Osx, PI3K and Akt1 in rat bone with chronic fluorosis.
Chin J Pathol, 2012, 41(9): 622–626.
(in Chinese). 于燕妮, 杨丹, 朱海振, 等. 慢性氟中毒大鼠p38、成骨相关转录因子、磷脂酰肌醇激酶、Akt1的表达与骨组织的损伤. 中华病理学杂志, 2012, 41(9): 622-626. DOI:10.3760/cma.j.issn.0529-5807.2012.09.011 |
| [4] | Yan XY, Hao XH, Nie QL, et al. Effects of fluoride on the ultrastructure and expression of Type Ⅰ collagen in rat hard tissue. Chemosphere, 2015, 128: 36–41. DOI: 10.1016/j.chemosphere.2014.12.090 |
| [5] |
Zhang B, Guo M, Wang HL, et al. Effect of sodium fluoride on cell apoptosis and caspase-3 expression in mouse Leydig cells in vitro.
J Shanxi Med Univ, 2011, 42(6): 464–468.
(in Chinese). 张斌, 郭民, 王海龙, 等. 氟对小鼠睾丸间质细胞凋亡与caspase-3表达的影响. 山西医科大学学报, 2011, 42(6): 464-468. DOI:10.3969/J.ISSN.1007-6611.2011.06.006 |
| [6] | Gaffney-Stomberg E, Lutz LJ, Rood JC, et al. Calcium and vitamin D supplementation maintains parathyroid hormone and improves bone density during initial military training:A randomized, double-blind, placebo controlled trial. Bone, 2014, 68: 46–56. DOI: 10.1016/j.bone.2014.08.002 |
| [7] | Zhang Y, Zhang KQ, Ma L, et al. Fluoride induced endoplasmic reticulum stress and calcium overload in ameloblasts. Arch Oral Biol, 2016, 69: 95–101. DOI: 10.1016/j.archoralbio.2016.05.015 |
| [8] | Sun Y, Ke LL, Zheng XR, et al. Effects of different levels of calcium intake on brain cell apoptosis in fluorosis rat offspring and its molecular mechanism. Biol Trace Elem Res, 2017, 176(2): 355–366. DOI: 10.1007/s12011-016-0850-9 |
| [9] | Lilley KS, Razzaq A, Dupree P. Two-dimensional gel electrophoresis:recent advances in sample preparation detection and quantitation. Curr Opin Chem Biol, 2002, 6(1): 46–50. |
| [10] | Ong SE, Pandey A. An evaluation of the use of two-dimensional gel electrophoresis in proteomics. Biomol Eng, 2002, 18(5): 195–205. |
| [11] | Lim MS, Elenitoba-Johnson KS. Proteomics in pathology research. Lab Invest, 2004, 84(10): 1227–1244. DOI: 10.1038/labinvest.3700167 |
| [12] | Scalf M, Westphall MS, Smith LM. Charge reduction electrospray mass spectrometry. Anal Chem, 2000, 72(1): 52–60. |
| [13] |
Wang JM, Xu HM, Zhang J, et al. Effects of different calcium levels on the apoptosis pathways of renal tissue cells in rats with fluorosis.
Chin J Anim Vet Sci, 2018, 49(12): 2723–2732.
(in Chinese). 王金明, 徐慧淼, 张杰, 等. 不同水平钙对氟中毒大鼠肾组织细胞内质网凋亡通路的影响. 畜牧兽医学报, 2018, 49(12): 2723-2732. |
| [14] |
Xiao R.Effect of different supplement of calcium on bone injury and endoplasmic reticulum stress in apoptosis pathway induced by fluoride in rat[D].Shanxi: Shanxi Agricultural University, 2015(in Chinese). 肖锐.不同钙水平对氟中毒大鼠骨质损伤及内质网应激的影响[D].山西: 山西农业大学, 2015. |
| [15] |
Wang L, Pei GX. Comparison of physical methods of protein extraction in rabbit bone tissue for Western blot.
Life Sci Res, 2009, 13(2): 137–141.
(in Chinese). 王簕, 裴国献. 兔骨组织总蛋白的提取和在免疫印迹法中的应用. 生命科学研究, 2009, 13(2): 137-141. |
| [16] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248–254. |
| [17] |
Zeng BB.Proteomic analysis on screening differentially expressed proteins of fluorosis rats'bone by iTRAQ combined with mass spectrometry and bioinformatics analysis[D].Guizhou: Guizhou Medical University, 2016(in Chinese). 曾贝贝.iTRAQ联合质谱技术筛选慢性氟中毒大鼠骨组织差异蛋白及生物信息学分析[D].贵州: 贵州医科大学, 2016. |
| [18] | Thamilselvan V, Craig DH, Basson MD. FAK association with multiple signal proteins mediates pressure-induced colon cancer cell adhesion via a Src-dependent PI3K/Akt pathway. FASEB J, 2010, 21(8): 1730–1741. |
| [19] | Golden LH, Insogna KL. The expanding role of PI3-kinase in bone. Bone, 2004, 34(1): 3–12. |
| [20] |
Chen R, Yu YN, Xu L, et al. Role of m TOR autophagy signaling in rats cartilages with fluorosis-caused damage.
Chin J Ctrl Endem Dis, 2017, 32(1): 18–19.
(in Chinese). 陈荣, 于燕妮, 徐淋, 等. mTOR自噬通路在染氟大鼠软骨关节损伤中的作用. 中国地方病防治杂志, 2017, 32(1): 18-19. |
| [21] | Liu XL, Song J, Liu KJ, et al. Role of inhibition of osteogenesis function by Sema4D/Plexin-B1 signaling pathway in skeletal fluorosis in vitro. J Huazhong Univ Sci Technol:Med Sci, 2015, 35(5): 712–715. DOI: 10.1007/s11596-015-1495-1 |
| [22] | Wang JM, Zhao YF, Cheng XF, et al. Effects of different Ca2+level on fluoride-induced apoptosis pathway of endoplasmic reticulum in the rabbit osteoblast in vitro. Food Chem Toxicol, 2018, 116: 189–195. DOI: 10.1016/j.fct.2018.04.013 |
| [23] | Yan XY, Yan XT, Morrison A, et al. Fluoride induces apoptosis and alters collagen I expression in rat osteoblasts. Toxicol Lett, 2011, 200(3): 133–138. |
| [24] | Song M, Huo H, Cao Z, et al. Aluminum trichloride inhibits the rat osteoblasts mineralization in vitro. Biol Trace Elem Res, 2016, 175(1): 186–193. |
| [25] | Guo CM, Liu SQ, Wang JS, et al. ACTB in cancer. Clin Chim Acta, 2013, 417: 39–44. DOI: 10.1016/j.cca.2012.12.012 |
| [26] | Lai JM, Hsieh CL, Chang ZF. Caspase activation during phorbol ester-induced apoptosis requires ROCK-dependent myosin-mediated contraction. J Cell Sci, 2003, 116: 3491–3501. DOI: 10.1242/jcs.00660 |
| [27] |
Wu YZ, Yan YX, Sun J. Research progress on the regulation of adhesion plaque signaling pathway in tumor epithelial interstitial transformation.
J Med Theor Prac, 2015, 28(19): 2601–2604.
(in Chinese). 吴艺舟, 严雨欣, 孙杰. 黏着斑信号通路调控肿瘤上皮间质转化的研究进展. 医学理论与实践, 2015, 28(19): 2601-2604. |
| [28] |
Chen XS, Yu XD, Wang SY, et al. Blockage of PI3K signal pathway significantly inhibits osteoblast differentiation in preosteoblast MC3T3-E1.
Bull Acad Mil Med Sci, 2004, 28(6): 513–515.
(in Chinese). 陈小三, 于晓妉, 王生余, 等. 阻断PI3K信号通路显著抑制成骨前体细胞MC3T3-E1的分化. 军事医学科学院院刊, 2004, 28(6): 513-515. DOI:10.3969/j.issn.1674-9960.2004.06.004 |
| [29] |
Xu J, Yang WP, Li Q, et al. Significance of transglutaminase 2 in henoch-sch nlein purpura nephritis.
J Nanchang Univ:Med Sci, 2018, 58(2): 42–45.
(in Chinese). 徐锦, 杨文萍, 李群, 等. TGM2在过敏性紫癜肾损伤中的意义. 南昌大学学报:医学版, 2018, 58(2): 42-45. |
| [30] | Thangaraju K, Király R, Mótyán J A, et al. Computational analyses of the effect of novel amino acid clusters of human transglutaminase 2 on its structure and function. Amino Acids, 2017, 49(3): 605–614. DOI: 10.1007/s00726-016-2330-0 |
| [31] | Caccamo D, Currò M, Ferlazzo N, et al. Monitoring of transglutaminase2 under different oxidative stress conditions. Amino Acids, 2012, 42(2/3): 1037–1043. |
| [32] | Zhang H, McCarty N. Tampering with cancer chemoresistance by targeting the TGM2-IL6-autophagy regulatory network. Autophagy, 2017, 13(3): 627–628. DOI: 10.1080/15548627.2016.1271516 |
| [33] | Antonyak MA, Miller AM, Jansen JM, et al. Augmentation of tissue transglutaminase expression and activation by Epidermal growth factor inhibit doxorubicin-induced apoptosis in human breast cancer cells. J Biol Chem, 2004, 79(40): 41461–41467. |
| [34] | Schmuck EM, Board PG, Whitbread AK, et al. Characterization of the monomethylarsonate reductase and dehydroascorbate reductase activities of Omega class glutathione transferase variants:implications for arsenic metabolism and the age-at-onset of Alzheimer's and Parkinson's diseases. Pharmacogenet Genom, 2005, 15(7): 493–501. DOI: 10.1097/01.fpc.0000165725.81559.e3 |
| [35] | Board PG, Coggan M, Chelvanayagam G, et al. Identification, characterization, and crystal structure of the omega classglutathione transferases. Biol Chem, 2000, 275(32): 24798–24806. DOI: 10.1074/jbc.M001706200 |
| [36] | Menon D, Innes A, Oakley AJ, et al. GSTO1-1 plays a pro-inflammatory role in models of inflammation, colitis and obesity. Sci Rep, 2017, 7: 17832. DOI: 10.1038/s41598-017-17861-6 |
| [37] |
Wang JM, Gao YF, Cheng XF, et al. Effects of GSTO1 gene silencing on autophagy and apoptosis of fluoride-induced osteoblasts.
Acta Vet Zootech Sin, 2019, 50(1): 183–192.
(in Chinese). 王金明, 高宇凤, 成小芳, 等. GSTO1基因沉默对氟致成骨细胞自噬与凋亡的影响. 畜牧兽医学报, 2019, 50(1): 183-192. |
| [38] | Burgener SS, Baumann M, Basilico P, et al. Myeloid conditional deletion and transgenic models reveal a threshold for the neutrophil survival factor Serpinb1. Biol Chem, 2016, 397(9): 897–905. |
| [39] | Ashida S, Nakagawa H, Katagiri T, et al. Molecular features of the transition from prostatic intraepithelial neoplasia(PIN) to prostate cancer:genome-wide gene-expression profiles of prostate cancers and PINs. Cancer Res, 2004, 64(17): 5963–5972. DOI: 10.1158/0008-5472.CAN-04-0020 |
 2019, Vol. 35
2019, Vol. 35




