中国科学院微生物研究所、中国微生物学会主办
文章信息
- 吴书祎, 兰世建, 文静, 赵天鑫, 黄岚, 罗忠礼
- Wu Shuyi, Lan Shijian, Wen Jing, Zhao Tianxin, Huang Lan, Luo Zhongli
- 手性自组装短肽对子宫创伤修复的影响
- Chirality Self-assembling peptide for rats endometrial regeneration model
- 生物工程学报, 2019, 35(6): 1079-1087
- Chinese Journal of Biotechnology, 2019, 35(6): 1079-1087
- 10.13345/j.cjb.180515
-
文章历史
- Received: December 11, 2018
- Accepted: March 4, 2019
子宫为胚胎植入和生长提供了最重要的内部环境,在妊娠建立与维持方面有着不可替代的作用。我国每年约有1 300万次人工流产发生,手术中机械性的刺激损伤可能造成感染、内膜变薄等[1-4],进而影响子宫腔的正常形态功能,最终导致不孕、习惯性流产等产科疾病。而子宫环境的复杂性,决定了药物很少能直接作用于患处。
子宫病理性创伤后自发修复困难。内膜与基底层同时受损,可导致内膜干细胞受损或缺失。与此同时,局部感染和炎症破坏干细胞微环境[5-6],导致细胞修复障碍,血管再生受阻,腺体减少萎缩,进而造成宫腔局部内膜缺失,宫壁产生纤维化或粘连等现象[7-8]。
自组装短肽是一种新型纳米生物支架材料,具有构建仿细胞外基质(Extracellular matrix,ECM)的功能,能部分模拟ECM功能[9-11]。且自组装短肽仅由氨基酸构成,对生物体无毒害作用[12],具有良好的生物相容性[13]。本课题组在前期研究中发现自组装短肽在心肌修复、快速止血、皮肤创伤[14-16]等再生修复方面具有良好应用。
本研究选用的自组装短肽Sciobio-Ⅱ与Sciobio-Ⅲ均由16个氨基酸残基构成,纯度分别是96.18%与97.03%。我们通过理化性质实验研究Sciobio-Ⅱ与Sciobio-Ⅲ自组装形态及效果;体外细胞实验检测其是否具有良好的生物相容性;通过动物实验分别探究Sciobio-Ⅱ与Sciobio-Ⅲ对子宫创伤模型的修复效果。
1 材料与方法 1.1 材料本研究使用的手性自组装短肽Sciobio-Ⅱ与Sciobio-Ⅲ由成都赛恩贝生物技术有限公司赠送;磷酸盐缓冲剂(PBS, 北京鼎国昌盛);高糖DMEM培养基、胰蛋白酶(Hyclone,美国);青霉素混合液(Genview,美国);4%多聚甲醛固定液、DAB显色试剂盒(上海碧云天);刚果红染液(Genivew,美国);免疫组织化学染色试剂盒(北京中杉新桥);兔抗MMP-9抗体、鼠抗VEGF抗体(Proteintech,美国);孕马血清注射用血促性素(PMSG,赤峰波恩药业,批号:兽药字(2012) 050074564);注射液用绒促性素(HCG,丽珠制药);去离子水;生理盐水。
1.2 方法 1.2.1 短肽溶液配制分别称取Sciobio-Ⅱ与Sciobio-Ⅲ冻干粉末各10 mg,1 mL去离子水溶解,制成10 mg/mL短肽母液,4 ℃冰箱保存备用。等体积PBS溶液与短肽母液混合,放置于室温下,短肽可发生自组装现象,得到浓度5 mg/mL短肽水凝胶。
1.2.2 检测分析短肽二级结构圆二色谱仪(AVIV 400 CD sepectrometer)对Sciobio-Ⅱ与Sciobio-Ⅲ进行CD检测:分别用PBS与短肽母液配制100 μmol/L Sciobio-Ⅱ与Sciobio-Ⅲ溶液,取400 μL于石英比色皿中,室温下进行CD检测[16]。
参数设置:扫描波长190−260 nm,波长间隔0.5 s,光径2 mm。导入测量值,根据下列公式计算[θ]值,横坐标为波长,纵坐标[θ]作图[16]。
[θ]=[m(deg)]/[10(peptide)ln]
1.2.3 宏观观察短肽自组装过程用PBS与短肽母液分别配制5 mg/mL Sciobio-Ⅱ与Sciobio-Ⅲ溶液,37 ℃孵育24 h,在自组装过程第0 h、4 h和24 h,分别吸取10 μL Sciobio-Ⅱ与Sciobio-Ⅲ溶液滴于载玻片上,刚果红染色约20−30 s,镜检观察[16]。
1.2.4 红细胞裂解实验1) 生理盐水与去离子水分别配制浓度为1、10、100 μg/mL的Sciobio-Ⅱ与Sciobio-Ⅲ溶液;2)取SD大鼠腹主动脉血,EDTA抗凝,2 000 r/min离心15 min,弃上清;生理盐水洗涤离心3次,至上层澄清透明;3)分别使用3种不同浓度的短肽溶液稀释红细胞悬液,至其终浓度为2%,作为实验组;去离子水稀释红细胞悬液为阳性对照组;生理盐水稀释红细胞悬液为阴性对照组;4)样本置于37 ℃下水浴孵育1 h,5 000 r/min离心15 min;吸取200 μL上清液,酶标仪检测其在570 nm处的吸光度值。
1.2.5 构建Hela细胞贴壁和空间三维培养体系细胞贴壁培养:将Hela细胞复苏后加入培养基重悬为细胞悬液,接种于25 cm2培养瓶,加入高糖DMEM培养基(10%胎牛血清,1%青链霉素混合液),置于37 ℃、5% CO2细胞培养箱中培养。
细胞三维培养:待细胞二维培养生长覆盖率达90%时进行三维培养。用去离子水和短肽粉末分别配制5 mg/mL Sciobio-Ⅱ与Sciobio-Ⅲ短肽溶液,4 ℃保存。0.25%胰蛋白酶消化后离心,弃上清液加入蔗糖溶液吹打重悬,将细胞浓度调整为约1×105个/mL,分别加入等体积Sciobio-Ⅱ与Sciobio-Ⅲ短肽溶液,将混合液滴加入96孔板,置于细胞培养箱中孵育5 min,然后每孔加入100 μL培养基,放置于37 ℃、5% CO2细胞培养箱孵育。
1.2.6 CCK-8检测三维环境中细胞活性1) 取96孔板中贴壁和空间三维培养的Hela细胞,在实验第1、3、5天进行酶标仪检测;2)每孔加入10 μL CCK-8溶液,37 ℃孵育2–4 h;3)检测450 nm处吸光度(OD)值,其中OD值越大,则细胞活力越强,细胞增殖数量越多。
1.2.7 制备大鼠假孕模型雌性SD大鼠于颈部皮下注射50 IU PMSG,48 h后皮下注射30 IU HCG,定义注射HCG 24 h后,为假孕第1天[17]。
1.2.8 建立大鼠子宫创伤模型1) 体重200-220 g的SD假孕模型大鼠,提前8 h对动物禁食,7%水合氯醛溶液按0.4 mL/100 g进行麻醉。将麻醉后动物固定在特定试验台上,备皮消毒;2)沿腹白线,距耻骨联合上方约2 cm处,纵切一个约2.5−3 cm的切口,依次切开皮肤、肌层、腹膜,进入腹腔,暴露Y型子宫;3)在距子宫交汇处约1 cm处,水平作一个约0.5 cm的切口,放入特制刮宫针,沿子宫系膜对侧宫腔行走约1 cm后退出;4)右侧子宫用微量注射器沿划痕注入30 μL 5 mg/mL Sciobio-Ⅱ与Sciobio-Ⅲ短肽溶液,右侧注入等量生理盐水;5)缝合子宫,温热生理盐水冲洗腹腔,依次缝合关闭腹腔;6)术后第3、7、14天颈椎脱臼处死大鼠,组织取材。用4%多聚甲醛溶液浸泡子宫组织样本,48 h后石蜡包埋并切片、制片。
1.2.9 子宫组织苏木精-伊红(HE)染色1) 组织包埋块脱蜡:放入二甲苯-Ⅰ浸泡10 min后,再放入二甲苯-Ⅱ浸泡5 min;2)梯度水化处理:放入100%酒浸泡1min后;放入95%酒精浸泡30 s;再放入80%酒精浸泡30 s;最后放入75%酒精浸泡30 s;用自来水冲洗2–3次,每次约5 min;3)染色:苏木素染色8 min;自来水冲洗2–3次;1%盐水乙醇6 s;氨水反蓝作用20 s,自来水冲洗;镜检至细胞核呈清晰蓝色;伊红染色2 min,自来水冲洗;4)梯度脱水处理:放入80%酒精浸泡30 s后;再放入95%酒精浸泡30 s;然后放入100%酒精浸泡5 min;最后放入无水酒精浸泡2 min;5)透明:放入二甲苯-Ⅰ浸泡2 min,再放入二甲苯-Ⅱ浸泡2 min;6)中性树脂封片,光镜下观察。
1.2.10 子宫组织免疫组织化学染色1) 烤片:切片置于60 ℃电热恒温烤箱,过夜;2)组织包埋块脱蜡:放入二甲苯-Ⅰ浸泡10 min后,再放入二甲苯-Ⅱ浸泡5 min;3)梯度水化处理:放入100%酒浸泡1 min后;放入95%酒精浸泡30 s;再放入80%酒精浸泡30 s;最后放入75%酒精浸泡30 s;用自来水冲洗2–3次,每次约5 min;4)修复:放入0.1 mol/L柠檬酸混合液,高温加热至沸腾,自然冷却。去离子水冲洗5 min,PBS冲洗5 min;5)阻断:3% H2O2孵育15 min,阻断内源性过氧化物,PBS冲洗10 min;6)滴入一抗,4 ℃孵育过夜;7)室温孵育30 min,滴入二抗,孵育30 min;8) DAB显色;9)苏木素染色,脱水处理步骤同前;10)中性树脂封片,光镜下观察。
2 结果与分析 2.1 手性自组装短肽自组装形态及效果短肽Sciobio-Ⅱ及Sciobio-Ⅲ在37 ℃下孵育24 h后,可在倒置EP管中观察到其呈现凝胶状(图 1);进一步刚果红染色检测,我们发现短肽在盐离子溶液中自组装0 h时,呈现较为分散的细密流沙状结构;4 h时,出现松散膜片结构;24 h后,Sciobio-Ⅱ和Sciobio-Ⅲ形成了颜色透明、稳定均一的膜结构(图 2),其中Sciobio-Ⅱ成膜速度更快。由此,我们初步推测Sciobio-Ⅱ及Sciobio-Ⅲ,可为细胞培养提供足够的支撑,从而进行下一步实验。

|
| 图 1 Sciobio-Ⅱ和Sciobio-Ⅲ水凝胶效果图 Fig. 1 Hydrogel effect of Sciobio-Ⅱ and Sciobio-Ⅲ. (A) Sciobio-Ⅱ. (B) Sciobio-Ⅲ. |
| |

|
| 图 2 Sciobio-Ⅱ和Sciobio-Ⅲ的刚果红染色图(Scale bar=200 μm) Fig. 2 Congo red staining of Sciobio-Ⅱand Sciobio-Ⅲ. Scale bar=200 μm. |
| |
经过圆二色谱(CD)分析,两条自组装短肽的二级结构均为稳定的β折叠结构。且Sciobio-Ⅱ在198 nm处有一强正峰,在212 nm处有一强负峰。Sciobio-Ⅲ与Sciobio-Ⅱ呈镜像相关,在198 nm处有一强负峰,212 nm处有一强正峰(图 3)。
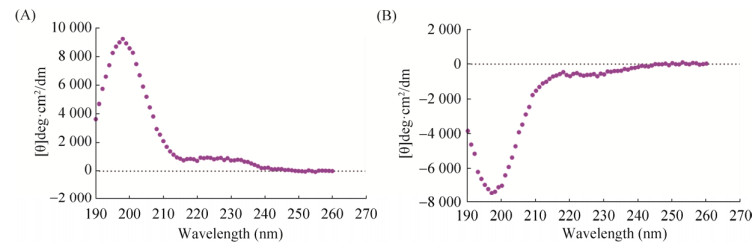
|
| 图 3 Sciobio-Ⅱ和Sciobio-Ⅲ的圆二色谱图 Fig. 3 Circular dichroism spectra (CD) of Sciobio-Ⅱand Sciobio-Ⅲat 25 ℃. (A) Sciobio-Ⅱ. (B) Sciobio-Ⅲ. |
| |
通过分析数据可得,3种不同浓度的Sciobio-Ⅱ及Sciobio-Ⅲ短肽溶液(1、10、100 μg/mL)均对红细胞的裂解程度较低。与阳性对照组裂解度相差30%左右。结果表明,手性自组装短肽在自组装24 h前后对细胞膜都没有破坏与裂解作用,可作为下一步动物实验材料参与大鼠子宫创伤修复实验(图 4)。
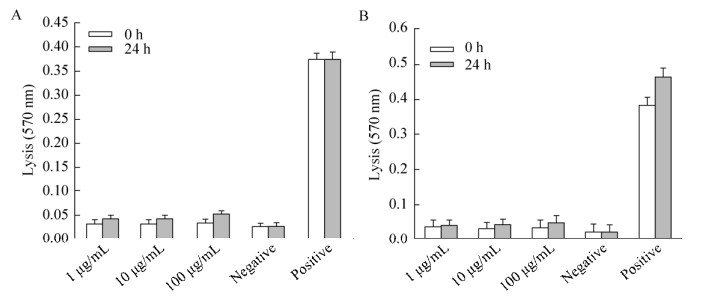
|
| 图 4 红细胞裂解实验 Fig. 4 Erythrocyte membrane lysis assay of Chirality Self-assembling Peptide. (A) Sciobio-Ⅱ. (B) Sciobio-Ⅲ. |
| |
光学显微镜下观察可以看到,在二维培养中Hela细胞呈贴壁生长,分布均匀,细胞多为菱形;在三维培养中,细胞为圆球形,细胞透亮边界清晰,表现为分层生长。在三维环境中,细胞相较于二维环境生长较为缓慢,但生长状态较好,细胞数量持续增长(图 5)。

|
| 图 5 Hela细胞在贴壁与三维培养环境中第3天的生长状态(Scale bar=200 μm) Fig. 5 The growth state at 3 days of Hela cells cultured at different microenvironment. (A) Sciobio-Ⅱ. (B) Sciobio-Ⅲ. (C) 2D environment. Arrowhead: Cells are spherical in Sciobio-Ⅱand Sciobio-Ⅲ. Scale bar=200 μm. |
| |
CCK-8检测结果显示,Hela细胞在由Sciobio-Ⅱ及Sciobio-Ⅲ构建的空间三维环境中增速与二维环境相比较为缓慢,但未出现细胞数量减少,说明Hela细胞可以在Sciobio-Ⅱ及Sciobio-Ⅲ构建的三维环境中生长,短肽Sciobio-Ⅱ及Sciobio-Ⅲ对细胞正常生长、增殖无抑制作用(图 6)。
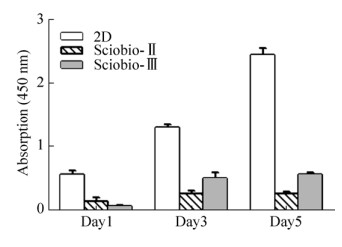
|
| 图 6 Hela细胞在贴壁、三维体系中的CCK-8检测 Fig. 6 CCK-8 (Cell counting kit-8) of hela cells in 2D (2-Dimensional) and 3D (3-Dimensional) systems. |
| |
实验第3天,Sciobio-Ⅱ短肽组基层细胞排列基本有序,Sciobio-Ⅲ短肽组腺体形态与Sciobio-Ⅱ组相比较为混乱,对照组宫腔内可见脱落物,内膜形态异常,内膜层与基层界限模糊。第5天,Sciobio-Ⅱ组基层细胞增多,Sciobio-Ⅲ组较Sciobio-Ⅱ组仍可见基层细胞排列紊乱,对照组出现膜上皮细胞粘连。实验第14天,短肽组基本完成修复过程,与Sciobio-Ⅲ组相比,可见Sciobio-Ⅱ组基底层细胞数量更多,且排列趋向规律,腺体增多;对照组仍可见内膜与腺体出现复层扁平上皮细胞,腺体上皮细胞异常(图 7)。
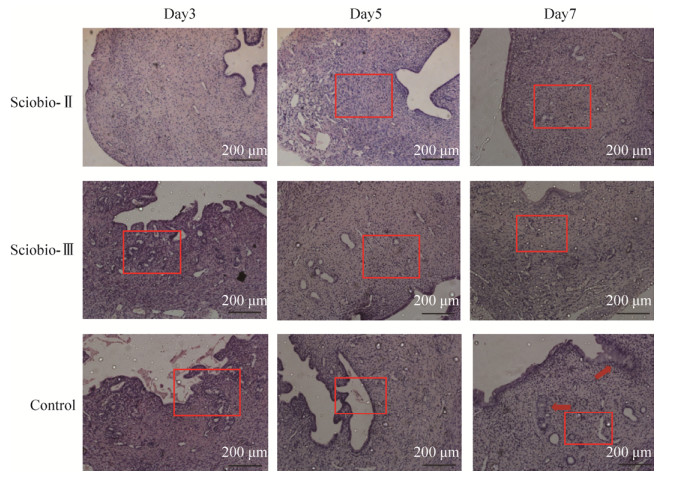
|
| 图 7 手性自组装短肽对子宫修复的HE染色图(Scale bar=200 μm) Fig. 7 HE staining of uterus at different time point in Chirality Self-assembling Peptide. Square: the morphology of endometrium and basal gland at different time points in each group; arrowhead: Abnormal endometrial and glandular epithelial cells in control group. Scale bar=200 μm. |
| |
实验选取在子宫修复过程中发挥重要作用的基质蛋白酶-9 (MMP-9)与血管内皮生长因子(VEGF)进行免疫组织化学染色。结果显示:实验第7天,VEGF主要表达在Sciobio-Ⅱ与Sciobio-Ⅲ腔内膜上皮、腺体上皮广泛表达,对照组阳性表达水平较低;第14天,3组均可见VEGF阳性水平上升,短肽组表达量更高,其中Sciobio-Ⅱ组在近腔侧基质中表达略高于Sciobio-Ⅲ组。MMP-9主要在近肌层基质中,实验第7天,短肽组阳性表达均高于对照组,其中Sciobio-Ⅱ组阳性水平略高于Sciobio-Ⅲ组;第14天,对照组中阳性表达分散在内膜基质中,短肽组仍集中在近肌层基质,其中Sciobio-Ⅲ组表达水平略高于Sciobio-Ⅱ组(图 8)。

|
| 图 8 手性自组装短肽对子宫修复的免疫组织化学染色(Scale bar=100 μm) Fig. 8 Immunohistochemical staining of VEGF and MMP-9 in the uterus at different time point in Chirality Self-assembling Peptide. Arrowhead: main positive reaction areas in endometrium and grass roots. Scale bar=200 μm. |
| |
子宫创伤是人工流产术后常见损伤,临床上,宫腔手术或感染一旦损伤子宫内膜基底层,会导致上皮、间质细胞再生障碍,新生血管形成受损,内膜难以实现自我修复[11],宫腔缺乏内膜覆盖,壁层可发生纤维化、瘢痕化及粘连,进而产生宫腔粘连(IUA)、月经不止、子宫瘢痕等并发症[17-19]。传统组织工程支架材料如合成聚酰类、去细胞基质、胶原类等存在组织强度大[20]、制备工序复杂和机械强度不足等缺点[21-22]。因此,构建适合体内培养的优质支架材料,成为子宫组织工程研究的关键。
本研究所用两条自组装短肽是由氨基酸合成的新型高分子材料,具有良好的生物相容性[23-25],在室温下均可自组装形成水凝胶结构;同时圆二色谱(CD)结果显示,Sciobio-Ⅱ及Sciobio-Ⅲ均可自组装形成纳米纤维交织的膜状结构,两者的二级结呈镜像相关的β折叠结构,其中Sciobio-Ⅱ的成膜速率更快。通过上述结果我们推测,Sciobio-Ⅱ及Sciobio-Ⅱ可为组织细胞提供一定的强度支撑,且构建成分单一、结构稳定。通过体外红细胞裂解实验与CCK-8细胞活性检测,提示在自组装短肽构建三维培养体系中,Hela细胞可持续生长,其中Sciobio-Ⅱ组细胞活动状态更加稳定。以上结果提示,手性自组装短肽对细胞无裂解作用,且细胞能在短肽形成的三维环境中持续增殖。动物实验我们制备假孕大鼠模拟刮宫术构建子宫创伤模型,结果显示,与对照组相比,短肽组中组织修复速度更快。在7 d与14 d两个时间点,短肽组VEGF表达量均高于对照组,其中Sciobio-Ⅱ组阳性水平更高。同时,与对照组相比,Sciobio-Ⅱ及Sciobio-Ⅲ实验组MMP-9表达量更稳定,其中Sciobio-Ⅱ与Sciobio-Ⅲ相比,两个时间点MMP-9表达量提升幅度更小。有研究者认为组织修复前期MMP-9高表达有利于细胞增殖与细胞外基质(ECM)分泌[26-28],后期相对低表达可促进多余ECM吸收,消除水肿。由此我们推测手性自组装短肽在促进子宫修复过程中模拟了部分ECM功能,改善了创面细胞微环境,从而促进部分生长因子与蛋白的表达释放,加快创伤修复进程。
但手性自组装短肽促进修复的分子机制,以及其作为组织工程支架材料与种子细胞、生长因子结合应用研究,还需要进一步探索。期望其能为临床减少宫腔术后并发症提供新材料和新思路,并具有更广泛的研究价值与市场前景。
致谢 感谢成都赛恩贝公司对本研究的赞助和支持。
| [1] | Luo ZL, Zhang SG. Designer nanomaterials using chiral self-assembling peptide systems and their emerging benefit for society. Chem Soc Rev, 2012, 41(13): 4736–4754. DOI: 10.1039/c2cs15360b |
| [2] | Zhang SG. Discovery and design of self-assembling peptides. Interface Focus, 2017, 7(6): 20170028. DOI: 10.1098/rsfs.2017.0028 |
| [3] | Cai SX, Liu AR, Chen S, et al. Activation of Wnt/β-catenin signalling promotes mesenchymal stem cells to repair injured alveolar epithelium induced by lipopolysaccharide in mice. Stem Cell Res Ther, 2015, 6: 65. DOI: 10.1186/s13287-015-0060-y |
| [4] | Luo ZL, Zhao XJ, Zhang SG. Structural dynamic of a self-assembling peptide d-EAK16 made of only D-amino acids. PLoS ONE, 2008, 3(5): e2364. DOI: 10.1371/journal.pone.0002364 |
| [5] | Saeed D, Maryam Y, Mehraveh G, et al. Induced abortion:a systematic review and meta-analysis. Mater Sociomed, 2017, 29(1): 58–67. DOI: 10.5455/msm. |
| [6] | Gabriela FM, Carla O, Susana V, et al. Apoptosis is increased and cell proliferation is decreased in out-of-phase endometria from infertile and recurrent abortion patients. Reprod Biol Endocrinol, 2010, 8: 126. DOI: 10.1186/1477-7827-8-126 |
| [7] | Ying L, Reshef T, Nicola P, et al. Systemic administration of bone marrow-derived cells leads to better uterine engraftment than use of uterine-derived cells or local injection. J Cell Mol Med, 2018, 22(1): 67–76. DOI: 10.1111/jcmm.2018.22.issue-1 |
| [8] | Xu L, Ding LJ, Wang L, et al. Umbilical cord-derived mesenchymal stem cells on scaffolds facilitate collagen degradation via upregulation of MMP-9 in rat uterine scars. Stem Cell Res Ther, 2017, 8: 84. DOI: 10.1186/s13287-017-0535-0 |
| [9] | Ando K, Imagama S, Kobayashi K, et al. Effects of a self-assembling peptide as a scaffold on bone formation in a defect. PLoS ONE, 2018, 13(1): e0190833. DOI: 10.1371/journal.pone.0190833 |
| [10] | Bellat V, Ting R, Southard TL, et al. Functional peptide nanofibers with unique tumor targeting and enzyme-induced local retention properties. Adv Funct Mater, 2018. DOI: 10.1002/adfm.201803969 |
| [11] | Hainline KM, Gu FQ, Handley JF, et al. Self-assembling peptide gels for 3d prostate cancer spheroid culture. Macromol Biosci, 2019, 19(1): e1800249. DOI: 10.1002/mabi.v19.1 |
| [12] | Ichihara Y, Kaneko M, Yamahara K, et al. Self-assembling peptide hydrogel enables instant epicardial coating of the heart with mesenchymal stromal cells for the treatment of heart failure. Biomaterials, 2018, 154: 12–23. DOI: 10.1016/j.biomaterials.2017.10.050 |
| [13] | Kokil GR, Veedu RN, Le BT, et al. Self-assembling asymmetric peptide-dendrimer micelles-a platform for effective and versatile in vitro nucleic acid delivery. Sci Rep, 2018, 8: 4832. DOI: 10.1038/s41598-018-22902-9 |
| [14] | Li Y, Cui T, Kong XD, et al. Nanoparticles induced by embedding self-assembling cassette into glucagon-like peptide 1 for improving in vivo stability. FASEB J, 2018, 32(6): 2992–3004. DOI: 10.1096/fj.201701033RRR |
| [15] | Lu J, Wang X. Biomimetic self-assembling peptide hydrogels for tissue engineering applications. Adv Exp Med Bio, 2018, 1064: 297–312. DOI: 10.1007/978-981-13-0445-3 |
| [16] |
Zhang HN, Li MM, Wen J, et al. Self-assembling peptide R2I4R2 for skin wounds repairing.
Chin Biotechnol, 2018, 38(2): 7–12.
(in Chinese). 张慧楠, 李萌萌, 文静, 等. 自组装短肽R2I4R2对皮肤创伤快速修复过程的研究. 中国生物工程杂志, 2018, 38(2): 7-12. |
| [17] |
Li GB, Liu XF, Song CJ, et al. Experimental study of endothelial progenitor cell differentiation to endothelial cell on corpus luteum of pseudocyesis rats.
Tianjing Med J, 2012, 40(6): 579–581.
(in Chinese). 李广斌, 刘晓帆, 宋春静, 等. 骨髓内皮祖细胞在假孕大鼠黄体向血管内皮细胞分化的实验研究. 天津医药, 2012, 40(6): 579-581. |
| [18] |
Lin NC, Li XA, Hu YL. Establishing of rat uterus repair model after full-thickness injury.
Prog Obstet Gynecol, 2015, 6: 401–404.
(in Chinese). 林娜成, 李新安, 胡娅莉. 大鼠子宫全层损伤修复模型的建立. 现代妇产科进展, 2015, 6: 401-404. |
| [19] |
Lin NC, Li XA, Hu YL. A review of endometrial repair after endometrial injury.
J Southeast Univ:Med Sci Edi, 2011, 30(4): 636–640.
(in Chinese). 林娜成, 李新安, 胡娅莉. 子宫内膜损伤后修复的研究进展. 东南大学学报:医学版, 2011, 30(4): 636-640. |
| [20] |
Zhu XY, Zhao HY, Wang L, et al. Effect of different vacuum pressures on incomplete abortion and endometrial injuries.
Acta Med Univ Sci Technol Huazhong, 2014, 43(01): 106–108.
(in Chinese). 祝鑫瑜, 赵海燕, 王莉, 等. 不同负压对不全流产以及子宫内膜损伤的影响. 华中科技大学学报, 2014, 43(01): 106-108. DOI:10.3870/j.issn.1672-0741.2014.01.024 |
| [21] | MacEwan MR, MacEwan S, Kovacs TR, et al. What makes the optimal wound healing material?A review of current science and introduction of a synthetic nanofabricated wound care scaffold. Cureus, 2017, 9(10): e1736. |
| [22] | Mehralitabar H, Taghdir M, Naderi MH. A combination of bioactive and nonbioactive alkyl-peptides form a more stable nanofiber structure for differentiating neural stem cells:a molecular dynamics simulation survey. J Biomol Struct Dyn, 2018, 21: 1–21. |
| [23] | Ruan H, Xiao RS, Jiang XH, et al. Biofunctionalized self-assembly of peptide amphiphile induces the differentiation of bone marrow mesenchymal stem cells into neural cells. Mol Cell Biochem, 2019, 450(1/2): 199–207. |
| [24] | Avitabile C, Diaferia C, Della Ventura B, et al. Self-assembling of fmoc-GC peptide nucleic acid dimers into highly fluorescent aggregates. Chemistry, 2018, 24(18): 4729–4735. DOI: 10.1002/chem.v24.18 |
| [25] | Brasted M, White CA, Kennedy TG, et al. Mimicking the events of menstruation in the murine uterus. Biol Reprod, 2003, 69(4): 1273–1280. DOI: 10.1095/biolreprod.103.016550 |
| [26] | Beltrami AP, Barlucchi L, Torella D, et al. Adult cardiac stem cells are multipotent and support myocardial regeneration. Cell, 2003, 114(6): 764–776. |
| [27] | Mabry KM, Payne SZ, Anseth KS. Microarray analyses to quantify advantages of 2D and 3D hydrogel culture systems in maintaining the native valvular interstitial cell phenotype. Biomaterials, 2016, 74: 31–41. DOI: 10.1016/j.biomaterials.2015.09.035 |
| [28] | Go BS, Sirohi S, Walker BM. The role of matrix metalloproteinase-9 in negative reinforcement learning and plasticity in alcohol dependence. Addict Biol, 2019: 1–11. |
 2019, Vol. 35
2019, Vol. 35




