中国科学院微生物研究所、中国微生物学会主办
文章信息
- 杨玉莹, 刘青, 李沛, 罗洪艳, 王豪举, 孔庆科
- Yang Yuying, Liu Qing, Li Pei, Luo Hongyan, Wang Haoju, Kong Qingke
- 细菌小细胞在癌症治疗中的应用
- Role of bacterial minicells in cancer therapy
- 生物工程学报, 2019, 35(6): 998-1008
- Chinese Journal of Biotechnology, 2019, 35(6): 998-1008
- 10.13345/j.cjb.180460
-
文章历史
- Received: November 8, 2018
- Accepted: February 11, 2019
- Published: February 26, 2019
无论是发达国家还是发展中国家,癌症的有效治疗都是世纪性难题。全球平均每分钟有18人因癌症去世;在中国,每年恶性肿瘤新发病例数约为380.4万例[1]。目前,常规的癌症治疗方式包括化疗、放疗和手术等,但它们均具有明显的局限性。例如,化疗需要使用高浓度的药物或抗体才会产生一定疗效,但大多数化疗药物不能特异性地靶向肿瘤细胞,从而导致化疗常常伴随着对机体正常组织的显著毒性,产生脱发、恶心呕吐和肝肾功能损害等副作用[2]。此前有研究应用脂质体和纳米颗粒来递送抗肿瘤药物,但临床试验结果显示了药物渗漏等问题[3]。因此,筛选新型的具有肿瘤靶向性的药物载体迫在眉睫。
小细胞(Minicells)是由细菌异常分裂时期产生的直径约为200–400 nm的纳米级无核细胞[4]。目前已成功从大肠杆菌Escherichia coli[5-7]、鼠伤寒沙门氏菌Salmonella typhimurium[8-9]、志贺氏菌Shigella spp.[10]、谷氨酸棒状杆菌Corynebacterium glutamicum[11]及乳酸菌Lactobacillus[12]等细菌中分离得到小细胞。小细胞包含除了染色体DNA外的其他亲本细胞所有成分,比如质粒、核糖体、转移核糖核酸和各种酶类等[13]。将某些特异性的抗体或配体结合到小细胞表面可以使小细胞具有肿瘤靶向性,具有肿瘤靶向性的小细胞则可以用于递送抗肿瘤药物,发挥高效的肿瘤治疗作用[5-6, 14]。
细菌小细胞作为药物载体主要有以下几点优势。1)小细胞能够运载化疗药物、功能性核酸分子(siRNAs、miRNA或核酶分子等)、外源蛋白质以及质粒DNA等,并且可以组合递送这些抗肿瘤药物以提高治疗效果。例如同时递送DNA疫苗和相应的蛋白,也可以同时递送两种或多种小分子药物,增加了药物运载的灵活性[7]。2)小细胞继承了亲本细胞的胞质组成,其细胞膜是由疏水性磷脂双分子层形成的非渗透性膜,富含心磷脂,维持了胞内蛋白质和离子浓度的稳定,在治疗中能增强药物的渗透性[15-16]。3)通过对小细胞表面的改造可以使其靶向特定细胞,从而降低对正常组织造成的毒副作用。另外,肿瘤微环境内对大分子药物或颗粒的高通透性和滞留效应(Enhanced permeability and retention effect,EPR效应)可以使小细胞很容易穿过毛细血管,在肿瘤组织中聚集并长时间滞留[3, 17]。4)小细胞不能生长、分裂,没有传染性。因此,相比活菌载体,小细胞具有明显的安全性[7]。小细胞作为一种新型的抗癌材料,已受到越来越多的关注。文中将对小细胞的生产纯化、药物装载、靶向机制、内化过程及小细胞递送抗肿瘤药物介导肿瘤治疗等方面的研究进展进行综述。
1 小细胞的产生与纯化 1.1 Min系统对小细胞形成的调控细菌小细胞是通过控制细菌分裂基因、抑制细胞分裂的极性位点而产生的无核纳米颗粒。目前已经鉴定的细菌细胞分裂蛋白主要有20多种,包括FtsZ、FtsA、FtsE、FtsX、FtsK、FtsQ、FtsL、FtsB、FtsW和ZipA等[18-19],它们可以在分裂位点组装成蛋白复合物。这种复合物是通过将微管蛋白同源物FtsZ装配成环状结构来起始的,随后在细胞生长过程中形成细胞动力环(Z环)。Z环能收缩成螺旋状或隔膜状,介导细胞包膜层(例如内膜、肽聚糖层和外膜)内陷,从而产生分裂[20]。此外,Lange等[21]发现一种名为PomZ的新蛋白质,它可以通过将FtsZ募集到细胞中部来正向调节Z环的组装;缺乏PomZ会导致分裂缺陷形成无染色体的小细胞和丝状细胞。
调节细胞分裂的系统包括类核闭塞系统和Min系统(图 1)。类核闭塞系统决定细胞分裂的潜在位点,防止分裂发生在类核(没有核膜包被的细胞核),引导Z环组装;而Min系统则用于调节Z环的适当位置和拮抗FtsZ的组装[22]。大肠杆菌的Min系统是目前研究比较清楚的,其minB基因簇主要编码MinC、MinD和MinE等蛋白。MinC有两个大小一致的结构域,由MinD蛋白激活,二者共同作用作为隔膜抑制剂。通过MinC的N端与FtsZ连接,影响FtsZ聚合物的横向相互作用力,从而阻断对FtsZ的组装,防止细胞在极性端形成Z环[3]。因此,minC和minD基因突变均可消除细胞分裂期间在细胞极中形成隔膜环的抑制,产生正常的子细胞和无核的小细胞。MinE有两个功能域,诱导MinC在细胞极两端摆动,特异性地在非极性位点降低MinC的抑制作用,促进小细胞的产生。在生理浓度下,MinE可阻止MinCD (MinC和MinD复合物)抑制剂作用于新的分裂位点,但不会阻止抑制剂与细胞极上的旧位点相互作用[23-25]。其他类型的菌株中可能存在minCDE的同源基因。枯草芽孢杆菌Bacillus subtilis中的Min系统包括MinC、MinD和DivIVA,DivIVA目前被认为是大肠杆菌中的MinE的对应基因[24, 26]。Suey等[24]还在枯草芽孢杆菌的Min系统中发现一个新组件MinJ,它是DivIVA和MinCD之间的桥梁。借助DivIVA的极性,MinC、MinD和MinJ的复合物(MinCDJ)可以靶向定位于细胞极,随后促进Z环的分解从而防止小细胞形成。有研究者尝试敲除大肠杆菌中的minCD基因和过表达minE基因,发现可诱导细菌的不对称分裂,并产生大量小细胞[23, 27]。过表达FtsZ也可以诱导小细胞的大量生成[28]。
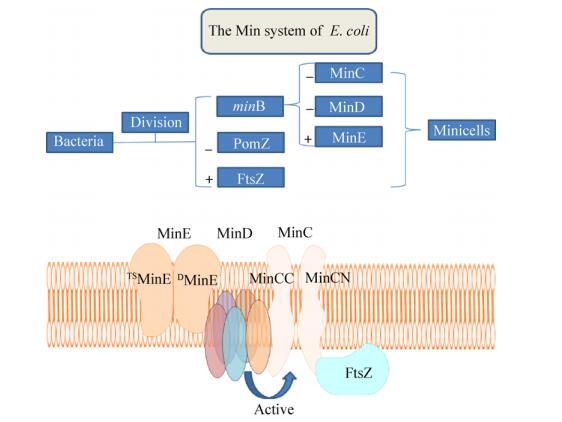
|
| 图 1 Min系统对小细胞形成的调控[3, 19] Fig. 1 The formation of minicells regulated by Min system[3, 19]. The minicell has been first isolated in E. coli mutant. The mutations responsible for the minicell formation are mapped to the minB locus, which encodes three proteins, designated MinC, MinD, and MinE. MinC comprises two domains of roughly equal size and its N-terminal domain interacts with FtsZ, which is required and sufficient to inhibit FtsZ polymerization in vitro and Z-ring formation in vivo. MinD contains five distinct domains, generally associates with the inner membrane, and is required for the binding and activation of MinC. MinE is an 88 amino acid protein with two known functional domains. The N-terminal domain (DMinE) is required and sufficient to interact with MinD and to counteract MinCD-mediated division inhibition. Similarly, inhibition of PomZ expression or promotion of FtsZ expression both promotes to minicells product. The symbols "–" and "+" represent "inhibit" and "promote", respectively. |
| |
此外,一些多糖类物质也能影响细菌基因的表达。例如,透明质酸能引起细菌细胞分裂分化,其程度取决于透明质酸的浓度,所以在分裂过程中该物质能促进小细胞的形成[3]。
1.2 小细胞的纯化为了得到无菌小细胞,去除亲代细菌、细胞碎片、膜泡、核酸和内毒素等,需要进行一系列的纯化过程。传统的差速离心、密度梯度离心及过滤等方法均无法完全去除较小的亲本细菌,目前常用的细菌小细胞纯化方法主要包括抗生素纯化法[4]、自溶素偶联离心法[29]、UV辐射和可调型基因自杀机制(MSM)[13]等。
抗生素纯化法是将抗生素裂解和渗滤法相结合。青霉素、头孢曲松、萘啶酸和安普霉素等抗生素可以通过抑制DNA和核糖核蛋白的合成来发挥其对细菌的细胞毒作用,而小细胞的膜完整性和组分不会受到抗生素的影响,但最近研究显示大肠杆菌minC突变体产生的小细胞能够帮助大肠杆菌细胞修复抗生素导致的蛋白质损伤,提高对抗生素的抵抗[30]。自溶素偶联离心法思路来源于噬菌体,噬菌体可以通过穴蛋白/溶素蛋白(Holin/lysin)裂解宿主细胞。将噬菌体的裂解基因holin/lysin导入细菌后,表达的溶素蛋白可以杀死亲本细菌而不影响小细胞;随后结合常规的离心方法就可以从细菌培养物中分离出高纯度的小细胞。该方法能将亲本细菌污染率从初始小细胞溶液中的0.001%降低到0.000 002 5%,但大量游离内毒素仍可能包含在里面[27]。UV辐射可以杀死活的亲代细菌,但是具有随机性。此外,可调型基因自杀机制引入可调型基因Ⅰ-CeuI等核酸内切酶,通过温度调控可诱导亲代细胞染色体双键断裂,形成不可逆的丝状表型,从而辅助亲代细胞与小细胞的分离[13]。有研究将基因自杀机制与FtsZ超表达相结合,获得了大量亲本细菌污染率极低的小细胞。Rang等[31]为了高效纯化小细胞,将细菌细胞分裂在高盐等应激条件下进行,发现能促进亲本细菌转化为不同长度的细丝,通过离心即可与小细胞分离而除去。
2 小细胞作为药物递送载体 2.1 药物的包装小细胞具有远高于其他纳米载体的药物容纳能力。对小细胞药物包装的定量研究表明,每个小细胞可以包装106–107个药物分子,50个质粒或12 000个小分子干扰RNA (Small interferencing RNA,siRNA)[9, 14]。而每个脂质体颗粒仅仅能容纳104个药物分子[32]。而且,由于小细胞磷脂双层膜的扩散基本上是单向的,所以即使将装载好药物的小细胞在明胶磷酸盐缓冲液或血清中孵育数小时,或长时间在大量缓冲液冲洗下也没有发现药物泄漏。
利用药物浓度梯度差是使药物渗透到小细胞的便利途径。在这种药物装载途径下,包装于小细胞内的药物浓度依赖于小细胞所处溶液中药物的浓度以及孵育时间[6]。在含有小细胞的细胞外介质和小细胞细胞质之间建立药物浓度梯度(使细菌小细胞的胞外药物浓度高于胞内),药物可以通过外膜的非特异性孔蛋白通道渗透到小细胞中[33]。例如,大肠杆菌的外膜通道孔蛋白OmpF和OmpC,可以允许高达600 Da大小的离子和代谢物通过而没有任何排斥性[34]。孔蛋白通道的渗透效率会受到一些因素的影响。首先,各种生理学相关离子盐的浓度和种类可以改变孔蛋白OmpC的渗透性,因为离子可以与亲和位点中涉及的底物和残基强烈作用[35]。其次,跨膜电位也可能与扩散过程有关。孔蛋白通道中的带电残留物产生了分离极性和非极性的横向电场,极性溶质通过渗透过程快速发生,非极性溶质可通过非特异性运动从细胞外膜蛋白的其他通道进入,例如外膜蛋白的FadL家族[36]和OmpW[37]。此外,还需要考虑外膜主要脂质成分脂多糖(Lipopolysaccharides,LPS),它的存在会影响细胞膜上的动力学,脂多糖相关的阻渗、有机溶剂耐受性、疏水性、抗生素耐受性、膜通透性等功能与小细胞药物装载量和渗透速率有关。
用小细胞装载药物的另一种方法是,构建可以表达治疗性药物的重组菌株,重组菌株经培养后可以将药物释放到细菌的细胞质中;当亲本细菌分裂并形成子代小细胞时,小细胞的细胞质中也含有相应的药物[13]。
2.2 靶向癌细胞相对于正常组织,小细胞更容易在肿瘤环境中聚集。正常组织中的微血管内皮间隙致密、结构完整,大分子颗粒不易透过血管壁;而实体瘤组织中血管丰富、血管壁间隙较宽、结构完整性差,淋巴回流缺失,可导致粒径在200–1 000 nm之间的大分子药物渗入肿瘤组织,蓄积并长时间滞留,实现小细胞在体内的被动靶向[17, 38-39]。与其他递送系统一样,小细胞的主动靶向是通过将靶向配体或双特异性抗体(Bispecific antibody,BsAb)附着在小细胞表面,可以提高装载有抗肿瘤药物小细胞对肿瘤细胞的特异靶向性(图 2)[5]。此外,鼠伤寒沙门氏菌Ⅲ型分泌系统(T3SS)也被应用于小细胞的特异性靶向。
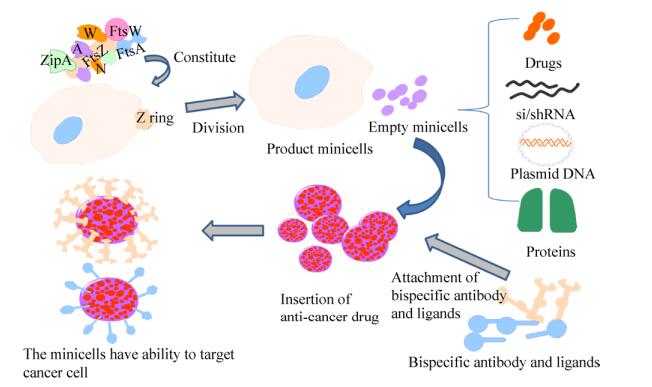
|
| 图 2 小细胞组装药物的流程[3, 9] Fig. 2 The general procession of drug assembly using minicells[3, 9]. Schematic shows bacterial-derived, bispecific antibody/ligands-loaded, drug-packaged minicells. The divided proteins (more than 20) assemble at the site of division into a multi-protein complex called the septal ring. Formation of this complex is thought to initiate with the assembly of FtsZ into a ring-like structure, the Z-ring, which mediates the coordinated invagination of three cell envelope layers. The schematic also denotes the packaging of anticancer drugs, si/shRNA, therapeutic proteins or even plasmid DNA into empty minicells, which can target to tumor cell-surface receptor using ligand such as folate or bispecific antibodies where one arm of the antibody has minicell-surface O-polysaccharide specificity and the other arm has specificity for the tumor cell-surface receptor for example EGFR. |
| |
BsAb的一个臂对小细胞表面的脂多糖或O-抗原等成分具有特异性,另一个臂对肿瘤细胞表面受体如EGFR[33]、HER2/neu[40-41] (也称为ERBB2)、CD33或CD3[42]等具有靶向性。因此,BsAb既可以附着在小细胞表面,又可以在进入肿瘤微环境后特异性结合到肿瘤细胞表面高表达的受体上,从而将小细胞与肿瘤细胞特异性地连接起来。但由于双特异性抗体成本高,且其靶向受体的多态性和基因突变可能会影响其与抗体的结合以及随后的内化,所以将其用于靶向递送小细胞运载的药物,过程复杂而且价格更昂贵。
根据肿瘤细胞的生长环境和表面特性,在小细胞表面载入合适的配体也是一种优良的选择。这种双特异性配体可以是多肽、碳水化合物或糖肽等[43]。叶酸(Folic acid)价格便宜,容易与细胞膜表面物质偶联,其羧基在偶联剂作用下可以与细菌小细胞表面存在的游离胺形成酰胺键。有研究证实叶酸受体在大多数恶性肿瘤(如卵巢癌细胞)表面过度表达,因此可作为开发靶向药物的配体[14]。此外,可通过蛋白展示技术[44]在小细胞外膜表面插入多肽,如肽PHLIP,它具有靶向肿瘤酸性微环境的能力。益生菌EcN来源的小细胞在酸配体PHLIP的靶向下可以携带化疗药物侵入肿瘤的坏死和缺氧区域进行治疗[45]。小细胞与靶向肿瘤微环境的配体结合在肿瘤治疗中具有相当大的潜力,更多靶向配体正在研发中。
T3SS可将细菌的毒力效应蛋白输送到宿主细胞的胞质中[46]。小细胞有能力合成蛋白质并维持质子梯度以供T3SS的能量需求。因此,可以构建毒力减弱的沙门氏菌突变株,将编码T3SS的质粒导入细菌中,使细菌分泌的小细胞中T3SS组分明显升高。形成的富含T3SS组分的小细胞制剂可以用来递送外源抗原(融合T3SS效应蛋白),继而激活抗原特异性CD8+ T细胞免疫应答[8]。
2.3 小细胞的内化癌细胞大多数是非吞噬细胞,所以用于小细胞修饰的抗体或配体最好能与癌细胞表面能介导内吞作用的受体特异性结合。在游离配体存在的情况下,表面偶联配体的小细胞将和游离配体竞争与肿瘤细胞受体的结合,从而影响小细胞被肿瘤细胞摄取内吞的效率。由此可见,小细胞表面的配体可通过特异性识别肿瘤细胞表面过度表达的受体而被后者所吞噬(内吞作用),且小细胞内化需要抗体/配体的主动靶向作用。众所周知,网格蛋白参与细胞的内吞作用,并且其摄取过程是需要能量的。因此,阻碍细胞ATP合成或网格蛋白通路的化学物质,如叠氮化钠、苯赖氨酸氧化物等都可导致细胞内化显著下降[14]。低温环境也会影响内吞作用,导致细胞摄取率降低,4 ℃下细胞完全不摄取。
小细胞被肿瘤细胞内吞后,肿瘤细胞内的吞噬小体/溶酶体活性增强,小细胞经晚期溶酶体酸化而被降解,完整性受到破坏。从溶酶体中渗漏出的蛋白药物等可以进入细胞质发挥相应活性,而siRNA或miRNA则要继续进入细胞核才能特异性地沉默相应基因[47]。单个细胞可携带多达40–50个小细胞药物制剂。药物在体内激活Toll样受体,从而诱导肿瘤坏死因子-α (TNF-α)、干扰素-γ (IFN-γ)和白细胞介素-6 (IL-6)显著增加[6]。同样,机体其他组织也会有少量游离小细胞残留,4 h后体内IL-6、IL-8、IL-10升高,24 h后恢复正常。IFN-α在一些患者中会出现持续升高。血液参数也会受到短暂的影响,白细胞和中性粒细胞会轻微升高,淋巴细胞和单核细胞下降[5]。虽然机体内生化指标会发生轻微变化,但在最大耐受剂量下并没有明显不良反应,无治疗致死案例。此外,从血清抗体中检测到小细胞的弱免疫原性,小细胞表面脂多糖引起体内产生的抗脂多糖抗体在第15天内达到峰值,反应呈剂量依赖性,重复给药后未见增强,呈弱阳性[5-6],说明小细胞在体内是安全有效的。
此外,小细胞的来源使其具有天然靶向性,能被体内相应的组织细胞内吞。沙门氏菌、埃希氏菌和志贺氏菌都携带粘附素,在不使用靶向配体的情况下将药物递送至哺乳动物细胞时,来源于这些亲本细菌的小细胞能被胃肠道中的肠细胞识别、内吞而被降解[38]。这种天然靶向适用于递送对结肠癌细胞有效的药物。
2.4 递送抗肿瘤药物近几年研究表明,非复制性小细胞在递送化疗药物、小分子干扰RNA、治疗性蛋白质和DNA疫苗等方面有巨大的潜力。小细胞制剂多数以静脉注射给药,亦可通过口服或者鼻腔给药,都能引起粘膜和体液免疫应答[48]。
小细胞对于不同结构、疏水性、电荷和溶解度的化学药物,如紫杉醇(Paclitaxel)、多柔比星(Doxorubicin)、阿霉素(Doxorubicin)、吉西他滨(Gemcitabine)等,都能轻易地实现装载。用小细胞将细胞毒性剂紫杉醇靶向递送至实体瘤中已进行Ⅰ期临床试验,这是一项新的生物系统进入人体临床研究。在晚期实体瘤患者中,在最大耐受剂量为1010个小细胞作用下,具有表皮生长因子受体(EGFR)靶向、负载紫杉醇的小细胞(EGFR小细胞Pac)在患者中具有一定的肿瘤消除作用。未有治疗不良而导致的死亡事件,从而证明小细胞递送的紫杉醇用于肿瘤治疗是安全有效的[5]。载有抗癌药物多柔比星的小细胞也正应用于胶质母细胞瘤(一种脑肿瘤)患者的Ⅱ期试验[12]。相关动物实验研究也显示,装载了阿霉素或长春碱等药物的小细胞,通过细胞表面的双特异性抗体可以特异性地靶向乳腺癌[45]、白血病、肺癌和卵巢癌异种移植小鼠体内的肿瘤细胞表面特定受体,从而释放药物并介导有效的肿瘤治疗。此外,小细胞还可以装载卡铂、顺铂、5-氟尿嘧啶(5-FU)、伊立替康和β-拉帕醌-单星素等化疗药物[6]。
除了包装化疗药物,小细胞还为RNA干扰技术提供了强有力的载体。小细胞递送的小分子干扰RNA,不仅可以实现相关基因的特异性沉默,抑制促肿瘤生长蛋白的表达,还能提高机体对药物的耐受性[49-50]。siRNA和miRNA (由内源基因编码的非编码单链RNA分子)能够靶向mRNA形成沉默复合物RISC,从而抑制mRNA表达。但它们在体内会被血清核酸酶快速降解,稳定性比较差,再加上这些RNA分子的细胞膜通透性也较差,导致其在体内被靶细胞摄取的效率严重受限。而siRNA和miRNA可以很容易地穿过小细胞的内膜,所以可以用小细胞来运载它们,从而实现靶向递送并延长它们的作用时间[47]。Jivrajani等[14]将针对血管内皮生长因子A (VEGFA)的siRNA包装在由大肠杆菌突变菌株产生的叶酸偶联小细胞(FA小细胞VEGFA)中。在肿瘤异种移植小鼠上,FA小细胞VEGFA能够沉默肿瘤血管内皮细胞VEGFA mRNA的表达。VEGFA水平的降低继而抑制新生血管的形成,切断肿瘤的氧气和营养供应,最终实现肿瘤的稳定或消退。此外,针对耐药性肿瘤,siRNA或shRNA还能抑制肿瘤细胞的耐药性和提高机体对其他化疗药物作用的敏感性。用含有siRNA和细胞毒性药物的小细胞制剂联合治疗,能达到比单独递送化疗药物更有效的肿瘤治疗效果。Karagiannis等[49]发现,先应用小细胞递送针对多药抗性蛋白(如PGP转运蛋白)的特异siRNA,再注射含有细胞毒性药物的靶向小细胞,可消除之前具有耐药性的肿瘤。这种组合疗法对所涉及的药物、siRNA和抗体比常规全身给药少几千倍[47]。在人体肿瘤临床试验中,用小细胞递送miRNA模拟物来沉默恶性胸膜间皮瘤的血管内皮生长因子,患者耐受良好并显示了一定的抗肿瘤效果[50]。此外,对于体内缺乏miRNA所引发的疾病,也可以使用小细胞装载相应的miRNA来补充[51]。
小细胞还能表达质粒DNA上的特殊蛋白。将携带大量蛋白质抗原或质粒DNA疫苗的小细胞特异性靶向肿瘤细胞或抗原识别因子,引起机体免疫应答。此外,由于小细胞携带了亲本细胞的胞质成分,它具有代谢活性,可以主动运输代谢物、转录和翻译质粒编码的基因产物。某些经改造的活的致病菌,如鼠伤寒沙门氏菌和大肠杆菌,能呈现较低毒力甚至无毒力并且具有表达外源抗原的能力,有潜力成为有效的疫苗载体[52-53],但这些细菌在体内的安全性涉及致病性逆转、水平基因转移和不良炎症反应等。而小细胞的使用为进一步开发安全有效的疫苗提供了一种独特的替代方法,它保留了细菌能够刺激机体固有免疫的大部分组分,包括脂多糖、溶血磷脂酸(LPA)和完整的肽聚糖层等。这些表面成分能被抗原递呈细胞(APC)迅速识别为病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)从而激发机体的固有免疫应答[54]。在荷瘤小鼠中,用大肠杆菌小细胞递送蛋白质抗原和质粒DNA可以诱导机体产生全身性抗原特异性反应,该递送组合通过肌内注射、鼻内注射和口服等不同途径给药都能诱导产生高水平的特异性血清免疫球蛋白(IgG)[54]。但应用小细胞同时递送淋巴细胞脉络丛脑膜炎病毒(LCMV)核蛋白(NP)和相应的DNA疫苗至患有淋巴细胞脉络丛脑膜炎的小鼠后,肌肉注射能产生更强的保护性细胞免疫,疗效远高于口服和鼻腔注射[7]。另外,Tsuji等研究显示,新型生物制药剂VAX-IP,一种基于表面结合侵袭素(Invasin)的细菌小细胞,能将细菌蛋白毒素(穿孔素O)特异性地递送至鼠和人尿道上皮细胞中的癌细胞(高表达整合素异二聚体亚型α5β1或α3β1),并发挥该毒素蛋白的肿瘤杀伤作用。为其应用于非肌层浸润性膀胱癌和其他肿瘤的临床研究提供依据[48]。最重要的是,上述实验均在小细胞重复给药条件下进行,小鼠存活率显著提高,这表明小细胞作为药物载体介导的肿瘤治疗是安全有效的。
3 总结与展望小细胞作为一种新型的药物载体,可以用于递送细胞毒性药物、siRNA、miRNA、外源蛋白以及质粒DNA等,从而介导高效的抗肿瘤作用。目前使用小细胞介导肿瘤治疗的临床试验也正在进行中[5]。从细菌中提取纳米级生物微泡(即小细胞)后,可以对其表面进行修饰,使小细胞具有肿瘤靶向能力。经过改造的具有肿瘤靶向性的小细胞,即使携带微量的药物也能起到显著的抗肿瘤作用;而脂质体携带的阿霉素剂量是小细胞100倍时,才会产生相同程度的肿瘤抑制作用[6]。相对于脂质体、纳米颗粒和外泌体等载体,小细胞能改善药物渗漏和增加药物装载量。而且,尽管化疗药物的结构、电荷、疏水性和溶解度不同,小细胞都可通过非特异性通道装载;而脂质体、纳米颗粒等需要对药物或载体进行显著的改变才能完成药物装载。外泌体是真核细胞主动分泌产生的一种直径为40–100 nm的囊泡,只可携带蛋白质、mRNA及miRNA,不能对DNA疫苗进行翻译表达[55]。而小细胞是细菌细胞异常分裂时期产生的,其具有基因表达的基本组分,因此小细胞可以作为良好的DNA疫苗载体。此外,小细胞的尺寸较大(200–400 nm),一般不会渗漏到非靶向组织(正常组织中的微血管内皮间隙致密,不允许粒径大于100 nm的大分子物质自由通过[56])。此外,小细胞的肿瘤渗透性、低毒性和低生物降解性,也是其作为抗肿瘤药物递送载体的优势。
与活细菌相反,小细胞疗法需要多次给药。小细胞可以在体内高剂量传递而不产生毒性,重复给药后不会对动物造成明显的毒副作用或死亡。在活体肿瘤模型中,小鼠经多次小细胞静脉注射后,未见发热反应、体重减轻、皮肤或皮毛变化等症状,体内电解质、肾脏和肝脏功能也没有发现异常。这些结果说明小细胞的使用具有一定的安全性。然而,小细胞作为细菌的衍生物,其在体内的安全使用仍存在几个问题。首先,即使来源于弱致病性细菌的小细胞,其表面也有毒力因子,仍有可能引起机体产生炎症甚至毒性不良反应,特别是肠外给药时。高剂量注射小细胞时,肝酶水平会出现短暂升高,可能引发肝中毒,因此需要控制使用剂量以降低肝毒性[5];Isabelle等[57]尝试通过修饰细菌细胞膜表面成分来降低毒性,发现细菌缺失lpxM基因后,其脂质A豆蔻酰化,从而降低了Toll样受体4 (TLR-4)的信号转导,LPS内毒素活性大大减弱;此外,GRAS (Generally recognized as safe)菌株或益生菌产生的小细胞可以降低其毒性,如天然无内毒素的革兰氏阳性菌谷氨酸棒状杆菌或乳酸菌通过敲除minCDE的同源基因产生的小细胞,具有结构简单、安全性高、免疫改善和生物降解率高等优点[11-12]。其次,使用小细胞来递送一些肿瘤抗原时,组分复杂的小细胞可能会诱发多重免疫反应,能否诱导机体产生有效的抗肿瘤免疫保护值得探究。此外,目前还无法实现小细胞的大规模纯化或生产。
小细胞具有独特的结构和组分,在药物递送和疫苗研制方面具有无可比拟的优势。但小细胞作为药物递送载体应用于人体临床治疗之前,还需在模式动物体内进行毒理学、稳定性和有效性等方面的深入研究,以便更好地了解小细胞的应用潜力和局限性。相信随着生物技术的不断发展和相关研究的深入,小细胞的开发利用一定会取得突破性的进展。
| [1] |
Chen WQ, Sun KX, Zheng RS, et al. Report of cancer incidence and mortality in different areas of China, 2014.
China Cancer, 2018, 27(1): 1–14.
(in Chinese). 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析. 中国肿瘤, 2018, 27(1): 1-14. |
| [2] | Parveen S, Sahoo SK. Polymeric nanoparticles for cancer therapy. J Drug Target, 2008, 16(2): 108–123. DOI: 10.1080/10611860701794353 |
| [3] | Nguyen THK. Cell division gene from bacteria in minicell production for therapy//Gali-Muhtasib H, Ed. Advances in Cancer Therapy. Croatia: InTech Press, 2011: 83-98. |
| [4] | Jivrajani M, Shrivastava N, Nivsarkar M. A combination approach for rapid and high yielding purification of bacterial minicells. J Microbiol Methods, 2013, 92(3): 340–343. DOI: 10.1016/j.mimet.2012.12.002 |
| [5] | Solomon BJ, Desai J, Rosenthal M, et al. A first-time-in-human phase Ⅰ clinical trial of bispecific antibody-targeted, paclitaxel-packaged bacterial minicells. PLoS ONE, 2015, 10(12): e0144559. DOI: 10.1371/journal.pone.0144559 |
| [6] | Macdiarmid JA, Mugridge NB, Weiss JC, et al. Bacterially derived 400 nm particles for encapsulation and cancer cell targeting of chemotherapeutics. Cancer Cell, 2007, 11(5): 431–445. DOI: 10.1016/j.ccr.2007.03.012 |
| [7] | Giacalone MJ, Zapata JC, Berkley NL, et al. Immunization with non-replicating E. coli minicells delivering both protein antigen and DNA protects mice from lethal challenge with lymphocytic choriomeningitis virus. Vaccine, 2007, 25(12): 2279–2287. DOI: 10.1016/j.vaccine.2006.11.069 |
| [8] | Carleton HA, Lara-Tejero M, Liu XY, et al. Engineering the type Ⅲ secretion system in non-replicating bacterial minicells for antigen delivery. Nat Commun, 2013, 4(3): 1590. |
| [9] | MacDiarmid JA, Brahmbhatt H. Minicells: versatile vectors for targeted drug or si/shRNA cancer therapy. Curr Opin Biotechnol, 2011, 22(6): 909–916. DOI: 10.1016/j.copbio.2011.04.008 |
| [10] | Gemski P, Griffin DE. Isolation and characterization of minicell-producing mutants of Shigella spp. Infect Immun, 1980, 30(1): 297–302. |
| [11] | Lee JY, Choy HE, Lee JH, et al. Generation of minicells from an endotoxin-free gram positive strain Corynebacterium glutamicum. J Microbiol Biotechnol, 2015, 25(4): 554–558. DOI: 10.4014/jmb.1408.08037 |
| [12] | Nguyen HN, Jovel SR, Nguyen THK. Nanosized minicells generated by lactic acid bacteria for drug delivery. J Nanomater, 2017: 6847297. |
| [13] |
Matthew J. Jacalone, Stanley Maloi, Jin Jinwu. Adjustable gene compositions and methods of suicide mechanism: CN, 102131927 B. 2015-11-25 (in Chinese). 马修·J·贾卡洛内, 斯坦利·马洛伊, 辻晋吾.可调型基因自杀机制组合物和方法: 中国, 102131927 B. 2015-11-25. |
| [14] | Jivrajani M, Nivsarkar M. Ligand-targeted bacterial minicells: futuristic nano-sized drug delivery system for the efficient and cost effective delivery of shRNA to cancer cells. Nanomedicine, 2016, 12(8): 2485–2498. DOI: 10.1016/j.nano.2016.06.004 |
| [15] | Koppelman CM, Den Blaauwen T, Duursma MC, et al. Escherichia coli minicell membranes are enriched in cardiolipin. J Bacteriol, 2001, 183(20): 6144–6147. DOI: 10.1128/JB.183.20.6144-6147.2001 |
| [16] | Kim OY, Dinh NTH, Park HT, et al. Bacterial protoplast-derived nanovesicles for tumor targeted delivery of chemotherapeutics. Biomaterials, 2017, 113: 68–79. DOI: 10.1016/j.biomaterials.2016.10.037 |
| [17] |
Lu L, Xiong SB. The research progress of EPR effect in solid tumor targeted therapy.
Northern Pharmacy, 2014, 11(7): 73.
(in Chinese). 卢琳, 熊素彬. EPR效应在实体瘤靶向治疗中的研究进展. 北方药学, 2014, 11(7): 73. |
| [18] | Du SS, Lutkenhaus J. Assembly and activation of the Escherichia coli divisome. Mol Microbiol, 2017, 105(2): 177–187. DOI: 10.1111/mmi.2017.105.issue-2 |
| [19] | Buddelmeijer N, Beckwith J. Assembly of cell division proteins at the E. coli cell center. Curr Opin Microbiol, 2002, 5(6): 553–557. DOI: 10.1016/S1369-5274(02)00374-0 |
| [20] | Park KT, Dajkovic A, Wissel M, et al. MinC and FtsZ mutant analysis provides insight into MinC/MinD-mediated Z ring disassembly. J Biol Chem, 2018, 293(16): 5834–5846. DOI: 10.1074/jbc.M117.815894 |
| [21] | Treuner-Lange A, Aguiluz K, van der Does C, et al. PomZ, a ParA-like protein, regulates Z-ring formation and cell division in Myxococcus xanthus. Mol Microbiol, 2013, 87(2): 235–253. DOI: 10.1111/mmi.2013.87.issue-2 |
| [22] | Barák I, Prepiak P, Schmeisser F. MinCD proteins control the septation process during sporulation of Bacillus subtilis. J Bacteriol, 1998, 180(20): 5327–5333. |
| [23] | Labie C, Bouché F, Bouché JP. Minicell-forming mutants of Escherichia coli: suppression of both DicB- and MinD-dependent division inhibition by inactivation of the minC gene product. J Bacteriol, 1990, 172(10): 5852–5855. DOI: 10.1128/jb.172.10.5852-5855.1990 |
| [24] | van Baarle S, Bramkamp M. The MinCDJ system in Bacillus subtilis prevents minicell formation by promoting divisome disassembly. PLoS ONE, 2010, 5(3): e9850. DOI: 10.1371/journal.pone.0009850 |
| [25] | Martos A, Raso A, Jiménez M, et al. FtsZ polymers tethered to the membrane by ZipA are susceptible to spatial regulation by min waves. Biophys J, 2015, 108(9): 2371–2383. DOI: 10.1016/j.bpj.2015.03.031 |
| [26] | Cha JH, Stewart GC. The divIVA minicell locus of Bacillus subtilis. J Bacteriol, 1997, 179(5): 1671–1683. DOI: 10.1128/jb.179.5.1671-1683.1997 |
| [27] | Park SY, Lee JY, Chang WS, et al. A coupling process for improving purity of bacterial minicells by holin/lysin. J Microbiol Methods, 2011, 86(1): 108–110. |
| [28] | Davie E, Sydnor K, Rothfield LI. Genetic basis of minicell formation in Escherichia coli K-12. J Bacteriol, 1984, 158(3): 1202–1203. |
| [29] | Saier MH Jr, Reddy BL. Holins in bacteria, eukaryotes, and archaea: multifunctional xenologues with potential biotechnological and biomedical applications. J Bacteriol, 2015, 197(1): 7–17. DOI: 10.1128/JB.02046-14 |
| [30] | Rang CU, Proenca A, Buetz C, et al. Minicells as a damage disposal mechanism in Escherichia coli. mSphere, 2018, 3(5): e00428–18. |
| [31] | Mattick KL, Jørgensen F, Legan JD, et al. Survival and filamentation of Salmonella enterica serovar enteritidis PT4 and Salmonella enterica serovar typhimurium DT104 at low water activity. Appl Environ Microbiol, 2000, 66(4): 1274–1279. DOI: 10.1128/AEM.66.4.1274-1279.2000 |
| [32] | Park JW. Liposome-based drug delivery in breast cancer treatment. Breast Cancer Res, 2002, 4(3): 95–99. DOI: 10.1186/bcr432 |
| [33] | El-Rayes BF, LoRusso PM. Targeting the epidermal growth factor receptor. Br J Cancer, 2004, 91(3): 418–424. DOI: 10.1038/sj.bjc.6601921 |
| [34] | Prajapati JD, Solano CJF, Winterhalter M, et al. Enrofloxacin permeation pathways across the porin OmpC. J Phys Chem B, 2018, 122(4): 1417–1426. DOI: 10.1021/acs.jpcb.7b12568 |
| [35] | Kojima S, Nikaido H. High salt concentrations increase permeability through OmpC channels of Escherichia coli. J Biol Chem, 2014, 289(38): 26464–26473. DOI: 10.1074/jbc.M114.585869 |
| [36] | van den Berg B, Black PN, Clemons WM Jr, et al. Crystal structure of the long-chain fatty acid transporter FadL. Science, 2004, 304(5676): 1506–1509. DOI: 10.1126/science.1097524 |
| [37] | van den Berg B. The FadL family: unusual transporters for unusual substrates. Curr Opin Struct Biol, 2005, 15(4): 401–407. DOI: 10.1016/j.sbi.2005.06.003 |
| [38] | Torchilin VP. Passive and active drug targeting: drug delivery to tumors as an example//Sch fer-Korting M, Ed. Handbook of Experimental Pharmacology, vol. 197. Berlin, Heidelberg: Springer, 2010: 3-53. |
| [39] | Hashizume H, Baluk P, Morikawa S, et al. Openings between defective endothelial cells explain tumor vessel leakiness. Am J Pathol, 2000, 156(4): 1363–1380. DOI: 10.1016/S0002-9440(10)65006-7 |
| [40] | Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science, 1987, 235(4785): 177–182. DOI: 10.1126/science.3798106 |
| [41] | Alotaibi AM, Alqarni MA, Alnobi A, et al. Human epidermal growth factor receptor 2 (HER2/neu) in salivary gland carcinomas: a review of literature. J Clin Diagn Res, 2015, 9(2): ZE04–ZE08. |
| [42] | Van Dessel N, Swofford CA, Forbes NS. Potent and tumor specific: arming bacteria with therapeutic proteins. Ther Deliv, 2015, 6(3): 385–399. DOI: 10.4155/tde.14.113 |
| [43] | Himanshu B, Jennifer M. Compositions and methods for targeted in vitro and in vivo drug delivery to mammalian cells via bacterially derived intact minicells: US, 20080051469. 2008-02-28. |
| [44] |
Xue S, Dong JC, Wu Q, et al. Development and application of microbial surface display technology.
Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2008(3): 50–51.
(in Chinese). 薛双, 董加才, 吴青, 等. 微生物表面展示技术的发展及应用. 上海畜牧兽医通讯, 2008(3): 50-51. DOI:10.3969/j.issn.1000-7725.2008.03.028 |
| [45] | Zhang YL, Ji W, He L, et al. E. coli nissle 1917-derived minicells for targeted delivery of chemotherapeutic drug to hypoxic regions for cancer therapy. Theranostics, 2018, 8(6): 1690–1705. DOI: 10.7150/thno.21575 |
| [46] | Hu B, Lara-Tejero M, Kong QK, et al. In situ molecular architecture of the salmonella type Ⅲ secretion machine. Cell, 2017, 168(6): 1065–1074. DOI: 10.1016/j.cell.2017.02.022 |
| [47] | MacDiarmid JA, Amaro-Mugridge NB, Madrid-Weiss J, et al. Sequential treatment of drug-resistant tumors with targeted minicells containing siRNA or a cytotoxic drug. Nat Biotechnol, 2009, 27(7): 643–651. DOI: 10.1038/nbt.1547 |
| [48] | Tsuji S, Chen XG, Hancock B, et al. Preclinical evaluation of VAX-IP, a novel bacterial minicell-based biopharmaceutical for nonmuscle invasive bladder cancer. Mol Ther Oncolytics, 2016, 3: 16004. DOI: 10.1038/mto.2016.4 |
| [49] | Karagiannis ED, Anderson DG. Minicells overcome tumor drug-resistance. Nat Biotechnol, 2009, 27(7): 620–621. DOI: 10.1038/nbt0709-620 |
| [50] | Van Zandwijk N, Pavlakis N, Kao SC, et al. Safety and activity of microRNA-loaded minicells in patients with recurrent malignant pleural mesothelioma: a first-in-man, phase 1, open-label, dose-escalation study. Lancet Oncol, 2017, 18(10): 1386–1396. DOI: 10.1016/S1470-2045(17)30621-6 |
| [51] | Fernandez-Pi eiro I, Badiola I, Sanchez A. Nanocarriers for microRNA delivery in cancer medicine. Biotechnol Adv, 2017, 35(3): 350–360. DOI: 10.1016/j.biotechadv.2017.03.002 |
| [52] | Parsa S, Pfeifer B. Engineering bacterial vectors for delivery of genes and proteins to antigen-presenting cells. Mol Pharmaceutics, 2007, 4(1): 4–17. DOI: 10.1021/mp0600889 |
| [53] | Hesse M, Weber R, Glünder G. Antibody titers in turkeys increase after multiple booster vaccinations with an attenuated Salmonella live vaccine. BMC Res Notes, 2018, 11(1): 367. DOI: 10.1186/s13104-018-3462-y |
| [54] | Giacalone MJ, Sabbadini RA, Chambers AL, et al. Immune responses elicited by bacterial minicells capable of simultaneous DNA and protein antigen delivery. Vaccine, 2006, 24(33/34): 6009–6017. |
| [55] |
Lu W, Yang RQ, Wang L. Research progerss of exosomes.
Chem Life, 2013, 33(4): 438–442.
(in Chinese). 卢婉, 杨人强, 王伶. 外泌体的研究进展. 生命的化学, 2013, 33(4): 438-442. |
| [56] | Mönkemöller V, Schüttpelz M, McCourt P, et al. Imaging fenestrations in liver sinusoidal endothelial cells by optical localization microscopy. Phys Chem Chem Phys, 2014, 16(24): 12576–12581. DOI: 10.1039/C4CP01574F |
| [57] | Cognet I, de Coignac AB, Magistrelli G, et al. Expression of recombinant proteins in a lipid A mutant of Escherichia coli BL21 with a strongly reduced capacity to induce dendritic cell activation and maturation. J Immunol Methods, 2003, 272(1/2): 199–210. |
 2019, Vol. 35
2019, Vol. 35




