中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈涛, 马立霞, 崔景香, 耿进红, 曾勇庆, 陈伟
- Chen Tao, Ma Lixia, Cui Jingxiang, Geng Jinhong, Zeng Yongqing, Chen Wei
- 猪miR-331-3p过表达载体的构建及其对细胞增殖的影响
- Construction of miR-331-3p overexpression vector and its effect on cell proliferation
- 生物工程学报, 2019, 35(5): 892-900
- Chinese Journal of Biotechnology, 2019, 35(5): 892-900
- 10.13345/j.cjb.180434
-
文章历史
- Received: October 24, 2018
- Accepted: February 20, 2019
- Published: February 26, 2019
2. 山东农业大学 山东省动物生物工程与疾病防治重点实验室,山东 泰安 271018;
3. 潍坊科技学院,山东 潍坊 262700
2. Shandong Provincial Key Laboratory of Animal Biotechnology and Disease Control and Prevention, Shandong Agricultural University, Tai'an 271018, Shandong, China;
3. Weifang University of Science and Technology, Weifang 262700, Shandong, China
miRNA是长度为18–24 nt的短序列的单链非编码RNA,在进化上具有高度的保守性,主要通过调控基因表达的水平起作用。许多研究已表明,miRNA主要通过与靶基因的3ʹ UTR互补配对,引起靶基因mRNA的降解或者抑制其翻译[1],实现对基因表达水平的调控,从而参与细胞的增殖、分化、凋亡和代谢等许多生物学过程[2-3]。
miR-331-3p是一种在各种物种中高度保守的miRNA,目前研究发现miR-331-3p在癌细胞的增殖分化以及癌症的发生、发展中发挥着重要作用[4],在功能上具有多种作用。miR-331-3p可以靶向作用于细胞周期相关基因E2F1 (E2F transcription factor 1),具有抑制胃癌细胞生长和克隆的形成的能力[5]。研究发现,miR-331-3p的受体lncRNA-HOTAIR参与调节人表皮生长因子受体2 (Glutamyl-tRNA (Gln) amidotransferase subunit HER2,HER2)的去阻遏,并强化额外水平的转录后调控可降低HER2蛋白的表达,进而降低胃癌细胞的增殖、迁移和侵袭[6]。ING5是一个肿瘤抑制基因,抑制细胞生长并且诱导细胞凋亡。miR-331-3p能够通过抑制ING5表达促进肝癌(HCC)细胞的增殖[7]。综上所述,miR-331-3p一直被认为是一种肿瘤相关因子,本身的作用也具有多样性,但这些研究都仅限于人类的癌症细胞中,miR-331-3p对于其他物种或细胞的作用研究很少。
猪是人类重要的肉食来源,其自身生长受多种因素的影响。miRNA作为目前较热门的研究领域,已经有很多研究表明miRNA在猪生长发育过程中发挥着重要的作用,例如miR-1、miR-133和miR-206都是肌肉特异性的miRNA,在肌肉形成过程中起着关键作用[8],但是miR-331-3p在猪细胞增殖方面的研究鲜有报道。猪肾上皮细胞系即PK15细胞,是一种常见的细胞系,对于猪圆环病毒(PCV)、猪细小病毒(PPV)和猪瘟病毒(CSFV)等多种病毒比较敏感,现已广泛应用于猪瘟病毒、猪伪狂犬病病毒和猪细小病毒等的分离、体外培养以及相关疫苗的生产中,具有非常重要的作用[9]。因此,本研究选取PK15细胞作为研究对象,通过研究miR-331-3p对PK15细胞增殖的影响,为进一步探讨miR-331-3p在猪生长发育中的作用机制奠定基础。
1 材料与方法 1.1 材料及主要试剂猪肾上皮细胞(PK15)、pcDNA 3.1(+)哺乳动物表达载体均由实验室保存。莱芜猪耳组织采于莱芜猪原种场;DMEM培养基、Opti-MEM无血清培养基、PBS、0.25%胰酶、胎牛血清(Fetal bovine serum,FBS)均购于Gibco公司(美国);青链霉素混合液购于北京索莱宝科技有限公司(中国北京);反转录和荧光定量试剂购于TaKaRa (中国大连)。CCK-8试剂盒购于碧云天生物技术有限公司(中国上海);微量RNA提取试剂盒购于Omega Bio-Tek (美国);细胞周期与凋亡检测试剂盒购于碧云天生物技术有限公司(中国上海);miR-331-3p inhibitor和miR-331-3p NC购于上海吉玛制药技术有限公司(中国上海);T4 DNA连接酶、KpnⅠ内切酶和XbaⅠ内切酶均购于Thermo Scientific (美国);DNA提取试剂盒、质粒大提试剂盒和普通琼脂糖凝胶DNA回收试剂盒购于天根生化科技有限公司(中国北京);转染试剂Lipofectamine® 3000购于Invitrogen (美国);实验所用引物合成以及测序均由生工生物工程(上海)股份有限公司完成。实验地点为山东农业大学动物育种学研究室。
1.2 培养基的配制10%完全培养基:10%胎牛血清+100 IU/mL青链霉素+DMEM。5%完全培养基:5%胎牛血清+100 IU/mL青链霉素+DMEM。无双抗培养基:10%胎牛血清+DMEM。
1.3 方法 1.3.1 miR-331-3p过表达载体的构建首先利用Primer 5.0设计包含miR-331-3p前体序列的上下游引物,分别在其5ʹ端添加KpnⅠ内切酶和XbaⅠ内切酶的酶切位点以及2 bp的保护碱基AA (表 1)[10]。然后提取莱芜猪耳组织的基因组,以DNA为模板通过普通PCR扩增的方式获得目的片段,PCR产物经琼脂糖凝胶电泳分离,经纯化回收。最后将目的片段和载体同时酶切、琼脂糖凝胶电泳分离、纯化回收、T4 DNA酶连接构建到pcDNA 3.1(+)载体上。
| Gene | GenBank accession number | Primer sequence (5ʹ–3ʹ) | Fragment size (bp) |
| miR-331-3p | F: GGTATGGGCCTATCCTAGAA | ||
| Pre-miR-331-3p | 100498734 | F: AAGGTACCCCAAGTCCTCGTGTATGC | 558 |
| R: AATCTAGATGTCCACTGTCATCCTTC | |||
| CDK2 | 100154715 | F: AAGATGGACGGAGCTTGTTATCGC | 108 |
| R: CTGGCTTGGTCACATCCTGGAAG | |||
| CDK3 | 100523273 | F: TCATCCACCGAGACCTGAAGCC | 192 |
| R: AGACATCCACAGCCGTCGAGTAG | |||
| CDK4 | 100144492 | F: TGAGATGGAGGAGTCTGGAGCAC | 80 |
| R: CTCGGAAGGCAGAGATTCGCTTG | |||
| Cyclin B | 397662 | F: GACTGGCTAGTGCAGGTTCAGATG | 137 |
| R: ATGGCAGTGACACCAACCAGTTG | |||
| ING5 | 110256977 | F: TGGAGCACTACCTGGACAGTATCG | 146 |
| R: GGTCTTCACCGTGGCAATGTACTC | |||
| CDKN1A | 100152215 | F: CGAGAGCGATGGAACTTCGACTTC | 200 |
| R: TCCACATGGTCCTCCTGAGACG | |||
| GAPDH | 396823 | F: AGGTCGGAGTGAACGGATTTG | 118 |
| R: ACCATGTAGTGGAGGTCAATGAAG | |||
| Note: denotes the protective bases; _____denotes the restriction site. | |||
PK15细胞培养使用完全培养基,培养在CO2培养箱中,培养条件为5% CO2、37 ℃。当细胞密度大于80%,换用无双抗培养基进行实验。该实验所用的所有细胞均处于对数生长期,细胞活性大于95%。
1.3.3 细胞转染将细胞接种到培养板上,生长到一定密度时,换用无双抗培养基继续培养。将实验分为4组:1)实验组:转染pcDNA3.1(+)-miR-331-3p载体;2)实验对照组:转染pcDNA3.1(+)载体;3)抑制剂组:转染miR-331-3p inhibitor;4)抑制剂对照组:转染miR-331-3p NC。转染步骤按照Lipofectamine® 3000说明书操作,转染4 h更换新的无双抗的培养基,24 h后更换完全培养基继续培养,48 h后收集细胞。
1.3.4 绘制细胞生长曲线将生长良好的PK15细胞1×104/mL的密度接种到96孔板,每孔加入100 μL 5%完全培养基。分别在第0 h、24 h、48 h、72 h和96 h,每孔加入10 μL CCK8试剂,37 ℃培养2 h,然后用酶标仪(Promega,美国)检测细胞在450 nm下的OD值,计算平均值,并绘制实验组、实验对照组、抑制剂组和抑制剂对照组的生长曲线。
1.3.5 细胞RNA提取及荧光定量PCR将PK15细胞接种到6孔板,待细胞汇合度达到80%时转染细胞,48 h后提取细胞总RNA,然后反转录为cDNA。利用Primier 5.0设计CDK2、CDK3、CDK4、Cyclin B、ING5、CDKN1A和GAPDH (Glyceraldehyde-3-phosphate dehydrogenase)基因的荧光定量引物(表 1),其中GAPDH持家基因作为内参[11]。利用LightCycler® 96实时荧光定量PCR系统,检测过表达miR-331-3p后细胞周期相关基因的表达情况,其定量结果通过2-ΔΔCt的方法计算。反应体系(20 μL)为:2× TB Green Premix Ex Taq 10 μL,上下游引物各0.4 μL,cDNA模板2 μL,ddH2O 7.2 μL。
同样,设计miR-331-3p的上游引物(表 1),下游引物使用试剂盒内的通用下游引物,以U6作为内参基因[12],引物使用miRNA反转录试剂盒内的U6上下游引物。同样使用LightCycler® 96实时荧光定量PCR系统,检测miR-331-3p的表达变化。反应体系(20 μL)为:2× TB Green Premix Ex Taq 10 μL,上下游引物各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。
1.3.6 细胞周期检测将细胞接种到6孔板,待细胞汇合度达到30%左右时分别转染实验组、实验对照组、抑制剂组和抑制剂对照组,当细胞密度达到80%–90%时,小心收集细胞培养液到1.5 mL离心管内备用。用胰酶消化细胞,至细胞可以被轻轻用移液管或枪头吹打下来时,加入前面收集的细胞培养液,终止胰酶消化过程,吹打下所有的贴壁细胞,并轻轻吹散细胞。再次收集到离心管内。300×g离心3 min去除培养基,再用1 mL预冷PBS洗1遍。然后进行细胞固定,加入1 mL冰浴预冷的70%乙醇中,4 ℃固定12 h,300×g离心去除70%乙醇,使用PBS再洗1遍。最后加入碘化丙啶染色液(PI),37 ℃避光水浴30 min,结束后锡箔纸包裹离心管放到冰盒上,经0.75 μm滤膜过滤后使用BD FACSCalibur流式细胞仪上机检测细胞所处周期的比例[13]。
1.3.7 实验设计与数据处理所有实验均设置不少于3次重复,所有数据均以平均值±标准差(x±s)表示,采用SPSS 20统计分析软件中的One-way ANOVA进行方差分析,通过Duncan氏方法进行多重比较,显著性水平定为P < 0.05。
2 结果与分析 2.1 miR-331-3p过表达载体的构建实验所克隆的miR-331-3p前体大小为558 bp,并且以其为模板进行菌液PCR后经琼脂糖凝胶电泳检测,发现扩增的目的片段与预期大小一致,且条带单一、无杂带(图 1A)。提取质粒经测序比对,结果与预期相符,无杂峰干扰(图 1B),所提取的质粒经核酸蛋白浓度测定仪检测质粒浓度高、质量好,可用于细胞转染实验。

|
| 图 1 菌液PCR扩增结果和pre-miR-331-3p测序分析 Fig. 1 Bacterial liquid PCR and pcDNA 3.1(+)-miR-331-3p sequencing map. (A) Agarose gel electrophoresis of bacterial PCR. (B) Sequencing map of pcDNA 3.1(+)-miR-331-3p. |
| |
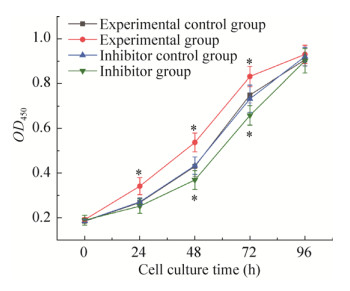
经检测发现,4组细胞的生长曲线均呈S型(图 2),符合体外细胞培养的生长特点。在转染24 h后,实验组细胞数显著高于实验对照组、抑制剂组和抑制剂对照组(P < 0.05);但是实验对照组、抑制剂组与抑制剂对照组之间差异均不显著(P > 0.05),可能是由于miR-331-3p抑制剂在24 h时作用效果不显著,导致此时miR-331-3p的表达下调不显著。在48 h和72 h时均呈现出实验组 > 实验对照组和抑制剂对照组 > 抑制剂组的趋势(P < 0.05),在96 h时实验组、实验对照组、抑制剂组和抑制剂对照组差异已不显著。
|
| 图 2 miR-331-3p对细胞生长曲线的影响 Fig. 2 Effect of miRNA-331-3p on cell growth curve. * P < 0.05. |
| |
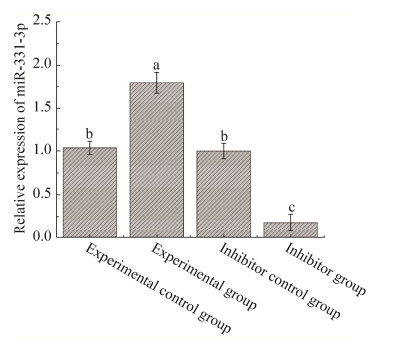
利用qPCR方法分别检测实验组、实验对照组、抑制剂组和抑制剂对照组细胞在转染48 h后miR-331-3p的表达差异。实验组miR-331-3p的表达量显著高于实验对照组(P < 0.05),这表明所构建的pcDNA3.1(+)-miR-331-3p载体在PK15细胞中能够发挥作用,提高了细胞自身miR-331-3p的表达水平,效果良好。相反,抑制剂组miR-331-3p的表达水平相对于抑制剂对照组显著下降(P < 0.05),这表明miR-331-3p inhibitor确实可以达到抑制细胞本身的miR-331-3p表达的水平,符合实验要求(图 3)。
|
| 图 3 miR-331-3p表达变化分析 Fig. 3 Analysis of expression changes of miR-331-3p. Different lower-case letters denoted significant difference (P < 0.05). |
| |
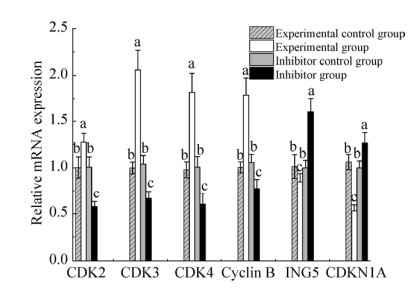
为了探讨miR-331-3p对细胞增殖的影响,利用RT-qPCR法检测了miR-331-3p的靶基因ING5,以及周期相关基因CDK2、CDK3、CDK4、Cyclin B和CDKN1A的表达变化。结果表明,促进细胞增殖的CDK2、CDK3、CDK4和Cyclin B基因的mRNA表达趋势均为实验组 > 实验对照组和抑制剂对照组 > 抑制剂组(P < 0.05) (图 4);而具有抑制细胞增殖作用的CDKN1A和ING5基因的mRNA表达量具有相反的变化趋势,即实验组 < 实验对照组和抑制剂对照组 < 抑制剂组(P < 0.05) (图 4)。
|
| 图 4 细胞增殖相关基因的表达变化分析 Fig. 4 Analysis of expression changes of cell proliferation related genes. Different lower-case letters of the same group denoted significant difference (P < 0.05). |
| |
PI染色后利用流式细胞仪检测各组PK15细胞的周期分布,得到的实验数据经ModFit软件分析后得到流式细胞图(图 5)。由图可知各组中DNA合成前期(G0/G1期)的细胞所占比例,实验组 < 实验对照组和抑制剂对照组 < 抑制剂组(P < 0.05)。各组中处于DNA合成期(S期)的细胞所占比例,实验组 > 实验对照组和抑制剂对照组 > 抑制剂组(P < 0.05)。并且各组中处于DNA合成后期和分裂期(G2/M期)的细胞所占的比例也是实验组 > 实验对照组和抑制剂对照组 > 抑制剂组(P < 0.05),与细胞处于S期的比例具有相同趋势。

|
| 图 5 流式细胞术分析细胞所处周期 Fig. 5 Flow cytometric analysis of the indicated cells. Different lower-case letters of the same group denoted significant difference (P < 0.05). |
| |
miRNA作为内源非编码短链RNA,在细胞增殖、凋亡、分化等细胞过程中发挥着重要的作用。不同的miRNA可能发挥着相同或相反的作用,甚至同种miRNA在不同的细胞中也具有不同的作用。研究表明miR-331-3p作用机制复杂,在不同的癌细胞中可能发挥着完全相反的作用机制[14-16]。
过表达miR-331-3p后相对于实验对照组和抑制剂对照组,流式细胞术结果表明G0/G1期细胞比例显著降低,抑制剂组显著升高,G0/G1期细胞所占比例降低说明细胞增殖速度加快,反之增殖速度减慢[17]。同时DNA合成期(S期),处于S期的细胞所占比例也显著性升高,表明过表达miR-331-3p后促使大量细胞由G1期过渡到S期,S期细胞所占比例升高,DNA、组蛋白合成速度加快,组装成染色体使细胞内染色体数目加倍为进入细胞分裂期做准备,抑制剂组结果相反。过表达miR-331-3p后在G0/G1期细胞所占比例降低S期细胞所占比例升高的基础上,DNA合成后期(G2期)和细胞分裂期(M期)细胞所占比例也显著地高于实验对照组、抑制剂组和抑制剂对照组。其中G2期是DNA复制结束与开始有丝分裂之间的间隙,在这期间细胞合成某些蛋白质和RNA分子,做好细胞进入M期的物质准备。M期为细胞分裂期,M期细胞所占比例升高直接说明了分裂期细胞增多,表明细胞生长分裂加速。所以处于G2/M期的细胞所占比例显著升高(P < 0.05),表明了细胞此时增殖能力较强能够快速大量分裂,使细胞数目增加。与其相反的是抑制剂组相对于其他分组均表现出细胞G2/M期所占比例下降,也从反面证明了这一点。因此流式细胞分析的结果表明miR-331-3p具有促进细胞增殖的效果,这与细胞增殖曲线实验组增殖速度增快,抑制剂组增殖速度减慢相符合。
细胞周期蛋白依赖性激酶(CDKs),如CDK2、CDK3和CDK4已被公认为真核生物细胞生长和增殖的关键调控因子,这是哺乳动物细胞G1-S相变所必需的[18-19]。Cyclin B是细胞进入和退出细胞周期M期所必需的[20]。相反地,细胞CDKN1A的过度表达可能通过诱导细胞抑制细胞增殖周期阻滞,它是CDKs的抑制剂[21]。荧光定量表明实验组随着miR-331-3p表达升高显著上调CDK2、CDK3和CDK4促进细胞周期由G1期到S期的转变,促使处于S期的细胞所占比例显著上调(P < 0.05),同时上调Cyclin B基因的表达促进细胞周期由G2期进入M期,使实验组处于G2/M期细胞的比例上调。随着miR-331-3p的高表达,细胞内的CDKN1A基因表达下调,CDKN1A具有阻滞细胞增殖的作用。其表达下调从另一个方面表明,miR-331-3p具有促进细胞增殖的作用。综合各个周期相关基因的荧光定量的表达结果说明,miR-331-3p具有促进细胞增殖的功能。有研究表明ING5为miR-331-3p的靶基因[7],miR-331-3p的过表达和抑制表达导致ING5基因发生相应的下调和上调也证明了这一观点,因此在猪肾上皮细胞中miR-331-3p有可能是通过作用于ING5基因达到促使细胞增殖的效果。
4 结论本研究成功构建了miR-331-3p的过表达载体,并且发现miR-331-3p可以通过促进周期相关基因CDK2、CDK3、CDK4、Cyclin B基因的表达,以及抑制ING5和CDKN1A的表达,从而促进猪肾上皮细胞增殖,这为深入研究miR-331-3p在猪生长发育中的作用机制奠定了基础。
| [1] | Lund E, Güttinger S, Calado A, et al. Nuclear export of MicroRNA precursors. Science, 2004, 303(5654): 95–98. DOI: 10.1126/science.1090599 |
| [2] | Zhuang M, Qiu XB, Cheng D, et al. MicroRNA-524 promotes cell proliferation by down-regulating PTEN expression in osteosarcoma. Cancer Cell Int, 2018, 18: 114. DOI: 10.1186/s12935-018-0612-1 |
| [3] | Pogue AI, Cui JG, Li YY, et al. Micro RNA-125b (miRNA-125b) function in astrogliosis and glial cell proliferation. Neurosci Lett, 2015, 476(1): 18–22. |
| [4] | Chang RM, Yang H, Fang F, et al. MicroRNA-331-3p promotes proliferation and metastasis of hepatocellular carcinoma by targeting PH domain and leucine-rich repeat protein phosphatase. Hepatology, 2015, 60(4): 1251–1263. |
| [5] | Guo XB, Guo L, Ji J, et al. miR-331-3p directly targets E2F1 and induces growth arrest in human gastric cancer. Biochem Bioph Res Commun, 2010, 398(1): 1–6. DOI: 10.1016/j.bbrc.2010.05.082 |
| [6] | Giles KM, Barker A, Zhang PM, et al. MicroRNA regulation of growth factor receptor signaling in human cancer cells//Wu W, ed. MicroRNA and Cancer. Totowa, NJ: Humana Press, 2011. |
| [7] | Cao YY, Chen J, Wang D, et al. Upregulated in Hepatitis B virus-associated hepatocellular carcinoma cells, miR-331-3p promotes proliferation of hepatocellular carcinoma cells by targeting ING5. Oncotarget, 2015, 6(35): 38093–38106. |
| [8] | Ge YJ, Chen J. MicroRNAs in skeletal myogenesis. Cell Cycle, 2011, 10(3): 441–448. DOI: 10.4161/cc.10.3.14710 |
| [9] | Walia R, Dardari R, Chaiyakul M, et al. Porcine circovirus-2 capsid protein induces cell death in PK15 cells. Virology, 2014, 468-470: 126–132. DOI: 10.1016/j.virol.2014.07.051 |
| [10] | Li CH, Chen W, Hu JQ, et al. miRNA-29a targets COL3A1 to regulate the level of type Ⅲ collagen in pig. Gene, 2016, 592(1): 140–147. |
| [11] | Shi T, Yan XR, Qiao LY, et al. MiR-330-5p negatively regulates ovine preadipocyte differentiation by targeting branched-chain aminotransferase 2. Anim Sci J, 2018, 89(6): 858–867. DOI: 10.1111/asj.2018.89.issue-6 |
| [12] | Mi L, Chen YS, Zheng XL, et al. MicroRNA-139-5p suppresses 3T3-L1 preadipocyte differentiation through notch and IRS1/PI3K/Akt insulin signaling pathways. J Cell Biochem, 2015, 116(7): 1195–1204. DOI: 10.1002/jcb.v116.7 |
| [13] | Xu LN, Qi YL, Lv LW, et al. In vitro anti-proliferative effects of Zuojinwan on eight kinds of human cancer cell lines. Cytotechnology, 2014, 66(1): 37–50. DOI: 10.1007/s10616-013-9534-x |
| [14] | Fujii T, Shimada K, Asano A, et al. MicroRNA- 331-3p suppresses cervical cancer cell proliferation and E6/E7 expression by targeting NRP2. Int J Mol Sci, 2016, 17(8): 1351–1364. DOI: 10.3390/ijms17081351 |
| [15] | Lai YJ, He S, Ma LM, et al. HOTAIR functions as a competing endogenous RNA to regulate PTEN expression by inhibiting miR-19 in cardiac hypertrophy. Mol Cell Biochem, 2017, 432(1/2): 179–187. |
| [16] |
Li J, Zhang YY. Research progress of miR-331-3p in malignant tumors.
Prac Oncol J, 2018, 32(2): 125–129.
(in Chinese). 李静, 张云艳. miR-331-3p在恶性肿瘤中的研究进展. 实用肿瘤学杂志, 2018, 32(2): 125-129. |
| [17] | Ye P, Ke XP, Zang XH, et al. Up-regulated MiR-27-3p promotes the G1-S phase transition by targeting inhibitor of growth family member 5 in osteosarcoma. Biomed Pharmacother, 2018, 101: 219–227. DOI: 10.1016/j.biopha.2018.02.066 |
| [18] | Tsai LH, Lees E, Faha B, et al. The cdk2 kinase is required for the G1-to-S transition in mammalian cells. Oncogene, 1993, 8(6): 1593–1602. |
| [19] | Sherr CJ, Roberts JM. Inhibitors of mammalian G1 cyclin-dependent kinases. Genes Dev, 1995, 9(10): 1149–1163. DOI: 10.1101/gad.9.10.1149 |
| [20] | Ito M. Factors controlling cyclin B expression. Plant Mol Biol, 2000, 43(5/6): 677–690. DOI: 10.1023/A:1006336005587 |
| [21] | Zhang YY, Xu ZN. miR-93 enhances cell proliferation by directly targeting CDKN1A in nasopharyngeal carcinoma. Oncol Lett, 2018, 15(2): 1723–1727. |
 2019, Vol. 35
2019, Vol. 35