中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李洪英, 常瑞, 朱秋劲, 朱旭玲, 徐阿奇, 周樱子, 晏印雪
- Li Hongying, Chang Rui, Zhu Qiujin, Zhu Xuling, Xu Aqi, Zhou Yingzi, Yan Yinxue
- 染料木黄酮对大鼠体内N-羟乙酰神经氨酸含量的影响及其与唾液酸转移酶相互作用的探讨
- Effects of genistein on N-glycolylneuraminic acid content in rats and the interaction with sialyl transferase
- 生物工程学报, 2019, 35(5): 857-870
- Chinese Journal of Biotechnology, 2019, 35(5): 857-870
- 10.13345/j.cjb.180505
-
文章历史
- Received: December 6, 2018
- Accepted: January 29, 2019
2. 贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025
2. Guizhou Province Key Laboratory of Agricultural and Animal Products Storage and Processing, Guiyang 550025, Guizhou, China
红肉的摄入与癌症、心血管和炎症等疾病密切相关,这是因为红肉中含Neu5Gc[1-7]。Neu5Gc主要存在于脊椎动物体内,极少部分存在于微生物中,通常与糖蛋白或者糖脂以结合态的形式存在于体内,很少以游离的形式存在[8-10]。其中结合态Neu5Gc含量是游离态的Neu5Gc含量的30倍,游离态Neu5Gc仅占2%左右[11],且结合态的Neu5Gc才具有引发炎症反应的生物学功能。
大多数哺乳动物自身能合成Neu5Gc,但人类由于在进化的过程中丢失了编码胞苷-磷酸-N-乙酰神经氨酸羟化酶(CMP-N-acetylneuraminic acid hydroxylase,CMAH)基因,所以正常人体内不能合成Neu5Gc[12-14],人体内的Neu5Gc主要通过红肉的摄入而积累,当红肉中的Neu5Gc进入人体后,游离态的Neu5Gc迅速随代谢产物(如尿液)排出体外,结合态的Neu5Gc则能在肠道、肝脏、血液中稳定存在,被机体当作外来物质,产生异种抗体,诱发机体处于低度炎症状态[15]。大量的流行病学资料表明,约20%的恶性肿瘤由炎症诱发或促进[16-17]。此外,红肉易被产志贺毒素型大肠杆菌(Shiga toxin-type Escherichia coli,STEC)污染;若人体上皮细胞中存在结合态的Neu5Gc,当它与志贺毒素结合时会引起胃肠道不适,从而引发腹泻等症状;而当肾内皮细胞中存在聚集结合态的Neu5Gc时,与STEC产生的志贺毒素结合会破坏内皮细胞,进而诱发溶血性尿毒症综合征(Hemolytic uremic syndrome,HUS),引起血性腹泻并伴随肾衰竭等症状[1, 18-20]。可见,大宗畜产品红肉中的Neu5Gc严重威胁着人类的健康,因此,设法从动物性食品的源头上降低Neu5Gc的含量显得尤为必要。
目前降低红肉中Neu5Gc含量的研究才刚刚起步,蒋芸等[21]分别使用物理和化学酶解法对猪肉和牛肉进行烹饪前的处理,发现它们对红肉中结合态Neu5Gc含量的降低有着不同程度的效果。Bardor等[22]利用阿米洛利和Gen培养人类的癌细胞及突变细胞,发现它们能降低细胞中Neu5Gc的含量,且Gen对Neu5Gc的抑制效果更好。然而,目前通过添加某种安全试剂降低动物体内Neu5Gc生物合成的方法鲜有报道。
本文基于Neu5Gc的合成路径,寻找在哺乳动物体内抑制Neu5Gc的生物合成的抑制剂。Neu5Gc在哺乳动物体内的生物合成路径[14]如图 1所示。由图 1可知,Neu5Gc的生物合成涉及CMAH和ST,故抑制ST的活性是降低对促炎起主要贡献的结合态Neu5Gc含量的关键;关于抑制ST的研究,王棐等[23]通过分子对接和分子动力学模拟的方法探讨了大豆皂苷Ⅰ抑制ST的机理,但在活体内还没有相关的实验验证。

|
| 图 1 Neu5Gc在哺乳动物体内的生物合成 Fig. 1 Biosynthesis of Neu5Gc in mammals. |
| |
Gen是从大豆中提取的异黄酮类化合物,存在于富含豆肽的多种天然植物中,在大豆中占到1.5%,明显高于大豆皂苷(0.6%)[24],无毒副作用,在动物细胞中具有广泛的药理学功效。Gen还可诱导T淋巴瘤细胞、乳腺癌、前列腺癌和结肠癌细胞的凋亡,具有抗肿瘤作用[25]。可见Gen对降低动物体内Neu5Gc的生物合成必然存在一定的影响,然而,目前这种影响及其作用机制尚不清楚。
本研究首先考察Gen对大鼠体内Neu5Gc的生物合成的影响;其次,通过分子对接探讨Gen降低大鼠体内Neu5Gc合成作用机制。本文以期为从饲喂环节降低红肉中Neu5Gc的含量提供实验依据;主要对原料肉(猪、牛、羊)的养殖具有一定指导意义;为后续探索降低宰前红肉中Neu5Gc含量的方法奠定研究基础。
1 材料与方法 1.1 试剂与仪器采用试剂包括:Gen (纯度 > 97%)(上海阿拉丁试剂有限公司);色谱纯试剂有:乙腈、甲醇(德国Applichem公司)、1, 2-二氨基4, 5-亚甲基二氧苯盐酸盐(DMB)、β-巯基乙醇(Sigma公司);分析纯试剂有:氢氧化钠、硫代硫酸钠、无水亚硫酸钠(天津市致远化学试剂有限公司)、冰乙酸、硫酸铵(成都金山化学试剂有限公司);Neu5Gc标准品。
主要仪器设备:Agilent-1260 Infinity高效液相色谱(配有荧光检测器和自动进样器);TGL20M台式高速冷冻离心机(长沙迈佳森仪器设备有限公司);DY89-Ⅱ型电动玻璃匀浆机、SCIENTZ-10N真空冷冻干燥机、SB25-12DT超声清洗器(宁波新芝有限公司);Heal Force超纯水系统(力新仪器(上海)有限公司);ADVENTURER电子分析天平(奥豪斯仪器有限公司)。
开源免费软件AutoDock vina、贵州大学云计算平台共享软件SYBYL2.0。
1.2 实验动物SPF级雄性SD大鼠(实验动物生产许可证号:SCXK(湘)2014-0011),4周龄,体重(70±2) g,由长沙市天勤生物技术有限公司提供。所有大鼠适应性喂养7 d后开始实验,大鼠饲料由长沙市天勤生物技术有限公司提供。
1.3 方法 1.3.1 实验分组及样品采集80只SD雄性大鼠,适应性饲养7 d后,随机分成2组,40只/组,即对照组、Gen组。分组后连续灌胃60 d,对照组灌胃5%的乙醇(1 mL/只),Gen组灌胃300 mg/(kg·d) (根据Gen的安全剂量范围及在动物体内发挥生理作用的特点选定300 mg/(kg·d)为实验剂量[26-30]) Gen的溶液(1 mL/只) (溶液配制方法:Gen的质量根据300×大鼠体重(kg)×数量(只)计算,1-4周Gen的质量分别为8.40、10.08、9.82和10.08 g,由于Gen不溶于水而溶于乙醇,故先用5 mL的酒精溶解Gen,再用蒸馏水稀释定容);动物房温度控制在(23±2) ℃,湿度60%;自由进食、自由进水。
灌胃15 d、30 d、45 d、60 d后,在对照组和Gen组中分别选10只大鼠,用乙醚迷晕后,断颈处死,取大腿肌肉、肝脏组织、肾脏组织于−80 ℃保存待用。
1.3.2 肌肉组织及内脏组织前处理分别称取1 g后腿肌肉及左肾组织、肝脏组织于匀浆瓶中,加入10 mL的30%的硫酸铵磨成匀浆液,−80 ℃冷冻12 h沉淀蛋白质后冷冻干燥成粉末;将干燥后的粉末加入10 mL浓度为2 mol/L的醋酸在80 ℃水浴3 h进行酸解,使样品中结合态的Neu5Gc解离为游离态的Neu5Gc[1, 8];之后13 363 ×g离心15 min,并用0.45 µm的有机滤头过滤后于−80 ℃冷冻12 h,之后进行真空冷冻干燥成粉末;将冻干粉溶于1.0 mL的蒸馏水和0.2 mL NaOH (浓度0.1 mol/L)中,在37 ℃的条件下水浴30 min去乙酰化处理;取去乙酰化的样品900 µL,加入100 µL的衍生剂,在避光的条件下衍生150 min后进行高效液相色谱检测样品中游离态和结合态Neu5Gc总的含量。
1.3.3 衍生剂的配置及HPLC检测条件衍生剂的配制参考了文献[1, 21]的配置方法:0.008 mol/L的DMB、0.25 mol/L的Na2S2O3·5H2O、1.5 mol/LCH3COOH(冰醋酸)分析纯、0.25 mol/L亚硫酸钠(分析纯)、0.8 mmol/L的2-巯基乙醇(色谱纯)。
衍生条件:将100 µL的衍生剂加入到盛有900 µL样品瓶中,50 ℃避光衍生2.5 h,冷却至室温后进样进行HPLC-FLD分析。
HPLC检测条件:德国默克Li Chrosorb RP-18色谱柱(150 mm×4.6 mm,5 µm),流动相为乙腈-甲醇-超纯水(8:7:85,V/V),流速为0.9 mL/min,柱温30 ℃,进样体积10 µL,荧光检测器激发波长373 nm、发射波长448 nm。
为探讨Gen降低大鼠体内Neu5Gc合成的作用机制,参考本团队前期探索和总结的方法[31],采用分子对接探讨Gen与ST可能的作用过程,具体步骤如下。
1.3.4 AutoDock vina对接采用分子对接和分子动力学分析探讨Gen与ST相互作用的可能过程。利用AutoDock vina和SYBYL2.0中的Surflex-Geom对接模块对对接过程中涉及的蛋白活性残基进行分析。对接受体准备:采用北京创腾科技有限公司的Discovery Studio (DS)客户端(2.5版)显示ST (2wnb)的三维结构信息,去水加氢后发现其中有两个底物配体,配体1为胞苷单磷酸,配体2由CG31345、A2G1346、Gal1347三个残基组成。保留配体1,删除配体2,记下配体1的空间位置参数(x=23.926 9,y=31.865 3,z=34.235 1),保存蛋白文件。对配体2操作如上,得到配体2位置空腔参数:x=34.034 286,y=23.860 486,z=40.470 714。在AutodockTool- 1.5.6中打开保存的蛋白文件,定义原子类型为AD4并加casteiger电荷,然后将两文件保存为pdbqt格式,作为对接受体。对接配体准备:Gen分子结构用Chemoffice构建,用Openbable转换为mol2文件。对Gen分子进行加氢和电荷处理时采用的是Autodock Tools工具,并将其原子格式设置为pdbqt文件。盒子大小设为size_x=30,size_y=30,size_z=30,选用“拉马克遗传算法”开展对接构象的搜索,最大对接构象数目控制为9,对接完成后,根据打分函数值的综合得分及其均方根偏差(Root mean square deviation,RMSD)值来评价和确定最佳的对接构象。对接结果采用Ligplot+软件来统计Gen与配体之间发生相互作用的氢键和氨基酸残基数目[23, 31]。
1.3.5 SYBYL-Surflex对接采用Surflex-Dock(SFXC)-Geom模式进行对接,采用加氢后删除配体、水分子以及杂原子的方式对受体唾液酸转移酶进行处理。在Tripos力场下,优化唾液酸转移酶的两个配体,优化的方法每步都采用最陡下降法,并加Casteiger- Huckel电荷处理,其余参数默认。对接空腔以配体形式产生,分别提取配体1和配体2产生对接位点,在其周围0.5 nm范围半径内产生活性空腔。唾液酸转移酶的两配体的均方根偏差RMSD值最小值控制在0.5,对接构象的数目控制在20种。采用SYBYL对对接结果进行分析。
1.3.6 Gromacs动力学模拟在上述优化对接结果的基础上,选取其中对接较好的复合物进行动力学模拟。具体方法参考本团队探索的方法[31],首先获得目标配体的限制势文件及拓扑文件,即在AMBER99-ILDN力场存在的条件下,以TIP3P三点水为模型,利用AmberTools 17中的GAFF力场进行处理产生拓扑文件;而限制势文件是通过genrestr工具产生的,然后再以DPOSRES对位置进行限制。盒子大小设为:边界距离复合物文件大小为0.8 nm。向体系中加入抗衡离子以平衡电荷,能量最小优化采用是最陡下降法,优化500步,模拟步长为0.01 ps。邻居列表的生成选择“cutoff-scheme=Verlet”,静电作用选择coulomb type,非键相互作用采用PME截断方式。使用LINCS算法对键进行约束,每50步输出一次能量信息,控温和控压的时间为100 ps,进行限制性动力学模拟,使体系达到平衡,热浴设定为velocity-rescale,平衡温度控制为147.86 ℃,时长为0.2 ps。压浴设定为Berendsen,采用各项同性控压,控压时间设为0.5 ps,动力学模拟过程中仅约束氢键,且每采用最陡下降法优化一次并输入一次能量信息,而每优化两次的时候输出一次坐标信息。限制性动力学完成后,对ST和Gen进行索引的设置并对其进行分组,进行200 ns的常规动力学模拟;即每步为0.002 ps,每1 000步输出一次能量信息。
模拟达到平衡后,在180-200 ns范围内,基于分子力学泊松-波尔兹曼表面积(MM-PBSA)法对配体和蛋白结合自由能△Gbind进行计算。受体和配体间的亲和力与△Gbind值成反比,即△Gbind值越低,受体与配体间的亲和力越好。
MM-PBSA法计算自由能主要包括以下4个过程:
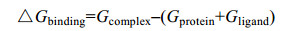
|
(1) |
式中,Gcomplex是总的自由能、Gligand为配体独立的自由能、Gprotein为溶剂中蛋白独立自由能。其中,Gligand和Gprotein由公式(2)计算:

|
(2) |
式中,Gx代表复合物;EMM是分子力学能;TS是熵变对自由能的贡献值;由于构象熵对本文变化影响不大,故TS一般设置为0;Gsolvation为溶剂化能。EMM由公式(3)计算,而Gsolvation则由公式(4)计算:

|
(3) |

|
(4) |
其中,Ebond代表成键作用,Enobonded为非键作用力。Gpolar由波兹曼方程计算;Gnonpolar通过SASA模型、SAV和WCA模型计算。
1.3.7 标准曲线的绘制称取Neu5Gc标准品0.032 5 g,并加入100 mL超纯水溶解标准品,将其配置成1 mol/mL标准品溶液。分别取50、100、200、300、400 µL的标准溶液和850、800、700、600、500 µL的超纯水及加入100 µL的DMB衍生液中(表 1),充分振荡混匀后,进行避光衍生2.5 h,用HPLC检测。每个浓度标准品均进样3次,以标准品浓度为纵坐标,以峰面积的平均值为横坐标,制作标准曲线,计算标准曲线方程[1, 21]。
样品中Neu5Gc含量降低百分比按式(5)进行计算:
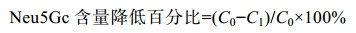
|
(5) |
式中,C0表示对照组中Neu5Gc含量,C1表示Gen组样品中Neu5Gc的含量。
1.3.9 数据处理分析方法数据以x±s表示,用IBM SPSS Statistics进行统计分析,两样本均采用t检验,根据清华大学出版社出版的张永爱主编的医学统计分析教材,P < 0.05为差异有统计学意义,涉及的图形用OriginPro 2016平台完成。
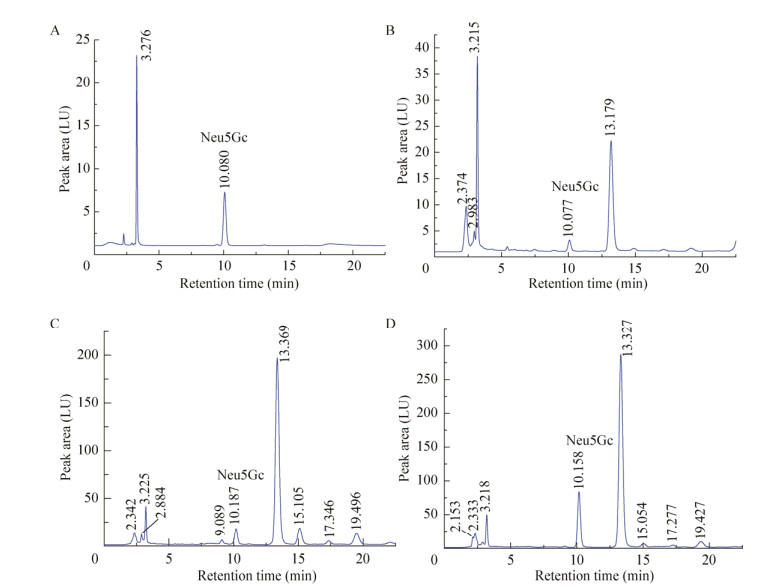
2 结果与分析 2.1 对照组中Neu5Gc及Neu5Gc标品的HPLC检测图谱将对照组样品按照“1.3.2和1.3.3”方法处理,按照“1.3.4”色谱条件进行3次分析,测得50 µmol/L Neu5Gc标品的保留时间为10.080 min (图 2A),对照组中后腿肌肉组织中Neu5Gc保留时间为10.077 min (图 2B),肝脏组织中Neu5Gc保留时间为10.187 min (图 2C),肾脏组织中Neu5Gc保留时间为10.158 min (图 2D)。
|
| 图 2 50 µmol/L的Neu5Gc标品(A)、对照组后腿肌肉组织中Neu5Gc (B)、肝脏组织中Neu5Gc (C)和肾脏组织中Neu5Gc (D)的HPLC图 Fig. 2 The HPLC chromatograms of the 50 µmol/L Neu5Gc standard (A), the hind leg muscle tissue (B), the liver tissue (C) and the kidney tissue (D) of the control group. |
| |
所得标准曲线方程为y=0.299 51x+33.812 2,R2=0.993 7,表明标准品在50-400 µmol/L浓度范围内,峰面积与浓度具有较好的线性关系。
2.3 Gen对大鼠后腿肌肉中Neu5Gc的影响实验结果显示灌胃15、45、60 d Gen组Neu5Gc含量均低于对照组,且差异具有统计学意义(P < 0.05) (图 3),各组不同灌胃时间Neu5Gc的含量如表 2所示。灌胃15 d时,Gen组Neu5Gc的含量比对照组显著降低,对照组中Neu5Gc的含量与Gen组中Neu5Gc的含量之间的差异有高度统计学意义(P < 0.01),但Neu5Gc的含量仅降低了2.50 µg/g,而这一降低值在生物学上实际意义不明显。灌胃30 d时,用HPLC-FLD法检测时系统未对其进行积分,说明在此灌胃时间段内,大鼠后腿肌肉中Neu5Gc的含量很低,以至于未检出,由此可以推测Gen在灌胃30 d抑制Neu5Gc的合成效果最好。灌胃45 d时,Gen组中Neu5Gc的含量降低了32.65%,对照组中Neu5Gc的含量与Gen组中Neu5Gc的含量之间差异具有高度统计学意义(P < 0.01),Neu5Gc的含量降低了8.18 µg/g,在生物学上实际意义明显。灌胃60 d时,Gen组中Neu5Gc的含量降低了12.72%,对照组中Neu5Gc的含量与Gen组中Neu5Gc的含量之间差异具有高度的统计学意义(P < 0.01),Neu5Gc的含量降低1.8 µg/g,而这一降低值在生物学上实际意义不明显。实验结果表明,在对照组中,在灌胃15-45 d时间段内,Neu5Gc的含量在逐渐增大,而在45-60 d时间段内,Neu5Gc含量在降低。造成这种结果的原因可能是:1)大鼠本身的差异,在饲养过程中,这一组大鼠个体大小差异较大;2)随着饲养时间的延长,大鼠个体增大,而排泄物的量也随着增加,另有文献报道[15]游离态的Neu5Gc在体内快速随着体液排出,所以随着排泄物的增加而游离态的Neu5Gc排出量增加,导致结合态的Neu5Gc合成减少,所以导致大鼠肌肉组织中Neu5Gc的含量减少。Gen组,Neu5Gc的含量与对照组有相似的变化趋势,除了上述对照组存在的原因外,还有一种可能是Gen在动物体内发生生理活性时具有剂量依赖性[27, 32],随着饲养时间的延长,大鼠体内蓄积Gen的量增多,增强了对Neu5Gc合成的影响。
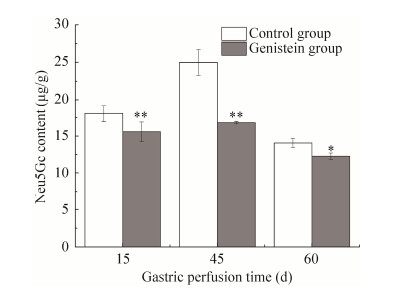
|
| 图 3 Gen对大鼠后腿肌肉组织中Neu5Gc含量的影响 Fig. 3 Effect of genistein on the content of Neu5Gc in rats hind legs muscle tissues. * P < 0.05; ** P < 0.01. |
| |
| Group | 15 d | 45 d | 60 d |
| Control group (µg/g) | 18.15±1.12 | 25.05±1.72 | 14.14±0.60 |
| Gen group (µg/g) | 16.87±0.15 | 15.65±1.32 | 12.34±0.45 |
| Neu5Gc content reduction (µg/g) | 2.50 | 8.18 | 1.80 |
由图 4可知,各时间段实验组肝脏组织中Neu5Gc的含量均低于对照组,各组在不同灌胃时间内Neu5Gc的含量如表 3所示。
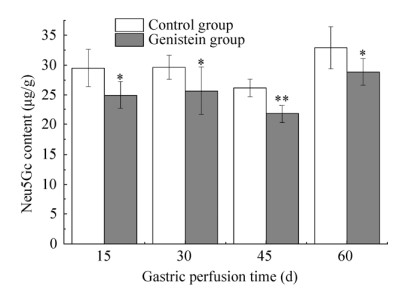
|
| 图 4 Gen对大鼠肝脏组织中Neu5Gc含量的影响 Fig. 4 Effect of genistein on the content of Neu5Gc in rat livers tissues. * P < 0.05; ** P < 0.01. |
| |
| Group | 15 d | 30 d | 45 d | 60 d |
| Control group (µg/g) | 29.60±3.11 | 29.71±1.20 | 26.27±1.48 | 32.99±3.52 |
| Gen group (µg/g) | 25.02±2.31 | 25.74±4.04 | 21.86±1.48 | 28.93±2.21 |
| Neu5Gc content reduction (µg/g) | 4.57 | 4.07 | 4.41 | 4.06 |
| Group | 15 d | 30 d | 45 d | 60 d |
| Control group (µg/g) | 212.50±20.03 | 113.56±11.24 | 149.47±13.83 | 153.53±12.25 |
| Gen group (µg/g) | 164.13±39.39 | 95.69±19.12 | 100.47±17.72 | 136.00±12.30 |
| Neu5Gc content reduction (µg/g) | 49.00 | 17.53 |
灌胃15 d时,Gen组中Neu5Gc的含量与对照组相比显著降低,Gen组中Neu5Gc含量降低了15.45%,经统计学分析,差异具有统计学意义(P < 0.05),Gen组中Neu5Gc的含量降低了4.57 µg/g,而这一降低值在生物学上实际意义不明显。灌胃30 d时,Gen组中Neu5Gc的含量与对照组相比显著降低,Gen组中Neu5Gc含量降低了13.35%,Gen组中Neu5Gc含量降低了4.07 µg/g,而这一降低值在生物学上的实际意义不明显。灌胃45 d时,Gen组Neu5Gc的含量与对照组相比显著降低,Gen组中Neu5Gc的含量降低了16.80%,经统计学分析差异具有高度的统计学意义(P < 0.01),Neu5Gc的含量降低了4.41 µg/g,而这一降低值在生物学上差异性实际意义不明显。灌胃60 d时,Gen组中Neu5Gc含量降低了12.30%,对照组中Neu5Gc的含量与Gen组中Neu5Gc的含量之间差异有高度统计学意义(P < 0.01),Neu5Gc的含量降低了4.06 µg/g,而这一降低值在生物学上的实际意义不明显。整个饲养阶段,在45 d时,对照组和Gen组中Neu5Gc的含量最低,Neu5Gc的含量降低值最高。然而,随着灌胃时间继续延长,Neu5Gc的含量开始升高,60 d时,对照组和Gen组中Neu5Gc的含量达到最高。
2.5 Gen对大鼠肾脏中Neu5Gc的影响由图 5可知,各时间段Gen组肾脏组织中Neu5Gc的含量均略低于对照组,但是15 d和30 d时经统计分析,差异不显著(P > 0.05),而灌胃45 d时,Gen组Neu5Gc的含量与对照组相比显著降低,Gen组中Neu5Gc的含量降低了32.78%,经统计学分析差异具有高度的统计学意义(P < 0.01),Gen组Neu5Gc的含量降低了49.00 µg/g,在生物学和统计学上具有高度的统计学意义。灌胃60 d时,Gen组Neu5Gc的含量与对照组相比显著降低,Gen组中Neu5Gc的含量降低了11.42%,经统计学分析差异具有高度的统计学意义(P < 0.01),Gen组Neu5Gc的含量降低了17.53 µg/g,在生物学和统计学都具有实际意义。这一结果与肌肉和肝脏组织存在一定的差异。在本实验中Gen对肌肉和肝脏组织中Neu5Gc的含量影响较肝脏明显,这可能与Gen在肾脏组织中存在的代谢机制与其在肌肉和肝脏组织中不同有关[29]。
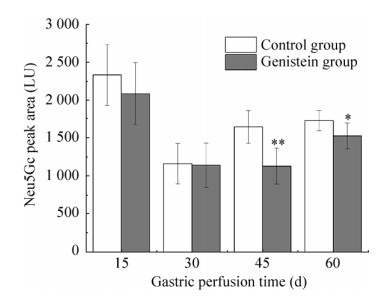
|
| 图 5 Gen对大鼠肾脏组织中Neu5Gc含量的影响 Fig. 5 Effect of genistein on the content of Neu5Gc in rat kidneys tissues. * P < 0.05; ** P < 0.01. |
| |
已知对接受体ST晶体结构解析得到的活性位点残基为:Gln108、Asn150、Met172、Asn173、Tyr194、Clu196、Phe212、Tyr233、Arg269、Thr272、Gly273、Gly293、Trp300、His302、Val318、His319[33-34]。
ST和Gen在配体1和配体2位置进行AutoDock vina对接后,打分最高的对接构象其结合能均为−35.564 kJ/mol,仅从结合能无法判定最佳结合位置,故继续进行相互作用残基分析和SYBYL-Surflex对接分析。
图 6A为Gen与ST在配体1位置完成Auto Dock vina对接后的二维相互作用模式图。由图可知,ST和Gen产生氢键的残基是Asn150、Ser151、Gly291、Glu324,共产生了4个氢键。产生疏水相互作用的残基为:His302、His301、Trp300、Ile274、Phe292、Ser271、Thr328、Ser325。图 6B为Gen与ST在配体1位置SYBYL-Surflex对接后相互作用示意图,可发现Gen和ST残基Asn173、Asn150、Gly293、Glu324、Ser271产生氢键,数目为5个。对比ST在配体1处的活性残基,Gen与其中的残基Asn150、Asn173、Gly273、Gly293产生了氢键作用,并且和残基Trp300、His302产生了疏水相互作用。综合以上分析,Gen在ST配体1处占据了ST中7个活性残基的6个,且和配体2处的活性残基没有相互作用,表明Gen在配体1处结合作用较强。

|
| 图 6 ST配体1与Gen对接模式图 Fig. 6 Binding mode of sialyltransferase ligand 1 with genistein by docking. (A) A two-dimensional analysis of genistein and ST after docking Auto Dock vina at the position of ligand 1. (B) A schematic diagram of the interaction between genistein and SYBYL-Surflex at the position of ligand 1. |
| |
图 7A为Gen与ST在配体2位置与Auto Dock vina对接后的二维相互作用模式图。在配体2处,ST和Gen产生氢键的残基是Asn150、Ser151、Glu324、Gly291,共产生了4个氢键。产生疏水相互作用的残基是His302、Trp300、Ser325、Phe292、Ile274、Thr328、Ser271共7个残基。图 7B为Gen与ST在配体2位置SYBYL-Surflex对接后相互作用示意图,由图可知仅和残基Tyr233、Thr272、Gly273产生氢键。综合以上分析,可知Gen在ST配体2处和ST活性残基Thr272、Tyr233产生氢键,而在配体1处不仅与ST活性残基Asn150、Gly273产生氢键,还和活性残基Trp300、His302产生疏水相互作用,因此Gen更易与ST配体1位点产生相互作用。

|
| 图 7 ST配体2与Gen对接模式图 Fig. 7 Binding mode of sialyltransferase ligand 2 with genistein by docking. (A) A two-dimensional interaction analysis diagram of genistein and ST after docking with Auto Dock vina at the position of ligand 2. (B) A schematic diagram of the interaction between genistein and SYBYL-Surflex at the position of ligand 2. |
| |
对Gen与ST在配体1处AutoDock vina对接后最佳复合物进行水环境下200 ns的分子动力学模拟,分子动力学模拟过程一般以均方根偏差RMSD来衡量体系的稳定性[34];从模拟结果可知,ST和ST-Genistein复合物的RMSD值在70 000- 130 000 ns时趋于平衡并收敛于0.25 nm附近,表明体系模拟过程中较为稳定。
图 8为动力学模拟平衡时ST和Gen结合模式图。氢键是维持底物和配体稳定结合的重要分子间作用力[34]。从图 8可以看出,动力学平衡后Gen主要和ST残基His319、Thr328、Gly293、Ser151产生4个氢键。对比Gen在配体1处与STAutoDock vina和SYBYL-Surflex对接揭示的可能相互作用残基结果,发现残基Ser151和Gly293与对接分析结果一致。这表明Ser151和Gly293在复合物体系稳定性中可能有重要贡献。
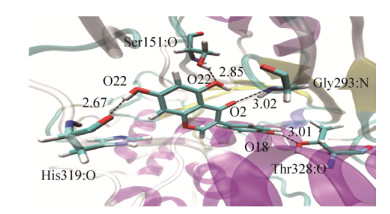
|
| 图 8 ST-Genistein动力学平衡后结合模式图 Fig. 8 ST-Genistein binding mode diagram at MD equilibrium position. |
| |
通过g_mmpbsa工具对动力学平衡后Gen与ST的结合能进行计算分解,结果显示:总结合能为−82.691 kJ/mol;对结合过程起促进作用的是范德华力(−155.167 kJ/mol)、静电作用力(−62.223 kJ/mol)和溶剂可积表面作用力(−14.502 kJ/mol);对结合过程起抑制作用的是极性溶剂化能(149.201 kJ/mol)。
图 9为ST-Genistein在动力学模拟相互结合过程中重要氨基酸残基的能量贡献。从图 9可知,ST中与Gen产生氢键作用的残基Asn150、Ser151和Glu324主要贡献了静电相互能,与Gen产生疏水作用的残基Phe292、His302、Thr328、His319、Trp300和Ile274主要贡献了极性作用力,这和对接分析的结果是一致的,表明分子间弱相互作用主导了Gen对ST活性抑制的机制。
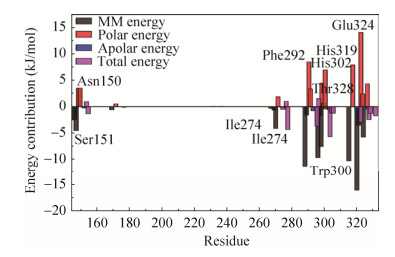
|
| 图 9 ST-Genistein结合位点残基能量分解图 Fig. 9 ST-Genistein binding residue energy decomposition map. |
| |
Neu5Gc在哺乳动物体内主要是以α2→8与寡糖连接和以α2→5与寡糖连接,形成结合态的Neu5Gc,极小部分以游离的形式存在[14]。而HPLC-FLD法能直接检测游离态的Neu5Gc,但是不能直接检测与糖蛋白和糖脂连接的结合态的Neu5Gc,因此,检测组织中总的Neu5Gc含量时,需将Neu5Gc从糖复合物上释放出来。结合先前的研究[1, 8],本研究选择2 mol/L的醋酸在80 ℃水浴3 h进行酸解,使各组织中结合态的Neu5Gc解离为游离态的Neu5Gc,然后用HPLC-FLD检测组织中游离态和结合态Neu5Gc总的含量。
实验结果表明,Gen对大鼠不同组织中Neu5Gc的含量具有不同的影响效果,并且不同灌胃时长的影响效果不一样;在肌肉组织中,灌胃时间段内,Gen组Neu5Gc含量与对照组相比降低极显著(P < 0.05),且灌胃30 d时,后腿肌肉组织中未检测到Neu5Gc,可能的原因是后腿肌肉中Neu5Gc量很少,达不到HPLC最低检测限,或是根本不存在Neu5Gc,但是进一步的依据还需后续大量的实验证实;而在肝脏组织中,整个灌胃时间内,Gen组Neu5Gc的含量显著低于对照组(P < 0.05),且在灌胃45 d时,Gen对肝脏组织的中Neu5Gc的含量影响最明显,Neu5Gc的含量降低了16.80%,体内Neu5Gc的含量也最低,若灌胃时间继续延长,Neu5Gc的含量开始升高,60 d时,对照组和Gen组中Neu5Gc的含量达到最高;在肾脏组织中,直到灌胃45 d时,Gen组中Neu5Gc的含量才显著低于对照组(P < 0.01),Gen组中Neu5Gc的含量降低了32.78%。Gen对不同部位Neu5Gc的含量影响效果不一样,这主要是因为:1)由于Gen具有雌激素活性和抗雌激素活性,当它与雌二醇受体结合时,动物的生理状态、给药途径、局部浓度以及内源性雌激素水平等均影响生物学功能[29, 35];2) Gen在哺乳动物中存在着不同的代谢机制;3)哺乳动物不同身体部位对Gen的吸收和代谢速率也不同[32, 35]。
3.2 Gen对Neu5Gc含量降低的机制探讨Neu5Gc的生物合成涉及CMAH和ST,其中ST是结合态Neu5Gc合成的关键酶[34],故抑制ST的活性是降低对促炎起主要贡献的结合态Neu5Gc含量的关键。
分子对接研究结果表明:Gen在大鼠体内占据ST活性位点His319、Ser151、Gly293、Thr328,并与其形成稳定的氢键,与残基His302、His301、Trp300、Ser271、Phe292、Thr328、Ser325、Ile274形成疏水相互作用,从而竞争性地降低了ST的活性,表明Gen在动物体内降低Neu5Gc的生物合成可以通过抑制ST的活性来实现。有研究报道[36-37]Gen可作为酪氨酸蛋白激酶抑制剂,通过去极化内皮超氧化物产生刺激物,抑制磷酸化的G蛋白Rac膜移位,达到抑制胞内还原型辅酶Ⅱ(NADPH)氧化酶的活性的目的,而Neu5Gc的合成需要还原型辅酶Ⅱ(NADPH)或NADH及Fe2+,所以使Neu5Gc的生物合成受到限制,从而达到降低大鼠体内肌肉和内脏组织中Neu5Gc含量的目的。
4 结论本文实验结果揭示了Gen具有降低大鼠后腿肌肉、肾脏组织、肝脏组织中Neu5Gc的含量的效果。在不同的灌胃时间和不同的组织器官中,Gen对Neu5Gc含量的影响存在差异。在肌肉组织中,灌胃30 d时抑制效果最好,未能检出Neu5Gc;在肾脏和肝脏组织中灌胃至45 d时抑制效果最好,其Neu5Gc的含量分别降低了31.04%和21.66%;且内脏组织中Neu5Gc的含量都高于肌肉组织中的含量。
分子对接结果反映Gen在生物体内抑制Neu5Gc生物合成的机制如下:4个氨基酸残基(His319、Ser151、Gly293、Thr328)与Gen形成稳定的氢键作用,8个氨基酸残基(His302、His301、Trp300、Ser271、Phe292、Thr328、Ser325、Ile274)与Gen形成疏水相互作用,占据了结合态Neu5Gc生成关键酶ST与底物结合的活性位点,所以Gen是ST的竞争性抑制剂,通过与ST底物作用间接地抑制了ST的活性,从而限制了游离态Neu5Gc向结合态Neu5Gc的转化,最终达到降低Neu5Gc生物合成的目的。本实验方法和所获数据对采用饲养方式降低红肉类动物中Neu5Gc的含量具有指导意义。
| [1] |
Liang ML, Zhu QJ, Liu CL, et al. Dissociation effect of different treatments on N-Glycolylneuraminic acid in beef.
Food Sci, 2018, 39(10): 28–34.
(in Chinese). 梁美莲, 朱秋劲, 刘春丽, 等. 不同加工处理方式对牛肉中Neu5Gc解离的影响. 食品科学, 2018, 39(10): 28-34. DOI:10.7506/spkx1002-6630-201810005 |
| [2] | Malykh YN, Schauer R, Shaw L. N-Glycolylneuraminic acid in human tumours. Biochimie, 2001, 83(7): 623–634. DOI: 10.1016/S0300-9084(01)01303-7 |
| [3] |
Fan XD, Li HW. Progress in studies on relationship between red meat intake, N-Glycolylneuraminic acid and cancer risk.
Food Sci, 2014, 35(15): 326–329.
(in Chinese). 范杏丹, 李红卫. 红肉、N-羟乙酰神经氨酸与癌症关系的研究进展. 食品科学, 2014, 35(15): 326-329. DOI:10.7506/spkx1002-6630-201415064 |
| [4] | Alisson-Silva F, Kawanishi K, Varki A. Human risk of diseases associated with red meat intake: analysis of current theories and proposed role for metabolic incorporation of a non-human sialic acid. Mol Aspects Med, 2016, 51: 16–30. DOI: 10.1016/j.mam.2016.07.002 |
| [5] | Zarogoulidis K, Eleftheriou P, Domvri K, et al. Determination of antibodies against the red meat derived antigen Neu5Gc in patients with lung cancer. Probable association with disease development and progress. Eur Respir J, 2015, 46(S59): PA533. |
| [6] | Samraj AN, Läubli H, Varki N, et al. Involvement of a non-human sialic acid in human cancer. Front Oncol, 2014, 4: 1–13. |
| [7] | Endo T, Seeberger PH, Hart GW, et al. Glycoscience: Biology and Medicine. Tokyo: Springer, 2015: 1-8. |
| [8] |
Wang MM. Establishment and optimization of method for sialic acid detection from animal-originated foods and the high-throughput method for sialylated conjunction extraction[D]. Nanjing: Nanjing Agricultural University, 2015 (in Chinese). 王毛毛.动物性食品中唾液酸测定及唾液酸复合物高通量提取方法研究[D].南京: 南京农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017040165.htm |
| [9] | Ji S, Wang F, Chen Y, et al. Developmental changes in the level of free and conjugated sialic acids, Neu5Ac, Neu5Gc and KDN in different organs of pig: a LC-MS/MS quantitative analyses. Glycoconj J, 2017, 34(1): 21–30. DOI: 10.1007/s10719-016-9724-9 |
| [10] | Iwasaki M, Inoue S, Kitajima K, et al. Novel oligosaccharide chains on polysialoglycoproteins isolated from rainbow trout eggs. A unique carbohydrate sequence with a sialidase-resistant sialyl group, DGalNAc.beta1 leads to 4(NeuGc2 leads to 3)DGalNAc. Biochemistry, 1984, 23(2): 305–310. |
| [11] | Muralikrishna G, Reuter G, Peter-Katalinić J, et al. Identification of a new ganglioside from the starfish Asterias rubens. Carbohydr Res, 1992, 236: 321–326. DOI: 10.1016/0008-6215(92)85025-U |
| [12] | Chou HH, Takematsu H, Diaz S, et al. A mutation in human CMP-sialic acid hydroxylase occurred after the Homo-pan divergence. Proc Natl Acad Sci USA, 1998, 95(20): 11751–11756. DOI: 10.1073/pnas.95.20.11751 |
| [13] | Hayakawa T, Aki I, Varki A, et al. Fixation of the human-specific CMP-N-acetylneuraminic acid hydroxylase pseudogene and implications of haplotype diversity for human evolution. Genetics, 2006, 172(2): 1139–1146. DOI: 10.1534/genetics.105.046995 |
| [14] |
Chen HJ, Ding C. Progress on Neu5Gc.
Prog Veterin Med, 2009, 30(4): 64–68.
(in Chinese). 陈鸿军, 丁铲. N-羟乙酰神经氨酸研究进展. 动物医学进展, 2009, 30(4): 64-68. DOI:10.3969/j.issn.1007-5038.2009.04.017 |
| [15] | Banda K, Gregg CJ, Chow R, et al. Metabolism of vertebrate amino sugars with N-glycolyl groups: mechanisms underlying gastrointestinal incorporation of the non-human sialic acid xeno-autoantigen N-glycolylneuraminic acid. J Biol Chem, 2012, 287(34): 28852–28864. DOI: 10.1074/jbc.M112.364182 |
| [16] | Glass CK, Olefsky JM. Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metab, 2012, 15(5): 635–645. DOI: 10.1016/j.cmet.2012.04.001 |
| [17] | Rocha VZ, Libby P. Obesity, inflammation, and atherosclerosis. Nat Rev Cardiol, 2009, 6(6): 399–409. DOI: 10.1038/nrcardio.2009.55 |
| [18] | Löfling JC, Paton AW, Varki NM, et al. A dietary non-human sialic acid may facilitate hemolytic-uremic syndrome. Kidney Int, 2009, 76(2): 140–144. DOI: 10.1038/ki.2009.131 |
| [19] | Serna IV A, Boedeker EC. Pathogenesis and treatment of Shiga toxin-producing Escherichia coli infections. Curr Opin Gastroenterol, 2008, 24(1): 38–47. DOI: 10.1097/MOG.0b013e3282f2dfb8 |
| [20] | Melton-Celsa A, Mohawk K, Teel L, et al. Pathogenesis of Shiga-toxin producing Escherichia coli. Curr Top Microbiol Immunol, 2012, 357: 67–103. |
| [21] |
Jiang Y, Fu H, Feng CY, et al. Effects of different treatments on N-glycolylneuraminic acid dissociation in red meat.
Meat Res, 2015, 29(12): 52–57.
(in Chinese). 蒋芸, 付浩, 冯昌雨, 等. 不同处理方式对红肉中N-羟乙酰神经氨酸解离的影响. 肉类研究, 2015, 29(12): 52-57. |
| [22] | Bardor M, Nguyen DH, Diaz S, et al. Mechanism of uptake and incorporation of the non-human sialic acid N-glycolylneuraminic acid into human cells. J Biol Chem, 2005, 280(6): 4228–4237. DOI: 10.1074/jbc.M412040200 |
| [23] |
Wang F, Zhang HL, Guang CE, et al. Mechanism of interaction between sialyltransferase and its inhibitory soyasaponin I.
J Food Sci Biotechnol, 2015, 34(4): 355–360.
(in Chinese). 王棐, 张海玲, 光翠娥, 等. 大豆皂苷Ⅰ抑制唾液酸转移酶的分子机理研究. 食品与生物技术学报, 2015, 34(4): 355-360. |
| [24] |
Sun MM, Wang P, Li ZY, et al. Research progress of soybean active ingredients.
Soyb Sci, 2018, 37(6): 975–983.
(in Chinese). 孙明明, 王萍, 李智媛, 等. 大豆活性成分研究进展. 大豆科学, 2018, 37(6): 975-983. |
| [25] | Akiyama T, Ishida J, Nakagawa S, et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. J Biol Chem, 1987, 262(12): 5592–5595. |
| [26] | McClain RM, Wolz E, Davidovich A, et al. Acute, subchronic and chronic safety studies with genistein in rats. Food Chem Toxicol, 2006, 44(1): 56–80. DOI: 10.1016/j.fct.2005.05.021 |
| [27] |
Sun JX, Zhang YZ, Gao F. The research progress on physiological function of genistein.
Food Res Dev, 2005, 26(3): 92–95.
(in Chinese). 孙洁心, 张永忠, 高锋. 染料木黄酮生理功能的研究进展. 食品研究与开发, 2005, 26(3): 92-95. DOI:10.3969/j.issn.1005-6521.2005.03.031 |
| [28] | Naaz A, Yellayi S, Zakroczymski MA, et al. The soy isoflavone genistein decreases adipose deposition in mice. Endocrinology, 2003, 144(8): 3315–3320. DOI: 10.1210/en.2003-0076 |
| [29] | Nielsen ILF, Williamson G. Review of the factors affecting bioavailability of soy isoflavones in humans. Nutr Cancer, 2007, 57(1): 1–10. DOI: 10.1080/01635580701267677 |
| [30] | Penza M, Montani C, Romani A, et al. Genistein affects adipose tissue deposition in a dose-dependent and gender-specific manner. Endocrinology, 2006, 147(12): 5740–5751. DOI: 10.1210/en.2006-0365 |
| [31] |
Zhou YZ, Zhu QJ, Chang R, et al. Effects of Kaempferol and Quercetin on the Synthesis of Neu5GcinRats and its Molecular Mechanism.
Chin J Biochem Mol Biol, 2019, 35(1): 101–111.
(in Chinese). 周樱子, 朱秋劲, 常瑞, 等. 山奈酚和槲皮素对大鼠体内Neu5Gc合成的影响及分子机制探究. 中国生物化学与分子生物学报, 2019, 35(1): 101-111. |
| [32] |
Xiu JC. Research progress of soy isoflavones in breed of pig, cow and sheep.
Sci Technol Innovat, 2018(11): 140–142.
(in Chinese). 修建成. 大豆异黄酮在猪牛羊养殖中的应用进展. 科学技术创新, 2018(11): 140-142. DOI:10.3969/j.issn.1673-1328.2018.11.088 |
| [33] | Rao FV, Rich JR, Rakić B, et al. Structural insight into mammalian sialyltransferases. Nat Struct Mol Biol, 2009, 16(11): 1186–1188. DOI: 10.1038/nsmb.1685 |
| [34] |
Duan YB, Yin Y, Meng FL, et al. Design, synthesis and biological evaluation of benzothiazoles as highly potent rock inhibitors through molecular docking and free energy calculations.
Chem J Chin Univ, 2017, 38(9): 1568–1577.
(in Chinese). 段永斌, 殷燕, 孟凡丽, 等. 基于分子对接和自由能计算的高活性苯并噻唑类ROCK抑制剂的设计、合成和生物学评价. 高等学校化学学报, 2017, 38(9): 1568-1577. |
| [35] |
Chen P, Li LK, Chen XL, et al. Effects of soy isoflavone on hepatic fatty acid metabolism of rats.
J Sichuan Agric Univ, 2018, 36(2): 267–272.
(in Chinese). 陈苹, 李立科, 陈晓林, 等. 大豆异黄酮对大鼠肝脏酸代谢的影响. 四川农业大学学报, 2018, 36(2): 267-272. |
| [36] | Sohn HY, Keller M, Gloe T, et al. The small G-protein Rac mediates depolarization-induced superoxide formation in human endothelial cells. J Biol Chem, 2000, 275(25): 18745–18750. DOI: 10.1074/jbc.M000026200 |
| [37] |
Zhu GC. Experimental study on genistein prevention and treatment of transplant arteriosclerosis in arotic transplants of rat. Huazhong Univ Sci and Technol, 2006 (in Chinese). 朱国超. Gen防治大鼠移植动脉硬化的实验研究华中科技大学, 2006. |
 2019, Vol. 35
2019, Vol. 35