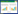中国科学院微生物研究所、中国微生物学会主办
文章信息
- 韦朝宝, 堵国成, 陈坚, 康振
- Wei Chaobao, Du Guocheng, Chen Jian, Kang Zhen
- 发酵透明质酸寡糖兽疫链球菌工程菌株的构建
- Construction of engineered Streptococcus zooepidemicus for the production of hyaluronic acid ligosaccharide
- 生物工程学报, 2019, 35(5): 805-815
- Chinese Journal of Biotechnology, 2019, 35(5): 805-815
- 10.13345/j.cjb.180405
-
文章历史
- Received: October 1, 2018
- Accepted: December 6, 2018
2. 江南大学 糖化学与生物技术教育部重点实验室 生物工程学院,江苏 无锡 214122
2. School of Biotechnology, Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China
透明质酸(Hyaluronic acid,简称HA),又名玻璃酸,是于1934年在牛眼玻璃体中检测到的线性大分子酸性黏多糖[1],其分子结构由(1-β-4) D-葡萄糖醛酸(1-β-3) N-乙酰基-D-氨基葡萄糖的双糖单位重复连接而成[2]。HA以其独特的分子结构和理化性质在机体内显示出多种重要的生理功能[3-6],广泛应用于医学、化妆品、食品等领域。HA的市场需求日益增大[7],2012年营销价值超过50亿美元,预计2019年将达到98.5亿美元[8]。
大分子HA传统生产方法是从动物组织(如公鸡鸡冠或脐带等)通过化学方法提取而得[9],受到原料少、工艺程序复杂、产品提取率极低、生产成本高等因素的影响,动物组织提取法已经逐渐被通过C族链球菌等毒性减弱菌株进行微生物合成所取代[10]。据文献报道,市场上存在的HA超过90%是来自C群的兽疫链球菌以及来自最近应用的枯草芽孢杆菌所生产[11]。研究表明HA的生物活性和使用效果由其相对分子量(Mw)直接决定[12]。大分子HA (分子量在100万Da以上)具有较好的弹性与保湿性,具有抑制炎性反应、润滑和药物缓释等功能[12],常用于眼科手术黏弹剂[13-14]、关节腔内注射治疗[15-16]、化妆品、皮肤烧伤愈合及术后防粘连等[12]。
相比于大分子量的HA,透明质酸寡糖(分子量低于1万Da)具有重要的生理活性与特殊生理功能,透明质酸寡糖能渗入真皮,具有轻微扩张毛细血管、增加血液循环、改善中间代谢、促进皮肤营养吸收作用;具有较强的消皱功能,可增加皮肤弹性,延缓皮肤衰老[12, 16]。透明质酸寡糖还具有促血管生成[17]、促创伤愈合[18]、免疫调节活性[19]和抗肿瘤活性等作用[20]。透明质酸寡糖在医药领域具有重要的应用前景[21]。当前制备透明质酸寡糖的方法主要集中于物理法[22-23]、化学法[24-25]、酶解法[26]。物理法操作过程简单,但效率较低,产品稳定性较差[22-23]。化学法引入化学试剂,造成污染,反应条件复杂,产生大量工业废水[24-25]。酶解法所使用的透明质酸酶昂贵、步骤繁琐,也不是大量合成透明质酸寡糖的高效方法[26]。近年来,不少研究者试图通过直接发酵生产低分子量HA[27-28]。随着合成生物学、代谢工程和分子生物学领域的重大进展,通过合理设计来获得增强生产目标代谢物的工程菌株已变得越来越普遍[29]。构建工程菌株实现从廉价碳源(例如蔗糖或葡萄糖)一步合成透明质酸寡糖是非常有前景和吸引力的选择。最近,Jin等合理设计枯草芽孢杆菌Bacillus subtilis 168的HA合成途径进行发酵合成透明质酸寡糖:一方面,将枯草芽孢杆菌HA合成途径中的各种基因组合过表达;另一方面,通过用TTG替换天然ATG起始密码子下调pfkA (6-磷酸果糖激酶,PfkA)的表达,然后将水蛭来源的透明质酸水解酶LHyal基因整合到基因组上,通过LHAase的RBS序列优化和N-端融合His标签策略,合理调节LHAase的表达,有效地生产特定分子量HA,最终获得一株在3 L发酵罐发酵100 h时HA累积至19.38 g/L的高产菌株[30]。重组枯草芽孢杆菌发酵合成HA的生产周期过长,生产强度较低,而商业生产HA最广泛使用的兽疫链球菌[3, 31],发酵周期短,生产强度较强。相比之下,兽疫链球菌是一个强大且具有高成本效益的HA生产平台[32]。本研究在兽疫链球菌WSH-24中过表达nisA启动子控制下透明质酸合酶HasA,优化在高葡萄糖浓度下的诱导剂乳酸链球菌素用量,然后进一步优化表达水蛭来源的透明质酸酶LHAase,使重组菌在合成HA的同时也能对HA进行降解,有效缓解发酵过程的溶氧问题,提高透明质酸寡糖产量。具体研究内容如图 1所示。

|
| 图 1 重组兽疫链球菌透明质酸寡糖合成路线示意图 Fig. 1 Schematic diagram of the synthesis route of hyaluronan oligosaccharide in recombinant Streptococcus zooepidemicus. |
| |
所用菌株和质粒详见表 1。
| Name | Description | Source |
| Plasmids | ||
| pNZ8148 | Cmr, nisin promoter, Streptococcus zooepidemicus expression vector | Laboratory preservation |
| pAX01-hasA | Ampr, Emr, Pxyla-hasA | [30] |
| pMA05-sp-H6LHyal | pMA05 derivate, sp (yweA)-H6LHyal | [30] |
| pNZ8148-hasA | pNZ8148 derivate, Pnis-hasA | This study |
| pNZ8148-H6LHyal | pNZ8148 derivate, Pnis-H6LHyal | This study |
| pNZ8148-H6LHyal-hasA | pNZ8148 derivate, Pnis-H6LHyal-hasA | This study |
| pNZ8148-hasA-H6LHyal | pNZ8148 derivate, Pnis-hasA-H6LHyal | This study |
| Strains | ||
| Streptococcus zooepidemicus WSH-24 | Industrial production strain of Streptococcus zooepidemicus | Laboratory preservation |
| E. coli MC1061 | The E. coli host of the NICE expression system | Laboratory preservation |
| SZha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-hasA plasmid | This study |
| SZh6 | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal plasmid | This study |
| SZh6(1)ha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal-hasA plasmid | This study |
| SZhah6 | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-hasA-H6LHyal plasmid | This study |
| SZpnz | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ814 plasmid | This study |
| SZh6(2)ha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal-hasA plasmid, Optimize RBS sequence of LHAasA | This study |
| SZh6(3)ha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal-hasA plasmid, Optimize RBS sequence of LHAasA | This study |
| SZh6(4)ha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal-hasA plasmid, Optimize RBS sequence of LHAasA | This study |
| SZh6(5)ha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal-hasA plasmid, Optimize RBS sequence of LHAasA | This study |
| SZh6ha | Streptococcus zooepidemicus WSH-24 derivative, containing the pNZ8148-H6LHyal-hasA plasmid, Optimize RBS sequence of LHAasA | This study |
PCR引物(表 2)由生工生物工程(上海)股份有限公司合成;Primer star DNA聚合酶和Taq DNA聚合酶购自宝赛生物(杭州)有限公司;DNA marker购自TaKaRa (大连);质粒小量抽提试剂盒、胶回收试剂盒、氯霉素和SDS-PAGE凝胶制备试剂盒购自生工生物工程(上海)股份有限公司;乳酸链球菌素购自Sigma-Aldrich,考马斯亮蓝染色液购自碧云天生物技术研究所;其他化学试剂购自国药的分析纯。
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| hasA-F | AAATTATAAGGAGGCACTCACTGCAGATGAGAACATTAAAAAACCTCATAACTG | 54 |
| hasA-R | CTTGAGCTCTCTAGAACTAGTGGTACCTTATAATAATTTTTTACGTGTTCCCC | 53 |
| H6(1)LHyal-F | AGGAACTACAAAATAAATTATAAGAGAGGAATGTACACATGCACCACCACCACCACCAC | 59 |
| H6(1)LHyal-R | CTTGAGCTCTCTAGAACTAGTGGTACCTTATTTTTTGCAGGCTTCAACGTTAGC | 54 |
| PNZ-F | GGTACCACTAGTTCTAGAGAGCTCAAG | 27 |
| PNZ-R | CTGCAGTGAGTGCCTCCTTATAATTT | 26 |
| H6(1)-ha-F | CAAAAAATAAGGTACCAAGGAGGCACTCACCATGAGAACATTAAAAAACCTCATAACTG | 59 |
| H6(1)-ha-R | GTGCCTCCTTGGTACCTTATTTTTTGCAGGCTTCAACGTTAGC | 43 |
| Ha-h6(1)-F | AAAAAATTATTATAAGGTACCAAGAGAGGAATGTACACATGCACCACCACCACCACCAC | 59 |
| Ha-h6(1)-R | CCTCCTTGGTACCTTATAATAATTTTTTACGTGTTCCCC | 39 |
| H6(2)-ha-F | AGGAACTACAAAATAAATTATAAGAAGAGAGTGGTACCATGCACCACCACCACCACCAC | 59 |
| H6(2)-ha-R | GTGGTGGTGGTGGTGGTGCATGGTACCACTCTCTTCTTATAATTTATTTTGTAGTTCCT | 59 |
| H6(3)-ha-F | AGGAACTACAAAATAAATTATAGGAGGAAAGTGTTACCATGCACCACCACCACCACCAC | 59 |
| H6(3)-ha-R | GTGGTGGTGGTGGTGGTGCATGGTAACACTTTCCTCCTATAATTTATTTTGTAGTTCCT | 59 |
| H6(4)-ha-F | AGGAACTACAAAATAAATTATAGGAAGAGAGTGTACACATGCACCACCACCACCACCAC | 59 |
| H6(4)-ha-R | GTGGTGGTGGTGGTGGTGCATGTGTACACTCTCTTCCTATAATTTATTTTGTAGTTCCT | 59 |
| H6(5)-ha-F | AGGAACTACAAAATAAATTATAAGAAGGAGATGGTACCATGCACCACCACCACCACCAC | 59 |
| H6(5)-ha-R | GTGGTGGTGGTGGTGGTGCATGGTACCATCTCCTTCTTATAATTTATTTTGTAGTTCCT | 59 |
| H6-ha-F | AGGAACTACAAAATAAATTATAAGGAGGCACTCACTGCATGCACCACCACCACCACCAC | 59 |
| H6-ha-R | GTGGTGGTGGTGGTGGTGCATGCAGTGAGTGCCTCCTTATAATTTATTTTGTAGTTCCT | 59 |
| Note: the underlined nucleotide sequence is the RBS sequence. | ||
LB培养基(g/L):蛋白胨10.0,酵母粉5.0,氯化钠10.0;固体LB培养基需添加20.0 g/L琼脂粉。
THY培养基(g/L):牛肉浸粉10.0,胰蛋白胨20.0,葡萄糖2.0,碳酸氢钠2.0,氯化钠2.0,磷酸氢二钠0.4,酵母粉2.0,pH 7.2。
斜面培养基(g/L):心脑浸粉(BHI) 37.0,葡萄糖10.0,酵母粉10.0,琼脂粉20.0,pH 7.2。
种子培养基(g/L):葡萄糖(蔗糖) 20.0,酵母粉20.0,七水合硫酸镁2.0,四水合硫酸锰0.1,磷酸二氢钾2.0,碳酸钙20,微量元素1 mL/L,缓冲液40 mL/L,pH 7.2。
微量元素(g/L):氯化钙2.0,氯化锌0.046,五水合硫酸铜0.019。
缓冲液(g/L):磷酸氢二钠36.76,磷酸二氢钠15.98,碳酸氢钠12.5。
发酵培养基(g/L):酵母粉20,磷酸氢二钠6.2,硫酸钾1.3,葡萄糖(蔗糖) 80,七水合硫酸镁2.0,微量元素1 mL/L,谷氨酰胺2.0,pH 7.2。
1.2.2 培养方法种子培养:将斜面种子接种至装有50 mL种子培养基的500 mL三角瓶中,根据需要加入终浓度为5 μg/mL氯霉素,37 ℃、200 r/min培养14–16 h。
摇瓶发酵:将种子培养液按10%的接种量转接至装有50 mL发酵培养基的500 mL三角瓶中,根据需要加入终浓度为5 μg/mL氯霉素和40 ng/mL乳酸链球菌素,37 ℃、200 r/min培养24 h。
3 L发酵罐发酵:按10%的接种量将种子液接入含1.35 L发酵培养基的3 L发酵罐中,根据需要加入终浓度为5 μg/mL氯霉素和40 ng/mL乳酸链球菌素,搅拌转速300 r/min,通气量1.0 v/(v·min),温度37 ℃,使用5 mol/L NaOH溶液进行调节以控制pH为7.0,在8 h期间开始流加速葡萄糖保持5 g/(L·h)的流速至发酵结束。
1.3 相关方法 1.3.1 制备兽疫链球菌感受态细胞将优良单菌落接入5 mL THY液体培养基中,200 r/min、37 ℃下培养10−14 h。按1%的接种量接入新鲜的40 mL的THY液体培养基中,37 ℃下培养至OD530为0.4左右时加入无菌的LHAase溶液10 mL (酶活5×105 U/mL),继续培养约30 min后将其冰浴10 min。6 000 r/min、4 ℃离心10 min,收集菌体,加入提前冰浴的0.5 mol/L的蔗糖溶液20 mL重悬菌体。重悬菌体和离心重复操作2次,加入500 μL 15%甘油的0.5 mol/L的蔗糖溶液,重悬菌体后进行分装。
1.3.2 兽疫链球菌的电转化及重组子的鉴定将5 500 ng质粒加入感受态细胞中,混匀,冰浴10 min后加入预冷的电转杯里进行电激,电压为2 500 V (2 mm电转杯)。电激后将900 μL冷THY培养液加入电转杯中,混匀后吸出置于离心管中,冰浴30 min。37 ℃静置培养1.5−2.5 h后涂布于带有氯霉素抗性的THY板。37 ℃培养24−48 h,挑选转化子提取质粒,进行PCR验证及测序鉴定。
1.3.3 菌体生长密度测定取1 mL发酵液加入适量稀HCl溶解CaCO3,10 000 r/min离心5 min。收集菌体,用蒸馏水重悬,适当稀释菌液后测定600 nm波长下的吸光值(用蒸馏水调零)。
1.3.4 透明质酸寡糖样品的分离纯化取5 mL发酵液,加入终浓度为0.1% (W/V)的十二烷基硫酸钠(SDS),颠倒混匀后室温下静置10 min。10 000 r/min离心10 min,将收集的上清液加入TCA调pH值至4.5,75 ℃水浴20 min后,10 000 r/min离心10 min,再将收集的上清液用NaOH调pH值至7.0后加入7倍体积的无水乙醇,颠倒混匀后置于4 ℃静置6 h,使HA沉淀。10 000 r/min离心5 min,除去上清;加入与发酵液等体积的去离子水,充分溶解,将醇沉和溶解操作重复2遍。分离纯化得到的样品将用于测定HA的浓度和分子量。
1.3.5 透明质酸寡糖含量测定采用Bitter-Muir氏法定量测定HA含量[30]。
1.3.6 透明质酸寡糖的分子量采用高效液相色谱-体积排阻色谱(HPSEC- MALLS-RI)测定透明质酸寡糖的质量平均分子量(Mw)、数量平均分子量(Mn)和多分散性系数Ip (Ip=Mw/Mn)[30]。
1.3.7 水蛭透明质酸酶活力的测定方法水蛭透明质酸酶的活力单位定义为:在pH 5.5和38 ℃下,每小时从透明质酸中释放1 μg葡萄糖还原当量的还原糖所需的酶量[30]。LHAase的活力测定方法采用DNS法[30]。
1.3.8 LHAase的纯化及质谱检测LHAase水解液中的HA寡糖LHAase的N端带有6个His标签,纯化LHAase蛋白时使用Ni-NTA亲和柱富集高度浓缩发酵液上清的H6LHyal[33]。以灭活的H6LHyal纯化液为对照,在38 ℃、pH 5.5的柠檬酸盐缓冲液中,用H6LHyal纯化液水解上述HA纯化样品15 h,水解液用含有ESI离子源C18柱(150 mm×2.0 mm;Shimadzu,Kyoto,Japan)的质谱仪检测[33]。流动相为水和乙腈,恒定流速0.2 mL/min。质谱分析以负离子模式进行,扫描范围为300−1 500 (m/z),10 s/scan。
2 结果与分析 2.1 表达系统与重组兽疫链球菌的构建以质粒pAX01-hasA和pMA05-sp-H6LHyal为模板,分别以引物hasA-F/hasA-R、H6(1)LHyal- F/H6(1)LHyal-R进行PCR扩增,将得到hasA、H6LHyal的线性DNA片段分别与骨架pNZ8148 (以质粒pNZ8148为模板,使用引物PNZ-F/PNZ-R扩增)进行组装获得重组质粒pNZ8148-hasA和pNZ8148-H6LHyal。以引物H6(1)-ha-F/hasA-R对质粒pAX01-hasA进行PCR扩增,将得到的hasA线性DNA片段和骨架pNZ8148-H6LHyal (以质粒pNZ8148-H6LHyal为模板,使用引物PNZ-F/H6(1)- ha-R扩增)进行组装获得重组质粒pNZ8148- H6LHyal-hasA。以引物Ha-h6(1)-F/hasA-R对质粒pMA05-sp-H6LHyal进行PCR扩增,将得到的H6LHyal线性DNA片段与骨架pNZ8148-hasA (以质粒pNZ8148-hasA为模板,使用引物PNZ-F/Ha- h6(1)-R扩增)进行组装获得重组质粒pNZ8148- hasA-H6LHyal。将质粒pNZ8148、pNZ8148-hasA、pNZ8148-H6LHyal、pNZ8148-H6LHyal-hasA、pNZ8148-hasA-H6LHyal分别电转入兽疫链球菌感受态细胞,得到重组兽疫链球菌SZpnz、SZha、SZh6、SZh6(1)ha、SZhah6 (重组菌的菌落PCR验证见图 2)。H6LHyal RBS序列优化以重组质粒pNZ8148-H6LHyal-hasA为模板,使用引物H6(2)-ha-F/H6(2)-ha-R、H6(3)-ha-F/H6(3)-ha-R、H6(4)-ha-F/H6(4)-ha-R、H6(5)-ha-F/H6(5)-ha-R、H6-ha-F/H6-ha-R分别进行全质粒PCR,用Dpn1消化后获得5个H6LHyal基因RBS强度不同的重组质粒pNZ8148-H6LHyal-hasA,再将这5个重组质粒电转入兽疫链球菌感受态细胞,得到重组兽疫链球菌SZh6(2)ha、SZh6(3)ha、SZh6(4)ha、SZh6(5)ha和SZh6ha。
|
| 图 2 重组菌菌落PCR验证 Fig. 2 Colony PCR validation of recombinant strains. N: negative control; 1, 2: positive clone PCR amplification band (The size of hasA DNA fragment: 1 254 bp; the size of H6LHyal DNA fragment: 1 491 bp). (A) Recombinant strain SZha. (B) Recombinant strain SZh6. (C) Recombinant strain SZh6ha. (D) Recombinant strain SZhah6. |
| |
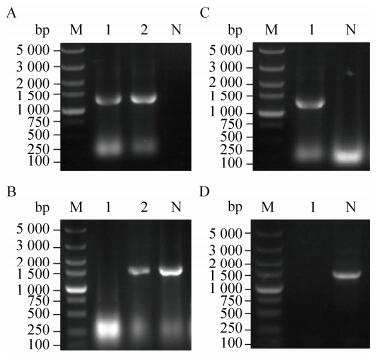
将重组兽疫链球菌SZha在不同乳酸链球菌素终浓度下摇瓶发酵,结果见图 3,在乳酸链球菌素终浓度小于40 ng/mL时,乳酸链球菌素诱导过表达HasA使HA产量提高,同时乳酸链球菌素没有对菌体生长带来明显的负面影响,菌体密度与对照(乳酸链球菌素终浓度为0)比相差不大。乳酸链球菌素终浓度大于40 ng/mL时,导致菌体密度与HA产量都减少了,这可能是高乳酸链球菌素浓度对细胞有毒性和对细菌生长有抑制作用的结果。当乳酸链球菌素终浓度为40 ng/mL时,HA产量达到最大,比对照提高64.9%。说明在适合乳酸链球菌素浓度下过表达HasA能显著提高HA产量。HasA利用两种糖底物(UDP-GlcA和UDP-GlcNAc)合成HA,是HA生产中的关键酶[3]。Chen等在兽疫链球菌中过表达HA合成操纵子的5个基因探究前体物浓度对HA产量及分子量影响,其研究结果也表明HasA的过表达导致HA产量的显著增加和分子量的显著降低[34]。
|
| 图 3 乳酸链球菌素添加量对菌体密度、透明质酸产量的影响 Fig. 3 Effects of nisin addition on strain density and hyaluronan production. |
| |
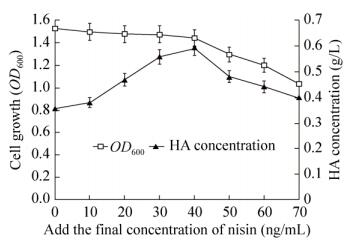
水蛭型透明质酸酶(LHAase;EC.3.2.1.36)专一作用于HA的β-1, 3糖苷键,产生还原端为葡萄糖醛酸的四糖或者己糖。通过DNS法检测LHyal水解HA产生的还原糖含量可以计算出它的酶活。借鉴于N-端融合6个His标签对LHyal基因在枯草芽孢杆菌168中的分泌表达有显著影响的成功案例[30],在LHyal的N-端也融合了6个His标签。以SZpnz为对照菌株,将重组菌SZh6、SZh6(1)ha和SZhah6进行摇瓶发酵。为避免培养基中还原糖的存在对实验结果的负面影响,将发酵培养基中的碳源由葡萄糖换成蔗糖,发酵24 h时将发酵液上清稀释适当倍数与DNS试剂反应,结果见图 4A,直观反映了SZh6、SZhah6、SZh6(1)ha发酵液上清有还原糖生产,证明了H6LHyal在兽疫链球菌中能分泌表达,并能在体外催化透明质酸水解而产生还原糖。酶活测定结果如图 4B所示,SZh6的酶活仅为5 859.3 U/mL,SZhah6、SZh6(1)ha的酶活比SZh6分别高9%、37.96%。SDS-PAGE分析重组菌的LHAase表达情况,结果见图 4C。可以看出重组菌SZh6(1)ha表达的LHAase含量高一些,这可能是在兽疫链球菌中H6LHyal的C端串联表达HasA更有助于LHAase表达的原因。SDS-PAGE蛋白电泳进一步分析纯化的LHAase,结果见图 4D,在分子量为58 kDa处有清晰条带,进一步证明了H6LHyal分泌表达。质谱检测LHAase纯化液水解HA纯化样品的结果见图 4E和图 4F,检测到HA2、HA4、HA6、HA10,进一步证明了分泌表达的H6LHyal存在酶活。H6LHyal的表达量比较低,需进一步优化。核糖体结合位点(RBS)是蛋白表达的重要调控元件之一,RBS强度显著影响蛋白的表达水平[30]。根据金鹏等[30]具有正结果的RBS序列及表达载体pNZ8148、pNZ8149、pNZ8150所用的RBS序列进行H6LHyal RBS序列优化,结果见表 2 (带有下划线的核苷酸序列为RBS序列)。优化H6LHyal RBS序列的结果如图 4G所示。SZh6ha的酶活高达11 113.2 U/mL,比SZh6的酶活提高了89.67%。
|
| 图 4 LHAase的分泌表达及优化 Fig. 4 Secretory expression and optimization of LHAase. (A) The LHAase activity of the recombinant strain by DNS method in the fermentation broth. (B) Recombinant LHAase activity detection. (C) SDS-PAGE analysis of LHAase by recombinant strains. 1: SZpnz; 2: SZh6; 3: SZh6(1)ha; 4: SZhah6; M: protein marker. (D) SDS-PAGE analysis of purified H6LHyal. 1: SZh6(1)ha; 2: SZh6; 3: SZhah6. (E) Mass spectrometric analysis of H6LHyal (inactivated) hydrolysate. (F) Mass spectrometry analysis of H6LHyal hydrolysate. {The anion m/z of 396.11 [M-H]-(HA2), 775.22 [M-H]-(HA4), 1154.33 [M-H]-(HA6), 576.66 [M-H]2-(HA6), 766.22 [M-H]2-(HA8)和955.77 [M-H]2-(HA10)}. (G) The enzyme activity analysis of LHAase by RBS sequence optimization. |
| |
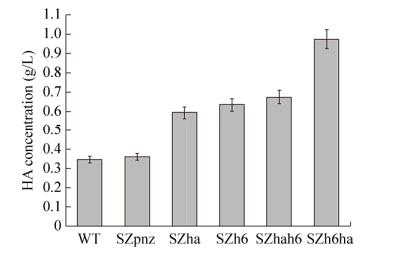
将兽疫链球菌重组菌株SZpnz、SZha、SZh6、SZhah6、SZh6ha与野生菌株WT进行摇瓶发酵,第24小时的HA产量结果如图 5所示,带有空载体pNZ8148的重组菌SZpnz的HA产量略微高于野生菌。其原因是外源质粒带来的应激效应有利于HA产量提高,但不显著[34]。相对于野生菌株,重组菌SZha、SZh6的HA产量明显提高,分别提高了72.0%和83.4%。hasA的过表达,导致更多透明质酸合酶竞争前体UDP-GlcUA和UDP-GlcNAcHA,使HA分子量显著降低,进而导致HA产量的显著增加[34]。摇瓶发酵过程中,随着发酵液粘稠度上升导致溶氧降低,严重影响细胞的正常代谢和HA产量的提高[30],而LHAase的分泌表达使得重组菌在产HA的同时也能对HA进行降解,有效缓解发酵过程的溶氧问题,有益于HA产量提高。相比于野生菌,重组菌SZhah6、SZh6ha的HA产量分别提高了94.8%和182.0%。由于摇瓶发酵不能对pH值、溶氧、碳源浓度等发酵条件进行有效控制,导致菌体密度低,HA产量低。因此,根据摇瓶发酵的结果,以野生菌株作为对照,将重组菌SZh6ha在3 L发酵罐中进行放大发酵,结果如图 6所示。重组菌SZh6ha培养12 h就开始进入稳定期,野生菌培养16 h才进入稳定期,重组菌的菌体浓度一直低于野生菌,这可能与重组菌表达LHAase和过表达HasA对细胞生长造成压力有关。发酵培养前8 h,HA积累量少,生长对数期的中后期,HA开始快速积累,细菌生长的稳定期HA依然在积累。发酵24 h时重组菌SZh6ha的HA积累量约为7.06 g/L,是摇瓶发酵水平的7.25倍,相比于野生菌的3 L发酵罐水平提高了112.4%;生产强度为294.2 mg/(L·h),比已报道的重组枯草芽孢杆菌[30]的生产强度大;HA Mw约为7.22×104 Da (表 3),相对于野生菌的HA Mw,有了大幅度的下降;Ip值约为1.31,说明重组菌SZh6ha在发酵时较好地保持了相对集中的分子量。在兽疫链球菌中表达LHAase和过表达HasA能提高碳通量流向透明质酸合成途径,最终达到提高透明质酸寡糖产量的目的,在透明质酸寡糖生产方面具有明显的优势。
|
| 图 5 摇瓶培养比较分析重组菌株和野生兽疫链球菌株 Fig. 5 The comparison of shake flask cultures of recombinant Streptococcus zooepidemicus and the wild-type strain. |
| |
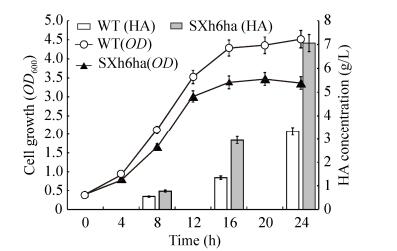
|
| 图 6 3 L发酵罐分批发酵比较分析重组菌株和野生兽疫链球菌株 Fig. 6 The comparison of batch fermentation of recombinant Streptococcus zooepidemicus and the wild-type strain. |
| |
| MW (×104 Da) | Mn (×104 Da) | Ip | |
| WT (shake flask) | 174.91±1.25 | 80.46±0.94 | 2.17±0.06 |
| SZh6ha (shake flask) | 7.52±0.94 | 3.83±0.91 | 1.97±0.08 |
| WT (3 L fermentor) | 163.48±1.17 | 94.27±0.83 | 1.73±0.10 |
| SZh6ha (3 L fermentor) | 7.22±1.24 | 5.50±0.65 | 1.31±0.11 |
透明质酸寡糖在医药领域具有重要的应用前景,构建重组兽疫链球菌发酵合成透明质酸寡糖具有重要意义。通过在兽疫链球菌WSH-24中过表达nisA启动子控制下的HasA,并优化在80 g/L葡萄糖浓度下诱导剂乳酸链球菌素的用量,确定乳酸链球菌素终浓度为40 ng/mL时,乳酸链球菌素对细胞生长副作用较低,同时HA积累量达到最大,比对照提高64.9%。通过LHAase的N-端融合6个His标签和RBS序列优化策略,实现LHAase在兽疫链球菌中分泌表达,重组菌的LHAase最高酶活高达11 113.2 U/mL。通过同时过表达HasA和优化表达水蛭来源的LHAase,解决了发酵过程的溶氧问题并实现了透明质酸寡糖的高效发酵合成。重组菌株摇瓶发酵24 h,HA积累至0.97 g/L,比野生菌提高了182.0%。在3 L发酵罐中发酵24 h,HA积累至7.06 g/L,比野生菌的罐上水平提高了112.4%;生产强度为294.2 mg/(L·h),与已报道的重组枯草芽孢杆菌相比[30],本研究所构建的重组兽疫链球菌具有更大的生产强度。本研究为透明质酸寡糖生物合成提供了新策略,在HA寡糖生产方面具有广阔的应用前景。
| [1] | Meyer K, Palmer JW. The polysaccharide of the vitreous humor. J Biol Chem, 1934, 107(3): 629–634. |
| [2] | Weissmann B, Meyer K. The structure of hyalobiuronic acid and of hyaluronic acid from umbilical cord. J Am Chem Soc, 1954, 76(7): 1753–1757. DOI: 10.1021/ja01636a010 |
| [3] | Kang Z, Zhou ZX, Wang Y, et al. Bio-based strategies for producing glycosaminoglycans and their oligosaccharides. Trends Biotechnol, 2018, 36(8): 806–818. DOI: 10.1016/j.tibtech.2018.03.010 |
| [4] | Cheng FY, Gong QY, Yu HM, et al. High-titer biosynthesis of hyaluronic acid by recombinant Corynebacterium glutamicum. Biotechnol J, 2016, 11(4): 574–584. DOI: 10.1002/biot.201500404 |
| [5] | Knudson CB, Knudson W. Hyaluronan-binding proteins in development, tissue homeostasis, and disease. FASEB J, 1993, 7(13): 1233–1241. DOI: 10.1096/fasebj.7.13.7691670 |
| [6] | Toole BP. Proteoglycans and hyaluronan in morphogenesis and differentiation//Hay ED, Ed. Cell Biology of Extracellular Matrix. 2nd ed. Boston, MA: Springer, 1991: 305-341. |
| [7] | Zakeri A, Rasaee MJ, Pourzardosht N. Enhanced hyluronic acid production in Streptococcus Zooepidemicus by over expressing HasA and molecular weight control with Niscin and glucose. Biotechnol Rep, 2017, 16: 65–70. DOI: 10.1016/j.btre.2017.02.007 |
| [8] | De Oliveira JD, Carvalho LS, Gomes AMV, et al. Genetic basis for hyper production of hyaluronic acid in natural and engineered microorganisms. Microb Cell Fact, 2016, 15(1): 119. DOI: 10.1186/s12934-016-0517-4 |
| [9] | Yamada T, Kawasaki T. Microbial synthesis of hyaluronan and chitin: new approaches. J Biosci Bioeng, 2005, 99(6): 521–528. DOI: 10.1263/jbb.99.521 |
| [10] | Liu L, Liu YF, Li JH, et al. Microbial production of hyaluronic acid: current state, challenges, and perspectives. Microb Cell Fact, 2011, 10(1): 99. DOI: 10.1186/1475-2859-10-99 |
| [11] | Cimini D, Iacono ID, Carlino E, et al. Engineering S. equi subsp. zooepidemicus towards concurrent production of hyaluronic acid and chondroitin biopolymers of biomedical interest. AMB Express, 2017, 7(1): 61. DOI: 10.1186/s13568-017-0364-7 |
| [12] | Stern R, Asari AA, Sugahara KN. Hyaluronan fragments: an information-rich system. Eur J Cell Biol, 2006, 85(8): 699–715. DOI: 10.1016/j.ejcb.2006.05.009 |
| [13] | Johnson ME, Murphy PJ, Boulton M. Effectiveness of sodium hyaluronate eyedrops in the treatment of dry eye. Graef's Arch Clin Exp Ophthalmol, 2006, 244(1): 109–112. DOI: 10.1007/s00417-005-0028-1 |
| [14] | Sand BB, Marner K, Norn MS. Sodium hyaluronate in the treatment of keratoconjunctivitis sicca. A double masked clinical trial. Acta Ophthalmol, 1989, 67(2): 181–183. |
| [15] | Patel, Sanjay R, Malhotra, et al. The mechanism of action for hyaluronic acid treatment in the osteoarthritic knee: a systematic review. Bmc Musculoskel Dis, 2015, 16(1): 321. DOI: 10.1186/s12891-015-0775-z |
| [16] | Chen LH, Xue JF, Zheng ZY, et al. Hyaluronic acid, an efficient biomacromolecule for treatment of inflammatory skin and joint diseases: a review of recent developments and critical appraisal of preclinical and clinical investigations. Int J Biol Macromo, 2018: 572–584. |
| [17] | West DC, Kumar S. The effect of hyaluronate and its oligosaccharides on endothelial cell proliferation and monolayer integrity. Exp Cell Res, 1989, 183(1): 179–196. DOI: 10.1016/0014-4827(89)90428-X |
| [18] | Trabucchi E, Pallotta S, Morini M, et al. Low molecular weight hyaluronic acid prevents oxygen free radical damage to granulation tissue during wound healing. Int J Tissue React, 2002, 24(2): 65–71. |
| [19] | Termeer C, Sleeman JP, Simon JC. Hyaluronan - magic glue for the regulation of the immune response?. Trends Immunol, 2003, 24(3): 112–114. DOI: 10.1016/S1471-4906(03)00029-2 |
| [20] | Benitez A, Yates TJ, Lopez LE, et al. Targeting hyaluronidase for cancer therapy: antitumor activity of sulfated hyaluronic acid in prostate cancer cells. Cancer Res, 2011, 71(12): 4085–4095. DOI: 10.1158/0008-5472.CAN-10-4610 |
| [21] | Karbownik MS, Nowak JZ. Hyaluronan: towards novel anti-cancer therapeutics. Pharmacol Rep, 2013, 65(5): 1056–1074. DOI: 10.1016/S1734-1140(13)71465-8 |
| [22] | Miyazaki T, Yomota C, Okada S. Ultrasonic depolymerization of hyaluronic acid. Polym Degrad Stab, 2001, 74(1): 77–85. DOI: 10.1016/S0141-3910(01)00104-5 |
| [23] | Reháková M, Bakoš D, Soldán M, et al. Depolymerization reactions of hyaluronic acid in solution. Int J Biol Macromol, 1994, 16(3): 121–124. DOI: 10.1016/0141-8130(94)90037-X |
| [24] | Tokita Y, Okamoto A. Hydrolytic degradation of hyaluronic acid. Polym Degrad Stab, 1995, 48(2): 269–273. DOI: 10.1016/0141-3910(95)00041-J |
| [25] | Hawkins CL, Davies MJ. Degradation of hyaluronic acid, poly- and mono-saccharides, and model compounds by hypochlorite: evidence for radical intermediates and fragmentation. Free Radic Biol Med, 1998, 24(9): 1396–1410. DOI: 10.1016/S0891-5849(98)00009-4 |
| [26] | Tawada A, Masa T, Oonuki Y, et al. Large-scale preparation, purification, and characterization of hyaluronan oligosaccharides from 4-mers to 52-mers. Glycobiology, 2002, 12(7): 421–426. DOI: 10.1093/glycob/cwf048 |
| [27] | Armstrong DC, Johns MR. Culture conditions affect the molecular weight properties of hyaluronic acid produced by Streptococcus zooepidemicus. Appl Environ Microbiol, 1997, 63(7): 2759–2764. |
| [28] | Pummill PE, DeAngelis PL. Alteration of polysaccharide size distribution of a vertebrate hyaluronan synthase by mutation. J Biol Chem, 2003, 278(22): 19808–19814. DOI: 10.1074/jbc.M301097200 |
| [29] | Keasling JD. Manufacturing molecules through metabolic engineering. Science, 2010, 330(6009): 1355–1358. DOI: 10.1126/science.1193990 |
| [30] | Jin P, Kang Z, Yuan PH, et al. Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168. Metab Eng, 2016, 35: 21–30. DOI: 10.1016/j.ymben.2016.01.008 |
| [31] | Zhang YL, Luo KL, Zhao QS, et al. Genetic and biochemical characterization of genes involved in hyaluronic acid synthesis in Streptococcus zooepidemicus. Appl Microbiol Biotechnol, 2016, 100(8): 3611–3620. DOI: 10.1007/s00253-016-7286-1 |
| [32] | Tlustá M, Krahulec J, Pepeliaev S, et al. Production of hyaluronic acid by mutant strains of group C Streptococcus. Mol Biotechnol, 2013, 54(3): 747–755. DOI: 10.1007/s12033-012-9622-8 |
| [33] | Jin P, Kang Z, Zhang N, et al. High-yield novel leech hyaluronidase to expedite the preparation of specific hyaluronan oligomers. Sci Rep, 2014, 4: 4471. |
| [34] | Chen WY, Marcellin E, Hung J, et al. Hyaluronan molecular weight is controlled by UDP-N-acetylglucosamine concentration in Streptococcus zooepidemicus. J Biol Chem, 2009, 284(27): 18007–18014. DOI: 10.1074/jbc.M109.011999 |
 2019, Vol. 35
2019, Vol. 35