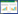中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈云雨, 牛夏忆, 李妍, 刘晓平
- Chen Yunyu, Niu Xiayi, Li Yan, Liu Xiaoping
- 基于β-catenin/Lef1相互作用为靶标的新型抗肿瘤药物高通量筛选模型的建立
- Development of an ELISA-based high throughput screening method for novel anticancer agents targeting β-catenin/Lef1 interaction
- 生物工程学报, 2019, 35(4): 707-717
- Chinese Journal of Biotechnology, 2019, 35(4): 707-717
- 10.13345/j.cjb.180341
-
文章历史
- Received: August 26, 2018
- Accepted: November 7, 2018
- Published: November 26, 2018
2. 中国科学院 长春应用化学研究所 化学生物学实验室,吉林 长春 130022;
3. 中国医学科学院-北京协和医学院 医药生物技术研究所 国家新药 (微生物) 筛选中心,北京 100050
2. Laboratory of Chemical Biology, Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, Jilin, China;
3. National Center for Microbial Drug Screening, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
Wnt/β-catenin信号通路的异常活化在结肠癌、肝癌、肺癌、乳腺癌、慢性淋巴细胞白血病等多种癌症的发生与发展中发挥重要作用,已经成为肿瘤分子靶向治疗的一个重要靶标[1]。β-catenin是介导Wnt信号转导的关键调控因子,同时通过与E-cadherin相互作用,参与细胞黏连和细胞骨架的构成。β-catenin核心功能区是12个连续重复的犰狳蛋白重复片段(Armadillo repeats, 138–686 aa),两侧是N端结构域和C端转录激活结构域(Carboxy-terminal transactivation domain, CTA)。其中犰狳蛋白重复片段对β-catenin的生物学功能尤为重要,几乎介导了β-catenin与所有已知互作蛋白的结合[2]。在经典Wnt信号通路中,β-catenin作为重要的核转录调控因子,通过与Tcf4 (T-cell factor 4)和Lef1 (Lymphoid enhancer factor 1)相互作用而启动大量原癌基因的表达[3-4]。研究表明,β-catenin/Lef1相互作用在非小细胞肺癌(Non-small cell lung cancer,NSCLC)脑(骨)转移过程中发挥重要作用,促进肺癌细胞浸润和脑(骨)转移的形成[5-6]。另一方面,β-catenin/Lef1相互作用对于维持肿瘤干细胞(Cancer stem cells, CSC)分化和自我更新具有极其重要的促进作用,参与维持肿瘤干细胞休眠体的形成,促进肿瘤耐药与复发[7-8]。此外,β-catenin/Lef1相互作用在急(慢)性淋巴细胞白血病的发生与发展中也发挥重要的促进作用,已经成为白血病治疗的新靶标[9-13]。因此,靶向β-catenin/Lef1相互作用小分子抑制剂的发现对于抑制NSCLC转移和急(慢)性淋巴细胞白血病的治疗具有重要意义。
本研究通过原核表达和分离纯化高活性的β-catenin与GST-Lef1功能蛋白,以β-catenin/Lef1相互作用为靶标,建立基于酶联免疫吸附实验(Enzyme-linked immunosorbent assay, ELISA)原理的高通量筛选模型,为靶向β-catenin/Lef1相互作用小分子抑制剂的理性化发现奠定基础。
1 材料与方法 1.1 材料pET-30a(+)与pGEX-4T-1载体由本室保存;GST-β-catenin-pGEX-4T-1重组质粒由中国科学院大学存济医学院袁莉教授惠赠;大肠杆菌Escherichia coli DH5α感受态细胞、E. coli Rosetta (DE3)感受态细胞、E. coli BL21(DE3)感受态细胞、TransTaq®-T DNA聚合酶、Trans2K® DNA Marker、ProteinRuler® Ⅱ、pEASY®-T1试剂盒、EasyPure®试剂盒、琼脂糖、FlyCut® BamHⅠ和FlyCut® XhoⅠ购自TransGen公司;酵母粉、胰蛋白胨和琼脂粉购自Oxoid公司;BCA (Bicinchoninic acid)试剂盒购自Thermo公司;硫酸卡那霉素、氨苄西林和异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG)购自上海阿拉丁生化科技股份有限公司;牛血清白蛋白(Bull serum albumin, BSA)、小鼠抗组氨酸(Histidine,His)标签单抗、小鼠抗谷胱甘肽转移酶(Glutathione S-transferase,GST)标签单抗和辣根过氧化物酶(Horseradish peroxidase,HRP)标记的羊抗小鼠IgG购自Biosharp公司;MaxiLuminTM化学发光液购自Biokits公司;96孔酶标板购自Corning公司;可溶型单组分四甲基联苯胺(3, 3', 5, 5'-Tetramethylbenzidine,TMB)溶液购自天根生化科技(北京)有限公司;醋酸纤维素膜购自Millipore公司;HisTrap和GSTrap层析柱购自GE公司;谷胱甘肽亲和介质购自中科森辉微球技术(苏州)有限公司;其他生化试剂为国产分析纯试剂。
1.2 方法 1.2.1 β-catenin (138–781 aa)基因片段扩增β-catenin功能区主要包括犰狳蛋白重复片段(138–686 aa)和C端转录激活结构域(687–781 aa),主要介导与Wnt信号通路中相关蛋白的相互作用和染色质重塑复合体的募集[2]。根据β-catenin (138–781 aa)基因序列设计引物,以GST-β-catenin- pGEX-4T-1重组质粒为模板扩增β-catenin基因片段(1 932 bp)。按照常规PCR方法进行β-catenin基因片段的扩增[14],以1%琼脂糖凝胶电泳检测目的基因扩增结果。
1.2.2 β-catenin原核表达质粒构建按照文献所述方法进行β-catenin原核表达质粒的构建[14]。首先,将回收的β-catenin基因片段与T载体连接,构建克隆质粒。将克隆质粒转化E. coli DH5α感受态细胞,经蓝白斑筛选后,以单菌落PCR反应和质粒双酶切法鉴定阳性克隆,质粒测序由General Biosystems公司完成。
双酶切克隆质粒中的β-catenin基因片段后回收,再与pET-30a(+)载体连接,构建β-catenin- pET-30a(+)重组质粒。将重组质粒转化E. coli DH5α感受态细胞,经卡那霉素抗性筛选后,同法鉴定阳性克隆。
1.2.3 β-catenin原核表达按照文献所述方法进行β-catenin原核表达[14]。首先,将β-catenin-pET-30a(+)重组质粒转化E. coli Rosetta (DE3)感受态细胞,经卡那霉素抗性筛选后,随机挑取6个单菌落,以1 mmol/L IPTG于25 ℃诱导培养10 h,进行β-catenin原核表达。离心收集菌体,以8% SDS-PAGE和Clinx Image Analysis软件进行β-catenin原核表达量分析。
工程菌大量诱导培养后,将离心收集的菌体以适量TBS (50 mmol/L Tris、150 mmol/L NaCl,pH 8.0)溶液重悬,离心收集超声波裂解后的上清液和沉淀。8% SDS-PAGE进行β-catenin的可溶性表达分析。
1.2.4 β-catenin分离纯化大量收集菌体裂解后的上清液,以25%饱和硫酸铵沉淀后制备粗提液,再按照文献所述方法以HisTrap层析柱进行β-catenin的分离纯化[14]。纯化的β-catenin以8% SDS-PAGE进行分析,经TBS溶液透析后,以BCA法定量。
1.2.5 Western blotting实验鉴定β-catenin按照文献所述方法[14],纯化的β-catenin经8% SDS-PAGE后转膜,一抗为1:2 000稀释的小鼠抗His标签单抗,二抗为1:4 000稀释的HRP-羊抗小鼠IgG,用MaxiLuminTM化学发光液显影成像。
1.2.6 GST-Lef1 (1–76 aa)原核表达与分离纯化Lef1是经典Wnt信号通路中重要的核转录调控因子,β-catenin通过犰狳蛋白重复片段结构域与Lef1的βBD结构域(β-catenin binding domain, βBD, 1–76 aa)相互作用,进而调控大量原癌基因的转录与表达[15-16]。检索Lef1 (1–76 aa)的基因序列,以BamHⅠ和XhoⅠ作为酶切位点,由General Biosystems公司进行全基因合成后连接pGEX-4T-1载体,构建GST-Lef1-pGEX-4T-1重组质粒。
Lef1 (1–76 aa)基因合成序列如下(下划线为双酶切位点):5'-GGATCCATGCCCCAACTTTC CGGAGGAGGCGGCGGGGGGGACCCGGAACTCTGCGCCACCGATGAGATGATCCCCTTCAAGGACGAAGGCGATCCCCAGAAGGAGAAGATCTTCGCCGAGATCAGTCATCCCGAAGAGGAGGGCGACTTAGCCGACATCAAGTCATCTTTGGTTAACGAGTCCGAAATCATCCCAGCCAGCAACGGGCATGAGGTGGTCAGACAAGCCCCGTCCCTCGAG-3'。
大量收集菌体裂解后的上清液,再按照文献所述方法以GSTrap层析柱分别进行GST-Lef1和GST的分离纯化[14]。纯化的GST-Lef1和GST以10% SDS-PAGE进行分析,经TBS溶液透析后,以BCA法定量。
1.2.7 GST Pulldown实验将10 μg GST-Lef1和10 μg GST分别加入到20 μL GST琼脂糖凝胶亲和介质中,4 ℃反应过夜。收集反应后的GST琼脂糖凝胶,以TBS溶液重悬。离心洗涤3次后,分别加入2 μg和10 μg β-catenin,室温反应1 h,收集GST凝胶。以1.2.5方法检测β-catenin的结合量。
1.2.8 基于ELISA原理的高通量筛选模型的优化与建立1) GST-Lef1最佳包被浓度的确定
将5、10、20、30、40、50、60、70、80、90、100 μg/mL的GST-Lef1包被96孔酶标板(100 μL/孔),每组3个复孔,以包被1 μg BSA孔作为阴性对照。酶标板经含0.1% Tween-20的磷酸盐(Phosphate-buffered solution, PBS)缓冲液(PBST)洗板3次后,以含10% BSA的PBST溶液于37 ℃封闭2 h。PBST洗板后,依次加入1:2 000稀释的小鼠抗GST标签单抗和1:4 000稀释的HRP-羊抗小鼠IgG,室温反应1 h。以PBST洗板3次后,每孔加入TMB溶液(100 μL/孔),室温避光显色5 min,再加入2 mol/L H2SO4终止反应,多功能酶标仪检测OD450值(CytationTM 5, BioTek)。
2) β-catenin最佳反应浓度的确定
GST与GST-Lef1 (10 μg/mL;100 μL/孔)包被96孔酶标板,以包被GST孔作为阴性对照组。酶标板经PBST洗涤和10% BSA封闭后,将0.5、1、2、3、4、5、6、7、8、9、10 μg/mL的β-catenin (100 μL/孔)依次加入到96孔酶标板中,每组3个复孔,室温孵育1 h。PBST洗板后,按照上述方法依次加入1:2 000稀释的小鼠抗His标签单抗和1:4 000稀释的HRP-羊抗小鼠IgG,室温反应1 h。以TMB溶液(100 μL/孔)显色,多功能酶标仪检测OD450值。
3) DMSO浓度对β-catenin/GST-Lef1结合的影响
GST-Lef1 (10 μg/mL;100 μL/孔)包被的96孔酶标板以PBST洗涤和10% BSA封闭后,依次加入含0%、1%、2%、3%、4%、5% DMSO浓度的β-catenin (6 μg/mL;100 μL/孔)到96孔酶标板中,每组3个复孔,室温反应1 h。按照上述方法检测OD450值。
4) Z'因子及其他主要技术参数的测定
GST和GST-Lef1 (10 μg/mL;100 μL/孔)包被的96孔酶标板以PBST洗涤和10% BSA封闭后,将β-catenin (6 μg/mL;100 μL/孔)加入到96孔酶标板中,室温孵育1 h。将GST-Lef1与β-catenin反应孔设置为阴性孔,GST与β-catenin反应孔设置为阳性孔,其中1#–30#孔为阴性孔,31#–60#孔为阳性孔。以多功能酶标仪检测OD450值并按照BioTek操作系统的相关程序进行Z'因子的自动计算。
另外,根据相关文献[17-18],我们也对本筛选模型的信号本底比(Signal to background,S/B)、信号窗(Signal window,SW)、信噪比(Signal to noise,S/N)、信号/本底变异系数(Coefficient of variation of signal/background,CV)进行了定量分析。
2 结果与分析 2.1 β-catenin原核表达质粒构建以GST-β-catenin-pGEX-4T-1重组质粒为模板,利用PCR反应成功扩增了与β-catenin基因片段(1 932 bp)大小一致的特异DNA片段(图 1A)。将构建的β-catenin-pET-30a(+)重组质粒转化E. coli DH5α,以单菌落PCR反应和质粒双酶切法鉴定经卡那霉素抗性筛选的阳性克隆。鉴定结果表明,所挑取的单菌落均可特异性扩增出约1 932 bp的DNA片段(图 1B)。构建的重组质粒经BamHⅠ和XhoⅠ双酶切后,再次得到了与PCR扩增结果大小一致的DNA片段(图 1C)。上述结果表明,成功构建了β-catenin原核表达质粒。

|
| 图 1 β-catenin原核表达质粒构建 Fig. 1 The construction of bacterial expression plasmid of β-catenin. (A) PCR product of β-catenin gene. 1: DNA marker; 2: β-catenin gene product. (B) PCR products of six random positive clones. 1: DNA marker; 2–7: β-catenin gene product. (C) Dual-restriction enzyme digestion map for β-catenin-pET-30a(+) plasmid. 1: DNA marker; 2: plasmid double digestion product |
| |
6株工程菌经诱导培养后,离心收集菌体,以8% SDS-PAGE和Clinx Image Analysis软件进行β-catenin原核表达分析。与阴性对照组相比,在β-catenin理论分子量(77 kDa)位置可见明显的蛋白表达条带,β-catenin表达量约为15% (图 2A)。取菌体裂解后的上清液和沉淀进行SDS-PAGE分析表明,β-catenin以可溶形式表达,大部分存在于上清液中(图 2B)。综上所述,成功进行了β-catenin原核表达。
|
| 图 2 β-catenin原核表达与分离纯化 Fig. 2 Bacterial expression and purification of β-catenin. (A) Bacterial expression of β-catenin. 1: negative control; 2: protein marker; 3–8: positive clones. (B) Purification of β-catenin. 1: negative control; 2: protein marker; 3: total cell proteins; 4: supernatant; 5: pellet; 6: purified β-catenin (77 kDa). (C) Western blotting analysis of β-catenin. 1: protein marker; 2: β-catenin band (77 kDa) |
| |
25%饱和硫酸铵沉淀的菌体裂解上清液经HisTrap层析柱分离纯化后,收集的样品进行SDS-PAGE分析。结果表明,在β-catenin理论分子量(77 kDa)位置呈单一蛋白条带,表明纯化的β-catenin具有较高的纯度(图 2B)。以Western blotting实验对纯化的β-catenin进行鉴定,在β-catenin理论分子量(77 kDa)位置仍呈现出特异性条带,证实了β-catenin的正确表达(图 2C)。β-catenin经TBS溶液透析和BCA法定量后,其浓度为1.0 mg/mL。
2.3 GST-Lef1原核表达与分离纯化工程菌经诱导培养后收集菌体,以10% SDS-PAGE和Clinx Image Analysis软件进行GST-Lef1原核表达分析。结果表明,在GST-Lef1理论分子量(34 kDa)位置可见明显的蛋白表达条带,GST-Lef1表达量约为18 % (图 3)。取菌体裂解后的上清液和沉淀进行SDS-PAGE分析表明,GST-Lef1以可溶形式表达,大部分存在于上清液中(图 3)。

|
| 图 3 GST-Lef1原核表达与分离纯化 Fig. 3 Bacterial expression and purification of GST-Lef1. 1: negative control; 2: protein marker; 3: total cell proteins; 4: pellet; 5: supernatant; 6: purified GST-Lef1; 7: purified GST |
| |
菌体裂解上清液经GSTrap层析柱分离纯化后,收集的样品进行SDS-PAGE分析。结果表明,得到了与预期分子量(34 kDa)大小一致且纯度较高的GST-Lef1 (图 3)。纯化的GST-Lef1和GST (26 kDa)经TBS溶液透析和BCA法定量后,其浓度分别为1.3 mg/mL和1.7 mg/mL。
2.4 β-catenin生物学活性鉴定细胞核内β-catenin/Lef1相互作用是Wnt/ β-catenin信号通路中最重要的转录调控方式[3-4,15-16]。GST Pulldown实验表明,纯化的β-catenin能与GST-Lef1在体外发生明显的特异性结合反应,且结合反应具有典型的量效关系,但β-catenin不能与GST发生结合反应(图 4)。上述结果表明,纯化的β-catenin具有良好的生物学活性。

|
| 图 4 GST Pulldown实验 Fig. 4 GST Pulldown assay. 1: protein marker; 2: 10 μg GST+10 μg β-catenin; 3: 10 μg GST-Lef1+2 μg β-catenin; 4: 10 μg GST-Lef1+10 μg β-catenin |
| |
将不同浓度的GST-Lef1包被96孔酶标板后,以ELISA方法进行包被量检测。结果表明,GST-Lef1包被浓度大于10 μg/mL时,OD450值趋于稳定并始终维持在0.73–0.81之间,10 μg/mL的包被浓度基本达到包被饱和量(图 5)。因此选用10 μg/mL作为GST-Lef1的最佳包被浓度。

|
| 图 5 GST-Lef1最佳包被浓度的确定 Fig. 5 Determination of an optimal coated concentration of GST-Lef1 in ELISA-based HTS method |
| |
将系列稀释的β-catenin加入到10 μg/mL GST-Lef1包被的96孔酶标板中,以ELISA方法进行β-catenin结合量检测。结果表明,β-catenin与GST-Lef1的结合反应具有良好的浓度依赖性。当β-catenin浓度达到7 μg/mL时,OD450值达到最大并趋于结合反应的饱和(图 6)。为了使其结合反应在实验体系中趋于饱和状态并增大实验体系的信号窗,因此选用6 μg/mL作为β-catenin的最佳反应浓度。

|
| 图 6 β-catenin最佳反应浓度的确定 Fig. 6 Determination of an optimal working concentration of β-catenin in ELISA-based HTS method |
| |
利用确定最佳GST-Lef1包被浓度和β-catenin反应浓度的ELISA分子结合模型进行DMSO浓度影响实验。结果表明,DMSO浓度在0%–5%时,OD450值趋于稳定并始终维持在0.97–1.05之间,其对β-catenin/GST-Lef1相互作用未产生显著影响(图 7)。
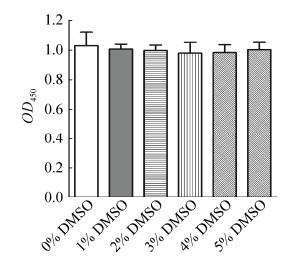
|
| 图 7 DMSO浓度对β-catenin/GST-Lef1相互作用的影响 Fig. 7 Effect of DMSO concentrations on β-catenin/ GST-Lef1interaction in ELISA-based HTS method |
| |
通过综合分析与计算,本筛选模型的Z'因子值为0.76,满足高通量筛选中Z'因子大于0.5的基本要求(图 8)。
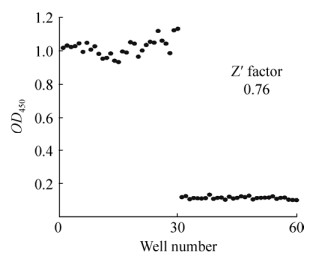
|
| 图 8 ELISA筛选模型Z'因子的确定 Fig. 8 Determination of Z' factor in ELISA-based HTS method |
| |
除Z'因子外,本筛选模型的其他4个通用技术指标,如信号本底比(S/B)、信噪比(S/N)、信号窗(SW)和信号/本底变异系数(CV)也完全满足高通量筛选的基本要求(表 1)。
| Indicators | Requirements of HTS | Results of HTS |
| S/B | > 3 | 10.39 |
| S/N | > 10 | 43.18 |
| SW | Not determined | 0.95 |
| CV (%) | < 10 | 1.94 |
| Z' factor | > 0.5 | 0.76 |
Wnt/β-catenin信号通路是调控肿瘤细胞生长增殖的关键信号通路,在肿瘤发生与发展中发挥着极其重要的作用,与肿瘤细胞的生长分化、上皮-间质转化、免疫耐受及化疗耐药密切相关。鉴于正常细胞中不存在Wnt/β-catenin信号通路,而肿瘤细胞中Wnt/β-catenin信号通路异常活化并启动大量原癌基因的表达,所以Wnt/β-catenin信号通路已成为新型高选择性抗肿瘤药物开发的一个理想靶标[3]。
Lef1与Tcf4同属于高迁移组分(High mobility group, HMG)转录因子,是经典Wnt信号通路中重要的核转录调控因子。在肿瘤细胞内β-catenin通过与Lef1的βBD结构域相互作用,启动大量原癌基因的转录与表达,促进肿瘤细胞的增殖与分化[3-4,15-16]。目前靶向β-catenin/Tcf4相互作用的小分子抑制剂(如ZTM-000990、PKF115-584、PKF222-815、PKF118-744、CGP049090、iCRT-3/5/14、LF-3等)已经成为抗肿瘤药物研究的热点,在结肠癌[19-21]、乳腺癌[22]、肝癌[23-24]、多发性骨肉瘤[25]等肿瘤实验治疗中展现出良好的应用前景。但关于靶向β-catenin/Lef1相互作用的小分子抑制剂筛选方法及相关抑制剂的肿瘤分子治疗研究却鲜有报道[13,26]。
由于蛋白质-蛋白质相互作用(Protein-protein interactions, PPIs)位点缺少较深的“口袋”式结构,且具有较大的非连续性的相互作用面积,这使得以PPIs为靶点的小分子药物开发依然面临较大的挑战;另外,由于缺少具有多样化学结构的靶向PPIs的小分子配体,较难进行基于结构的定向药物设计[27]。因此,靶向β-catenin/Lef1相互作用小分子抑制剂的发现对未来以其为靶标的新型抗肿瘤药物定向设计具有重要的理论意义。
大肠杆菌原核表达体系已成为制备重组蛋白的首选表达体系[28],本研究综合利用DNA重组技术,成功进行了β-catenin和GST-Lef1的原核表达与分离纯化。由于His标签较小,几乎不影响目的蛋白的理化性质且方便目的蛋白的检测与纯化,His标签已被广泛应用于多种重组蛋白在各种表达系统的表达与纯化中[29]。故此在设计β-catenin原核表达和分离纯化策略时,笔者首次采用pET-30a(+)载体的His标签融合表达策略成功进行了β-catenin原核表达与分离纯化。与已报道的GST-β-catenin融合表达策略相比[30],笔者建立的β-catenin原核表达与分离纯化方法具有更好的简便性和实用性。此外,鉴于E. coli Rosetta (DE3)可补充大肠杆菌缺乏的6种稀有密码子对应的tRNA,可提高真核基因在大肠杆菌中的表达水平,故此选择E. coli Rosetta (DE3)作为β-catenin的表达宿主菌。
GST Pulldown实验主要在溶液中进行,可以真实地反映蛋白质分子间的相互作用,已成为体外研究蛋白质-蛋白质相互作用的经典实验方法[31]。我们利用GST Pulldown实验进行β-catenin的生物学活性鉴定,证实了纯化的β-catenin能与GST-Lef1发生特异性结合反应,这表明纯化的β-catenin具有良好的生物学活性。
酶联免疫吸附实验具有操作简便、检测灵敏、成本低廉等优点,使其在疾病诊断和药物筛选研究领域得到了极大的应用与发展[32-34]。本研究以β-catenin/Lef1相互作用为靶标,应用ELISA原理建立的高通量筛选模型还具有所需样品量少、重复性好、检测结果稳定等诸多优点,可以实现大样本的简便、快速的高通量筛选与分析。虽然本筛选模型还存在一定的局限性(如操作步骤较多、需多次洗涤、耗时较长等),但和本实验室曾采用的酵母双杂交筛选模型相比,应用本筛选方法不但可以有效减少筛选化合物用量,降低筛选成本,还具有更好的简便性和灵敏性。另外,本筛选模型基本真实模拟了β-catenin/Lef1的生理相互作用,不仅可以应用于以β-catenin/Lef1相互作用为靶标的抗肿瘤药物高通量筛选,还可以联合GST Pulldown实验用于评价小分子抑制剂的体外抑制活性,因此本方法也具有良好的实用性。
目前,我们成功应用本筛选模型对本实验室天然产物化合物库进行了初步筛选,已获得了若干苗头化合物,相关化合物的抗肿瘤分子机制研究正在进行之中。此外,我们也利用本筛选模型对本实验室设计的一系列靶向多肽进行了系统筛选和体外抑制活性评价,已获得了若干有深入研究价值的多肽分子,相关多肽的细胞药理学研究也在同步进行之中。在本筛选模型的后续方法改进中,可直接使用HRP-抗His标签抗体一步法检测和显色,通过减少实验操作步骤以提高筛选效率。
Z'因子是评价高通量筛选模型的核心参数,它结合了信号窗(SW)和信号/本底变异系数(CV)这2个与模型质量密切相关的重要参数,一般要求Z'因子>0.5的模型才适用于药物高通量筛选[35]。通过对建立的ELISA高通量筛选模型的通用技术指标,如Z'因子、信号本底比(S/B)、信噪比(S/N)、信号窗(SW)、信号/本底变异系数(CV)进行定量评价,表明本筛选模型具有良好的稳定性、灵敏性和特异性。
综上所述,本研究成功建立了基于β-catenin/Lef1相互作用为靶标的ELISA高通量筛选模型,为靶向β-catenin/Lef1相互作用的小分子抑制剂高通量筛选和药理学活性评价奠定了实验基础。
致谢 衷心感谢中国科学院大学存济医学院袁莉教授和美国华盛顿大学结构生物学系许文清教授在β-catenin原核表达方面给予的悉心指导和无私帮助!
| [1] | Anastas JN, Moon RT. WNT signalling pathways as therapeutic targets in cancer. Nat Rev Cancer, 2013, 13(1): 11–26. DOI: 10.1038/nrc3419 |
| [2] |
Su S, Wu W. Regulation of target gene transcription by Wnt/β-catenin signaling.
Sci Sin Vitae, 2014, 44(10): 1029–1042.
(in Chinese). 苏尚, 吴畏. Wnt/β-catenin信号通路对靶基因转录的调控. 中国科学:生命科学, 2014, 44(10): 1029-1042. |
| [3] | Barker N, Clevers H. Mining the Wnt pathway for cancer therapeutics. Nat Rev Drug Discov, 2006, 5(12): 997–1014. DOI: 10.1038/nrd2154 |
| [4] | Clevers H, Nusse R. Wnt/β-catenin signaling and disease. Cell, 2012, 149(6): 1192–1205. DOI: 10.1016/j.cell.2012.05.012 |
| [5] | Nguyen DX, Chiang AC, Zhang XHF, et al. WNT/TCF signaling through LEF1 and HOXB9 mediates lung adenocarcinoma metastasis. Cell, 2009, 138(1): 51–62. |
| [6] | Chen CY, Jan YH, Juan YH, et al. Fucosyltransferase 8 as a functional regulator of nonsmall cell lung cancer. Proc Natl Acad Sci USA, 2013, 110(2): 630–635. DOI: 10.1073/pnas.1220425110 |
| [7] | Iqbal W, Alkarim S, AlHejin A, et al. Targeting signal transduction pathways of cancer stem cells for therapeutic opportunities of metastasis. Oncotarget, 2016, 7(46): 76337–76353. |
| [8] | Steeg PS. Targeting metastasis. Nat Rev Cancer, 2016, 16(4): 201–218. DOI: 10.1038/nrc.2016.25 |
| [9] | Metzeler KH, Heilmeier B, Edmaier KE, et al. High expression of lymphoid enhancer-binding factor-1 (LEF1) is a novel favorable prognostic factor in cytogenetically normal acute myeloid leukemia. Blood, 2012, 120(10): 2118–2126. DOI: 10.1182/blood-2012-02-411827 |
| [10] | Yeung J, Esposito MT, Gandillet A, et al. β-Catenin mediates the establishment and drug resistance of MLL leukemic stem cells. Cancer Cell, 2010, 18(6): 606–618. DOI: 10.1016/j.ccr.2010.10.032 |
| [11] | Petropoulos K, Arseni N, Schessl C, et al. A novel role for Lef-1, a central transcription mediator of Wnt signaling, in leukemogenesis. J Exp Med, 2008, 205(3): 515–522. DOI: 10.1084/jem.20071875 |
| [12] | Gandhirajan RK, Poll-Wolbeck SJ, Gehrke I, et al. Wnt/β-catenin/LEF-1 signaling in chronic lymphocytic leukemia (CLL): a target for current and potential therapeutic options. Curr Cancer Drug Targets, 2010, 10(7): 716–727. DOI: 10.2174/156800910793605794 |
| [13] | Gandhirajan RK, Staib PA, Minke K, et al. Small molecule inhibitors of Wnt/β-catenin/Lef-1 signaling induces apoptosis in chronic lymphocytic leukemia cells in vitro and in vivo. Neoplasia, 2010, 12(4): 326–335. DOI: 10.1593/neo.91972 |
| [14] |
Chen YY, Liu G, Zhang J, et al. Bacterial expression, purification and biological activity evaluation of Plk1 PBD protein.
J Chongqing Med Univ, 2018, 43(11): 1453–1457.
(in Chinese). 陈云雨, 刘刚, 张晶, 等. Plk1 PBD蛋白原核表达、分离纯化与活性鉴定. 重庆医科大学学报, 2018, 43(11): 1453-1457. |
| [15] | Behrens J, von Kries JP, Kühl M, et al. Functional interaction of β-catenin with the transcription factor LEF-1. Nature, 1996, 382(6592): 638–642. DOI: 10.1038/382638a0 |
| [16] | von Kries JP, Winbeck G, Asbrand C, et al. Hot spots in β-catenin for interactions with LEF-1, conductin and APC. Nat Struct Biol, 2000, 7(9): 800–807. DOI: 10.1038/79039 |
| [17] | Gong SQ, Han XW, Li XH, et al. Development of a high-throughput screening strategy for upregulators of the OPG/RANKL ratio with the potential for antiosteoporosis effects. J Biomol Screen, 2016, 21(7): 738–748. DOI: 10.1177/1087057116654657 |
| [18] |
Chen YY, Miao DD, Zhang YM, et al. Development of a novel fluorescence polarization-based high-throughput screening method for PLK1 PBD inhibitors.
Chin Med Biotechnol, 2017, 12(5): 385–390.
(in Chinese). 陈云雨, 缪冬冬, 张叶明, 等. 靶向PLK1 PBD小分子抑制剂荧光偏振高通量筛选模型的建立. 中国医药生物技术, 2017, 12(5): 385-390. DOI:10.3969/j.issn.1673-713X.2017.05.001 |
| [19] | Lepourcelet M, Chen YNP, France DS, et al. Small-molecule antagonists of the oncogenic Tcf/β-catenin protein complex. Cancer Cell, 2004, 5(1): 91–102. |
| [20] | Fang L, Zhu QH, Neuenschwander M, et al. A Small-molecule antagonist of the β-catenin/TCF4 interaction blocks the self-renewal of cancer stem cells and suppresses tumorigenesis. Cancer Res, 2016, 76(4): 891–901. |
| [21] | Gonsalves FC, Klein K, Carson BB, et al. An RNAi-based chemical genetic screen identifies three small-molecule inhibitors of the Wnt/wingless signaling pathway. Proc Natl Acad Sci USA, 2011, 108(15): 5954–5963. DOI: 10.1073/pnas.1017496108 |
| [22] | Jang GB, Hong IS, Kim RJ, et al. Wnt/β-catenin small-molecule inhibitor CWP232228 preferentially inhibits the growth of breast cancer stem-like cells. Cancer Res, 2015, 75(8): 1691–1702. DOI: 10.1158/0008-5472.CAN-14-2041 |
| [23] | Wei W, Chua MS, Grepper S, et al. Small molecule antagonists of Tcf4/β-catenin complex inhibit the growth of HCC cells in vitro and in vivo. Int J Cancer, 2010, 126(10): 2426–2436. |
| [24] | Kim JY, Lee HY, Park KK, et al. CWP232228 targets liver cancer stem cells through Wnt/β-catenin signaling: a novel therapeutic approach for liver cancer treatment. Oncotarget, 2016, 7(15): 20395–20409. |
| [25] | Sukhdeo K, Mani M, Zhang YY, et al. Targeting the β-catenin/TCF transcriptional complex in the treatment of multiple myeloma. Proc Natl Acad Sci USA, 2007, 104(18): 7516–7521. DOI: 10.1073/pnas.0610299104 |
| [26] | Hsieh TH, Hsu CY, Tsai CF, et al. A novel cell-penetrating peptide suppresses breast tumorigenesis by inhibiting β-catenin/LEF-1 signaling. Sci Rep, 2016, 6: 19156. DOI: 10.1038/srep19156 |
| [27] | Ivanov AA, Khuri FR, Fu HA. Targeting protein-protein interactions as an anticancer strategy. Trends Pharmacol Sci, 2013, 34(7): 393–400. DOI: 10.1016/j.tips.2013.04.007 |
| [28] | Baeshen MN, Al-Hejin AM, Bora RS, et al. Production of biopharmaceuticals in E. coli: current scenario and future perspectives. J Microbiol Biotechnol, 2015, 25(7): 953–962. DOI: 10.4014/jmb.1412.12079 |
| [29] |
Li YJ, Chen YY, Bi LJ. Fusion tags technology and their applications.
Chin J Biotech, 2006, 22(4): 523–527.
(in Chinese). 李永进, 陈媛媛, 毕利军. 融合标签技术及其应用. 生物工程学报, 2006, 22(4): 523-527. DOI:10.3321/j.issn:1000-3061.2006.04.001 |
| [30] |
Yin HL, Yuan L. Prokaryotic expression, purification, and identification of GST-β-catenin-His double labeled fusion protein.
J Grad Univ Chin Acad Sci, 2012, 29(6): 847–852.
(in Chinese). 尹会龙, 袁莉. GST-β-catenin-His双标签融合蛋白的原核表达、纯化及鉴定. 中国科学院研究生院学报, 2012, 29(6): 847-852. |
| [31] |
Chai ZB, Zhang GL, Han JX. Application of GST-pull down technique in study on protein-protein interaction.
Chin J Biol, 2014, 27(10): 1354–1358.
(in Chinese). 柴政斌, 张更林, 韩金祥. GST-pull down技术在蛋白质相互作用中的应用. 中国生物制品学杂志, 2014, 27(10): 1354-1358. |
| [32] | Wang L, Bao Y, Yang Y, et al. Discovery of antagonists for human scavenger receptor CD36 via an ELISA-like high-throughput screening assay. J Biomol Screen, 2010, 15(3): 239–250. DOI: 10.1177/1087057109359686 |
| [33] |
Zhang XL, Nie YZ, Lan XG, et al. Preparation of anti-HBsAg epitope monoclonal antibodies and establishment of a sandwich ELISA for HBV serotype detection.
Chin J Cell Mol Immunol, 2014, 30(2): 171–175.
(in Chinese). 张晓磊, 聂玉哲, 蓝兴国, 等. 抗HBsAg表位单克隆抗体的制备及HBV血清型夹心ELISA的建立. 细胞与分子免疫学杂志, 2014, 30(2): 171-175. |
| [34] | Siarot L, Chutiwitoonchai N, Sato H, et al. Identification of human immunodeficiency virus type-1 Gag-TSG101 interaction inhibitors by high-throughput screening. Biochem Biophys Res Commun, 2018, 503(4): 2970–2976. DOI: 10.1016/j.bbrc.2018.08.079 |
| [35] | Zhang JH, Chung TDY, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2): 67–73. DOI: 10.1177/108705719900400206 |
 2019, Vol. 35
2019, Vol. 35