中国科学院微生物研究所、中国微生物学会主办
文章信息
- 侯若琳, 李琳, 项凯凯, 吴小平, 林文雄, 郑明锋, 傅俊生
- Hou Ruolin, Li Lin, Xiang Kaikai, Wu Xiaoping, Lin Wenxiong, Zheng Mingfeng, Fu Junsheng
- 利用扁桃斑鸠菊叶发酵生产蛹虫草胞外多糖的条件及其抗氧化活性
- Production of antioxidative exopolysaccharides of Cordyceps militaris with Vernonia amygdalina leaves in substrate
- 生物工程学报, 2019, 35(4): 667-676
- Chinese Journal of Biotechnology, 2019, 35(4): 667-676
- 10.13345/j.cjb.180353
-
文章历史
- Received: September 2, 2018
- Accepted: October 29, 2018
2. 福建农林大学 生命科学学院,福建 福州 350002;
3. 福建农林大学 菌物研究中心,福建 福州 350002
2. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China;
3. Mycological Research Center, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China
蛹虫草(Cordyceps militaris L.Link),又名北冬虫夏草,属于子囊菌亚门核菌纲球壳目麦角菌科虫草属[1]。多糖是蛹虫草主要活性物质[2],已有大量研究证实,蛹虫草多糖有降血糖、抗肿瘤、抗氧化、提高免疫力等功效[3-4],因而其具有非常巨大的开发应用价值。蛹虫草目前已实现了人工栽培[5],这为蛹虫草多糖的大量获取提供了基础,但是人工栽培蛹虫草子实体周期较长,这在一定程度上限制了蛹虫草多糖的高效生产。胞外多糖是一种通过液体发酵技术快速获得的菌株活性代谢产物,能够在一定程度上表现出与子实体多糖相近的活性,其与从子实体中获取多糖的途径相比具有更短的生产周期,并且避免了多糖繁琐的热水提取过程。
胞外多糖的产量和活性通常会受发酵条件影响,如何高效地发酵生产胞外多糖就显得尤为重要。已有许多研究表明,通过向发酵培养基中添加适当的中药材物质可以提高菌株活性代谢物质的产量,2011年,贺宗毅等[6]研究发现通过添加适量的天麻到发酵培养基中,可以显著地提高灰树花胞外多糖的产量;2015年,徐丹丹[7]探究了铁皮石斛原球茎对羊肚菌发酵的影响,发现铁皮石斛原球茎能够促进羊肚菌发酵产胞外多糖。目前,有关蛹虫草胞外多糖发酵优化的研究主要是通过调整发酵所需的氮源、碳源及微量元素来达到提高胞外多糖产量的目的[8-10],而其胞外多糖的产量提升能否通过添加药性基质来实现,目前还尚未见相关研究报道。
扁桃斑鸠菊叶是菊科斑鸠菊属植物扁桃斑鸠菊(Vernonia amygdalina Del.)的叶,又称南非叶,是一种重要的中药材[11-12]。扁桃斑鸠菊叶主要活性成分有皂苷、生物碱、萜类、黄酮类等,具有抗氧化、保肝、抗癌、降血脂等作用[13]。实验前期经过筛选,发现扁桃斑鸠菊叶能够有效地提高蛹虫草胞外多糖的产量。为进一步明确添加扁桃斑鸠菊叶促进蛹虫草发酵生产胞外多糖的适宜条件,本实验采用单因素实验和正交实验对液体发酵的条件进行了优化,并对优化发酵得到的胞外多糖进行了红外光谱和抗氧化活性分析,以期为蛹虫草胞外多糖的高效生产及其产品的开发提供科学依据。
1 材料与方法 1.1 材料、试剂和仪器 1.1.1 材料蛹虫草菌种:实验室收藏菌种(菌株编号:MF28,ITS序列NCBI登录号:MF379054);扁桃斑鸠菊叶(实验室种植获得)。
1.1.2 试剂和仪器葡萄糖、酒石酸钾钠、3, 5-二硝基水杨酸、苯酚等试剂均为国产分析纯;二苯基苦味酰基苯肼(DPPH,Sigma公司);纯电热鼓风干燥箱(SYIOIS-2型,天津市三水科学仪器有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司);恒温摇床THZ-98AB (上海一恒科技仪器有限公司);pH计(FE-20型,梅特勒托利多仪器有限公司);红外光谱仪(德国布鲁克仪器公司)。
1.2 发酵液胞外多糖含量的测定 1.2.1 发酵液收集将发酵液10 000 r/min离心3 min,收集上清液,备用。
1.2.2 胞外多糖含量的计算参照陈才法等[14]的研究方法计算发酵液胞外多糖含量,即胞外多糖含量 = 总糖含量-还原糖含量。
1.2.3 总糖含量的测定采用苯酚硫酸法[15]测定发酵液中总糖含量。以葡萄糖为标准品,绘制总糖含量标准曲线。将样品测定的吸光值代入标准曲线回归方程(y = 4.436 1 x+ 0.062 1,R2 = 0.999 1),计算得到发酵液总糖含量。
1.2.4 还原糖含量的测定采用DNS法[16]测定发酵液中还原糖含量。以葡萄糖为标准品,绘制还原糖含量标准曲线。将样品测定的吸光值代入标准曲线回归方程(y = 0.751 3 x+ 0.040 4,R2 = 0.996 5),计算得到发酵液还原糖含量。
1.3 扁桃斑鸠菊叶粉末及其发酵基础培养基制备将采摘后的新鲜扁桃斑鸠菊叶置于烘箱50 ℃烘干,然后用粉碎机将干燥的扁桃斑鸠菊叶粉碎,过80目筛,备用。
发酵基础培养基为加富的PDB培养基:土豆200 g,葡萄糖20 g,蛋白胨5 g,磷酸二氢钾2 g,硫酸镁1.5 g,维生素B1 10 mg,沸水煮沸30 min,3层纱布过滤,加水定容至1 L,121 ℃高压灭菌30 min。
1.4 蛹虫草液体菌种制备将蛹虫草菌株活化后,接入装有100 mL PDB液体培养基的250 mL锥形瓶中,置于25 ℃、160 r/min摇瓶培养5 d。接种前,将菌种用无菌水稀释1倍,备用。
1.5 液体发酵单因素实验 1.5.1 扁桃斑鸠菊叶粉末添加量在单因素实验中,保持所探究变量以外的其他条件相一致,并在前一个单因素实验的基础上,探究下一个因素的适宜条件。在装有90 mL PDB加富培养基的摇瓶中分别加入0、0.2、0.4、0.6、0.8、1.0 g扁桃斑鸠菊叶粉末,每组重复3次,121 ℃高压灭菌30 min,冷却后,每个摇瓶中接入10 mL蛹虫草液体菌种,放入摇床,于25 ℃、160 r/min避光培养7 d,收集发酵液测定多糖含量。
1.5.2 发酵时间取适量的扁桃斑鸠菊叶粉末加入装有90 mL PDB加富培养基的摇瓶中,每组重复3次,121 ℃高压灭菌30 min,冷却后,每个摇瓶中接入10 mL蛹虫草菌种,放入摇床,于25 ℃、160 r/min避光培养,分别培养4、5、6、7、8、9 d,收集发酵液测定多糖含量。
1.5.3 pH取适量的扁桃斑鸠菊叶粉末添加到有90 mL PDB加富培养基的摇瓶中,用氢氧化钠和盐酸调节pH至4.5、5.0、5.5、6.0、6.5、7.0、7.5,每组重复3次,121 ℃高压灭菌30 min,冷却后,各摇瓶均接入10 mL蛹虫草菌种,放入摇床,于25 ℃、160 r/min避光培养8 d,收集发酵液测定多糖含量。
1.5.4 接种量取适量的扁桃斑鸠菊叶粉末加入到装有PDB加富培养基的摇瓶中,将pH调至适宜,121 ℃高压灭菌30 min,冷却后,各组接入2.5、5.0、7.5、10.0、12.5、15.0 mL蛹虫草菌种,每组重复3次,放入摇床,于25 ℃、160 r/min避光培养8 d,收集发酵液测定多糖含量。
1.6 液体发酵正交优化实验在发酵单因素实验的基础上,对扁桃斑鸠菊叶粉末添加量、发酵时间、pH和接种量进行4因素3水平的正交实验,每个实验组重复3次,以胞外多糖含量为考察指标。正交实验设计表见表 1。
| Level | Factors | |||
| Powder addition (g) | Fermentation time (d) | pH | Inoculation quantity (mL) | |
| 1 | 0.6 | 7 | 6.5 | 2.5 |
| 2 | 0.8 | 8 | 7.0 | 5.0 |
| 3 | 1.0 | 9 | 7.5 | 7.5 |
参照张建国等[17]的方法,发酵结束后,过滤除去菌丝体,将发酵液旋转蒸发浓缩后加入4倍体积的无水乙醇,4 ℃静置过夜,离心收集沉淀,用蒸馏水复溶,采用Sevage法除去蛋白杂质,离心收集上清液,将多糖溶液装入透析袋中流水透析48 h,除去小分子物质,将透析后的多糖溶液冻干,得到精制的胞外多糖。
1.7.2 红外分析参照韩丽荣等[18]的方法,将精制的胞外多糖粉末与KBr研磨混匀压片,然后在红外光谱仪上进行测定,采用2 /cm的分辨率,扫描60次,扫描范围为400–4 000 /cm。
1.8 胞外多糖抗氧化活性分析 1.8.1 ABTS自由基清除率的测定参照孙晓琦等[19]的研究方法。取1.5 mL的ABTS工作液和100 μL不同质量浓度(0.25、0.5、1、2、4 mg/mL)的样品溶液,加入试管混匀,室温下避光反应1 h,在波长734 nm处测定吸光值AX;以蒸馏水替代样品溶液测定吸光值A0;以蒸馏水替代ABTS测定吸光值AX0。根据公式(2)计算清除率,实验每组重复3次,取平均值。
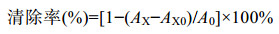
|
(2) |
参照Saiga等[20]的方法。取不同质量浓度(0.25、0.5、1、2、4 mg/mL)的样品溶液2 mL和2×10–4 mol/L的DPPH无水乙醇溶液2 mL,加入试管中摇匀,室温下密闭静置30 min,于波长517 nm处测得吸光度AX;以蒸馏水替代样品溶液测定吸光值A0;以蒸馏水替代DPPH测定吸光值AX0。根据公式(2)计算DPPH自由基的清除率。重复3次,取平均值。
1.8.3 羟基自由基清除率的测定参照白生文等[21]的方法,采用水杨酸-硫酸亚铁法测定。在试管中依次加入9 mmol/L的水杨酸-乙醇溶液、9 mmol/L的FeSO4溶液、不同质量浓度(0.25、0.5、1、2、4 mg/mL)的样品溶液和8.8 mmol/L的H2O2溶液各1 mL,最后加蒸馏水补至15 mL,摇匀,置于37 ℃水浴中反应15 min,在波长510 nm处测定吸光度AX;以蒸馏水1 mL替代样品溶液测定吸光度A0;以蒸馏水1 mL替代H2O2测定吸光度AX0。根据公式(2)计算清除率。重复3次,取平均值。
1.9 数据统计分析实验数据采用SPSS 13.0软件分析处理。计量资料数据用x±s表示,组间比较采用t检验,以P < 0.05表示差异有统计学意义。
2 结果分析 2.1 单因素实验结果 2.1.1 扁桃斑鸠菊叶粉末添加量扁桃斑鸠菊叶粉末对蛹虫草胞外多糖产量的影响结果见图 1。从图 1可以看出,扁桃斑鸠菊叶粉末在一定的剂量范围内,可以显著提高(P < 0.05)蛹虫草胞外多糖的产量。当粉末添加量为0.8 g时,胞外多糖产量达到最高。进一步增加扁桃斑鸠菊叶添加量时,胞外多糖的产量有所下降。因此,在发酵时添加0.8 g扁桃斑鸠菊叶粉末较为适宜。

|
| 图 1 扁桃斑鸠菊叶粉末添加量对蛹虫草胞外多糖产量的影响 Fig. 1 Effect of the addition amount of the bitter leaf powder on the production of extracellular polysaccharide of Cordyceps militaris. Compared to the previous condition, *P < 0.05 |
| |
发酵时间对蛹虫草胞外多糖产量的影响结果见图 2。从图 2可以看出,当发酵时间为8 d时,胞外多糖产量达到最大。发酵时间大于8 d时,胞外多糖产量没有进一步上升。因此,发酵培养时间选取8 d较为合适。

|
| 图 2 发酵时间对蛹虫草胞外多糖产量的影响 Fig. 2 Effect of fermentation time on the production of extracellular polysaccharide of Cordyceps militaris. Compared to the previous condition, *P < 0.05 |
| |
发酵pH对蛹虫草胞外多糖产量的影响结果见图 3。从图 3可以看出,在pH为7.0时,发酵液中多糖含量达到最高。当pH过酸或过碱,胞外多糖的产量均有所降低。因此,选取发酵初始pH值为7.0较为适宜。

|
| 图 3 pH对蛹虫草胞外多糖产量的影响 Fig. 3 Effect of pH on the production of extracellular polysaccharide of Cordyceps militaris. Compared to the previous condition, *P < 0.05 |
| |
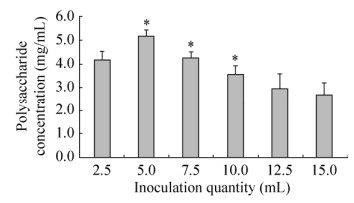
蛹虫草液体菌种接种量对蛹虫草胞外多糖产量的影响结果见图 4。从图 4可以看出,当接种量为5.0 mL时,胞外多糖产量达到最高。因此,接种量为5.0 mL时较为适宜。
|
| 图 4 接种量对蛹虫草胞外多糖产量的影响 Fig. 4 Effect of inoculation quantity on the production of extracellular polysaccharide of Cordyceps militaris. Compared to the previous condition, *P < 0.05 |
| |
由于单因素实验结果单一,所以本研究试验采用正交实验进一步对发酵条件进行优化。根据单因素实验结果,选取粉末添加量、发酵时间、pH和接种量中较优良的3个水平进行四因素三水平的正交试验(表 2)。
| No. | Powder addition (g) | Fermentation time (d) | pH | Inoculation quantity (mL) | Polysaccharide concentration (mg/mL) |
| 1 | 1(0.6) | 1(7) | 1(6.5) | 1(2.5) | 3.50±0.43 |
| 2 | 1(0.6) | 2(8) | 2(7.0) | 2(5.0) | 4.34±0.15 |
| 3 | 1(0.6) | 3(9) | 3(7.5) | 3(7.5) | 4.05±0.21 |
| 4 | 2(0.8) | 1(7) | 2(7.0) | 3(7.5) | 4.48±0.30 |
| 5 | 2(0.8) | 2(8) | 3(7.5) | 1(2.5) | 3.83±0.21 |
| 6 | 2(0.8) | 3(9) | 1(6.5) | 2(5.0) | 5.24±0.28 |
| 7 | 3(1.0) | 1(7) | 3(7.5) | 2(5.0) | 2.18±0.21 |
| 8 | 3(1.0) | 2(8) | 1(6.5) | 3(7.5) | 2.39±0.17 |
| 9 | 3(1.0) | 3(9) | 2(7.0) | 1(2.5) | 2.24±0.26 |
| K1 | 11.88 | 10.16 | 11.13 | 9.57 | |
| K2 | 13.55 | 10.56 | 11.06 | 11.77 | |
| K3 | 6.82 | 11.53 | 10.06 | 10.92 | |
| k1 | 3.96 | 3.39 | 3.71 | 3.19 | |
| k2 | 4.52 | 3.52 | 3.69 | 3.92 | |
| k3 | 2.27 | 3.84 | 3.35 | 3.64 | |
| R | 2.25 | 0.32 | 0.36 | 0.73 |
从表 2可以看到,粉末添加量中k2最大,发酵时间中k3最大,pH中k1最大,接种量中k2最大,所以可以得出液体发酵产胞外多糖的最佳条件为:粉末添加量为0.8 g、发酵时间为9 d、pH为6.5、接种量为5.0 mL。在最佳条件下,胞外多糖产量可达到(5.24±0.28) mg/mL。
进一步对极差进行分析可以发现,4种影响因素中,粉末添加量的极差最大,为2.25,接种量次之,表明发酵产胞外多糖的过程中,主要的影响因素是粉末添加量,其次是接种量。通过方差分析可以发现(表 3),粉末添加量的F值最大,为306.330,其次是接种量,F值为30.558,pH的F值最小,为8.976。所以4种因素的显著性差异由大到小顺序为:粉末添加量 > 接种量 > 发酵时间 > pH。
| Source | Sum of squares | df | Mean square | F | Significance |
| Powder addition | 49.135 | 2 | 24.567 | 306.330 | < 0.001 |
| Fermentation time | 1.986 | 2 | 0.993 | 12.382 | < 0.001 |
| pH | 1.440 | 2 | 0.720 | 8.976 | 0.01 |
| Inoculation quantity | 4.901 | 2 | 2.451 | 30.558 | < 0.001 |
| Error | 3.609 | 45 | 0.080 | ||
| Total | 61.071 | 53 |
为验证扁桃斑鸠菊叶对蛹虫草胞外多糖产量的提升效果,实验在优化得到的最佳条件基础上,设置了未添加扁桃斑鸠菊叶粉末的空白对照组,在实验条件控制上,空白组除了未添加扁桃斑鸠菊叶,其他条件均相同,每组重复5次。结果表明,扁桃斑鸠菊叶能够显著地提高(P < 0.05)蛹虫草发酵液中胞外多糖的产量,其与未添加扁桃斑鸠菊叶的空白组胞外多糖产量相比提高了约205.20% (图 5)。

|
| 图 5 最优条件验证及其与未添加扁桃斑鸠菊叶发酵多糖含量比较 Fig. 5 Validation of the optimum condition and comparison of the extracellular polysaccharide production with the control group without bitter leaf added. Note: Compared with blank control group, *P < 0.05 |
| |
为确定扁桃斑鸠菊叶本身含有的多糖是否会对发酵液胞外多糖含量测定造成影响,实验对扁桃斑鸠菊叶本身的多糖含量进行了测定,结果发现扁桃斑鸠菊叶本身的多糖含量极低,加之扁桃斑鸠菊叶添加量很少(8 g/L),并且发酵是在25 ℃进行,因此扁桃斑鸠菊叶溶出的多糖对蛹虫草胞外多糖含量的测定几乎没有影响。
2.4 胞外多糖红外光谱分析实验进一步对添加了扁桃斑鸠菊叶和未添加扁桃斑鸠菊叶的发酵胞外多糖的红外光谱进行了分析。从图 6可以发现,添加扁桃斑鸠菊叶后生产得到的胞外多糖与未添加扁桃斑鸠菊叶生产得到的胞外多糖红外光谱主要特征吸收峰一致,表明扁桃斑鸠菊叶对蛹虫草发酵生产的胞外多糖化学结构影响较小。

|
| 图 6 添加扁桃斑鸠菊叶发酵多糖与未添加扁桃斑鸠菊叶发酵多糖的红外光谱比较 Fig. 6 Comparison of infrared spectrometer of the extracellular polysaccharide between control group and the group with Vernonia amygdalina leaf added |
| |
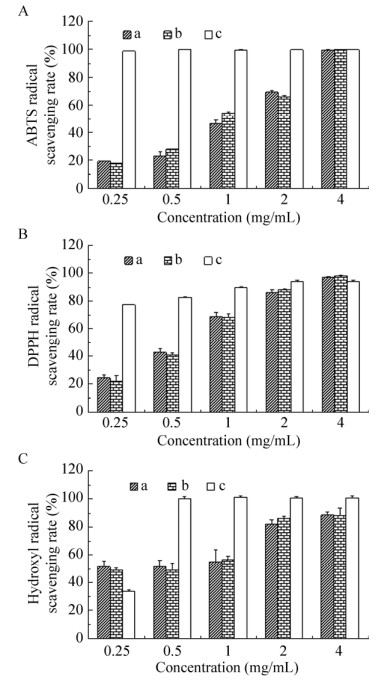
通过上述红外光谱分析,我们发现了扁桃斑鸠菊叶对蛹虫草发酵生产的胞外多糖化学结构影响较小,但是否会对它的活性产生影响,还需要进一步探究。因此,我们进一步对添加扁桃斑鸠菊叶发酵与未添加扁桃斑鸠菊叶发酵生产的胞外多糖抗氧化活性进行了对比分析。实验结果显示,这两种胞外多糖对ABTS、DPPH以及羟基自由基清除能力相近(图 7),表明扁桃斑鸠菊叶对蛹虫草发酵胞外多糖的抗氧化活性影响较小。
|
| 图 7 添加扁桃斑鸠菊叶发酵多糖与未添加扁桃斑鸠菊叶发酵多糖的抗氧化活性比较 Fig. 7 Antioxidant activity comparison of the extracellular polysaccharide between control group and the group with Vernonia amygdalina leaf added. Legend a: Vernonia amygdalina leaf group; Legend b: blank control group; Legend c: vitamin C group |
| |
微生物发酵技术是快速获取目标菌株活性物质的重要手段,但是采用常规的发酵方式往往很难做到快速生产的同时又实现大量生产。药用真菌液体双向发酵技术是一种通过向培养基中添加中药材成分来促进目标菌株生产活性物质,并促使药性基质在真菌酶作用下产生新活性成分的技术[22-23],受这种模式的启发,本研究尝试通过向蛹虫草液体发酵培养基中添加适量的扁桃斑鸠菊叶,来提高蛹虫草胞外多糖的产量。
研究首先探索了发酵的单因素条件,对于扁桃斑鸠菊叶粉末添加量,当大于0.8 g后,蛹虫草发酵液中胞外多糖的产量下降,分析其原因,可能是由于扁桃斑鸠菊叶中的某些成分在达到一定量后会抑制菌株产胞外多糖活性。在探索发酵时间时,发现当发酵时间超过8 d后,发酵液中的胞外多糖反而有所降低,这可能是由于发酵时间过长,培养基无法提供充足的营养物质以维持菌株生长,为维持正常的生理活动,菌丝体进一步消耗了发酵液中可利用的自身代谢产物。在探究pH对胞外多糖产量影响的过程中,发现当pH过酸或过碱时,胞外多糖的产量均会明显下降,这可能是由于过酸或过碱的环境抑制了蛹虫草中产生多糖的酶活性。对于蛹虫草液体菌种接种量,接种量过多,会导致培养基中的营养物质消耗过快,不利于胞外多糖的产生;接种量过少,菌株在有限的时间无法充分利用营养物质合成胞外多糖,因此,在发酵生产中要合理控制接种量。
经过正交实验优化后,我们得到了液体发酵产胞外多糖的最优发酵条件:扁桃斑鸠菊叶粉末添加量8 g/L、发酵时间9 d、pH 6.5、接种量5.0 mL,在此条件下,蛹虫草胞外多糖的产量达到(5.24±0.28) mg/mL。在以往的报道中,也有研究人员尝试通过添加微量金属元素或生长素来促进蛹虫草胞外多糖的生产。2009年,周毅峰等[24]发现添加适量的硒可以有效地促进蛹虫草胞外多糖的产生,在最佳添加量下,胞外多糖的产量相比未添加硒的空白对照组提高了约77%。2017年,郑鑫等[25]研究发现较高浓度的生长调节激素α-萘乙酸(NAA)可以促进蛹虫草胞外多糖的产生,在最优添加量下,胞外多糖产量相比于未加生长素的空白组提高了约80%。在本研究中,扁桃斑鸠菊叶可以显著促进蛹虫草胞外多糖的生产,与未添加扁桃斑鸠菊叶的空白组胞外多糖产量相比提高了约205.20%。
为了解添加扁桃斑鸠菊叶后是否会对蛹虫草胞外多糖的结构和活性产生影响,实验最后对添加扁桃斑鸠菊叶与未添加扁桃斑鸠菊叶生产的胞外多糖红外光谱和抗氧化活性进行了研究,结果显示添加扁桃斑鸠菊叶后的胞外多糖与未添加扁桃斑鸠菊叶的胞外多糖红外主要吸收峰一致,并且对ABTS、DPPH以及羟基自由基的清除能力相近,说明扁桃斑鸠菊叶对蛹虫草液体发酵生产的胞外多糖结构和抗氧化活性影响较小,可以作为一种新的添加剂用于蛹虫草液体发酵中胞外多糖的高效生产。关于扁桃斑鸠菊叶是如何促进蛹虫草产生胞外多糖以及是何种成分发挥着主要作用,还有待后期实验的进一步研究。
| [1] |
Fan HT, Lin HS. Advances on Cordyceps militaris constituents and pharmacological effect.
China J Chin Materia Medica, 2013, 38(15): 2549–2552.
(in Chinese). 樊慧婷, 林洪生. 蛹虫草化学成分及药理作用研究进展. 中国中药杂志, 2013, 38(15): 2549-2552. |
| [2] |
Chen AH, Fan W, Zhang LR, et al. Optimization of extraction of Cordyceps militaris polysaccharides and the antioxidant activity.
J Anhui Agric Sci, 2018, 46(19): 175–178.
(in Chinese). 陈安徽, 范旺, 张良睿, 等. 蛹虫草多糖的提取及抗氧化活性研究. 安徽农业科学, 2018, 46(19): 175-178. DOI:10.3969/j.issn.0517-6611.2018.19.052 |
| [3] |
Liu HJ, Jiang N, Li JJ, et al. Study on extraction and purification of polysaccharides from Cordyceps militaris.
Acta Agric Jiangxi, 2007, 19(12): 80–82.
(in Chinese). 刘红锦, 蒋宁, 李建军, 等. 蛹虫草多糖提取及纯化工艺研究. 江西农业学报, 2007, 19(12): 80-82. DOI:10.3969/j.issn.1001-8581.2007.12.027 |
| [4] |
Wu GH, Wang M. Separation, purification and the immunoregulation effect of polysaccharides in cultured Cordyceps militaris.
Chin J Nat Med, 2007, 5(1): 73–76.
(in Chinese). 吴光昊, 王旻. 蛹虫草多糖的分离及免疫活性的研究. 中国天然药物, 2007, 5(1): 73-76. |
| [5] |
Zhang S, Zhang YJ, Shrestha B, et al. Ophiocordyceps sinensis and Cordyceps militaris: research advances, issues and perspectives.
Mycosystema, 2013, 32(4): 577–597.
(in Chinese). 张姝, 张永杰, ShresthaB, 等. 冬虫夏草菌和蛹虫草菌的研究现状、问题及展望. 菌物学报, 2013, 32(4): 577-597. |
| [6] |
He ZY, Wu TX. Effects of Rhizoma gastrodiae on the submerged fermentation of Polyporus frondosus.
Sci Technol Food Ind, 2011, 32(1): 184–186.
(in Chinese). 贺宗毅, 吴天祥. 天麻对灰树花液体深层发酵的影响. 食品工业科技, 2011, 32(1): 184-186. |
| [7] |
Xu DD. Study on bidirectional fermentation of Morchella esculenta and protocorms of Dendrobium candidum[D]. Dalian: Dalian Polytechnic University, 2015 (in Chinese). 徐丹丹.羊肚菌与铁皮石斛原球茎的双向发酵[D].大连: 大连工业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10152-1015621376.htm |
| [8] |
Li YL, Su YY, Miao M, et al. Studies on fermentation conditions for exopolysaccharides production by Cordyceps militaris.
J Taishan Med College, 2007, 28(12): 942–944.
(in Chinese). 李艳玲, 苏延友, 苗苗, 等. 泰山蛹虫草菌产胞外多糖发酵工艺的研究. 泰山医学院学报, 2007, 28(12): 942-944. DOI:10.3969/j.issn.1004-7115.2007.12.007 |
| [9] |
Ye WJ. Studies on optimization of fermentation conditions, structure and antioxidant activity of Cordyceps militaris polysaccharides[D]. Wuhan: Huazhong Agricultural University, 2014 (in Chinese). 叶文姣.蛹虫草多糖的发酵条件优化、结构及抗氧化活性研究[D].武汉: 华中农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10504-1014213306.htm |
| [10] |
Wang YM, Zhu WX, An LG, et al. Optimized cultivation conditions and production efficiency of mycelium and lixiviated cordycepic polysaccharide of Cordyceps militaris.
J Unive Jinan: Sci & Tech, 2010, 24(2): 148–151.
(in Chinese). 王永敏, 祝文兴, 安利国, 等. 优化条件对蛹虫草菌丝体与胞外多糖得率研究. 济南大学学报:自然科学版, 2010, 24(2): 148-151. |
| [11] |
Yang Z. Antitumor research and clinical applications of bitter leaf.
J Nanjing Univ Tradit Chin Med, 2013, 29(4): 397–400.
(in Chinese). 杨早. 南非叶化学成分及药理作用研究进展. 南京中医药大学学报, 2013, 29(4): 397-400. DOI:10.3969/j.issn.1000-5005.2013.04.027 |
| [12] |
Huang W, Li XQ, Liu J, et al. Effects of different hormone combinations on callus inducing of shoot explant from bitter leaf (Vernonia amygdallina Del).
J Trop Biol, 2017, 8(4): 419–423.
(in Chinese). 黄伟, 黎秀琼, 刘娇, 等. 不同激素配比对南非叶茎愈伤组织诱导的影响. 热带生物学报, 2017, 8(4): 419-423. |
| [13] | Audu SA, Taiwo AE, Ojuolape AR. A study review of documented phytochemistry of Vernonia amygdalina (family asteraceae) as the basis for pharmacologic activity of plant extract. J Natl Sci Res, 2012, 2(7): 1–8. |
| [14] |
Chen CF, Xiang XY, Gu Q, et al. Submerged fermentation conditions for synthesis of extracellular polysaccharide by Inonotus obliquus.
Chin Tradit Herbal Drugs, 2007, 38(3): 358–361.
(in Chinese). 陈才法, 项小燕, 顾琪, 等. 桦褐孔菌胞外多糖合成的深层发酵条件研究. 中草药, 2007, 38(3): 358-361. DOI:10.3321/j.issn:0253-2670.2007.03.016 |
| [15] |
Meng FL, Song ZF, Liu XX, et al. Determination of cordycepin and total sugar in Cordyceps sinensis and Cordyceps militaris.
Food Res Dev, 2017, 38(21): 146–149.
(in Chinese). 孟繁磊, 宋志峰, 刘笑笑, 等. 冬虫夏草与蛹虫草中虫草素和总糖含量测定. 食品研究与开发, 2017, 38(21): 146-149. DOI:10.3969/j.issn.1005-6521.2017.21.028 |
| [16] |
Zhang TX, Wang B, Zhang X, et al. Study on the degradation of sugars in Lentinus edodes fermentation broth by Bacillus subtilis.
Food Ind, 2017, 38(1): 184–187.
(in Chinese). 张腾霄, 王斌, 张希, 等. 枯草芽孢杆菌对香菇发酵液糖类成分降解规律研究. 食品工业, 2017, 38(1): 184-187. |
| [17] |
Zhang JG, Chen XM, He XS. Kinetic model for exopolysaccharides (EPS) of Ganoderma lucidum in batch fermentation.
Chin J Biotech, 2007, 23(6): 1065–1070.
(in Chinese). 张建国, 陈晓明, 贺新生. 灵芝胞外多糖分批发酵动力学模型. 生物工程学报, 2007, 23(6): 1065-1070. DOI:10.3321/j.issn:1000-3061.2007.06.018 |
| [18] |
Han LR, Cheng D, Wang LR, et al. Structure and immunomodulatory activity of extracellular polysaccharide from Grifola frondosa.
Chin J Biotech, 2016, 32(5): 648–656.
(in Chinese). 韩丽荣, 程代, 王莉蕊, 等. 灰树花胞外多糖的结构及免疫调节活性. 生物工程学报, 2016, 32(5): 648-656. |
| [19] |
Sun XQ, Zhou DQ, Wang SS, et al. Study on enhancement of antioxidant activity of tofu whey by fermentation with three species of Lactobacillus.
Food Res Dev, 2017, 38(18): 1–6.
(in Chinese). 孙晓琦, 周德庆, 王珊珊, 等. 3种乳酸菌发酵提高黄浆水抗氧化能力的研究. 食品研究与开发, 2017, 38(18): 1-6. |
| [20] | Saiga A, Tanabe S, Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment. J Agric Food Chem, 2003, 51(12): 3661–3667. DOI: 10.1021/jf021156g |
| [21] |
Bai SW, Tang C, Tian J, et al. Extraction and antioxidant activity of total flavonoids from Sea buckthorn pomace.
Food Sci, 2015, 36(10): 59–64.
(in Chinese). 白生文, 汤超, 田京, 等. 沙棘果渣总黄酮提取工艺及抗氧化活性分析. 食品科学, 2015, 36(10): 59-64. DOI:10.7506/spkx1002-6630-201510012 |
| [22] |
Li Y, Yang S, Wan DG. Advances and existed problems in studies on liquid fermentation of medicinal fungi.
Chin Tradit Herb Drugs, 2012, 43(10): 2066–2070.
(in Chinese). 李羿, 杨胜, 万德光. 药用真菌液体发酵研究进展及存在问题探讨. 中草药, 2012, 43(10): 2066-2070. |
| [23] |
Zhuang Y, Pan Y, Xie XM, et al. The origin, development and its advantage and potential of "the bi-directional solid fermentation" for medicinal fungi.
Edible Fungi China, 2007, 26(2): 3–6.
(in Chinese). 庄毅, 潘扬, 谢小梅, 等. 药用真菌"双向发酵"的起源、发展及其优势与潜力. 中国食用菌, 2007, 26(2): 3-6. DOI:10.3969/j.issn.1003-8310.2007.02.001 |
| [24] |
Zhou YF, Cai ZX, Qin EH, et al. Effects of selenium on metabolism and total antioxidation of Cordyceps militari hypha.
China Brew, 2009, 28(4): 48–51.
(in Chinese). 周毅峰, 蔡忠雄, 秦恩华, 等. 硒对蛹虫草菌丝代谢和总抗氧化能力的影响. 中国酿造, 2009, 28(4): 48-51. DOI:10.3969/j.issn.0254-5071.2009.04.013 |
| [25] |
Zheng X, Tao CY, Xu JL, et al. Effect of three kinds of auxin on the liquid fermentation of Cordyceps militaris.
Edible Fungi China, 2017, 36(6): 68–71.
(in Chinese). 郑鑫, 陶春雨, 徐嘉潞, 等. 3种生长素对蛹虫草液体发酵的影响. 中国食用菌, 2017, 36(6): 68-71. |
 2019, Vol. 35
2019, Vol. 35