中国科学院微生物研究所、中国微生物学会主办
文章信息
- 郭玉杰, 涂涛, 邱锦, 彤丽格, 罗会颖, 姚斌
- Guo Yujie, Tu Tao, Qiu Jin, Tong Lige, Luo Huiying, Yao Bin
- 篮状菌Talaromyces leycettanus JCM12802来源的高温葡萄糖淀粉酶性质与结构
- Characterization and structure of a novel thermostable glucoamylase from Talaromyces leycettanus JCM12802
- 生物工程学报, 2019, 35(4): 616-625
- Chinese Journal of Biotechnology, 2019, 35(4): 616-625
- 10.13345/j.cjb.180330
-
文章历史
- Received: August 15, 2018
- Accepted: November 7, 2018
- Published: November 26, 2018
葡萄糖淀粉酶(EC 3.2.1.3)又称糖化酶,它能够从淀粉糖链的非还原末端切下葡萄糖分子,是一种典型的外切酶[1]。葡萄糖淀粉酶在食品、医药和发酵工业等行业都有广泛应用[2-4],尤其是对于葡萄糖的生产。葡萄糖的工业生产主要分为淀粉液化和糖化两步。首先是高温α-淀粉酶在95–105 ℃、pH 5.5–6.5的条件下将淀粉分解成寡糖和麦芽糖,降低黏度;然后冷却降温到60–65 ℃、调整pH至4.0–4.5后,添加葡萄糖淀粉酶分解寡糖和麦芽糖,最终生成葡萄糖[5]。工业生产中所用的α-淀粉酶有极好的温度稳定性,在95–105 ℃条件下能够快速完成淀粉的液化。但是葡萄糖淀粉酶的最适反应温度相对较低,在进行糖化反应之前需要进行降温处理。提高糖化过程的反应温度不仅可以减少降温过程的处理时间,而且还能够增加底物溶解度,降低底物黏度,有效降低染菌风险和加快反应速率[4]。但是,一直以来糖化酶的最适反应温度和热稳定性距离期望值还有一定的差距[6-7],因此高温葡萄糖淀粉酶的研究一直都备受关注。
目前,工业普遍应用的葡萄糖淀粉酶主要来源于黑曲霉、泡盛曲霉和米根霉等丝状真菌。这些葡萄糖淀粉酶在碳水化合物活性酶(Carbohydrate- active enzymes, CAZy)数据库中属于GH15家族。在三维结构上,它们通常含有一个催化域(Catalytic domain, CD)和一个淀粉结合域(Starch- binding domain, SBD);两个结构域之间通过富含O-糖基化的Linker连接,也有一些葡萄糖淀粉酶只存在催化域[8]。糖化酶的催化区域是一个通过(α/α)6形成的漏斗状活性中心,主要负责底物的水解[9];淀粉结合域可以有效地结合淀粉颗粒协同催化域水解不溶性底物,它通常位于葡萄糖淀粉酶的C端,但是来源于稻根霉菌Rhizopus oryzae葡萄糖淀粉酶的SBD位于其催化结构域的N端[10]。有关葡萄糖淀粉酶结构的研究起始较早,当前被PDB (Protein Data Bank)数据库收录的葡萄糖淀粉酶晶体结构有很多[11],但是早期报道的葡萄糖淀粉酶结构只有催化结构域。Li等[12]对红褐肉座菌Hypocrea jecorina来源的葡萄糖淀粉酶HjGA进行了晶体结构的解析,成功报道了第一个涵盖了催化域、淀粉结合域和连接域完整的葡萄糖淀粉酶的晶体结构(2VN4)。近来,工业上应用最广泛的3种葡萄糖淀粉酶HrGA、PoGA和AnGA完整的晶体结构也相继被成功解析并报道[13]。以上研究主要分析了葡萄糖淀粉酶整体的结构特点及其与催化底物反应的关系,针对其与温度稳定性相关的结构分析尚未见报道。由于高温葡萄糖淀粉酶资源相对匮乏和与温度稳定性相关的结构特点尚不清楚,当前提高葡萄糖淀粉酶温度稳定性的研究主要通过定向进化的方法[14-15]。该方法需要建立庞大的突变体库,筛选过程耗时较长且工作量大。因此,新颖高温葡萄糖淀粉酶的基因资源挖掘和结构特点的分析对于高温葡萄糖淀粉酶的研究具有重要意义。
嗜热真菌是高温葡萄糖淀粉酶的重要来源之一[5],目前报道的产葡萄糖淀粉酶的嗜热真菌有篮状菌属Talaromyces[16]、嗜热真菌属Thermomyces[17]和毛壳菌属Chaetomium[18]等。T. leycettanus JCM12802的最适生长温度为40 ℃,属于典型的嗜热真菌。该真菌来源的众多酶资源已被发掘和研究,且大多具有较高的温度特性,例如淀粉酶、木聚糖酶、葡聚糖酶、甘露聚糖酶和果胶酶等[19-23]。本研究中,我们从嗜热真菌T. leycettanus JCM12802基因组中检索到一个葡萄糖淀粉酶基因,并命名为Tlga15A。将其成功克隆后在毕赤酵母中进行高效异源表达和基本性质研究,发现其具有较高的反应温度和温度稳定性,在工业葡萄糖生产中有较大应用潜力。最后,我们针对高温葡萄糖淀粉酶TlGA的结构特点进行了初步分析,为今后的突变研究提供了思路。
1 材料与方法 1.1 菌株、载体及试剂菌株T. leycettanus JCM12802购自日本微生物保藏中心(Japan Collection of Microorganisms, JCM),活化和培养所选用的培养基均为马铃薯葡萄糖培养基(PDA),培养温度为40 ℃。用于基因克隆的载体为pEASY-T3,宿主菌为大肠杆菌Trans-T1,均购自北京全式金生物技术有限公司。葡萄糖淀粉酶基因Tlga15A的表达载体为pPIC9,表达宿主为毕赤酵母GS115。试验中所用的总RNA提取试剂盒和反转录试剂盒分别购自天根生化科技有限公司和东洋纺生物科技有限公司;DNA高保真聚合酶FastPfu Fly购自北京全式金生物技术有限公司;质粒提取试剂盒购自Omega,限制性内切酶均购自NEB。用于酶活测定的可溶性淀粉、支链淀粉、直链淀粉、糖原、糊精、普鲁兰酶、α-环糊精、β-环糊精、γ-环糊精等底物均购自Sigma-Aldrich。其他常见化学试剂均为分析纯。
1.2 培养基的配制实验中所用的培养基有马铃薯葡萄糖固体培养基(PDA)、马铃薯葡萄糖液体培养基(PDB)、LB液体培养基、LB固体培养基、MD固体培养基、BMGY培养基、BMMY培养基和YPD培养基。其详细制备方法可参照文献[24]。
1.3 基因序列信息的获取及分析根据T. leycettanus JCM12802的全基因组测序结果,查找到一个GH15家族葡萄糖淀粉酶基因并命名为Tlga15A,然后对该基因进行生物信息学分析。将葡萄糖淀粉酶TlGA的基因序列通过Blast (http://blast.ncbi.nlm.nih.gov/Blast/)检索同源序列,从而对该基因的新颖性进行评估,然后提交Softberry (http://linux1.softberry.com/berry.phtml),对基因的内含子和外显子进行预测。利用Vector NTI Advance 10.0软件将基因序列翻译成氨基酸序列后,并分析其编码蛋白质的序列长度、等电点和分子量等信息。利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)预测其编码蛋白质的信号肽序列。
1.4 葡萄糖淀粉酶基因Tlga15A的克隆与毕赤酵母表达载体构建将菌株T. leycettanus JCM12802在40 ℃摇瓶培养活化,48 h后转接以淀粉为唯一碳源的诱导培养基中培养3–4 d,12 000 r/min离心收集菌体。根据总RNA提取试剂盒使用说明提取菌体的总RNA,然后参照东洋纺ReverTra Ace-a-TM kit反转录试剂盒方法,将RNA反转录合成cDNA。通过分析基因Tlga15A的全长序列和编码的成熟氨基酸序列,去除信号肽序列后,设计分别含有EcoRⅠ和NotⅠ酶切位点的引物TlGAF (5′-GGGGAAT TCGCACCACAGCCTGTGCTTCCCAGAG-3′)和TlGAR (5′-GGGGCGGCCGCCTATCTCCAGGTAT CGTTCTCCGTC-3′),然后以cDNA为模板进行PCR扩增。将扩增产物用EcoRⅠ和NotⅠ双酶切后连入pPIC9载体转化Trans1-T1大肠杆菌感受态,挑选阳性克隆并测序验证。
1.5 葡萄糖淀粉酶TlGA的表达与纯化将经测序验证正确的表达载体pPIC9_Tlga15A用限制性内切酶DraⅠ线性化处理,电击转入毕赤酵母GS115感受态细胞中;将转化子涂布组氨酸缺陷型的MD平板于30 ℃培养箱培养2 d,然后挑取48个单克隆菌落于3 mL BMGY液体培养基中培养(30 ℃、250 r/min),培养2 d后4 500 r/min离心5 min,弃上清培养基并收集菌体,然后重悬于1.0 mL的BMMY诱导培养基中诱导培养2 d。最后,通过酶活检测挑选出活性最高的克隆子进行摇瓶放大培养。
将筛选的高酶活转化子用YPD培养基活化后接种于300 mL BMGY液体培养基中,接种量为1% (V/V)。30 ℃条件下培养48 h后,4 500 r/min离心5 min收集菌体,转入200 mL含有0.5%甲醇的BMMY液体培养基继续培养48 h,期间每隔12 h补加1 000 μL甲醇,使甲醇终浓度控制在0.5%左右。
培养结束后,将粗酶液1 2000 r/min离心10 min收集上清液,并用截留分子量为10 kDa的膜包(Vivascience)浓缩至10 mL,然后于pH 6.5、10 mmol/L柠檬酸-磷酸盐缓冲液中过夜透析。将透析处理的酶液通过阴离子交换层析(HiTrap Q XL)进行纯化,获得单一组分的目的蛋白。将纯化后的蛋白用Endo H (NEB)处理去除N-糖基化修饰。最后,将纯化后的蛋白与去除N-糖基化修饰的蛋白进行SDS-PAGE分析。
1.6 TlGA的酶活力测定及性质研究葡萄糖淀粉酶TlGA活力测定所使用的底物为1%可溶性淀粉,在由900 μL底物和100 μL的酶液组成的反应体系中(pH 4.5),75 ℃条件下反应30 min,使用3, 5-二硝基水杨酸(DNS)法检测还原糖生成量[25],每分钟产生1 μmol葡萄糖所需要的酶量即为一个酶活力单位,符号为U/mL。
测定葡萄糖淀粉酶的最适pH时,将纯化的葡萄糖淀粉酶TlGA分别置于不同pH的反应环境中,75 ℃条件下反应30 min,然后测定还原糖的生成量,分别计算不同pH条件下的酶活,其中酶活最高时对应的pH值即为该酶的最适pH。pH稳定性的测定方法为将纯化的酶液调至在pH 1.0–12.0范围内,37 ℃下孵育1 h,然后于pH 4.5条件下75 ℃反应30 min测定其剩余酶活,计算不同pH处理下的相对剩余酶活。
葡萄糖淀粉酶TlGA最适温度测定方法为将纯化的酶用pH 4.5的柠檬酸-磷酸氢二钠缓冲溶液(50 mmol/L)稀释到合适的浓度,添加到相同pH的底物溶液中;分别检测其在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、75 ℃、80 ℃、85 ℃条件下酶活力,其中酶活最高时的反应温度即为该酶的最适反应温度。将纯化的葡萄糖淀粉酶分别在60 ℃、65 ℃和70 ℃条件下孵育2–60 min不同时间,然后测定其剩余酶活。以0 ℃处理的样品为参照(100%),分别计算不同温度条件下处理不同时间后样品的剩余酶活。
1.7 不同金属离子和化学试剂对葡萄糖淀粉酶TlGA活力的影响Na+、K+、Ag+、Cu2+、Mg2+、Mn2+、Ca2+、Ni2+、Pb2+、Zn2+、Fe3+、Cr3+、SDS、EDTA和β-巯基乙醇等金属离子及化学试剂对TlGA活力的影响。在酶促反应体系中加入以上金属离子和化学试剂,使其终浓度为5 mmol/L。然后,在标准反应条件下测定葡萄糖淀粉酶活力;以未添加任何试剂的反应体系为对照组;最终,计算金属离子及化学试剂对酶活性的影响,每组试剂设置3个平行反应。
1.8 TlGA的酶学动力学及底物特异性研究用pH 4.5的柠檬酸-磷酸氢二钠缓冲溶液配制浓度为1–10 mg/mL不等的可溶性淀粉,糊化后作为反应底物。然后在pH 4.5、75 ℃条件下反应5 min并测定不同底物浓度下的酶活。将酶活数据使用GraphPad Prism 5.01进行处理分析。
分别选取支链淀粉、糖原、普鲁兰、糊精、直链淀粉、α-环糊精、β-环糊精、γ-环糊精为底物,用pH 4.5的柠檬酸-磷酸氢二钠缓冲溶液配制浓度为5 mg/mL。将酶液稀释到合适的浓度后,分别测定葡萄糖淀粉酶TlGA对不同底物在75 ℃条件下的酶活力。以可溶性淀粉为底物时的酶活为100%,分别计算其他底物的相对酶活力。
1.9 TlGA同源建模与结构分析为了探究葡萄糖淀粉酶TlGA的高温机制和与之对应的结构特点,需要通过同源建模的方法获得葡萄糖淀粉酶TlGA三维结构。首先,将TlGA的氨基酸序列输入PDB数据进行检索;其次,综合考虑一致性和覆盖度两个指标挑选适合的模板;最后,利用软件Discovery Studio 2017进行三维结构的预测和构建。
2 结果与分析 2.1 葡萄糖淀粉酶基因Tlga15A的克隆与序列分析从T. leycettanus JCM12802成功克隆葡萄糖淀粉酶编码基因Tlga15A并提交GenBank数据库,序列注册号为MH730064。该基因全长为2 186 bp,包含4个内含子,长度分别为88 bp、57 bp、66 bp和64 bp。葡萄糖淀粉酶基因Tlga15A的cDNA全长为1 911 bp,能够编码636个氨基酸。对其编码的氨基酸序列进行信号肽预测分析结果表明,其N端的前20个氨基酸残基是其信号肽序列。成熟肽部分的理论分子量为63.3 kDa,预测等电点为4.76。网站预测有3个潜在的N-糖基化修饰位点,分别为N183、N443和N572。葡萄糖淀粉酶TlGA的氨基酸序列与丝衣霉Byssochlamys spectabilis来源的葡萄糖淀粉酶GAD95639最为相似,一致性为76%;与已报道过性质的葡萄糖淀粉酶P69328[26]的序列一致性为70.6%;并与来源于泡盛曲霉Aspergillus awamori的葡萄糖淀粉酶晶体结构1GAI_A的序列一致性为75%。
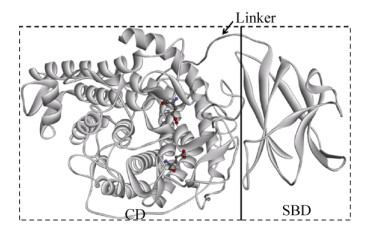
2.2 葡萄糖淀粉酶TlGA同源建模与结构分析在PDB数据库中,TlGA与泡盛曲霉Aspergillus awamori来源的葡萄糖淀粉酶晶体结构1GAI_A有最高的序列一致性(75%),但是覆盖度仅有74%;而与黑曲霉Aspergillus niger来源的葡萄糖淀粉酶晶体结构6FRV_A的序列一致性为70%,其覆盖度可高达95%。因此,我们以1GAI_A和6FRV_A同时作为模板进行同源建模。从结构上来看(图 1),TlGA由2个结构域组成:底物结合域(SBD)和催化结构域(CD),二者之间为连接域(Linker)。从序列比对的结果来看,TlGA的底物结合域属于CBM20,位于葡萄糖淀粉酶的C-末端。该区域在序列上富含苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸残基,其二级结构主要是由7段β-折叠片反向平行折叠形成的β-卷筒结构。葡萄糖淀粉酶催化域含有440个氨基酸残基,是由13股α-螺旋组成的(α/α)6桶状结构。Glu188和Glu409组成葡萄糖淀粉酶催化中心,Glu188作为质子供体将H+传递给淀粉链中易断裂键的糖苷键上形成含氧碳正离子,然后水分子在Glu409协助下发起亲核攻击,从而使糖苷键断裂。葡萄糖淀粉酶的连接域是一段高度O-糖基化的多肽链,长度为73个氨基酸。该区域富含Ser和Thr残基并且容易发生O-糖基化。糖基化作用能够有效稳定蛋白质骨架,避免蛋白酶水解,增强糖化酶亲和力和增加糖化酶热稳定性等作用。
|
| 图 1 TlGA的三维结构 Fig. 1 Overall structure of TlGA. |
| |
将转化了Tlga15A基因的GS115毕赤酵母菌株进行摇瓶发酵,获得粗酶液后进行浓缩、纯化和SDS-PAGE分析。结果显示TlGA的目的条带大小为75 kDa (图 2A),Endo H酶处理后,目的条带有轻微减小,但仍旧比63.3 kDa的理论分子量大。可能的原因是连接催化域(CD)和底物结合域(CBM)的Linker区存在大量的O糖基化位点,从而导致电泳条带远大于理论分子量。为了进一步确认纯化得到的蛋白是编码葡萄糖淀粉酶TlGA的目标蛋白,将条带进行质谱检测,检测结果显示有5个片段能与目的序列完全匹配,其覆盖度为39% (图 2B)。质谱结果充分证明了75 kDa附近的蛋白条带是目的蛋白。

|
| 图 2 TlGA的SDS-PAGE及质谱检测分析 Fig. 2 SDS-PAGE and mass spectrometry (MS) analysis of recombinant TlGA. (A) SDS-PAGE analysis of recombinant TlGA. Lane M: the standard modecule weight; Lane 1: concentrated TlGA with a flow 200 ultrafiltration membrane; Lane 2: purified TlGA; Lane 3: purified TlGA treated with Endo H. (B) Amino acid sequence of TlGA. The correspondence of MS was labeled with shadow and underline. |
| |
与多数真菌来源的葡萄糖淀粉酶相似,TlGA在酸性条件下有较高的酶活力。其最适pH为4.5 (图 3A),在pH 3.0–5.5范围内保持40%以上的酶活力;在pH 7.0的中性条件和碱性条件下葡萄糖淀粉酶完全丧失活力。葡萄糖淀粉酶TlGA在较宽的pH范围内均能保持稳定,在pH 3.0–9.0范围内37 ℃处理1 h,都有80%以上的剩余酶活(图 3B)。在40–75 ℃的温度范围内,重组的葡萄糖淀粉酶TlGA随着反应温度升高,糖化酶活性逐步增加,75 ℃时达到最高酶活力;当反应温度超过75 ℃时,酶活骤降;反应温度为80 ℃时,仅有不到20%的酶活(图 3C)。TlGA具有较好的热稳定性,65 ℃处理1 h,酶活损失在30%以内;70 ℃条件下处理30 min,仍有43%的剩余酶活;75 ℃条件下处理5 min的剩余酶活约为40% (图 3D)。

|
| 图 3 TlGA的基本酶学性质(A:最适pH;B:pH稳定性;C:最适温度;D:温度稳定性) Fig. 3 Characterization of purified recombinant TlGA. (A) Effect of pH on enzyme activities. (B) pH stabilities. (C) Effect of temperature on enzyme activities. (D) Thermostability. |
| |
尽管很多α-淀粉酶都存在金属离子激活效应,但是一些常见的离子对葡萄糖淀粉酶TlGA促进作用并不明显。Na+、Ca2+、Cu2+和Zn2+对葡萄糖淀粉酶有一定的促进作用;而Ag+ (62.2%)、Mn2+ (82.2%)、β-Mercaptoeth (61.8±0.98)、EDTA (89.7±1.41)和SDS (24.3±0.75)能有效抑制其酶活力(表 1)。
| Chemicals | Relative activity (%) | Chemicals | Relative activity (%) |
| Control | 100.0±0.9 | Ni2+ | 109.8±1.3 |
| K+ | 98.0±1.1 | Cr3+ | 105.5±1.6 |
| Mg2+ | 109.5±1.2 | Cu2+ | 116.6±1.2 |
| Na+ | 115.2±0.7 | Zn2+ | 117.2±1.2 |
| Ca2+ | 113.9±0.4 | Fe3+ | 98.7±1.2 |
| Pb2+ | 106.1±0.7 | β-Mercaptoethanol | 61.8±0.9 |
| Ag+ | 62.2±1.2 | EDTA | 89.7±1.4 |
| Mn2+ | 82.2±2.8 | SDS | 24.3±0.8 |
纯化的葡萄糖淀粉酶TlGA以可溶性淀粉为底物时,在75 ℃、pH 4.5的条件下的比活力为(255.6±15.3) U/mg;Km值为(1.79±0.11) mg/mL,Vmax值为(276.0±3.5) μmol/(min·mg)。葡萄糖淀粉酶TlGA不仅可以高效地催化可溶性淀粉的水解,对其他底物也表现出较高的水解活性。对支链淀粉、糖原、糊精、普鲁兰的比活力分别为(342.3±24.7) U/mg、(185.4±12.5) U/mg、(423.3±29.3) U/mg和(65.7±8.1) U/mg (表 2)。对于直链淀粉、α-环糊精、β-环糊精、γ-环糊精等底物未检测到活性。
| Substrates | Km(mg/mL) | Specific activities (U/mg) |
| Amylopectin | 1.6±0.2 | 342.3±24.7 |
| Soluble starch | 1.8±0.1 | 255.6±15.3 |
| Glycogen | 2.7±0.2 | 185.4±12.5 |
| Dextrin | 1.1±0.1 | 423.3±29.3 |
| Pullulan | 2.4±0.1 | 65.7±8.1 |
工业制糖过程通常是在较高的温度条件下完成的,因此要求葡萄糖淀粉酶要有较高的温度稳定性。目前黑曲霉的葡萄糖淀粉酶AnGA应用最为广泛[4, 27],其最适反应温度为65–70 ℃,通常在60 ℃条件下能够保持稳定[4]。在本研究中,从嗜热真菌T. leycettanus JCM12802中获得了一个高温葡萄糖淀粉酶TlGA,其最适温度为75 ℃,65 ℃处理1 h仍剩余70%以上的酶活,在最适温度和温度稳定性上优于当前工业上广泛应用的葡萄糖淀粉酶。通常真菌来源的葡萄糖淀粉酶温度稳定性较差[8],而嗜热真菌一直以来都是高温糖化酶的重要来源之一[28]。Nielsen等从嗜热真菌Talaromyces emersonii克隆了一个耐热葡萄糖淀粉酶基因pJaL518,并在黑曲霉A. niger中进行了表达[16]。该葡萄糖淀粉酶的最适温度为70 ℃,低于T. leycettanus来源的葡萄糖淀粉酶TlGA (75 ℃);但是二者在温度稳定性方面差距并不明显,可能的原因是由表达宿主差异导致糖基化程度不同造成的。结合高温葡萄糖淀粉酶TlGA的性质特点,以低温葡萄糖淀粉酶AmyT1[29]和中温葡萄糖淀粉酶HjGA[12]为参照,从蛋白的一级结构、二级结构和三级结构这3个层面进行了比较分析。
分析葡萄糖淀粉酶一级结构时,主要从特殊氨基酸组成、N-糖基化位点和形成二硫键数目这3个特点进行比较分析。Arg和Pro在3种不同葡萄糖淀粉酶序列中出现的频率差异不大,但是Gly在TlGA中所占的比例明显低于HjGA和AmyT1 (表 3)。Gly作为柔性最强的氨基酸,它在蛋白分子中出现的频率与整个蛋白分子的柔性密切相关,这在以往的研究中已被广泛证实[30]。根据报道,蛋白的糖基化程度和二硫键数目也与其稳定性密切相关[31, 32];我们对其进行了比较分析,发现在不同葡萄糖淀粉酶分子的N-糖基化位点与其温度特点没有明显规律;但是在二硫键组成方面,低温葡萄糖淀粉酶AmyT1和中温葡萄糖淀粉酶HjGA均有4对二硫键,而高温葡萄糖淀粉酶TlGA仅有3对。众所周知,二硫键是维持蛋白酶稳定的重要作用力;在蛋白的热稳定性改良时,引入二硫键也是一个重要的策略。但是在高温葡萄糖淀粉酶TlGA材料中二硫键缺失的生物学意义尚不清楚。因此,从氨基酸组成上来看,低频率的Gly是葡萄糖淀粉酶TlGA高温耐受性的重要原因之一。
| TlGA | HjGA | AmyT1 | |
| Total number of amino acid | 616 | 617 | 616 |
| Primary structure | |||
| Arg | 17 (2.75%) | 18 (2.91%) | 28 (4.54%) |
| Gly | 43 (6.98%) | 49 (7.94%) | 52 (8.44%) |
| Pro | 28 (4.54%) | 27 (4.38%) | 28 (4.54%) |
| Ratio of Gly/Pro | 1.54 | 1.81 | 1.85 |
| The number of disulfide bond | 3 | 4 | 4 |
| The number of N-glycosylation site | 6 | 4 | 6 |
| Secondary structure | |||
| Amino acid number for α-helix | 252 (40.92%) | 255 (41.33%) | 243 (39.45%) |
| Amino acid number for β-pleated sheet | 99 (16.07%) | 101 (16.37%) | 98 (15.91%) |
| Amino acid number for random coil | 265 (43.01%) | 261 (42.30%) | 275 (44.64%) |
| Tertiary structure | |||
| Solvent accessible surface (SASA, Å2) | 13 808.2 | 13 669.7 | 14 057.4 |
| Exposed nonpolarity SASA (Å2) | 6 857.5 | 7 680.6 | 7 657.2 |
| Exposed polarity SASA (Å2) | 3 722.0 | 2 892.9 | 3 291.9 |
| Exposed charge SASA (Å2) | 3 228.7 | 3 095.5 | 3 108.3 |
蛋白的二级结构原件主要包括α-螺旋、β折叠和无规则卷曲,蛋白二级结构的组成往往会影响蛋白整体的稳定性[30]。因此,我们对高温葡萄糖淀粉酶TlGA、中温葡萄糖淀粉酶HjGA和低温葡萄糖淀粉酶AmyT1的二级结构进行了统计。从结果可以看出,高温葡萄糖淀粉酶TlGA在二级结构组成和占比上与HjGA和AmyT1没有明显差异(表 3)。可能的原因是3种葡萄糖淀粉酶在序列上有很高的相似性,从而其二级结构的差异也不明显。因此,从二级结构层面并不能很好地解释葡萄糖淀粉酶TlGA的高温机制。
在三级结构层面上,我们主要分析不同葡萄糖淀粉酶分子的溶剂可及表面积并比较它们的差异。与中温葡萄糖淀粉酶HjGA和低温葡萄糖淀粉酶AmyT1相比,高温葡萄糖淀粉酶TlGA的非极性残基的溶剂可及表面积明显小于HjGA和AmyT1 (表 3)。疏水作用力是维持蛋白质三级结构稳定的主要因素,因此,过多的疏水残基暴露在溶剂环境是影响蛋白稳定的重要原因。非极性残基的溶剂可及表面积越小,整个蛋白分子在三级结构上越稳定。因此,从氨基酸组成上来看,较小的非极性残基的溶剂可及表面积是葡萄糖淀粉酶TlGA高温耐受性的又一重要原因。
综上所述,本研究获得了一个新颖的高温葡萄糖淀粉酶基因Tlga15A,并在毕赤酵母中成功进行了高效表达。该葡萄糖淀粉酶有较高的最适反应温度和温度稳定性,同时对普鲁兰有较好的降解活性。这些特点使其在工业制糖中有很好的应用前景。另外,我们分析了TlGA的结构特点,对葡萄糖淀粉酶的分子改造具有重要的指导意义。
| [1] | Sauer J, Sigurskjold BW, Christensen U, et al. Glucoamylase: structure/function relationships, and protein engineering. Biochim Biophys Acta, 2000, 1543(2): 275–293. DOI: 10.1016/S0167-4838(00)00232-6 |
| [2] | Nguyen QD, Rezessy-Szabó JM, Claeyssens M, et al. Purification and characterisation of amylolytic enzymes from thermophilic fungus Thermomyces lanuginosus strain ATCC 34626. Enzyme Microb Technol, 2002, 31(3): 345–352. DOI: 10.1016/S0141-0229(02)00128-X |
| [3] | Pandey A, Nigam P, Soccol CR, et al. Advances in microbial amylases. Biotechnol Appl Biochem, 2000, 31: 135–152. DOI: 10.1042/BA19990073 |
| [4] | Kumar P, Satyanarayana T. Microbial glucoamylases: characteristics and applications. Crit Rev Biotechnol, 2009, 29(3): 225–255. DOI: 10.1080/07388550903136076 |
| [5] | Saha BC, Zeikus JG. Microbial glucoamylases: biochemical and biotechnological features. Starch-Starke, 1989, 41(2): 57–64. DOI: 10.1002/(ISSN)1521-379X |
| [6] | Liu Y, Li QS, Zhu HL, et al. Purification and characterization of two thermostable glucoamylases produced from Aspergillus niger B-30. Chem Res Chin Univ, 2013, 29(5): 917–923. DOI: 10.1007/s40242-013-3074-y |
| [7] |
Wu J, Duan XG. Research progress of enzymes involved in starch processing.
J Chin Inst Food Sci Technol, 2015, 15(6): 14–25.
(in Chinese). 吴敬, 段绪果. 淀粉加工用酶研究进展. 中国食品学报, 2015, 15(6): 14-25. |
| [8] | Hostinová E, Gašperík J. Yeast glucoamylases: molecular-genetic and structural characterization. Biologia, 2010, 65(4): 559–568. |
| [9] | Coutinho PM, Reilly PJ. Glucoamylase structural, functional, and evolutionary relationships. Proteins, 1997, 29(3): 334–347. DOI: 10.1002/(ISSN)1097-0134 |
| [10] | Lin SC, Liu WT, Liu SH, et al. Role of the linker region in the expression of Rhizopus oryzae glucoamylase. BMC Biochem, 2007, 8(1): 9. |
| [11] | Li ZL, Wei PY, Cheng HR, et al. Functional role of β domain in the Thermoanaerobacter tengcongensis glucoamylase. Appl Microbiol Biotechnol, 2014, 98(5): 2091–2099. DOI: 10.1007/s00253-013-5051-2 |
| [12] | Bott R, Saldajeno M, Cuevas W, et al. Three-dimensional structure of an intact glycoside hydrolase family 15 glucoamylase from Hypocrea jecorina. Biochemistry, 2008, 47(21): 5746–5754. DOI: 10.1021/bi702413k |
| [13] | Roth C, Moroz OV, Ariza A, et al. Structural insight into industrially relevant glucoamylases: flexible positions of starch-binding domains. Acta Crystallogr Sect D Struct Biol, 2018, 74(5): 463–470. DOI: 10.1107/S2059798318004989 |
| [14] | McDaniel A, Fuchs E, Liu Y, et al. Directed evolution of Aspergillus niger glucoamylase to increase thermostability. Microb Biotechnol, 2008, 1(6): 523–531. DOI: 10.1111/mbt.2008.1.issue-6 |
| [15] | Wang Y, Fuchs E, da Silva R, et al. Improvement of Aspergillus niger glucoamylase thermostability by directed evolution. Starch-Starke, 2006, 58(10): 501–508. DOI: 10.1002/(ISSN)1521-379X |
| [16] | Nielsen BR, Lehmbeck J, Frandsen TP. Cloning, heterologous expression, and enzymatic characterization of a thermostable glucoamylase from Talaromyces emersonii. Protein Express Purif, 2002, 26(1): 1–8. DOI: 10.1016/S1046-5928(02)00505-3 |
| [17] | Thorsen TS, Johnsen AH, Josefsen K, et al. Identification and characterization of glucoamylase from the fungus Thermomyces lanuginosus. Biochim Biophys Acta, 2006, 1764(4): 671–676. DOI: 10.1016/j.bbapap.2006.01.009 |
| [18] | Chen J, Zhang YQ, Zhao CQ, et al. Cloning of a gene encoding thermostable glucoamylase from Chaetomium thermophilum and its expression in Pichia pastoris. J Appl Microbiol, 2007, 103(6): 2277–2284. DOI: 10.1111/jam.2007.103.issue-6 |
| [19] | Wang XY, Ma R, Xie XM, et al. Thermostability improvement of a Talaromyces leycettanus xylanase by rational protein engineering. Sci Rep, 2017, 7(1): 15287. DOI: 10.1038/s41598-017-12659-y |
| [20] | Shuai Y, Tao T, Zhang L, et al. Improvement of the thermostability and catalytic efficiency of a highly active β-glucanase from Talaromyces leycettanus JCM12802 by optimizing residual charge-charge interactions. Biotechnol Biof, 2016, 9(1): 124. |
| [21] | Zhang DD, Tu T, Wang Y, et al. Improving the catalytic performance of a Talaromyces leycettanus α-amylase by changing the linker length. J Agric Food Chem, 2017, 65(24): 5041–5048. DOI: 10.1021/acs.jafc.7b00838 |
| [22] | Wang CH, Luo HY, Niu CF, et al. Biochemical characterization of a thermophilic β-mannanase from Talaromyces leycettanus JCM12802 with high specific activity. Appl Microbiol Biotechnol, 2015, 99(3): 1217–1228. DOI: 10.1007/s00253-014-5979-x |
| [23] | Li YQ, Wang Y, Tu T, et al. Two acidic, thermophilic GH28 polygalacturonases from Talaromyces leycettanus JCM 12802 with application potentials for grape juice clarification. Food Chem, 2017, 237: 997–1003. DOI: 10.1016/j.foodchem.2017.06.037 |
| [24] |
Li XL, Tu T, Yao B, et al. A novel bifunctional xylanase/cellulase TcXyn10A from Thermoascus crustaceus JCM12803.
Chin J Biotech, 2018, 34(12): 1996–2006.
(in Chinese). 李晓丽, 涂涛, 姚斌, 等. 嗜热子囊菌JCM12803来源的双功能木聚糖/纤维素酶. 生物工程学报, 2018, 34(12): 1996-2006. |
| [25] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem, 1959, 31(3): 426–428. DOI: 10.1021/ac60147a030 |
| [26] | Svensson B, Larsen K, Gunnarsson A. Characterization of a glucoamylase G2 from Aspergillus niger. Eur J Biochem, 1986, 154(3): 497–502. DOI: 10.1111/ejb.1986.154.issue-3 |
| [27] | Rezaul Karim KM, Husaini A, Hossain MA, et al. Heterologous, expression, and characterization of thermostable glucoamylase derived from Aspergillus flavus NSH9 in Pichia pastoris. BioMed Res Int, 2016, 2016: 5962028. |
| [28] | Ben Abdelmalek-Khedher I, Urdaci MC, Limam F, et al. Purification, characterization, and partial primary sequence of a major-maltotriose-producing α-amylase, ScAmy43, from Sclerotinia sclerotiorum. J Microbiol Biotechnol, 2008, 18(9): 1555–1563. |
| [29] | Carrasco M, Alcaíno J, Cifuentes V, et al. Purification and characterization of a novel cold adapted fungal glucoamylase. Microb Cell Factor, 2017, 16(1): 75–85. DOI: 10.1186/s12934-017-0693-x |
| [30] | Vieille C, Zeikus GJ. Hyperthermophilic enzymes: sources, uses, and molecular mechanisms for thermostability. Microbiol Mol Biol Rev, 2001, 65(1): 1–43. |
| [31] | Fonseca-Maldonado R, Vieira DS, Alponti JS, et al. Engineering the pattern of protein glycosylation modulates the thermostability of a GH11 xylanase. J Biol Chem, 2013, 288(35): 25522–25534. DOI: 10.1074/jbc.M113.485953 |
| [32] |
Min R, Li JF, Gao SJ, et al. Correlation between thermostability of the xylanase EvXyn11TS and its N-terminal disulfide bridge.
Acta Microbiol Sin, 2013, 53(4): 346–353.
(in Chinese). 闵柔, 李剑芳, 高树娟, 等. 木聚糖酶EvXyn11TS耐热性与其N端二硫键的相关性分析. 微生物学报, 2013, 53(4): 346-353. |
 2019, Vol. 35
2019, Vol. 35