中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王程, 耿泽男, 纪朋艳, 李庆华, 罗军, 李妍, 隋春红
- Wang Cheng, Geng Zenan, Ji Pengyan, Li Qinghua, Luo Jun, Li Yan, Sui Chunhong
- 重组圆锥芋螺胰岛素G1的原核表达与降糖活性检测
- Prokaryotic expression and hypoglycemic activity determination of insulin G1 from Conus geographus
- 生物工程学报, 2019, 35(3): 505-512
- Chinese Journal of Biotechnology, 2019, 35(3): 505-512
- 10.13345/j.cjb.180280
-
文章历史
- Received: July 5, 2018
- Accepted: September 11, 2018
- Published: October 8, 2018
基因工程制备的重组胰岛素是糖尿病药物治疗领域的一个里程碑,应用于临床已逾30载,具有纯度高、不良反应少、用量少等优点[1]。胰岛素必须以单体分子形式与受体结合才能发挥生物活性,然而在重组胰岛素的临床应用过程中,较高的血药浓度会促进胰岛素分子发生自身缔合而形成多聚体,需要经过一段时间解聚才发挥作用[2]。因此通过分子改造,设计出在血液中以单体形式存在的速效胰岛素成为研究的重要方向之一[3]。目前用于临床控制餐后血糖波动的速效胰岛素主要有赖脯胰岛素(Lispro)、门冬胰岛素(Aspart)和赖谷胰岛素(Glulisine),其结构改造均发生在胰岛素B链羧基末端,通过在聚体形成面引入相同电荷、调整分子间疏水性、改变与金属离子的结合力等方式使胰岛素单体难以聚合[4]。2016年,美国和澳大利亚的研究人员从海洋圆锥芋螺Conus geographus的毒液中提取出一种单体形式存在的圆锥芋螺胰岛素G1 (Cone snail insulin G1,cI G1),并发现其可与人胰岛素受体结合,且发挥作用的速度比人胰岛素(Human insulin,hI)更快,有望开发成一种超级速效胰岛素[5]。本研究参照人胰岛素原(Human proinsulin,hPI)和圆锥芋螺胰岛素G1原(Cone snail proinsulin G1,cPI G1)的基因,设计适于大肠杆菌(Escherichia coli,E. coli)表达的重组cPI G1的核苷酸序列,构建pET22b(+)-cPI G1原核表达质粒,以E. coli BL21(DE3)作为宿主进行表达,经酶切纯化获得重组cI G1;随后以重组hI甘舒霖50R为对照,对等剂量重组cI G1作用的正常小鼠和链脲佐菌素(Streptozotocin,STZ)致糖尿病模型小鼠进行空腹血糖检测(Fasting blood glucose test,FBGT)和葡萄糖耐量测试(Oral glucose tolerance test,OGTT),评估重组cI G1的降糖作用。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株和动物质粒pGH-cPI G1由上海捷瑞生物科技公司合成,pET22b(+)质粒购于美国Novagen公司。E. coli BL21(DE3)菌株购于北京天根生物科技公司。近交系C57BL雄性小鼠,体质量16-20 g,SPF级,购于长春亿斯实验动物技术公司,实验动物生产使用许可证:SCXK (吉)-2011-0004。
1.1.2 主要试剂和仪器限制性核酸内切酶EcoRⅠ和Hind Ⅲ、核酸染料、T4 DNA连接酶购于大连宝生物公司;质粒提取试剂盒、凝胶回收试剂盒购于美国OMEGA公司;β-巯基乙醇、胰蛋白酶冻干粉(EC3.4.21.4)、链脲佐菌素购于美国Sigma公司;异丙基-β-D-硫代半乳糖苷(IPTG)、三羟甲基氨基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine-SDS-PAGE)凝胶制备试剂盒、镍-次氮基三乙酸(Ni-NTA)琼脂糖凝胶6FF、Sephadex G-25凝胶、透析袋(3 500 Da)购于北京索莱宝科技有限公司;重组人胰岛素标准品(批号140633-201104,28.3 IU/mg)购自中国药品生物制品检定所;甘舒霖50R混合重组人胰岛素注射液(3 mL:300 IU,国药准字S20083008)购于通化东宝药业股份有限公司;0.9%氯化钠(NaCl)注射液(100 mL:0.9 g,国药准字H22025619)购于吉林康乃尔药业有限公司;其他试剂均为国产或进口分析纯试剂。590型血糖仪为江苏鱼跃医疗设备股份有限公司产品;LC-20AT高效液相色谱(HPLC)仪为日本岛津公司产品。
1.2 方法 1.2.1 质粒的设计和构建比对hI和cI G1氨基酸序列,替换cI G1序列中非编码和可能成为胰蛋白酶水解位点的氨基酸,参照hPI和cPI基因与E. coli优势密码子进行设计重组cPI G1核苷酸序列并合成pGH-cPI G1质粒。利用EcoRⅠ和Hind Ⅲ双酶切pGH-cPI G1质粒和pET22b(+)质粒。纯化回收双酶切的cPI G1目的片段和pET-22b(+)载体片段,连接酶连接后转化到E. coli BL21(DE3)感受态细胞中,涂布于含有氨苄青霉素的LB固体培养基平板,挑选阳性菌落进行液体培养,单、双酶切后1%琼脂糖凝胶电泳鉴定重组菌,并送上海捷瑞生物科技有限公司进一步测序鉴定。
1.2.2 蛋白表达和亲和层析将测序鉴定和理论序列相符的阳性重组菌按1% (V/V)接种量在LB液态培养基中37 ℃摇菌培养,当光密度值(OD600)达到0.4-0.6时加入IPTG (终浓度为1 mmol/L)诱导4 h,离心收集菌体,超纯水清洗3次,重悬于5倍菌体积的裂解缓冲液(20 mmol/L Tris-HCl,1 mmol/L EDTA,100 mmol/L NaCl,pH 8.0),冰水浴超声破碎,高速离心收集上清液。按Ni-NTA琼脂糖凝胶6FF使用说明进行亲和层析(柱尺寸:Φ1.28 cm×7 cm;床体积:5 mL;流速:0.5 mL/min;检测波长:280 nm),纯化蛋白冻干保存。采用16.5% Tricine-SDS-PAGE鉴定目的蛋白[6]。蛋白产率(mg/g)=纯化获得的重组cPI G1质量(mg)/所用湿菌质量(g)。
1.2.3 蛋白酶解和分子筛层析用蛋白质折叠缓冲液(50 mmol/L甘氨酸,1 mmol/L EDTA, pH 10.5,高纯度氮气除气)溶解重组cPI G1,按1.5倍二硫键摩尔浓度加入β-巯基乙醇诱导二硫键形成[7],4 ℃密封孵育12 h,1 mol/L Tris-HCl调定pH 8.5,与胰蛋白酶按20:1 (W/W)均匀混合,37 ℃酶切18 h。酶切产物进行Sephadex G-25分子筛层析(柱尺寸:Φ1.0 cm× 90 cm;床体积:65 mL;流速:1 mL/min;检测波长:280 nm),纯化蛋白冻干保存。采用16.5% Tricine-SDS-PAGE鉴定目的蛋白。蛋白回收率(%) =酶解后获得重组cI G1物质的量(mol)/酶解前重组cPI G1物质的量(mol) ×100%。
1.2.4 生物效价测定参考《中国药典》(2015版) HPLC测定胰岛素生物活性的方法[8],采用C18色谱柱,以0.2 mol/L硫酸盐缓冲液(硫酸钠28.4 g/L,磷酸2.7% (V/V),乙醇胺调pH值至2.3,定容至1000 mL)-乙腈(74:26)为流动相,流速1.0 mL/min,柱温40 ℃,波长214 nm。以0.01 mol/L盐酸溶液配制1 mg/mL的重组人胰岛素对照品、甘舒霖50R和重组cI G1,精密量取各个样品20 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算效价。
1.2.5 动物模型建立小鼠适应性饲养1周后,12 h禁食不禁水,按200 mg/kg腹腔注射现配造模剂(40 mg/mL STZ,0.1 mol/L柠檬酸钠,pH 4.4),60 h后给小鼠进食,72 h后称量小鼠体重并尾端采血检测空腹血糖值,以体重明显减轻且血糖值≥16.7 mmol/L确定为小鼠糖尿病模型[9]。
1.2.6 动物分组、给药和指标测定正常小鼠和糖尿病小鼠各随机分为3组,每组16只,为正常对照组(NC组)、正常重组cI G1组(NG组)、正常重组hI组(NH组)、模型对照组(MC组)、模型重组cI G1组(MG组)、模型重组hI组(MH组)。NC组和MC组注射0.9% NaCl,剂量为5 mL/kg;NG组和MG组注射20 μg/mL重组cI G1,剂量为100 μg/kg (按1 IU = 0.0347 mg hI计算[10]);NH组和MH组注射0.5 IU/mL甘舒霖50R,剂量为2.5 IU/kg[11]。给药方式均为背部皮下注射,剂量按小鼠体重计算。在禁食8 h后,各组随机选取8只小鼠空腹给药进行FBGT,另外8只小鼠以200 mg/mL葡萄糖灌胃,剂量为1 mg/kg,然后迅速给药进行OGTT[12]。
1.2.7 统计学方法应用SPSS13.0统计软件进行统计学分析,各项指标检测数据以平均值±标准差(x±s)表示。
2 结果与分析 2.1 重组cPI G1氨基酸序列的设计和质粒pET22b(+)-cPI G1的构建对比cI G1 (PDB:A chain 5JYQ_A,B chain 5JYQ_B)和hI (GenBank:A chain AAA72170.1,B chain AAA72171.1)的氨基酸序列,并进行必要的氨基酸替换(图 1A):①A4、B12位点的γ-羧基谷氨酸(γ-carboxyglutamic acid,Gla,γ)替换为谷氨酸(Glutamic acid,Glu,E);②B5位点的羟脯氨酸(Hydroxyproline,Hyp,X)替换为脯氨酸(Proline,Pro,P);③A9、B8位点的精氨酸(Arginine,Arg,R)替换为亮氨酸(Leucine,Leu,L);④A18、A19、B6位点的赖氨酸(Lysine,Lys,K)分别替换为E、天冬酰胺(Asparagine,Asn,N)和谷氨酰胺(Glutamine,Gln,Q),使重组cI G1中均为编码氨基酸且不影响胰蛋白酶水解。参照hPI (GenBank:AY899304.1)和cPI (UniProtKB/ Swiss-Prot:A0A0B5AC95.1)基因,按照大肠杆菌偏爱密码子表,设计重组cPI G1核苷酸序列(图 1B),GC含量为46.9%,其结构中包括:①两端限制性核酸内切酶位点EcoRⅠ和Hind Ⅲ;②具有促进可溶性表达并可延长目的蛋白10倍半衰期的前导肽pelB leader;③重组cI G1 A链和B链及其之间的连接肽C-peptide;④可与二价镍离子螯合用于亲和层析的标签肽6×His Tag;⑤4个可被胰蛋白酶识别的酶切位点。用EcoRⅠ和Hind Ⅲ单、双酶切鉴定构建的pET22b(+)-cPI G1质粒(图 2),其中双酶切后可见一条250 bp左右的条带,和理论值大小一致,进一步测序鉴定其核苷酸序列和理论值一致,表明已成功构建表达cPI G 1的原核表达载体,可用于后续实验。
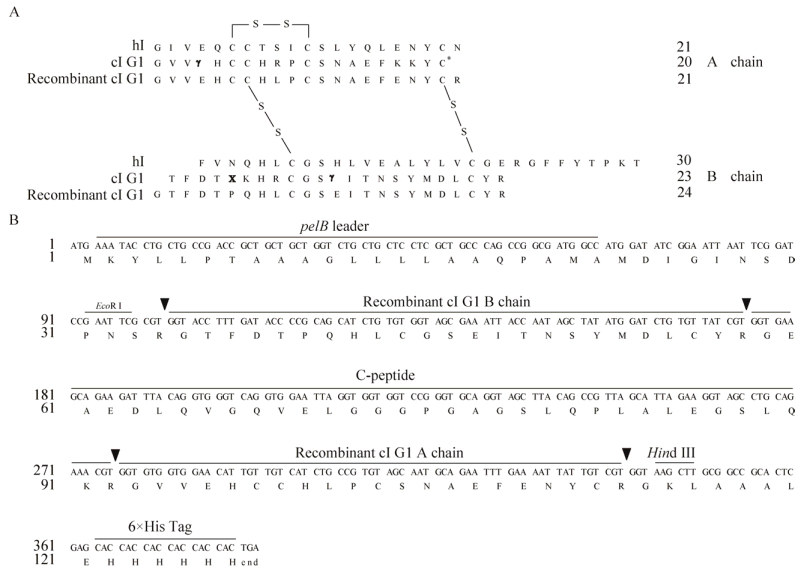
|
| 图 1 pET22b(+)-cPI G1质粒的设计 Fig. 1 Design of the plasmid pET22b(+)-cPI G1. (A) Sequence comparison of hI, cPI G1 and recombinant cPI G1. γ: Gla; X: Hyp; *: C-terminal amidation; —s—s—: disulfide links. (B) Characterization of recombinant cPI G1 sequence. ▼: the cleavage site of trypsin. |
| |

|
| 图 2 质粒pET22b(+)-cPI G1的酶切鉴定 Fig. 2 Identification of the plasmid pET22b(+)-cPI G1 by double restriction enzyme. M: DNA marker; 1: pET22b(+)-cPI G1 plasmid; 2: pET22b(+)-cPI G1 plasmid digested with EcoRⅠ; 3: pET22b(+)-cPI G1 plasmid digested with Hind Ⅲ; 4: pET22b(+)-cPI G1 plasmid digested with EcoRⅠand Hind Ⅲ. |
| |
重组菌通过IPTG诱导表达(图 3),与未诱导的重组菌对比,IPTG诱导的重组菌在14 kDa左右有明显的特异性条带,与理论分子量一致(pelB leader约3.4 kDa,重组cPI G1约8.7 kDa,6×His Tag约1.5 kDa,共13.6 kDa),表明融合蛋白已经得到可溶性表达。经Ni-NTA亲和层析获得纯化重组cPI G1蛋白,蛋白产率为(3.9±0.7) mg/g。

|
| 图 3 重组cPI G1的表达及纯化 Fig. 3 Expression and purification of recombinant cPI G1. M: ultra-low molecular weight protein marker; 1: supernatant from bacterial before induced by IPTG; 2: supernatant from bacteria induced by IPTG; 3: purified recombinant cPI G1. |
| |
纯化的重组cPI G1蛋白经胰蛋白酶水解后用Sephadex G-25分子筛层析纯化(图 4),重组cI G1在5 kDa左右有明显的特异性条带,与理论分子量一致(重组cI G1约5.2 kDa),表明重组cI G1水解成功并已经正确折叠,蛋白回收率为51.9%±4.5%。

|
| 图 4 重组cPI G1的胰蛋白酶水解及重组cI G1的纯化 Fig. 4 Hydrolysis of recombinant cPI G1 by trypsin and purification of recombinant cI G1. M: ultra-low molecular weight protein marker; 1: purified recombinant cPI G1; 2: purified recombinant cI G1. |
| |
HPLC测定相同蛋白浓度的重组人胰岛素标准品、甘舒霖50R和重组cI G1,结果显示3种样品的出峰时间基本一致(图 5),根据峰面积计算得出重组人胰岛素标准品的效价为28.3 IU/mg,甘舒霖50R的效价为28.5 IU/mg,重组cI G1的效价为25.9 IU/mg。

|
| 图 5 重组人胰岛素标准品、甘舒霖50R和重组cI G1的HPLC图谱 Fig. 5 HPLC chromatogram of recombinant human insulin standard, Gansulin 50R and recombinant cI G1. |
| |
腹腔注射STZ的小鼠72 h后体重平均减轻4.5 g,血糖值均高于16.7 mmol/L,表明小鼠糖尿病模型建模成功。FBGT结果显示,NC组和MC组小鼠血糖值在180 min内一直保持恒定,分别为(5.76±0.32) mmol/L和(21.1±0.51) mmol/L;NG组和MG组小鼠在注射重组cI G1后,血糖值均在20 min时达到最低,分别为(1.73±0.46) mmol/L和(6.94±0.52) mmol/L,然后随时间逐步回升,在150 min后恢复到初始水平;NH组和MH组小鼠在注射甘舒霖50R后30 min血糖值达到最低,分别为(2.03±0.47) mmol/L和(8.07±0.49) mmol/L,随后血糖值一直控制在较低水平(图 6A)。OGTT结果显示,各组小鼠在糖负荷后20 min时达到血糖高峰(图 6B);糖负荷后NG组和MG组小鼠血糖值均在10 min至60 min时间段明显降低,在20 min时降低幅度最大,分别达(4.18±0.16) mmol/L和(2.94±0.13) mmol/L;NH组和MH组小鼠均在20 min至180 min时间段降低,在30 min时降低幅度最大,分别达(6.57±0.21) mmol/L和(3.48±0.15) mmol/L (图 6B)。

|
| 图 6 重组cI G1和重组hI对正常和糖尿病小鼠血糖的影响 Fig. 6 Effect of recombinant cI G1 and recombinant hI on blood glucose in normal and diabetic mice. (A) FBGT. (B) OGTT. |
| |
Ⅰ型糖尿病和Ⅱ糖尿病胰岛素缺乏的患者均需要胰岛素治疗,速效类胰岛素是糖尿病治疗药物研究开发的重要方向之一[13]。本研究以单体形式存在的圆锥芋螺胰岛素cI G1基因设计合成了适合原核表达的重组cPI G1核苷酸序列,与pET22b(+)质粒连接后实现了重组cPI G1基因在大肠杆菌BL21(DE3)中的成功表达,并通过亲和层析成功得到了重组cPI G1蛋白。降糖活性研究发现,重组cI G1具有与甘舒霖50R相似的降血糖功效,且发挥作用更速效,这可能由于重组cI G1不仅与受体的结合效率高[5],而且短时间内单体形式存在的重组cI G1会比含有多聚体成分的甘舒霖50R具有更大的血药浓度。但重组cI G1作用持久性较差,其原因可能是重组cI G1与受体结合后迅速被胞吞[14],血浆中胰岛素降解酶也仅切割单体胰岛素[15],这使体内重组cI G1水平迅速降低而不能持久发挥作用,而甘舒霖50R中多聚体胰岛素的解聚过程可延长作用时间。制备的重组cI G1的效价较甘舒霖50R略低,从降糖活性的总体效果来看重组cI G1也不如甘舒霖50R,其可能有如下方面原因:1)为符合重组cI G1表达的要求,在设计过程中替换了部分非编码和影响酶切的氨基酸,分子结构和长度的改变可能影响其生物学活性。2)原核表达方法简单、表达量高,但表达环境不利于蛋白二硫键的形成,且缺乏翻译后加工修饰体系[16],尽管采用低浓度的β-巯基乙醇促进重组cI G1空间构象的形成,仍达不到真核表达系统的效果。此外,与正常小鼠相比,重组cI G1和甘舒霖50R均对糖尿病模型小鼠血糖的调节更有力,这可能是由于正常小鼠对自身血糖的调节能力比糖尿病模型小鼠更强的原因。综上所述,采用生物工程方法可制备具有明确降血糖活性的重组cI G1。然而重组cI G1在制备和储存时的稳定性、应用时的免疫原性以及产生胰岛素抵抗效应等方面问题,还需要更加深入的研究。
| [1] |
Lu P, Shen L. Thirty years of experience with recombinant human insulin-from familiarity to reliance.
Chin J Diabetes, 2018, 26(1): 84–88.
(in Chinese). 鲁平, 沈丽. 重组人胰岛素30载. 中国糖尿病杂志, 2018, 26(1): 84-88. DOI:10.3969/j.issn.1006-6187.2018.01.018 |
| [2] | Gast K, Schüler A, Wolff M, et al. Rapid-acting and human insulins: hexamer dissociation kinetics upon dilution of the pharmaceutical formulation. Pharm Res, 2017, 34(11): 2270–2286. DOI: 10.1007/s11095-017-2233-0 |
| [3] | Mbanya JC, Sandow J, Landgraf W, et al. Recombinant human insulin in global diabetes management-focus on clinical efficacy. Eur Endocrinol, 2017, 13(1): 21–25. DOI: 10.17925/EE.2017.13.01.21 |
| [4] | Bagchi K, Roy S. Sensitivity of water dynamics to biologically significant surfaces of monomeric insulin: role of topology and electrostatic interactions. J Phys Chem B, 2014, 118(14): 3805–3813. DOI: 10.1021/jp411136w |
| [5] | Menting JG, Gajewiak J, MacRaild CA, et al. A minimized human insulin-receptor-binding motif revealed in a Conus geographus venom insulin. Nat Struct Mol Biol, 2016, 23(10): 916–920. DOI: 10.1038/nsmb.3292 |
| [6] | Schägger H. Tricine-SDS-PAGE. Nat Protoc, 2006, 1(1): 16–22. DOI: 10.1038/nprot.2006.4 |
| [7] | Castellanos-Serra LR, Hardy E, Ubieta R, et al. Expression and folding of an interleukin-2-proinsulin fusion protein and its conversion into insulin by a single step enzymatic removal of the C-peptide and the N-terminal fused sequence. FEBS Lett, 1996, 378(2): 171–176. DOI: 10.1016/0014-5793(95)01437-3 |
| [8] |
National Pharmacopoeia Committee. Pharmacopoeia of Peoples Republic of China. Part 2. Beijing: China Medical Science Press, 2015: 789-790 (in Chinese). 国家药典委员会.中华人民共和国药典.二部.北京: 中国医药科技出版社, 2015: 789-790. |
| [9] |
Zheng GJ, Ni L, Guo DJ. Expression of human insulin precursor in Pichia pastoris using GAP promoter and activity of expressed product.
Chin J Biol, 2013, 26(12): 1753–1757, 1763.
(in Chinese). 郑国君, 倪玲, 郭德军. 人胰岛素前体在毕赤酵母中的组成型表达及其活性. 中国生物制品学杂志, 2013, 26(12): 1753-1757, 1763. |
| [10] | Elsayed AM, Khaled AH, Al Remawi MM, et al. Low molecular weight chitosan-insulin complexes solubilized in a mixture of self-assembled labrosol and plurol oleaque and their glucose reduction activity in rats. Mar Drugs, 2018, 16(1): 32–47. DOI: 10.3390/md16010032 |
| [11] |
Wu RS, Fan SJ, Mei Y, et al. The effect of blood sugar level after insulin skin-poping in mice.
Prog Mod Biomed, 2012, 12(5): 852–855.
(in Chinese). 吴润生, 范世锦, 梅赟, 等. 胰岛素小鼠皮下注射的降血糖作用研究. 现代生物医学进展, 2012, 12(5): 852-855. |
| [12] |
Li N, Yang ZC, Jin JY, et al. Hypoglycemic effect of Long Hu Ren Dan on STZ-induced diabetic mice.
J Guangdong Pharm Univ, 2018, 34(1): 69–72.
(in Chinese). 李柠, 杨智承, 金家骅, 等. 龙虎人丹对链脲佐菌素诱导糖尿病小鼠降糖作用研究. 广东药科大学学报, 2018, 34(1): 69-72. |
| [13] | Racsa PN, Meah Y, Ellis JJ, et al. Comparative effectiveness of rapid-acting insulins in adults with diabetes. J Manag Care Spec Pharm, 2017, 23(3): 291–298. |
| [14] | Duckworth WC, Bennett RG, Hamel FG. Insulin degradation: progress and potential. Endocr Rev, 1998, 19(5): 608–624. |
| [15] | Tang WJ. Targeting insulin-degrading enzyme to treat type 2 diabetes mellitus. Trends Endocrinol Metab, 2016, 27(1): 24–34. DOI: 10.1016/j.tem.2015.11.003 |
| [16] |
Li JD, Wang H. Strategies to improve the folding and modification of recombinant proteins: a review.
Chin J Biotech, 2017, 33(4): 591–600.
(in Chinese). 李家冬, 王弘. 重组蛋白正确折叠与修饰的提高策略. 生物工程学报, 2017, 33(4): 591-600. |
 2019, Vol. 35
2019, Vol. 35




