中国科学院微生物研究所、中国微生物学会主办
文章信息
- 余桂珍, 袁航, 罗著, 刘延娟, 刘娴, 高艳秀, 龚明, 邹竹荣
- Yu Guizhen, Yuan Hang, Luo Zhu, Liu Yanjuan, Liu Xian, Gao Yanxiu, Gong Ming, Zou Zhurong
- 一种基于亚磷酸盐及其脱氢酶的植物磷利用和杂草控制系统的建立
- Establishment of a plant phosphorus utilization and weed control system based on phosphite and its dehydrogenase
- 生物工程学报, 2019, 35(2): 327-336
- Chinese Journal of Biotechnology, 2019, 35(2): 327-336
- 10.13345/j.cjb.180158
-
文章历史
- Received: April 23, 2018
- Accepted: September 17, 2018
- Published: October 12, 2018
植物的正常生长发育依赖于磷素(即+5价正磷酸盐,Pi)的持续供给,因为Pi作为磷的唯一化学营养形式可被植物大量利用,在各种代谢途径中起着核心作用,对农作物高产及保持品种的优良特性至关重要[1]。植物所需Pi的90%以上由土壤供给,土壤中Pi的储量实际上并不低,但因其高反应活性使得绝大多数易与土壤中Ca2+、Fe3+和A13+等金属阳离子结合成难溶性磷酸盐,同时还会被土壤细菌快速转化为植物无法直接吸收利用的有机形式[2]。而且由于这两个原因,土壤外加施肥也只有20%–30%的Pi能被植物利用。再加上杂草与作物竞争使用Pi[3],使得大多数土壤中有效磷的含量远远不能满足农作物的生长需要。随着全球粮食生产需求的增加,于是过度使用磷肥和除草剂便成为常态,这不仅加剧不可再生磷资源的耗竭、增加生产成本和农产品价格,同时还带来严重的环境恶化问题(如水体富营养化)[4-5]。另外,近年来除草剂在农业中的广泛使用已进化出越来越多抗除草剂的超级杂草。因为传统的除草剂针对的是特定的酶,容易被杂草在酶的被抑制位点发生突变而进化成抗性,而且农业中不断使用相同除草剂更是进一步加快了这种进化;杂草还可以通过其他不同机制获得除草剂的抗性,如阻止其吸收、将其隔离在特定的亚细胞区室或产生相应的靶酶将其代谢掉[6]。因此,土壤中Pi的低可利用性和杂草的抗除草剂能力已被视为当前制约农业可持续发展的重要瓶颈[2, 6-7],所以寻求可替代正磷酸盐的磷肥、提高植物的磷利用效率以及开发新型杂草控制系统已成为亟待解决的问题。
土壤中亚磷酸盐(+3价磷,Phi)的含量仅次于正磷酸盐。因为正磷酸盐在植物营养中的不可替代性,所以其他化学形式的磷在化肥制作和应用方面长时间被忽视。与正磷酸盐相比,亚磷酸盐具有独特的生化特性,包括较高的溶解度、对土壤成分有较低的化学反应性以及大多数微生物不能转化使用它作为磷源[8-9],因而理论上对植物具有较高的可利用性。然而,植物却不能代谢亚磷酸盐,限制了其直接用作肥料[10]。相反,亚磷酸盐甚至抑制植物的生长发育并具有除草剂功效,它可能干扰植物受正磷酸盐饥饿所激活的信号途径从而抑制植物和杂草生长[11-12]。不过,自然界中亚磷酸盐能被少数土壤和海洋细菌利用[9],这类细菌(譬如施式假单胞菌)含有专一性的亚磷酸盐脱氢酶(PTDH),能将亚磷酸盐氧化为可代谢利用的正磷酸盐[13],其基因目前已从某些特定分离菌株中得到克隆[14-16]。
本研究将实验室前期从土壤宏基因组中直接扩增到的假单胞菌PTDH基因PsPtx转入烟草,并分析PsPtx转基因烟草在亚磷酸盐胁迫条件下的生长特性,期望以此建立一种基于亚磷酸盐为磷肥和除草剂的植物磷利用和杂草控制系统,为当前农作物转基因研究存在的一些重大关切问题提供一个有效解决方案。
1 材料与方法 1.1 材料大肠杆菌菌株DH5α、根癌农杆菌菌株LBA4404以及植物双元载体pBI121均为本实验室保存。含土壤假单胞菌亚磷酸盐脱氢酶基因PsPtx的原核表达载体pET(PsPtx)由本实验室构建。取烟草Nicotiana tabacum Xanthi一个月左右的无菌苗叶片作为转化外植体。植物基因组DNA提取试剂盒、质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自北京Tiangen生化科技有限公司;TransZol Up RNA提取试剂盒、反转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis Super Mix)、2×Taq Plus Master Mix、DNA分子量标准等购自北京Transgene生物科技有限公司;Pfu DNA聚合酶、T4 DNA连接酶、限制性内切酶KpnⅠ、SacⅠ等购自Thermo Scientific公司;其他生化试剂均为国产分析纯。利用Vector NTI Advance 11软件设计引物(表 1),引物合成和DNA测序均由北京华大基因公司完成。
| Primer | Sequence (5′–3′) | Remarks |
| PsPtx-5Kn | GATCAGGTACCAGGAGACGCAACAATGGCTCTG CCGAAACTCGTTATA | The site of restriction enzyme KpnⅠ is underlined |
| PsPtx-3Sc | GTATCGAGCTCAGCCAGACCGGATTCAAC | The site of restriction enzyme SacⅠ is underlined |
| 35Spro-Fw | GACGTAAGGGATGACGCACAATC | Forward primer inside CaMV 35S promoter of vector pBI121 |
| NosTer-Rv | GACCGGCAACAGGATTCAATC | Reverse primer inside Nos terminator of vector pBI121 |
| NosDw-Rv | GGATGTGCTGCAAGGCGATTAAGTTG | Reverse primer downstream of Nos terminator of vector pBI121 |
| Nt18S-iFw | GAAACGGCTACCACATCCAAG | Forward primer inside tobacco 18S rRNA (Acc. No. HQ384692) |
| Nt18S-iRv | GGCAAATGCTTTCGCAGTTG | Reverse primer inside tobacco 18S rRNA (Acc. No. HQ384692) |
以质粒pET(PsPtx) DNA为模板,利用高保真的Pfu DNA聚合酶和引物PsPtx-5Kn、PsPtx-3Sc将土壤假单胞菌亚磷酸盐脱氢酶基因PsPtx重新扩增出来,程序为:95 ℃ 5 min;94 ℃ 30 s,47 ℃ 30 s,72 ℃ 2.5 min,1个循环;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 2.5 min,30个循环;72 ℃ 10 min。PsPtx PCR产物纯化后用KpnⅠ和SacⅠ进行双酶切,再与经同样酶切的载体pBI121大片段连接,构建成其植物表达载体pBI(PsPtx),重组克隆用载体上游引物35Spro-Fw和PsPtx基因下游引物PsPtx-3Sc通过菌落PCR鉴定,并用引物35Spro-Fw进行测序验证。通过冻融法将载体pBI(PsPtx)转化农杆菌LBA4404,转化菌落通过PCR鉴定(使用引物35Spro-Fw、PsPtx-3Sc),然后按照常规的农杆菌叶盘侵染法转化烟草。
1.2.2 PsPtx转基因烟草阳性植株的鉴定使用试剂盒提取PsPtx转化再生烟草植株的基因组总DNA。以其为模板通过3对引物(PsPtx- 5Kn/PsPtx-3Sc、35Spro-Fw/PsPtx-3Sc、PsPtx-5Kn/NosTer-Rv)进行PCR鉴定,得到PsPtx转基因烟草阳性植株,然后将阳性植株移栽到温室培养,开花结籽。对PsPtx转基因烟草子代植株的分子鉴定也是采用同样方法。
1.2.3 PsPtx转基因烟草基因表达的RT-PCR分析使用试剂盒通过Trizol法提取PsPtx转基因烟草植株的根、茎、叶总RNA。将提取的RNA进行电泳检测,然后使用反转录试剂盒和随机引物进行cDNA的合成。以此作为模板,分别用引物对PsPtx-5Kn/PsPtx-3Sc、Nt18S-iFw/Nt18S-iRv进行PCR,分析PsPtx基因和内参基因烟草18S rRNA在转基因植株不同组织(根、茎、叶)中的表达情况。
1.2.4 亚磷酸盐胁迫垂直平板实验将野生型(WT)和PsPtx转基因烟草的种子消毒后,按顺序分别播种在缺磷(−P)、正磷酸盐(Pi,浓度为1 mmol/L的Na2HPO4)和不同浓度亚磷酸盐(Phi,浓度为1、3、5 mmol/L的Na2HPO3)的1× MS固体培养基平板的水平直线上。将平板垂直置于26 ℃、湿度75%、光照强度1 500 Lux、16 h光照/8 h黑暗条件下的光照培养箱培养20 d,然后比较幼苗生长状况。
1.2.5 显性标记实验将WT和PsPtx转基因烟草的种子消毒后,取适量分别播种于正常(CK)、含3 mmol/L Phi、含100 mg/L Kan的1× MS固体培养基平板上,水平置于26 ℃、湿度75%、光照强度1 500 Lux、16 h光照/8 h黑暗条件下的光照培养箱培养20 d,然后比较幼苗生长状况。
1.2.6 杂草控制系统实验将WT和PsPtx转基因烟草的种子按100:1的比例混合,分别播种于缺磷(−P)、正磷酸盐(Pi,浓度为120 mg/kg的Na2HPO4)和亚磷酸盐(Phi,浓度为120 mg/kg的Na2HPO3)的沙子和蛭石(1:1)的混合物上,温室培养40 d,然后比较植株生长状况。最后,按上文1.2.2的方法对Phi沙石混合物上长出的植株进行PCR鉴定分析。
2 结果与分析 2.1 PsPtx转基因烟草植株的获得在前期工作中已从土壤宏基因组中扩增得到假单胞菌亚磷酸盐脱氢酶基因PsPtx并构建了其原核表达载体pET(PsPtx),其大肠杆菌重组表达蛋白PsPtx表现出正常的酶活性。在本研究中,首先以pET(PsPtx)质粒为模板,利用引物PsPtx-5Kn、PsPtx-3Sc将该基因PsPtx重新扩增出来,然后通过KpnⅠ和SacⅠ酶切克隆到常用植物载体pBI121中,获得了PsPtx基因的植物表达载体pBI(PsPtx)。然后,将此载体通过农杆菌叶盘侵染法转化烟草,并对转化再生烟草小植株进行多重PCR鉴定。结果显示,WT植株用3对引物(PsPtx-5Kn/PsPtx-3Sc、35Spro-Fw/PsPtx-3Sc、PsPtx-5Kn/NosTer-Rv)均未扩增出任何清晰条带;而PsPtx转化烟草再生植株(PsPtx-3、4、7、8)用这3对引物均能扩增出特异性目标产物,大小均正确(分别约为1 062、1 156、1 122 bp),且无非特异性条带(图 1),说明PsPtx基因已转入到烟草中,成功获得了PsPtx转基因烟草阳性植株。

|
| 图 1 PsPtx转基因烟草植株的PCR鉴定 Fig. 1 PCR identification of PsPtx transgenic tobacco plants. |
| |
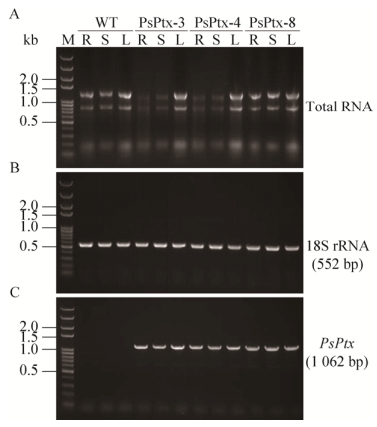
使用Trizol法提取WT和PsPtx转基因烟草植株(PsPtx-3、4、8)的根、茎、叶总RNA,电泳检测显示各样品的28S、18S、5.8S rRNA条带都较为清晰,没有明显降解(图 2A)。分别使用引物对Nt18S-iFw/Nt18S-iRv和PsPtx-5Kn/PsPtx-3Sc,通过RT-PCR依次分析内参基因(烟草18S rRNA)和PsPtx基因在WT和转基因植株不同组织(根、茎、叶)中的表达情况。结果显示,18S rRNA在所有样品中都有一致表达,扩增产物大小正确(552 bp)且条带清晰(图 2B);相比较,PsPtx基因在WT烟草中无表达(扩增不出条带),而在所有转基因烟草植株的根、茎、叶中都有相近水平的表达,均能扩增出清晰整齐且大小正确(1 062 bp)的目的条带(图 2C)。
|
| 图 2 PsPtx转基因烟草根(R)、茎(S)和叶(L)中的基因表达分析 Fig. 2 Analysis of gene expression in roots (R), stems (S), and leaves (L) of PsPtx transgenic tobacco plants. (A) Total RNA. (B) RT-PCR of tobacco 18S rRNA. (C) RT-PCR of PsPtx. |
| |
为了直观说明不同形式磷对WT和PsPtx转基因烟草(PsPtx-3、4、8)生长发育的影响,进行了垂直平板上的种子萌发和幼苗生长试验。由图 3可以看出,所有类型烟草的种子在任何磷供应条件下均能萌发,而且在1 mmol/L正磷酸盐(Pi)培养基上幼苗均能生长正常。与之相比,在缺磷(−P)培养基上它们的幼苗根系较为发达(主根稍长和有更多的根毛),但根上部分发育受到了影响(茎较短、叶片较小),导致整株鲜重减少,这是缺磷造成植物形态学上的基本反应。而在3种不同浓度(1、3、5 mmol/L)的亚磷酸盐(Phi)培养基上,WT烟草幼苗的根系和根上部分生长均受到明显抑制以及整株鲜重显著降低,且随着Phi浓度升高而越明显,甚至差于缺磷培养基上的生长状况;相反,3个转基因株系(PsPtx-3、4、8)的幼苗均能正常生长,与生长在Pi培养基上相比在外形、根长、茎高和鲜重几方面均无明显差异。这些结果说明,Phi不但不能被WT烟草生长发育所利用,而且还具有明显的抑制作用;相对比,PsPtx转基因烟草的生长并没有受到抑制,而且比在缺磷培养基上生长更好,推测PsPtx转基因烟草中表达出的亚磷酸脱氢酶不但能解除Phi对烟草植株的毒害作用,而且能将Phi转化为植物可利用的Pi,供给烟草植株生长发育。

|
| 图 3 野生型和PsPtx转基因烟草在不同形式磷供应条件下的幼苗生长比较 Fig. 3 Seedling growth comparison between WT tobacco and PsPtx transgenic lines under different forms of phosphorus supply. (A) Growth profile. (B) Root length. (C) Stem height. (D) Fresh weight. |
| |
由图 3可以看出,亚磷酸盐(Phi)对野生型烟草的根系和根上部分生长均有明显抑制作用,而表达亚磷酸盐脱氢酶的PsPtx转基因烟草则能抵御这种抑制,因此PsPtx基因具备成为植物遗传转化显性选择标记的基本特质。当前,植物转基因研究用得最多的选择标记还是抗生素类抗性基因如卡那霉素(Kan)抗性基因,于是我们将它与PsPtx基因一起平行进行了显性标记对比实验。由于本研究获得的PsPtx转基因烟草是Kan选择培养出来的,因此它们应该兼具对Kan和Phi的抗性。
由图 4A结果可以看出,无论在100 mg/L Kan培养基还是在3 mmol/L Phi培养基上,所有PsPtx转基因烟草(PsPtx-3、4、8)都表现出抗性幼苗生长状况,而WT烟草幼苗生长均一致受到显著抑制。进一步选取转基因株系PsPtx-3单独进行抗性试验,由于转基因子一代会出现性状分离,所以种子萌发会有白化苗的出现。由图 4B结果可以看出,100 mg/L Kan培养基和3 mmol/L Phi培养基上白化苗(黄色圆圈标记)的出现频率非常接近。另外,图 4C结果显示,PsPtx-3转基因烟草株系在3 mmol/L Phi培养基上抗性生长幼苗的根长、茎高和鲜重均接近正常无选择压培养基(CK)上的幼苗,但都显著超过100 mg/L Kan培养基上的抗性幼苗。这些结果表明PsPtx基因可用作植物遗传转化的有效显性选择标记,而且是非抗生素抗性类的,生物安全性可能会更高,同时也避免了抗生素解毒给细胞带来负担而影响生长的问题,这可能与其编码酶PTDH的反应特性有关。

|
| 图 4 PsPtx转基因烟草在卡那霉素和亚磷酸盐平板上的幼苗生长比较 Fig. 4 Growth comparison of PsPtx transgenic tobacco seedlings on culture plates with Kan or Phi. (A) Resistance test of all transgenic lines (PsPtx-3, 4, 8). (B) Trait segregation test of transgenic line PsPtx-3 (T1 generation). (C) Determination of the root length, stem height, and fresh weight of the seedling in panel (B). |
| |
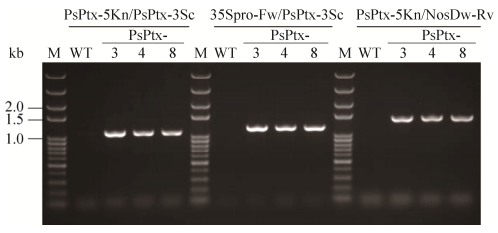
同样是利用亚磷酸盐对野生型烟草的抑制作用,设计了一个基于生长竞争的杂草控制系统实验。将3个转基因株系(PsPtx-3、4、8)种子分别和WT烟草(扮作杂草)种子按1:100的比例混合,分别播种在缺磷(−P)、含120 mg/kg正磷酸盐(Pi)和含120 mg/kg亚磷酸盐(Phi)的沙石混合土基上,温室培养40 d后观察植株生长情况。由图 5可以看出,所有3种转基因株系/野生型的混合播种在120 mg/kg Pi土基中都能长出众多生长正常的小植株,而在缺磷(−P)土基中都只能稀疏长出一些矮小苗。相比较,这些混合播种在120 mg/kg Phi土基中除了长出数目更少的矮小苗外,还有符合预期的少量正常小植株长出;而且,这些从Phi胁迫下长出的抗性小植株(黄色圆圈标记)甚至比正常Pi生长条件下的小植株要大,累积有更多的生物量。进一步通过3对引物组合(PsPtx-5Kn/PsPtx-3Sc、35Spro-Fw/PsPtx-3Sc、PsPtx-5Kn/NosDW-Rv)对不同混合播种长出的Phi抗性烟草植株进行多重PCR分析,鉴定出它们均为PsPtx转基因烟草,都能分别扩增出大小正确(约1 062 bp、1 156 bp、1 403 bp)的特异性条带(图 6)。这些结果再次说明缺磷显著抑制烟草的生长,亚磷酸盐对野生型烟草生长发育具有强毒害作用(甚至大于缺磷的影响),另外也表明PsPtx转基因烟草具备这种解毒能力故而在亚磷酸盐胁迫条件下较野生型烟草有相当明显的竞争优势,因此PsPtx基因可用于开发一个基于亚磷酸盐筛选的杂草控制系统。

|
| 图 5 PsPtx转基因烟草和野生型烟草在不同磷供应的沙石土基上的生长竞争实验 Fig. 5 Competitive growth of WT tobacco and PsPtx transgenic lines on sand/vermiculite-mixed soil with different forms of phosphorus supply. |
| |
|
| 图 6 生长竞争实验中不同混合播种长出的亚磷磷酸盐抗性烟草植株的PCR鉴定 Fig. 6 PCR identification of Phi-resistant tobacco plants dominantly selected from the competitive growth tests for different sowings of seed mixtures. |
| |
目前全球农业主要面临两大挑战:一是土壤磷的低可利用性;二是杂草进化滋生的抗除草剂能力[2, 6-7],为此亟需一种有效解决途径。自然界中亚磷酸盐(Phi)是含量仅次于正磷酸盐(Pi)的磷源,虽对植物具备较高的可利用性,但不为植物以及大多数微生物所利用[8-9],反倒具有生长抑制作用和符合除草剂的特质[11-12],却在少数细菌中能被专一性的亚磷酸盐脱氢酶(PTDH)氧化为可利用的正磷形式[9]。这些特性若加以利用,即向目标植物引入PTDH基因,应该可以赋予转基因植物代谢利用亚磷酸盐作为磷肥的能力并同时获得比周边杂草更好的生长优势,从而建立一套新型植物磷利用和杂草控制的双重系统。目前,这一设想已在拟南芥[17]、烟草[17-18]、棉花[19]、玉米[20]和水稻[21]中得到检验,并在转基因作物研究领域展现出相当看好的应用前景[22],但国内还尚未见文献报道。
PTDH只存在于少数可代谢利用亚磷酸盐的土壤和海洋细菌中[9],目前已从包括施式假单胞菌在内的某些特定分离菌株中克隆了其基因[14-16]。我们在前期工作中基于假单胞菌在土壤分布的广泛性,首次直接从新鲜提取的土壤宏基因组中克隆了一未知种名假单胞菌的PTDH基因PsPtx,并验证了其重组表达蛋白的特定酶活性[23]。文中对该基因在其转基因烟草植株中进一步进行了功能验证。通过垂直板幼苗生长、显性标记和生长竞争实验发现,在亚磷酸盐胁迫条件下,PsPtx转基因烟草不但能解除亚磷酸盐对植株的毒害作用并将它氧化成生长发育所需的磷源(图 3、图 5),而且较野生型烟草有相当明显的生长竞争优势(图 5),另外PsPtx还表现出作为非抗生素抗性类的植物遗传转化显性选择标记的优良特质(图 4)。这些结果在很大程度上验证了PsPtx基因可用于建立一种基于亚磷酸盐为磷肥和除草剂的植物磷利用和杂草控制兼用型系统,并与国外已有的相关报道总体一致[17-21]。
这种新型植物磷利用和杂草控制系统将集成以下两大优点:1)利用储量较丰富、植物可利用性较高、但不被大多数微生物(如蓝藻)利用的Phi作为磷肥,可以缓解当前农业中土壤有效磷相对亏缺、Pi磷肥的资源耗竭和滥用引发的环境污染等问题;2) Phi不被天然植物种类所利用反而抑制其生长,它用作PTDH转基因作物磷肥的同时又具有广谱的非选择性除草剂作用,而且功效应该十分稳定,因为杂草获得Phi抗性的唯一机制是进化出氧化Phi的能力即在杂草基因组中出现PTDH基因,这在自然条件下将会非常缓慢甚至不可能发生。毫无疑问,本工作基于PsPtx基因建立的这种系统将有潜力助推我国农作物的转基因研究和农业可持续发展。
| [1] | Schachtman DP, Reid RJ, Ayling SM. Phosphorus uptake by plants: from soil to cell. Plant Physiol, 1998, 116(2): 447–453. |
| [2] | Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: a review. Plant Soil, 2001, 237(2): 173–195. DOI: 10.1023/A:1013351617532 |
| [3] | Gianessi LP, Reigner NP. The value of herbicides in U.S. crop production. Weed Technol, 2007, 21(2): 559–566. DOI: 10.1614/WT-06-130.1 |
| [4] | Abelson PH. A potential phosphate crisis. Science, 1999, 283(5410): 2015. DOI: 10.1126/science.283.5410.2015 |
| [5] | Carpenter SR. Phosphorus control is critical to mitigating eutrophication. Proc Natl Acad Sci USA, 2008, 105(32): 11039–11040. DOI: 10.1073/pnas.0806112105 |
| [6] | Powles SB, Yu Q. Evolution in action: plants resistant to herbicides. Annu Rev Plant Biol, 2010, 61: 317–347. DOI: 10.1146/annurev-arplant-042809-112119 |
| [7] | Tilman D, Cassman KG, Matson PA, et al. Agricultural sustainability and intensive production practices. Nature, 2002, 418(6898): 671–677. DOI: 10.1038/nature01014 |
| [8] | Pasek MA. Rethinking early Earth phosphorus geochemistry. Proc Natl Acad Sci USA, 2008, 105(3): 853–858. DOI: 10.1073/pnas.0708205105 |
| [9] | White AK, Metcalf WW. Microbial metabolism of reduced phosphorus compounds. Annu Rev Microbiol, 2007, 61(1): 379–400. DOI: 10.1146/annurev.micro.61.080706.093357 |
| [10] | Ratjen AM, Gerendás J. A critical assessment of the suitability of phosphite as a source of phosphorus. J Plant Nutr Soil Sci, 2009, 172(6): 821–828. DOI: 10.1002/jpln.v172:6 |
| [11] | McDonald AE, Grant BR, Plaxton WC. Phosphite (phosphorous acid): its relevance in the environment and agriculture and influence on plant phosphate starvation response. J Plant Nutr, 2001, 24(10): 1505–1519. DOI: 10.1081/PLN-100106017 |
| [12] | Ticconi CA, Delatorre CA, Abel S. Attenuation of phosphate starvation responses by phosphite in Arabidopsis. Plant Physiol, 2001, 127(3): 963–972. DOI: 10.1104/pp.010396 |
| [13] | Relyea HA, van der Donk WA. Mechanism and applications of phosphite dehydrogenase. Bioorg Chem, 2005, 33(3): 171–189. DOI: 10.1016/j.bioorg.2005.01.003 |
| [14] | Costas AM, White AK, Metcalf WW. Purification and characterization of a novel phosphorus-oxidizing enzyme from Pseudomonas stutzeri WM88. J Biol Chem, 2001, 276(20): 17429–17436. DOI: 10.1074/jbc.M011764200 |
| [15] | Hirota R, Yamane ST, Fujibuchi T, et al. Isolation and characterization of a soluble and thermostable phosphite dehydrogenase from Ralstonia sp. strain 4506. J Biosci Bioeng, 2012, 113(4): 445–450. DOI: 10.1016/j.jbiosc.2011.11.027 |
| [16] | Liu DF, Ding HT, Du YQ, et al. Cloning, expression, and characterization of a wide-pH-range stable phosphite dehydrogenase from Pseudomonas sp. K in Escherichia coli. Appl Biochem Biotechnol, 2012, 166(5): 1301–1313. DOI: 10.1007/s12010-011-9518-2 |
| [17] | López-Arredondo DL, Herrera-Estrella L. Engineering phosphorus metabolism in plants to produce a dual fertilization and weed control system. Nat Biotechnol, 2012, 30(9): 889–893. DOI: 10.1038/nbt.2346 |
| [18] | López-Arredondo DL, Herrera-Estrella L. A novel dominant selectable system for the selection of transgenic plants under in vitro and greenhouse conditions based on phosphite metabolism. Plant Biotechnol J, 2013, 11(4): 516–525. DOI: 10.1111/pbi.2013.11.issue-4 |
| [19] | Pandeya D, Campbell LM, Nunes E, et al. ptxD gene in combination with phosphite serves as a highly effective selection system to generate transgenic cotton (Gossypium hirsutum L.). Plant Mol Biol, 2017, 95(6): 567–577. DOI: 10.1007/s11103-017-0670-0 |
| [20] | Nahampun HN, López-Arredondo D, Xu X, et al. Assessment of ptxD gene as an alternative selectable marker for Agrobacterium-mediated maize transformation. Plant Cell Rep, 2016, 35(5): 1121–1132. DOI: 10.1007/s00299-016-1942-x |
| [21] | Manna M, Achary VM, Islam T, et al. The development of a phosphite-mediated fertilization and weed control system for rice. Sci Rep, 2016, 6: 24941. DOI: 10.1038/srep24941 |
| [22] | Achary VMM, Ram B, Manna M, et al. Phosphite: a novel P fertilizer for weed management and pathogen control. Plant Biotechnol J, 2017, 15(12): 1493–1508. DOI: 10.1111/pbi.2017.15.issue-12 |
| [23] |
Yuan H, Luo Z, Yang YM, et al. Gene cloning, prokaryotic expression and enzymatic analysis of the phosphite dehydrogenase from soil Pseudomonas species.
Biotechnol Bull, 2018, 34(8): 130–137.
(in Chinese). 袁航, 罗著, 杨玉梅, 等. 土壤假单胞菌亚磷酸盐脱氢酶的基因克隆和原核表达及其酶活分析. 生物技术通报, 2018, 34(8): 130-137. |
 2019, Vol. 35
2019, Vol. 35




