中国科学院微生物研究所、中国微生物学会主办
文章信息
- 邹瑞, 蓝增全, 吴田, 贾丹丹, 杨自云
- Zou Rui, Lan Zengquan, Wu Tian, Jia Dandan, Yang Ziyun
- 诺丽茎段愈伤组织诱导优化及细胞悬浮系的建立
- Optimization of noni callus induction and establishment of callus suspension system
- 生物工程学报, 2019, 35(2): 298-306
- Chinese Journal of Biotechnology, 2019, 35(2): 298-306
- 10.13345/j.cjb.180141
-
文章历史
- Received: April 15, 2018
- Accepted: June 26, 2018
2. 西南绿色发展研究院,云南 昆明 650224
2. Southwest Institute of Green Development, Kunming 650224, Yunnan, China
诺丽(Morinda citrifolia Linn.)又称海巴戟、诺尼、萝梨、印桑椹、四季果等[1],是一种常绿多年生阔叶小乔木、灌木,茜草科(Rubiales)巴戟天属(Morinda)植物[2],它的树皮可提取黄色染料,皮中含有袖木醒二酚(Soranjidiol)、巴戟醌(Morindone),印度尼西亚民间作药用[3]。树皮的提取物用于治疗风湿、发热、创伤、溃疡、肿瘤[4]。然而诺丽在全球分布都十分稀少,国外主要分布在南太平洋诸岛,在夏威夷、印度、印度尼西亚、马来西亚及中南美洲等国家地区都有生长[5-6],在我国仅分布于少数几个地方如海南省、西沙群岛及台湾地区,近年来在云南省进行引种栽培,并在云南热带地区引种成功[7]。诺丽陆续在植物组织培养方面取得一些研究进展,如黄骐以诺丽种子为试料进行诱导不定芽生根研究[8];吴田用诺丽茎尖及带芽茎段作为外植体进行离体培养,成功建立了诺丽离体再生体系[9];潘晓晴以不含腋芽的诺丽茎段薄片为外植体进行离体培养研究[10]。
诺丽茎段中富含袖木醒二酚、巴戟醌等次生代谢物,这些次生代谢物有治疗风湿、发热、创伤、溃疡、肿瘤等作用。提取植物有效成分,同时不对植株本身造成损害,可以在建立诺丽茎段细胞悬浮培养体系的基础上进行诱导。另外,植物悬浮细胞是遗传转化理想的受体之一,建立稳定的细胞悬浮系对遗传转化起到巨大促进作用。植物细胞培养将常规植物育种技术与细胞培养技术相结合,可以获得常规技术无法得到的种质材料,缩短育种周期,提高育种效率,同时植物细胞的全能性使得悬浮细胞培养再生植株具有母本优良性状,采用细胞培养技术保存植物种质节省人力物力的同时避免不可预测因素对种质资源造成的损失。本研究拟在诺丽茎段愈伤组织诱导的基础上,进行细胞悬浮系的建立,为后续次生代谢物的诱导和遗传转化体系的建立奠定基础。
1 材料与方法 1.1 材料实验所用外植体为西南林业大学园林学院组培室的诺丽无菌组培苗,组培苗每90 d左右继代一次,继代培养基为MS+0.2 mg/L NAA。
1.2 方法 1.2.1 愈伤组织的诱导无菌苗剪去叶片,去除茎段两端腋芽,取茎段中间部分切成2 mm的薄片,平放于愈伤组织诱导培养基上(表 1),30 d后将诱导出的愈伤组织转接至原培养基中继续增殖培养。培养过程中每5 d观察1次,30 d后统计培养物的形态、颜色、生长情况、愈伤组织诱导率。愈伤组织诱导率=(产生愈伤组织外植体数∕接种外植体数)×100%。数据用SPSS 19.0统计软件进行计算和单因素方差分析及独立样本t检验,显著水平P < 0.05。
| Medium number | Different hormone concentrations (mg/L) | ||
| 6-BA | 2, 4-D | NAA | |
| 1 | 1.00 | – | 0.05 |
| 2 | 1.00 | 0.10 | – |
| 3 | 1.00 | 0.20 | – |
| 4 | 1.00 | 0.30 | – |
| 5 | 2.00 | 0.10 | – |
| 6 | 2.00 | 0.20 | – |
| 6-BA: 6-benzylaminopurine; 2, 4-D: 2, 4-dichlorophenoxyacetic acid; NAA: 1-naphthalene acetic acid. | |||
挑取黄绿色、松散性好、活性高的愈伤组织接种于原培养基上继代增殖培养。
1.2.3 诺丽悬浮系的建立选取黄绿色、分散性好且质地疏松的继代愈伤组织,用镊子轻轻夹碎后接种在液体培养基中,每250 mL的培养瓶中加入液体培养基50−100 mL,pH为5.85,摇床转速为110 r/min,温度(25±2) ℃,暗培养。悬浮初期,除去大细胞团,保留分散程度良好的小细胞团和单细胞,每隔10 d继代1次按1:2的体积转入新鲜培养液,连续继代5−8次逐渐形成稳定的悬浮细胞系。
1) 不同起始接种量对诺丽悬浮细胞生长的影响。将不同重量(12.5、25、37.5、62.5 g/L)诺丽茎段诱导出的愈伤组织接种到液体培养基中,每种处理接种5瓶液体培养基,20 d后计算细胞生长速度,接种量和收获量以湿细胞鲜重计,取2 mL培养液,4 ℃、5 000 r/min离心5 min,弃去上清液,称量底部沉淀细胞鲜重,细胞生长速度以比生长速率计。
2) 细胞形态观察。培养液摇匀,取一滴培养液于倒置光学显微镜下观测细胞生长情况。
3) 培养液pH值的测定。采用pH仪测定悬浮培养液pH值,使用前经标准试剂液校准,每2 d测定一次培养液pH值,绘制pH曲线。
4) 细胞生长曲线的测定。用血球计数板法检测细胞数。培养过程中,每2 d取悬浮培养细胞,先用5%铬酸对细胞培养液进行处理,使其分散均匀,持续检测,取平均值绘制细胞悬浮生长曲线。
1.2.4 TTC法测定细胞活力1) TTC染色所需药品配置
磷酸盐缓冲液(pH 7.0,0.1 mmol/L):称取磷酸氢二钠3.12 g溶于无菌蒸馏水,定容至100 mL;称取磷酸二氢钠7.17 g溶于无菌蒸馏水,定容至100 mL;取30.5 mL磷酸氢二钠溶液与19.5 mL磷酸二氢钠溶液充分混合。
0.4% TTC溶液:0.4 g红四氮唑溶于少量乙醇,加入磷酸盐缓冲液,定容至100 mL。
2) TTC染色
用TTC法测定细胞活力。每3 d取诺丽茎段悬浮细胞液,抽滤去除培养液并用蒸馏水冲洗以去除培养基。用滤纸吸取细胞上的水分,称取200 mg (鲜重)细胞置于10 mL离心管中,向离心管中加入2.5 mL 0.4% TTC溶液,并加入2.5 mL pH 7.0的磷酸缓冲液混匀,静止25 ℃暗处理13–16 h,细胞会变成红色,弃上清,加入蒸馏水洗涤3−5次,加入5 mL 95%的乙醇,置60 ℃水浴30 min,其间轻摇试管1−2次,静止于室温下至细胞完全无色,取上清在分光光度计上于485 nm处测吸光值(Abs),初始培养基按以上程序操作为空白对照。
1.2.5 细胞存活率的测定悬浮细胞培养结束后,取少量悬浮细胞,先用5%铬酸对细胞悬液进行处理,使其分散均匀,再用0.1%的酚藏花红染色液染色,活细胞无色或仅有液泡呈淡淡的红色,死细胞核和细胞碎片被染成红色。显微镜下计数500个悬浮细胞,计算活细胞所占的比例。悬浮细胞存活率(%)=(活细胞总数/悬浮细胞总数)×100%。
1.2.6 平板培养及悬浮细胞植株再生将灭菌后的培养基倒入培养皿1/2处,待培养基凝固后,将稳定的悬浮培养液接种于培养基上,再将40 ℃的培养基覆盖一层在接种的细胞上。将诺丽茎段细胞悬浮培养液接种于MS+2.0 mg/L 2, 4-D+0.1 mg/L 6-BA培养基上诱导分化愈伤组织,再将分化出的愈伤组织转接至MS+1.0 mg/L 6-BA+0.05 mg/L NAA培养基诱导分化不定根不定芽。
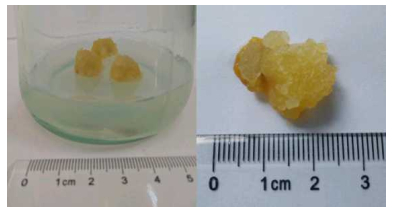
2 结果与分析 2.1 不同激素组合对茎愈伤组织诱导影响及增殖采用6种培养基对诺丽茎段愈伤组织进行诱导(表 2),在6-BA和NAA配合使用的培养基上,可诱导出绿色愈伤组织(图 1A),质地坚硬紧实,诱导的同时伴随植株分化;在6-BA和2, 4-D配合使用的培养基上,可诱导出疏松愈伤组织(图 1B、C、E),当6-BA浓度一定时,愈伤组织长势随2, 4-D的增加而逐渐变差。综合诱导率、愈伤组织长势和分化能力的因素,诺丽茎段诱导愈伤组织最佳培养基为MS+2.0 mg/L 2, 4-D+0.1 mg/L 6-BA,将愈伤组织代入原培养基可继代增殖(图 2)。
| Medium number | Different hormone concentrations (mg/L) | Inoculation number (each) | Callus induction number (each) | Callus induction rate (%) | Callus induction days (d) | Callus texture | Callus growth | Callus differentiation ability | ||
| 2, 4-D | 6-BA | NAA | ||||||||
| 1 | 1.00 | – | 0.05 | 50 | 47 | 94 b | 20 | Compact | ++++ | ++++ |
| 2 | 1.00 | 0.10 | – | 50 | 50 | 100 a | 25 | Loose | +++ | +++ |
| 3 | 1.00 | 0.20 | – | 50 | 47 | 94 b | 25 | Loose | ++ | ++ |
| 4 | 1.00 | 0.30 | – | 50 | 45 | 90 c | 25 | Loose | + | + |
| 5 | 2.00 | 0.10 | – | 50 | 50 | 100 a | 25 | Loose | ++++ | ++++ |
| 6 | 2.00 | 0.20 | – | 50 | 45 | 90 c | 25 | Loose | + | + |
| + Callus growth is poor; ++ Callus growth is general; +++ Callus growth is well; ++++ Callus growth is best. There were significant differences between different lower-case letters in the same column (P < 0.05), but no significant differences between the same letters (P > 0.05). | ||||||||||

|
| 图 1 诺丽茎段愈伤组织诱导 Fig. 1 Inducement of callus of noni stem. (A) Callus is hard texture. (B) Calus is cloose. (C) Callus is cloose. (D) Callus is brown loose. (E) Callus is cloose. (F) Callus is brown loose. |
| |
|
| 图 2 诺丽茎段愈伤组织继代 Fig. 2 Subculture of callus of noni stem. |
| |
诺丽茎段悬浮细胞接种量低于25 g/L时,悬浮细胞生长速度较低,接种量37.5 g/L时悬浮细胞生长速度高(图 3),当悬浮细胞接种量高达62.5 g/L,细胞生长速率较低。因此诺丽茎段悬浮细胞在液体培养基中接种量以37.5 g/L为宜。

|
| 图 3 诺丽茎段不同初始接种量对细胞悬浮培养影响 Fig. 3 Effects of noni stem from different initial inoculum on cell suspension culture. |
| |
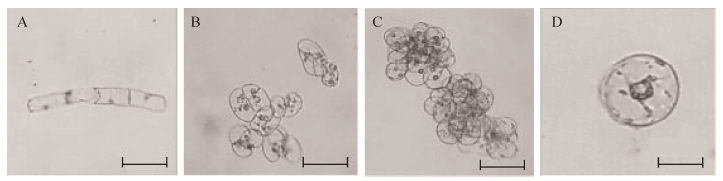
诺丽茎段为外植体的悬浮细胞,初代多为规则型杆状细胞(图 4),随着继代次数的增加,在第6代后为20个左右小细胞团居多,形态稳定。
|
| 图 4 诺丽茎段悬浮细胞不同培养时期倒置显微镜观察图(×100) Fig. 4 Different training period inverted microscope observation map stem cell suspension noni (×100). (A) First generation. (B) 3–4 generation. (C) After the sixth generation. (D) After the sixth generation. The scale plate represents 50 μm. |
| |
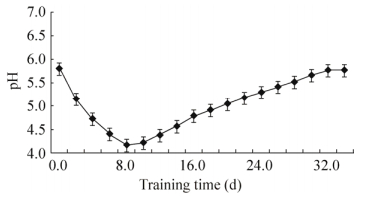
诺丽茎段悬浮细胞培养过程中pH变化近似“V”形曲线(图 5)。整个实验过程中培养液的pH值在小范围内呈先下降后缓慢升高的变化趋势。在接种后1−12 d的范围内pH不断下降,从5.85降到最低点4,此时细胞增殖缓慢;随后进入对数生长期,pH值逐渐回升;pH在4.5−5.0范围内细胞增殖最快,而后培养液的pH仍在缓慢增加。有可能是诺丽茎段悬浮细胞产生的大量代谢物使培养液的pH值升高。
|
| 图 5 诺丽茎段悬浮细胞培养液pH值变化 Fig. 5 The change of curve of cell suspension culture solution of noni's pH. |
| |
诺丽茎段细胞悬浮系,在0−6 d细胞数目增长不明显(图 6),生长缓慢,此时为停滞期;在6−12 d进入对数生长期,悬浮细胞状态良好,具有较高的活力,细胞数目急剧增加;在6−20 d进入直线生长期,细胞数量达到峰值22.6×104个/mL,后增长减缓,直至下降。

|
| 图 6 诺丽茎段细胞悬浮生长曲线 Fig. 6 The growth curve of stem suspension cells of noni. |
| |
对诺丽悬浮细胞活力曲线进行测定,细胞新陈代谢越旺盛其OD485值越高(图 7A),且细胞呈深红色(图 7B)。以茎段为外植体的悬浮细胞,OD值随培养时间的增加而增加,在第18天达到最大1.9,随后缓慢下降。

|
| 图 7 诺丽茎段悬浮细胞活力测定 Fig. 7 Activity determination of noni of stem suspended cell. (A) Suspension cell viability curve of different explants of noni. (B) Noni stem cells suspended overnight after staining. |
| |
综上,细胞悬浮生长曲线、悬浮液pH值、细胞活力曲线之间存在一定对应关系。诺丽茎段细胞悬浮培养液细胞生长曲线在18 d达到峰值,数量为18.97×104个/mL,而此时悬浮液的pH值下降后回升至pH值5.52,用细胞存活力在第18天细胞活力值最大OD485=1.9,对应了细胞生长曲线与pH,此时期细胞悬浮液生长状态较好。
2.2.6 细胞存活力测定细胞悬浮培养在继代5−8次以后,形成稳定的悬浮培养液,将培养结束的稳定悬浮培养液进行细胞存活力测定,染色后活细胞无色(图 8),死细胞呈红色,以茎段为外植体的细胞悬浮培养细胞存活力达到78.8%。说明培养悬浮细胞的培养基和继代周期可行。

|
| 图 8 诺丽悬浮细胞染色后活细胞和死细胞 Fig. 8 Suspension cells of noni after staining live cells and dead cells. The scale plate represents 50 μm. |
| |
将诺丽茎段细胞悬浮培养液,接种于MS+ 2.0 mg/L 2, 4-D+0.1 mg/L 6-BA培养基上,25 d诱导分化出嫩黄色泥状愈伤组织(图 9)。

|
| 图 9 诺丽茎段细胞悬浮液的平板培养 Fig. 9 Cell culture of noni stem cell suspension. The size of the Petri dish is 90 mm. |
| |
不同植物激素及浓度对愈伤组织的诱导的影响差别较大,其中2, 4-D和6-BA对愈伤组织的诱导必不可少,这与张志强等[11]诱导诺丽愈伤组织最适激素组合一致,但培养基的种类不同,他们采用的是B5培养基而在本实验中采用的是MS培养基,这与实验目的不同有关,用B5培养基更利于次生代谢产物的积累[12],而我们更关注稳定的细胞悬浮系的产生,以利于后续用细胞悬浮系进行遗传转化。此外,张志强等用的外植体是田间诺丽苗顶芽的叶脉,不仅需要消毒步骤,而且可取材范围较窄,而本课题组有大批量可用的诺丽无菌试管苗,几乎所有的茎段都可以作为本实验外植体,取材范围广。当6-BA的浓度为1 mg/L时,随着2, 4-D浓度的增大,会对愈伤组织诱导及生长产生抑制作用,愈伤组织生长缓慢且易老化,与吕冬霞等[13]的研究结果一致。同时,当2, 4-D浓度为0.1 mg/L时,随着6-BA浓度的增大,愈伤组织的生长速度不会减慢,愈伤组织的老化程度加快。因此,0.1 mg/L 2, 4-D+1.0 mg/L 6-BA为诱导诺丽茎段愈伤组织的最佳浓度组合。
采用适宜的接种量对建立稳定的悬浮培养体系起关键性作用[14-18]。悬浮培养体系的增殖速率与初始接种量密切相关,接种量过低或过高均不利于悬浮细胞的生长和增殖。初始接种量过低,限制了增长量;反之,过高,则可能由于细胞团过多而造成培养基养分不足或过多有害分泌物积累而限制了细胞的快速分裂与生长[19-20]。本试验研究发现,诺丽茎段悬浮细胞培养的最适宜接种量为37.5 g/L,当接种量达到62.5 g/L时,细胞生长量显著降低。
本研究对诺丽茎段进行细胞悬浮培养研究,获得了诺丽茎段稳定的细胞悬浮培养液,后续可对诺丽细胞悬浮系进行次生代谢物的诱导,同时与诺丽植株本身的功能性物质相对比,以及建立诺丽细胞悬浮培养动力学模型。稳定的诺丽细胞悬浮培养液可再生愈伤组织及外植体,从单细胞直接进行转化,这将成为诺丽遗传转化的优良受体材料,为诺丽遗传转化高频转化体系奠定了基础。后续实验拟采用真菌[21-22]、寡糖类物质[23]及重金属离子[24]等诱导因子在诺丽茎段愈伤组织建立的细胞悬浮系中,以诱导袖木醒二酚、巴戟醌等物质。最新研究发现,采用复合诱导子诱导处理其他植物细胞时可以合成更高含量的生物活性物质,这可能得益于复合诱导子具有协同增效的作用,起到增强诱导能力的效果[25-26]。此外,后续拟将稳定生长的诺丽细胞悬浮系,经短暂离心后直接用于遗传转化,后接种于筛选培养基上。具体的方法、结论有待进一步研究。
| [1] |
Yang Y, Yang PL, Xu R, et al. The analysis and evaluation of appearance character and nutritive content in different Morinda citurifolia L. germplasms.
China J Trop Crops, 2017, 38(1): 53–58.
(in Chinese). 杨焱, 杨朴丽, 徐荣, 等. 不同诺丽种质外观性状与营养成分的分析及评价. 热带作物学报, 2017, 38(1): 53-58. DOI:10.3969/j.issn.1000-2561.2017.01.010 |
| [2] |
Yang XB.
Hainan Plants Directory. Beijing: Science Press, 2013: 340-341(in Chinese).
杨小波. 海南植物名录. 北京: 科学出版社, 2013: 340-341. |
| [3] |
Chen XQ, Cui HB, Dai LK, et al.
Flora of China:19. Beijing: Science Press, 2011: 180-187(in Chinese).
陈心启, 崔鸿宾, 戴伦凯, 等. 中国植物志: 19卷. 北京: 科学出版社, 2011: 180-187. |
| [4] |
Jiang JW.
Dictionary of Medicinal Plants. Tianjin: Science and Technology Press, 2005: 875-972(in Chinese).
江纪武. 药用植物辞典. 天津: 科学技术出版社, 2005: 875-972. |
| [5] | Dixon AR, Mcmillen H, Etkin NL. Ferment this: the transformation of noni, a traditional polynesian medicine (Morinda citrifolia, Rubiaceae). Econom Bot, 1999, 53(1): 51–68. |
| [6] | Hirazumi A, Furusawa E. An immunomodulatory polysaccharide-rich substance from the fruit juice of Morinda citrifolia (noni) with antitumour activity. Phytother Res, 1999, 13(5): 380–387. DOI: 10.1002/(ISSN)1099-1573 |
| [7] |
Wu T, Lan ZQ. Genetic relationship of Morinda citrifolia germplasms by ISSR.
J Tropl Subtrop Bot, 2014, 22(6): 617–623.
(in Chinese). 吴田, 蓝增全. 基于ISSR技术研究诺丽种质资源的亲缘关系. 热带亚热带植物学报, 2014, 22(6): 617-623. |
| [8] |
Huang Q, He WJ, Ye BY, et al. Studies on the micropropagation of noni (Morinda citrifolia L.).
J Fujian Norm Univ: Nat Sci Ed, 2007, 23(1): 87–90.
(in Chinese). 黄骐, 何文锦, 叶冰莹, 等. 诺丽(Morinda citrifolia L.)离体快速繁殖研究. 福建师范大学学报:自然科学版, 2007, 23(1): 87-90. |
| [9] |
Wu T, Lan ZQ. Study on culture in vitro of noni (Morinda citrifolia Linn.).
J Shandong Agric Univ: Nat Sci, 2011, 42(2): 179–182.
(in Chinese). 吴田, 蓝增全. 诺丽离体培养研究. 山东农业大学学报:自然科学版, 2011, 42(2): 179-182. |
| [10] |
Pan XQ, Wu T, Lan ZQ, et al. Regeneration of stem segments of noni (Morinda citrifolia Linn.).
J Northeast For Univ, 2014, 42(8): 20–24.
(in Chinese). 潘晓晴, 吴田, 蓝增全, 等. 诺丽茎段的离体再生. 东北林业大学学报, 2014, 42(8): 20-24. DOI:10.3969/j.issn.1000-5382.2014.08.005 |
| [11] |
Zhang ZQ, Li YC. Study on callus induction and cell suspension culture of Morinda citrifolia.
Guangdong Agric Sci, 2014, 41(4): 108–112.
(in Chinese). 张志强, 李永成. 海巴戟天愈伤组织诱导及细胞悬浮培养试验. 广东农业科学, 2014, 41(4): 108-112. DOI:10.3969/j.issn.1004-874X.2014.04.028 |
| [12] |
Wang GL, Shi RF, Fang HJ. Effects of medium and culture conditions on polysaccharide synthesis by suspension cell culture of Gardenia jasminoides Eills.
Chin J Biotech, 2001, 17(6): 688–692.
(in Chinese). 王关林, 石若夫, 方宏筠. 培养基和培养条件对栀子悬浮细胞合成多糖的影响. 生物工程学报, 2001, 17(6): 688-692. DOI:10.3321/j.issn:1000-3061.2001.06.020 |
| [13] |
Lv DX, Qu CF. The effects that the regulating agenr for she plants growth takes to callus culfuring.
Northern Horticult, 2004(5): 68–69.
(in Chinese). 吕冬霞, 曲长福. 植物生长调节剂对愈伤组织培养的影响. 北方园艺, 2004(5): 68-69. DOI:10.3969/j.issn.1001-0009.2004.05.041 |
| [14] |
Zhao JP, Yang SS. Establishment of cell suspension culture system for Taxus media.
J Northwest A & F Univ: Nat Sci Ed, 2014, 42(1): 189–195.
(in Chinese). 赵继鹏, 杨淑慎. 曼地亚红豆杉细胞悬浮培养体系的建立. 西北农林科技大学学报:自然科学版, 2014, 42(1): 189-195. |
| [15] |
Gao Y, Sun MD, Xu QZ, et al. Establishment of callus induction and cell suspension culture system of Sophora alopecuroides.
Jiangsu Agricl Sci, 2017, 45(14): 27–31.
(in Chinese). 高媛, 孙牧笛, 徐全智, 等. 苦豆子愈伤组织诱导及细胞悬浮培养体系的建立. 江苏农业科学, 2017, 45(14): 27-31. |
| [16] |
Yang JL, Gui YL, Guo ZC. Studies on kinetics of somatic embryo suspension culture in Picea meyeri Rehd.et Wils.
Chin J Biotech, 2000, 16(2): 218–220.
(in Chinese). 杨金玲, 桂耀林, 郭仲琛. 白杄体细胞胚悬浮培养的动力学研究. 生物工程学报, 2000, 16(2): 218-220. DOI:10.3321/j.issn:1000-3061.2000.02.024 |
| [17] |
Yang YG, Gui YL, Tang W, et al. Observation on differentiation potential and chromosome stability of callus in subcultures of Picea wilsonii.
Acta Botan Sin, 1994, 36(12): 934–939.
(in Chinese). 杨映根, 桂耀林, 唐巍, 等. 青杄愈伤组织在继代培养中的分化能力及染色体稳定性研究. 植物学报, 1994, 36(12): 934-939. |
| [18] | Salaj T, Blehová A, Salaj J. Embryogenic suspension cultures of Pinus nigra Arn: Growth parameters and maturation ability. Acta Physiol Plant, 2007, 29(3): 225–231. DOI: 10.1007/s11738-007-0028-3 |
| [19] |
Yu B, Liu JM, Liu XR, et al. An efficient system of embryogenic cell suspension cultures and plant regeneration in Spathiphyllum cannifolium.
Acta Horticultu Sin, 2015, 42(4): 721–738.
(in Chinese). 于波, 刘金梅, 刘晓荣, 等. 白鹤芋胚性细胞悬浮培养和高效植株再生体系的建立. 园艺学报, 2015, 42(4): 721-738. |
| [20] | Mukherjee S, Ghosh B, Jha S. Establishment of forskolin yielding transfomed cell suspension cultures of Coleus forskohlii as controlledby different factors. J Biotechnol, 2000, 76(1): 73–81. DOI: 10.1016/S0168-1656(99)00181-9 |
| [21] |
Chen YQ, Zhu WH, Wu YQ, et al. Effects of fungal elicitor on taxol prodction in suspension cells of Taxus yunnanensis.
Chin J Biotech, 1999, 15(4): 522–524.
(in Chinese). 陈永勤, 朱蔚华, 吴蕴祺, 等. 几种真菌诱导子对云南红豆杉细胞产生紫杉醇的影响. 生物工程学报, 1999, 15(4): 522-524. DOI:10.3321/j.issn:1000-3061.1999.04.020 |
| [22] |
Zhang CP, Li C, Yuan YJ. Effects of fungal elicitor on secondary metabolism of cell suspension culture of Taxus chinensis var. mairei.
J Chem Ind Eng (China), 2002, 53(5): 498–502.
(in Chinese). 张长平, 李春, 元英进. 真菌诱导子对悬浮培养南方红豆杉细胞次生代谢的影响. 化工学报, 2002, 53(5): 498-502. DOI:10.3321/j.issn:0438-1157.2002.05.013 |
| [23] |
Sun Z, Yuan LH, Wu PM. Effects of elicitors on saffron pigment production in cell suspension cultures of Crocus sativus L..
Chin J Bioprs Eng, 2013, 11(3): 18–23.
(in Chinese). 孙镇, 袁丽红, 吴频梅. 诱导子对藏红花悬浮培养细胞生产藏红花色素的影响. 生物加工过程, 2013, 11(3): 18-23. DOI:10.3969/j.issn.1672-3678.2013.03.004 |
| [24] |
Dong YL, Pan XW. Effects of copper ion induction elicitation on camptothecin biosynthesis in cell suspension culture of campototheca acuminata decaisne.
J Anhui Agric Sci, 2010, 38(23): 12457–12459.
(in Chinese). 董妍玲, 潘学武. Cu2+诱导刺激对喜树悬浮培养细胞喜树碱生物合成的影响. 安徽农业科学, 2010, 38(23): 12457-12459. DOI:10.3969/j.issn.0517-6611.2010.23.058 |
| [25] | Almagro L, García-Pérez P, Belchí-Navarro S, et al. New strategies for the use of Linum usitatissimum cell factories for the production of bioactive compounds. Plant Physiol Biochem, 2015, 99: 73–78. |
| [26] | Zhao J, Zhu W H, Hu Q. Enhanced catharanthine production in Catharanthus roseus cell cultures by combined elicitor treatment in shake flasks and bioreactors. Enzyme Microb Technol, 2001, 28(7/8): 673–681. |
 2019, Vol. 35
2019, Vol. 35




