中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李毅坚, 罗国兴, 杨晗, 贾连智, 曾渊君, 赵毕妍, 李廷栋, 葛胜祥
- Li Yijian, Luo Guoxing, Yang Han, Jia Lianzhi, Zeng Yuanjun, Zhao Biyan, Li Tingdong, Ge Shengxiang
- 轮状病毒VP4*高聚体的制备及其免疫保护性评价
- Polymerization and evaluation of the protective efficacy of rotavirus VP4* proteins
- 生物工程学报, 2019, 35(2): 281-289
- Chinese Journal of Biotechnology, 2019, 35(2): 281-289
- 10.13345/j.cjb.180208
-
文章历史
- Received: May 16, 2018
- Accepted: July 2, 2018
- Published: August 1, 2018
2. 厦门大学公共卫生学院 国家传染病诊断试剂与疫苗工程技术研究中心 分子疫苗学与分子诊断学国家重点实验室,福建 厦门 361102
2. State Key of Molecular Vaccinology and Molecular Diagnostics, National Institute of Diagnostics and Vaccine Development in Infection Disease, School of Public Health, Xiamen University, Xiamen 361102, Fujian, China
在全球范围内,轮状病毒是引起5岁以下婴幼儿急性腹泻的主要病原体之一,每年导致约20万的死亡病例,主要发生在非洲和东南亚等发展中国家和地区[1]。目前有多种减毒轮状病毒疫苗上市,其中Rotarix® (GlaxoSmithKline)和RotaTeq® (Merck)在世界各地广泛接种[2]。随着减毒疫苗的广泛接种和医疗卫生条件的改善,轮状病毒导致的死亡率有所下降[3]。然而,在轮状病毒导致的死亡率较高的发展中国家,减毒活疫苗的保护性较低[4-5]。此外,减毒活疫苗也存在一定的安全风险,如增加肠套叠的风险[6-7]。因此,研究更加安全、高效的轮状病毒疫苗才能进一步降低轮状病毒导致的发病率和死亡率。
高滴度的母源抗体是导致减毒活疫苗在发展中国家有效性低的原因之一[8-12]。相比减毒活疫苗,基因工程疫苗无需在体内的复制过程,并且通过肠道外免疫可以在一定程度上避免母源抗体的干扰,有望解决减毒活疫苗在发展中国家有效性低的问题。
轮状病毒刺突蛋白VP4能被胰酶水解形成VP8*和VP5*蛋白,并增强轮状病毒的感染性[13-14]。其中VP8*蛋白可以与细胞表面受体结合,介导轮状病毒吸附,而VP5*蛋白介导轮状病毒的入胞[15-16]。VP8*与VP5*蛋白都能刺激机体产生中和抗体,大多数针对VP8*蛋白的中和抗体能阻断病毒吸附,而VP5*蛋白的特异性抗体能阻断病毒入胞[17]。VP4蛋白在轮状病毒感染过程中的关键作用使其成为轮状病毒疫苗研究的关键靶标。
全长的VP4蛋白具有较好的免疫保护性,但是其在真核系统的表达量较低,而在原核系统中以包涵体的形式表达[18-20]。2012年,闻小波等研究发现,VP8*蛋白核心区(ΔVP8,aa 65–223)可在大肠杆菌中以可溶形式表达[21],并且与破伤风毒素CD4+ T细胞表位P2融合表达可提高ΔVP8蛋白的免疫原性[22]。临床研究的结果表明,P2-VP8具有更高免疫原性,但血清中和抗体的阳转率仅为50%–66.7%[22]。本课题组在前期工作中发现,将ΔVP8的N端延长至aa 26具有更高的免疫原性,且含有VP5抗原区的截短蛋白VP4* (aa 26–476)在铝佐剂条件下具有较高的免疫原性,并且在小鼠模型中能够介导对轮状病毒导致的腹泻和排毒的免疫保护[23]。
尽管如此,在更高攻毒剂量的条件下,VP4*蛋白三聚体可能不能介导足够的免疫保护。研究表明,DC细胞对颗粒性抗原具有更高的递呈效率[24-26]。因此,我们尝试通过不同的方式使VP4*蛋白形成颗粒以进一步提高其免疫原性和免疫保护性。本研究发现,VP4*蛋白三聚体在37 ℃加热条件下可形成结构均一的高聚体,并且高聚体比三聚体具有更高的免疫原性和免疫保护性,为轮状病毒基因工程疫苗的研究提供了更广阔的思路。
1 材料与方法 1.1 主要材料表达轮状病毒VP4*蛋白的菌株为本实验室在前期工作中制备[23]。轮状病毒(LLR)和细胞(MA104)均来自北京万泰生物有限公司的馈赠;实验动物(Balb/c小鼠);酶及抗体:rTaq DNA聚合酶购自TaKaRa公司;限制性核酸内切酶购自TaKaRa和NEB公司;T4 DNA连接酶购自华美生物工程公司;AMV逆转录酶、胰酶购自Promega公司;羊抗鼠IgG碱性磷酸酶标记抗体购自晶美公司;轮状病毒VP4*中和抗体是本实验室自行制备筛选;DMEM培养基购自Invitrogen公司;细胞培养用抗生素购自华北制药厂;胎牛血清(FBS)购自GIBCO公司;PCR引物合成及DNA测序由生工生物工程(上海)股份有限公司完成;小量胶回收试剂盒及质粒小量提取试剂盒均购自北京Tiangen公司;DL2000的核酸Marker购自日本TaKaRa公司;SYBR Green DNA荧光染料购自Clare Chemical公司;考染试剂(SDS-PAGE)购自HyClone Pierce公司;去除内毒素的Detoxi-Gel预装柱购自Thermo Scientific公司;检测细菌内毒素的鲎试剂购自厦门鲎试剂厂;除此之外的其他试剂均为进口试剂或者是国产分析纯试剂。
1.2 轮状病毒VP4*蛋白纯化及高聚体制备及理化性质分析 1.2.1 轮状病毒VP4*蛋白的纯化及高聚体制备将表达VP4*蛋白的菌株在LB液体培养基中37 ℃培养4 h,降温到20 ℃后加入IPTG低温诱导6 h。之后用50 mmol/L Tris-HCl (pH 8.0) (TB8.0)吹溶菌液,超声裂解,释放目的蛋白。之后按照文献报道的方法[23],通过阴离子交换层析柱、苯基疏水柱分离纯化。将纯化后的VP4*蛋白透析至TB8.0缓冲液,通过Detoxi-Gel预装柱去除内毒素,并通过鲎试剂法检测残留的内毒素。将去除内毒素后的VP4*三聚体37 ℃处理24 h可形成高聚体。
1.2.2 高效液相色谱G5000 (HPLC)分析VP4*蛋白的均一性及聚体大小通过高效液相色谱TSK Gel G5000PWXL (TOSOH,Tokyo,Japan)分析VP4*三聚体和高聚体的均一性及聚体大小。分析过程中所用缓冲液为TB8.0,流速为0.5 mL/min,UV检测器波长为280 nm。
1.2.3 透射电镜(TEM)分析VP4*蛋白的聚体形式利用日本电子公司研制开发的100 kV透射电镜,放大倍数为100 000倍。将蛋白样品滴于镀炭的铜网上,吸附10 min,滤纸擦去残液,铜网上加一滴2%磷钨酸溶液(pH 7.0),负染1 min,吸掉负染液,晾干;透射电镜样品室中观察样品的颗粒形态,拍照进一步分析保存。
1.2.4 分析型超速离心(AUC)分析VP4*蛋白的分子量使用Beckman XL分析型超速离心机(Beckman Coulter,Fullerton,CA),按照文献报道的方法[27],将样品杯依次组装完整,装填蛋白样品和缓冲液对照,对高聚体颗粒进行超离分析,利用其专有程序进行数据采集,并用SEDFIT软件进行处理,作图。
1.2.5 差示扫描量热技术(DSC)分析VP4*蛋白的热稳定性DSC实验所使用的仪器为GE公司差示扫描量热仪Microcal VP capillary DSC。样品填充完毕后运行程序,扫描范围15–90 ℃,扫描速度为90 ℃/h。在Origin软件中,将样品曲线扣去对照曲线,得到样品的CP和温度的曲线,再读取并计算Tm等参数。
1.3 酶联免疫吸附试验比较VP4*蛋白的抗原性为了验证VP4*蛋白三聚体、高聚体与VP4*中和抗体的反应性,以便评价其在形成高聚体的过程中重要的中和表位是否受到破坏。我们尝试用间接ELISA方法对其进行评价,所用中和单抗均为VP4*蛋白免疫小鼠通过中和实验筛选获得[23, 28]。参照文章报道方法[23, 28-29],抗原50 ng/孔包板室温2 h,封闭2 h,将不同轮状病毒VP4*中和抗体稀释至100 ng/mL,分别加入相应的微孔板,与抗原室温反应1 h,洗涤后加入辣根过氧化物酶标记的羊抗鼠抗体(GAM-HRP),并通过TMB进行显色,通过酶标仪(TECAN,Männedorf,Switzerland)检测波长450/630 nm处的吸光度。
1.4 小鼠免疫和母源抗体模型评价VP4*蛋白免疫原性及免疫保护性 1.4.1 小鼠免疫和攻毒试验所有的实验方案均是按照厦门大学实验动物中心的实验动物伦理委员会批准的指导方针进行的。
免疫采用无特定病原体级(SPF) 5–6周龄Balb/c雌性小鼠,每组实验小鼠7只,通过眼眶静脉丛采血法采集小鼠免前血。将VP4*蛋白三聚体及高聚体,采用肌肉注射方法免疫小鼠(10 μg/只)。每隔2周免疫一次,共3次,每次免疫前以及最后一次免疫后14 d采集小鼠眼眶血进行血清抗体和中和抗体的检测。
参照文献报道方法[28],第3针免疫2周后进行雌鼠交配,分笼后产崽,对7日龄的乳鼠进行LLR病毒灌胃攻毒,攻毒剂量为5×106 TCID50/只小鼠,之后连续7 d进行监测子代乳鼠的腹泻情况。腹泻评分:正常固体粪便,不腹泻(1分);黄色软粪便,腹泻(2分);水样便,严重腹泻(3分)。
1.4.2 酶联免疫吸附试验检测VP4*蛋白的免疫原性血清抗体水平检测参照文献报道的方法[23],将VP4*蛋白三聚体进行包被,将采集的小鼠血清进行连续10倍稀释后,加入96孔中室温反应1 h,再用GAM-HRP进行检测。
1.4.3 ELISPOT检测VP4*蛋白的免疫中和活性血清中和效价检测参照文献报道方法[30],取采集的小鼠血清10 μL,56 ℃水浴30 min灭活补体,首孔100倍稀释,并在此基础上进行2倍梯度稀释后,分别与100 μL胰酶处理后的LLR病毒混合;再取100 μL的血清-病毒混合物,加入铺板在96孔板的MA104细胞中进行37 ℃感染14 h;对照组则用稀释液与处理后的病毒混合,再与MA104细胞进行37℃感染14 h;孵育后再用7H11-HRP抗体(实验室筛选制备的HRP标记的VP6抗体)进行检测。
抑制率=(1–实验组孔内的平均斑点数/对照组孔内的平均斑点数)×100%。通过四参数法计算50%抑制率时对应的稀释倍数即NT50。
1.5 数据分析SPSS软件21.0版本(SPSS,Chicago,IL,USA)进行统计分析,使用独立样本T检验比较两组连续变量差异,如血清总抗体水平、中和抗体效价等。作图采用GraphPad Prism V5.0及Adobe Illstrator CS6软件。
2 结果与分析 2.1 轮状病毒VP4*蛋白高聚体的制备及其理化性质分析按照文献中的方法对VP4*蛋白进行表达和纯化,经过两步纯化可以获得纯度高于95%的VP4*蛋白(图 1A)[23]。将纯化获得VP4*蛋白在4 ℃透析50 mmol/L TB8.0后,通过Detoxi-Gel去除残留的内毒素,并通过鲎试剂进行检测,结果发现,纯化后的VP4*蛋白中内毒素含量低于20 EU/mg。将纯化后的VP4*三聚体37 ℃处理24 h,并通过分子筛分析37 ℃处理后与4 ℃样品差异。结果发现,相比4 ℃保存的样品,37 ℃处理后的样品保留时间从17.2 min缩短为12.4 min (图 1B),这一结果提示,在37 ℃处理的过程中VP4*蛋白形成了高聚体。
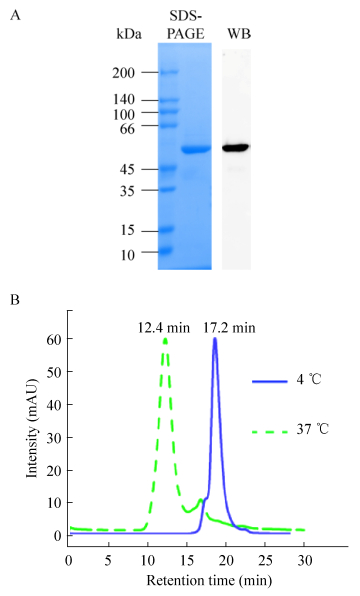
|
| 图 1 VP4*蛋白纯度和均一性的分析 Fig. 1 Evaluation of the purified VP4* proteins. (A) SDS-PAGE and WB analysis of the truncated VP4* proteins. (B) HPLC analysis of the VP4* truncated proteins treated at 4 ℃ and 37 ℃. |
| |
为了进一步分析VP4*蛋白高聚体的均一性,我们分别进行了分析型超速离心分析和透射电镜观察。分析超离和电镜结构均显示,VP4*蛋白高聚体的结构较为均一(图 2A和2B)。通过c(s)和c(M)分析发现,VP4*蛋白高聚体的分子量约为2 500 kDa,而VP4*蛋白的理论分子量约为50 kDa。因此,我们推测有50个左右的VP4*蛋白聚集形成高聚体。为了进一步比较高聚体和三聚体的热稳定性,分别对VP4*蛋白三聚体和高聚体进行了DSC分析,结果发现,VP4*蛋白三聚体有2个峰(图 2C),Tm1和Tm2分别为44.9 ℃和67.5 ℃,而VP4*蛋白高聚体仅在67.1 ℃出现的一个峰(图 2C)。

|
| 图 2 VP4*蛋白理化性质的比较 Fig. 2 Physicochemical characterization of the truncated VP4* proteins. (A) AUC analysis of the truncated VP4* protein treated at 37 ℃. (B) TEM analysis of the truncated VP4* protein treated at 37 ℃. (C) DSC analysis of the truncated VP4* proteins treated at 4 ℃ and 37 ℃. |
| |
我们推测,Tm1可能代表三聚体解聚形成单体的过程,而Tm2代表单体彻底变性的过程。VP4*蛋白三聚体加热到45 ℃后性质发生改变,聚集后再解聚;而高聚体耐受67 ℃才开始发生解聚,热稳定性明显优于三聚体。
2.2 轮状病毒VP4*蛋白三聚体与高聚体抗原性比较为了比较VP4*蛋白三聚体和高聚体的抗原性,分别将二者以50 ng/孔的量包被在96孔微孔板上,封闭后与轮状病毒VP4*中和抗体进行反应,并通过GAM-HRP进行检测。结果发现,大部分中和抗体与VP4*蛋白高聚体的反应显著高于VP4*三聚体(图 3)。这一结果提示,在VP4*蛋白高聚体形成过程中,能够较好地保留VP4*蛋白的中和表位。
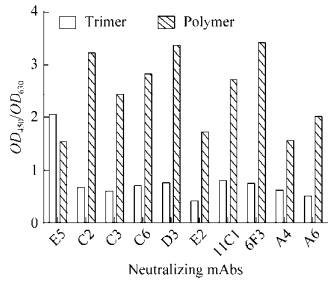
|
| 图 3 VP4*蛋白三聚体和高聚体与中和单抗反应性的比较 Fig. 3 The binding activity of VP4* trimers and polymers to rotavirus neutralizing antibodies. |
| |
为了比较VP4*蛋白三聚体和高聚体的免疫原性,将SPF级雌性Balb/c小鼠进行分组(7只/组),并分别免疫内毒素合格的VP4*蛋白三聚体和高聚体(内毒素 < 10 EU/mg),同时以灭活的LLR病毒作为阳性对照,以PBS作为阴性对照,佐剂为铝佐剂。
第三针免疫后14 d,采集小鼠的眼眶血,进行抗体滴度及中和抗体滴度的检测。结果发现,VP4*蛋白三聚体的免疫原性与灭活病毒相当,而无论是血清抗体滴度还是中和抗体滴度,VP4*蛋白高聚体均显著高于三聚体(图 4)。我们推测这可能与DC细胞对高聚体的递呈效率更高有关。
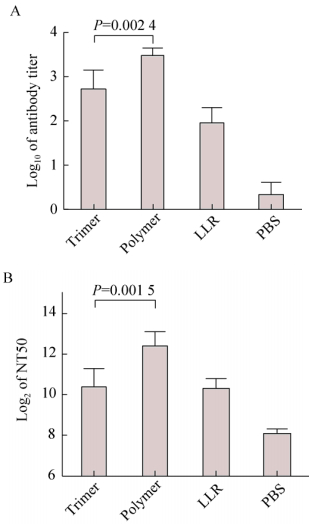
|
| 图 4 VP4*三聚体和高聚体免疫原性的比较 Fig. 4 Comparative study of the immunogenicity of VP4* trimers and polymers. (A) Antibody titers. (B) Neutralizing antibody titers. |
| |
三针免疫后,将雌性小鼠与雄性小鼠进行交配。子代小鼠出生7 d后,以5×106 TCID50的轮状病毒LLR对子代小鼠进行灌胃攻毒,并在攻毒后连续7 d监测乳鼠的腹泻情况。结果发现,对照组乳鼠100%出现严重腹泻,而无论是通过VP4*蛋白三聚体、高聚体还是灭活病毒进行免疫,免疫组的腹泻率、腹泻水平以及持续时间均显著低于对照组(图 5,表 1)。VP4*蛋白三聚体免疫组有20%的乳鼠出现腹泻,而VP4*蛋白高聚体免疫组乳鼠均未出现腹泻(图 5,表 1)。相比三聚体,高聚体具有更高的免疫保护性(P=0.03)。

|
| 图 5 VP4*抗原对轮状病毒导致的腹泻的免疫保护性 Fig. 5 The protective efficacy of VP4* against rotavirus-induced diarrhea. The Y axis represent the diarrhea score after challenges, and the error bars represent the standard error (n≥8). |
| |
| Immunogen | Numbera | Diarrhea | Severe diarrhea | Cumulative diarrhea scorec | ||||
| Percentage | Onset dayb | Duration (d) | Percentage | Duration (d) | ||||
| Trimer | 20 | 25 (5/20)* | 2±0* | 0.2±0.5* | 25 (5/20)* | 0.1±0.3* | 7.7±0.6* | |
| Polymer | 16 | 0 (0/16)*, # | / | 0*, # | 0*, # | 0*, # | 7±0.0*, # | |
| LLR | 17 | 29.4 (5/17)* | 1.8±0.32* | 0.5±1.3* | 29.4 (5/17)* | 0.3±0.4* | 7.9±1.1* | |
| PBS | 12 | 100 (12/12) | 1±0 | 4.8±0.8 | 100 (12/12) | 3.2±0.6 | 14.7±1.25 | |
| a The number of pups varied from group to group due to differences in the mating rate and the litter size.
b The onset day of diarrhea was calculated for the mice with diarrhea. c Calculated as the sum of daily fecal scores for 7 d post challenge/n. A cumulative score of 7 mean that none of pups in this group developed diarrhea. * Significant difference was found as compared to the PBS control group (P < 0.05). # Significant difference was found as compared between Trimer group with Polymer group (P < 0.05). |
||||||||
在本研究中,我们发现VP4*蛋白三聚体在37 ℃处理24 h,能够形成较为均一、稳定的高聚体结构,并且在小鼠模型中,VP4*蛋白高聚体相比三聚体具有更高的免疫原性和免疫保护性,为轮状病毒基因工程疫苗的研究提供了新的思路。
相比传统的减毒活疫苗和灭活疫苗,基因工程疫苗具有更高的安全性,并且大量数据表明,乙型肝炎病毒基因工程疫苗和乳头瘤病毒基因工程疫苗均为病毒样颗粒(VLP)疫苗,在结构上与天然病毒较为接近,并且容易被DC细胞递呈,具有较好的免疫保护性[24-26]。轮状病毒VP4蛋白是重要的中和抗原,在病毒吸附、入胞过程中发挥着重要作用,是轮状病毒疫苗研究的主要靶标。本实验室在前期工作中发现截短表达的VP4*蛋白(aa26–476)在小鼠模型中具有较高的免疫原性和免疫保护性[23]。本研究发现,VP4*蛋白经37 ℃处理后可形成高聚体,并且相比三聚体具有更高的免疫原性和免疫保护性。一方面,与VLP疫苗类似,VP4*高聚体由于其粒径较大,更容易被DC细胞递呈;另一方面,高聚体与中和抗体的反应性与三聚体相比显著升高,说明在形成高聚体的过程中,较好地保留了VP4*蛋白的中和表位。此外,VP4*高聚体的稳定性、均一性均较好,因此,该蛋白具有成为轮状病毒基因工程疫苗的潜力。
目前VP4*蛋白高聚体成为轮状病毒候选疫苗还需要开展大量的工作。首先,本研究基于动物源轮状病毒LLR毒株开展研究,尽管VP4*蛋白高聚体在小鼠上具有较好的保护性,然而,动物源毒株的VP4基因序列与人源毒株的同源性较低,因此,在后续工作中我们将进一步表达人源毒株的VP4*蛋白,并研究其免疫原性和免疫保护性;其次,在轮状病毒VLP疫苗的研究过程中发现,同一抗原在不同的动物模型中的免疫保护性具有显著差异[31-32],因此,我们将进一步研究VP4*蛋白在其他动物模型特别是肠道系统结构与人体较为接近的小型猪以及非人灵长类动物中的免疫原性;最后,轮状病毒基因型和血清型较多,我们还要进一步研究VP4*蛋白免疫血清的交叉中和活性,并进一步分析研究多价苗的必要性与可行性。
| [1] | Mullick S, Mandal P, Nayak MK, et al. Hospital based surveillance and genetic characterization of rotavirus strains in children (< 5 years) with acute gastroenteritis in Kolkata, India, revealed resurgence of G9 and G2 genotypes during 2011-2013. Vaccine, 2014, 32(S1): A20–A28. |
| [2] | Parashar UD, Glass RI. Rotavirus vaccines-early success, remaining questions. N Engl J Med, 2009, 360(11): 1063–1065. DOI: 10.1056/NEJMp0810154 |
| [3] | Harris VC, Armah G, Fuentes S, et al. Significant correlation between the infant gut microbiome and rotavirus vaccine response in rural ghana. J Infect Dis, 2017, 215(1): 34–41. |
| [4] | Cunliffe NA, Witte D, Ngwira BM, et al. Efficacy of human rotavirus vaccine against severe gastroenteritis in Malawian children in the first two years of life: a randomized, double-blind, placebo controlled trial. Vaccine, 2012, 30(S1): A36–A43. |
| [5] | Armah GE, Sow SO, Breiman RF, et al. Efficacy of pentavalent rotavirus vaccine against severe rotavirus gastroenteritis in infants in developing countries in sub-Saharan Africa: a randomised, double-blind, placebo- controlled trial. Lancet, 2010, 376(9741): 606–614. DOI: 10.1016/S0140-6736(10)60889-6 |
| [6] | Payne DC, Edwards KM, Bowen MD, et al. Sibling transmission of vaccine-derived rotavirus (RotaTeq) associated with rotavirus gastroenteritis. Pediatrics, 2010, 125(2): e438–e441. DOI: 10.1542/peds.2009-1901 |
| [7] | Yen C, Jakob K, Esona MD, et al. Detection of fecal shedding of rotavirus vaccine in infants following their first dose of pentavalent rotavirus vaccine. Vaccine, 2011, 29(24): 4151–4155. DOI: 10.1016/j.vaccine.2011.03.074 |
| [8] | Moon SS, Wang YH, Shane AL, et al. Inhibitory effect of breast milk on infectivity of live oral rotavirus vaccines. Pediatr Infect Dis J, 2010, 29(10): 919–923. DOI: 10.1097/INF.0b013e3181e232ea |
| [9] | Moon SS, Tate JE, Ray P, et al. Differential profiles and inhibitory effect on rotavirus vaccines of nonantibody components in breast milk from mothers in developing and developed countries. Pediatr Infect Dis J, 2013, 32(8): 863–870. |
| [10] | Appaiahgari MB, Glass R, Singh S, et al. Transplacental rotavirus IgG interferes with immune response to live oral rotavirus vaccine ORV-116E in Indian infants. Vaccine, 2014, 32(6): 651–656. DOI: 10.1016/j.vaccine.2013.12.017 |
| [11] | Becker-Dreps S, Vilchez S, Velasquez D, et al. Rotavirus-specific IgG antibodies from mothers' serum may inhibit infant immune responses to the pentavalent rotavirus vaccine. Pediatr Infect Dis J, 2015, 34(1): 115–116. DOI: 10.1097/INF.0000000000000481 |
| [12] | Chilengi R, Simuyandi M, Beach L, et al. Association of maternal immunity with rotavirus vaccine immunogenicity in zambian infants. PLoS ONE, 2016, 11(3): e0150100. DOI: 10.1371/journal.pone.0150100 |
| [13] | Estes MK, Graham DY, Mason BB. Proteolytic enhancement of rotavirus infectivity: molecular mechanisms. J Virol, 1981, 39(3): 879–888. |
| [14] | Settembre EC, Chen JZ, Dormitzer PR, et al. Atomic model of an infectious rotavirus particle. EMBO J, 2011, 30(2): 408–416. DOI: 10.1038/emboj.2010.322 |
| [15] | Abdelhakim AH, Salgado EN, Fu XF, et al. Structural correlates of rotavirus cell entry. PLoS Pathog, 2014, 10(9): e1004355. DOI: 10.1371/journal.ppat.1004355 |
| [16] | Mackow ER, Vo PT, Broome R, et al. Immunization with baculovirus-expressed VP4 protein passively protects against simian and murine rotavirus challenge. J Virol, 1990, 64(4): 1698–1703. |
| [17] | Trask SD, McDonald SM, Patton JT. Structural insights into the coupling of virion assembly and rotavirus replication. Nat Rev Microbiol, 2012, 10(3): 165–177. DOI: 10.1038/nrmicro2673 |
| [18] |
Liu X, Sun MS. Procaryotic expression of rotavirus VP4 gene, protein purification and animal immunization.
Progr Vet Med, 2006, 27(12): 88–90.
(in Chinese). 刘馨, 孙茂盛. 轮状病毒VP4基因的原核表达、蛋白纯化及动物免疫试验. 动物医学进展, 2006, 27(12): 88-90. DOI:10.3969/j.issn.1007-5038.2006.12.022 |
| [19] | Lee J, Babiuk LA, Harland R, et al. Immunological response to recombinant VP8* subunit protein of bovine rotavirus in pregnant cattle. J Gen Virol, 1995, 76(10): 2477–2483. DOI: 10.1099/0022-1317-76-10-2477 |
| [20] | Favacho ARM, Kurtenbach E, Sardi SI, et al. Cloning, expression, and purification of recombinant bovine rotavirus hemagglutinin, VP8*, in Escherichia coli. Protein Expr Purif, 2006, 46(2): 196–203. DOI: 10.1016/j.pep.2005.09.014 |
| [21] | Wen XB, Cao DJ, Jones RW, et al. Construction and characterization of human rotavirus recombinant VP8* subunit parenteral vaccine candidates. Vaccine, 2012, 30(43): 6121–6126. DOI: 10.1016/j.vaccine.2012.07.078 |
| [22] | Wen XB, Wen K, Cao DJ, et al. Inclusion of a universal tetanus toxoid CD4+ T cell epitope P2 significantly enhanced the immunogenicity of recombinant rotavirus ΔVP8* subunit parenteral vaccines. Vaccine, 2014, 32(35): 4420–4427. DOI: 10.1016/j.vaccine.2014.06.060 |
| [23] | Li YJ, Xue MG, Yu LQ, et al. Expression and characterization of a novel truncated rotavirus VP4 for the development of a recombinant rotavirus vaccine. Vaccine, 2018, 36(16): 2086–2092. DOI: 10.1016/j.vaccine.2018.03.011 |
| [24] | Levin D, Constant S, Pasqualini T, et al. Role of dendritic cells in the priming of CD4+ T lymphocytes to peptide antigen in vivo. J Immunol, 1993, 151(12): 6742–6750. |
| [25] | Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature, 1998, 392(6673): 245–252. DOI: 10.1038/32588 |
| [26] | Tuyaerts S, Van Meirvenne S, Bonehill A, et al. Expression of human GITRL on myeloid dendritic cells enhances their immunostimulatory function but does not abrogate the suppressive effect of CD4+ CD25+ regulatory T cells. J Leukoc Biol, 2007, 82(1): 93–105. DOI: 10.1189/jlb.0906568 |
| [27] | Li SW, Tang XH, Seetharaman J, et al. Dimerization of hepatitis E virus capsid protein E2s domain is essential for virus-host interaction. PLoS Pathog, 2009, 5(8): e1000537. DOI: 10.1371/journal.ppat.1000537 |
| [28] | Xue MG, Yu LQ, Che YJ, et al. Characterization and protective efficacy in an animal model of a novel truncated rotavirus VP8 subunit parenteral vaccine candidate. Vaccine, 2015, 33(22): 2606–2613. DOI: 10.1016/j.vaccine.2015.03.068 |
| [29] | Xue MG, Yu LQ, Jia LZ, et al. Immunogenicity and protective efficacy of rotavirus VP8* fused to cholera toxin B subunit in a mouse model. Hum Vaccin Immunother, 2016, 12(11): 2959–2968. DOI: 10.1080/21645515.2016.1204501 |
| [30] | Li TD, Lin HJ, Yu LQ, et al. Development of an enzyme-linked immunospot assay for determination of rotavirus infectivity. J Virol Methods, 2014, 209: 7–14. DOI: 10.1016/j.jviromet.2014.08.012 |
| [31] | Yuan LJ, Geyer A, Hodgins DC, et al. Intranasal administration of 2/6-rotavirus-like particles with mutant Escherichia coli heat-labile toxin (LT-R192G) induces antibody-secreting cell responses but not protective immunity in gnotobiotic pigs. J Virol, 2000, 74(19): 8843–8853. DOI: 10.1128/JVI.74.19.8843-8853.2000 |
| [32] | Li TD, Lin HJ, Zhang Y, et al. Improved characteristics and protective efficacy in an animal model of E. coli-derived recombinant double-layered rotavirus virus-like particles. Vaccine, 2014, 32(17): 1921–1931. DOI: 10.1016/j.vaccine.2014.01.093 |
 2019, Vol. 35
2019, Vol. 35




