中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王霞, 刘录祥, 乔利仙, 隋炯明, 姜德锋, 李冠, 赵琳姝, 王晶珊
- Wang Xia, Liu Luxiang, Qiao Lixian, Sui Jiongming, Jiang Defeng, Li Guan, Zhao Linshu, Wang Jingshan
- 快中子辐照结合组织培养培育花生新品种宇花7号
- Breeding peanut variety Yuhua 7 by fast neutron irradiation and tissue culture
- 生物工程学报, 2019, 35(2): 270-280
- Chinese Journal of Biotechnology, 2019, 35(2): 270-280
- 10.13345/j.cjb.180207
-
文章历史
- Received: May 16, 2018
- Accepted: August 13, 2018
- Published: August 28, 2018
2. 中国农业科学院 作物科学研究所 国家农作物基因资源与基因改良重大科学工程 国家农作物航天诱变技术改良中心,北京 100081;
3. 青岛农业大学 农学院 山东省旱作农业重点实验室,山东 青岛 266109
2. National Center of Space Mutagenesis for Crop Improvement, National Key Facility for Crop Gene Resources and Genetic Improvement, Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3. Dry-land Farming Technology Laboratory, College of Agronomy, Qingdao Agricultural University, Qingdao 266109, Shandong, China
花生Arachis hypogaea是重要的油料和经济作物之一[1-3],除榨油外也广泛用于食品加工或作为坚果直接食用[4]。花生籽仁营养丰富,有补脾润肺、补中益气、开胃醒脾的功效,又有强身健脑、驻颜延年之用,故又称“长生果”[5]。花生富含蛋白质,必需氨基酸营养全面,尤其是各类主食中所缺乏的赖氨酸含量较高,对人类膳食营养具有重要的意义[6-7]。然而,随着人们生活水平的提高和保健意识增强,营养过剩问题深受关注。研究表明膳食脂肪的过量摄入会严重影响人类的健康[8-10],低脂饮食是影响健康最主要的保护因素之一[11]。而一般花生品种含油率较高,目前花生育种者们提出优质专用作为花生品种选育目标之一[12]。但花生遗传基础狭窄、多样性差,通过杂交育种的手段选育出有突破性的花生新品种越来越困难[13-14]。诱变技术的应用是创造种质资源、加速品种改良进程的重要手段之一[15-18]。与常规诱变育种相比,利用诱变结合组织培养进行育种,能够提高变异频率,增加选择几率[19-21]。并且在植物组织培养中,通过体细胞胚胎发生途径再生植株,通常被认为是单细胞起源的,而突变也是一种单细胞事件,能够克服突变体嵌合现象[22-23]。研究者们已在不同植物上开展了离体诱变研究[24-27],并利用突变体育成了新品种[28]。近年来研究者们开展了花生离体诱变研究,Venkatachalam等利用离体诱变和定向筛选获得了对黑斑病抗性明显提高的植株[29],Muthusamy等在花生离体诱变中获得了叶片形状变化及单株结果数和荚果重提高的突变体[19]。本课题组利用平阳霉素作为诱变剂进行离体诱变,分别获得了耐盐性和抗旱性明显提高的花生突变体[20, 30],并从中育成了花生新品种[14]。
本研究利用快中子作为辐照源,对辐照处理后的花生种子胚小叶进行组织培养,对再生植株后代农艺性状和品质性状进行测定分析,并培育出低油早熟耐涝大花生新品种宇花7号。
1 材料与方法 1.1 植物材料供试材料为花生品种鲁花11号的成熟饱满干种子,由青岛农业大学农学院保存。
1.2 方法 1.2.1 辐照处理及离体培养选用鲁花11号成熟饱满的干种子在中国原子能科学研究院进行快中子辐照处理,辐照能量为14 MeV,辐照剂量分别设置为0、9.7、14.0、18.0 Gy。
取每个辐照剂量照射后的种子8粒,去除子叶,取种胚进行表面消毒。先用70%的酒精浸泡20 s,再用0.1%升汞浸泡10 min,最后用灭菌水漂洗3遍后,置于无菌水中浸泡10 h。将种胚置于培养皿中剥离胚小叶,随即接种到体细胞胚诱导培养基上进行培养。诱导培养基为MSB5 (MS无机盐+B5有机成分)培养基,添加10 mg/L 2, 4-D、3%蔗糖、0.8%琼脂,pH值调至5.8。培养4周后,将外植体转移到添加4 mg/L BAP、3%蔗糖、0.8%琼脂的MSB5培养基(pH值调至5.8)上,诱导体细胞胚萌发成苗。每4周继代培养1次,直到小苗长到1.5 cm左右。培养条件均为(25±1) ℃、13 h/d光照、光照强度3 000 lx。
1.2.2 再生苗的嫁接、移栽及其后代的选育以体细胞胚萌发长成的小苗(1.5 cm以上)作为接穗,无菌萌发的苗龄10–12 d的花生苗作为砧木,在超净工作台内进行无菌嫁接。嫁接苗在培养瓶中闭瓶培养2–3 d,促进嫁接口愈合。打开瓶口炼苗1–2 d后,将嫁接苗移栽于育苗基质中,在驯化室内培养3周。之后移栽到青岛农业大学莱阳试验基地。移栽初期2周内中午9点至下午4点加盖遮荫网,之后按田间种植方式管理。成熟后按单株收获荚果。
选育方法采用系谱法,M2–M5代按株行种植,起垄单粒播种,每垄播种2行,株距20 cm,以诱变亲本鲁花11号作为对照,选择变异单株,其中优良单株作为育种材料。优良单株的选择,是在出苗期和开花期挂牌标记出苗早、苗壮和开花早、花期集中的单株,收获期结合挂牌标记,选择产量高、结果整齐集中的单株作为育种选择材料,并结合海南加代加快育种进程;其他明显变异的单株作为突变材料自交纯合。
M5代从单株结果多、荚果整齐、抗逆性强、遗传基本稳定的株行中选择优良单株混收形成株系。2012年将选择的优良株系进行产量鉴定试验,入选株系于2013至2014年进行产量品比试验,试验分别在青岛农业大学莱阳实验基地和山东省招远市毕郭镇进行。起垄双粒播种,每垄播种2行,每个小区面积为12.78 m2,重复3次,以亲本鲁花11号作为对照。按常规进行田间管理,收获晒干后进行室内考种,并称重各小区荚果产量。
1.2.3 辽宁省非主要农作物品种登记试验选择优良品系于2016年参加辽宁省非主要农作物品种登记试验,起垄双粒播种,每垄播种2行,每个小区面积13.34 m2,重复3次,全省不同地域共设6个试验点。
1.2.4 籽仁含油率和蛋白含量测定采用德国BRUKER公司生产的型号为MATRIX-1近红外光谱仪,测定分析籽仁含油率和蛋白含量。
2 结果与分析 2.1 辐照处理的胚小叶离体培养及植株再生经辐照处理后的种子胚小叶外植体在添加10 mg/L 2, 4-D的诱导培养基上培养1周后,观察到胚小叶展开,并由原来的白色逐渐变为浅绿色,之后部分外植体形成体细胞胚,而另外部分外植体形成了愈伤组织。培养4周后统计体细胞胚诱导率见图 1,随辐照剂量的增加体细胞胚的诱导率呈下降趋势,未辐照的对照体细胞胚诱导率为92.1%;辐照剂量为9.7 Gy时,体细胞胚诱导率为65.7%;辐照剂量增加到14.0 Gy时,体细胞胚诱导率降低到34.9%;当辐照剂量增加到18.0 Gy时,体细胞胚诱导率仅为25.1%。之后将形成体细胞胚的外植体转移到添加4 mg/L BAP的培养基上进行培养,体细胞胚萌发并长成小苗。当小苗长到1.5 cm以上后,以再生苗作为接穗、无菌萌发的花生种子实生苗作为砧木进行嫁接,嫁接苗经驯化后移栽于青岛农业大学莱阳试验基地,最终83株嫁接的再生苗收获了正常成熟的种子。

|
| 图 1 不同快中子辐照剂量对花生品种鲁花11号体细胞胚诱导率的影响 Fig. 1 The effect of fast neutron irradiation on somatic embryo induction in peanut cultivar Luhua 11. |
| |
收获的83个单株种子次年种成株行(M2代),以诱变亲本鲁花11号作为对照。生育期及收获期观察发现,9.7、14、19.8 Gy辐照组分别有9个、7个、8个M2代株行单株之间发生明显分离,与亲本相比表现出明显的变异。收获期选择变异单株,M3代和M4代继续按株行单粒播种,观察发现,同一株行单株间仍有分离,直到M5代观察已基本稳定。
分别将M5代同一株行的单株混收,作为突变材料或育种材料,共获得107份突变体。其中9.7 Gy辐照组32份,14 Gy辐照组35份,18 Gy辐照组40份。这些突变材料在主茎高、分枝数、荚果大小、果形、种皮颜色、内种皮颜色等方面与诱变亲本不同,表现出明显的变异。主茎高变异幅度较大,最高达162 cm (图 2A),最矮仅为35 cm (图 2B),而亲本鲁花11号主茎高为46.6 cm (图 2D)。突变体的分枝数也有变异,总分枝数最多28条(图 2C),而鲁花11号总分枝数为10条(图 2D)。

|
| 图 2 突变体植株变异 Fig. 2 Plant variation of mutants. (A–C) Mutants. (D) Luhua 11. The digital unit is cm. |
| |
突变体荚果和籽仁大小的变异幅度较大,统计百果重和百仁重变异分布范围(图 3和图 4)。由图 3和图 4可以看出,百果重主要分布在200–300 g,百仁重主要分布在70–110 g,但有极大果和极小果变异,百果重最大为330.1 g,最小仅为176.6 g。百仁重最大为122.2 g,最小仅为66.2 g。而诱变亲本鲁花11号百果重为235.2 g,百仁重为89.1 g。

|
| 图 3 快中子辐照鲁花11号突变体百果重变异分布 Fig. 3 Variation distribution of 100 pod weight of mutants. |
| |

|
| 图 4 快中子辐照鲁花11号突变体百仁重变异分布 Fig. 4 Variation distribution of 100 seed weight of mutants. |
| |
鲁花11号荚果普通形,种皮颜色粉红色,内种皮白色,而突变体荚果形状有不规则形(图 5A)、蜂腰形(图 5B)等突变,种皮颜色有紫色突变,内种皮颜色有桔黄色突变。

|
| 图 5 突变体荚果形状变异 Fig. 5 Pod variation of mutants. (A) Irregular shape (right). (B) Bee-waist shape (right). The left is parent Luhua 11. |
| |
采用近红外测定籽仁成分,4份突变体蛋白含量超过30%,6份突变体含油率超过55%,分别达到高蛋白和高油标准,另有5份突变体含油率较低,在48%以下。而亲本鲁花11号含油率为52.1%,蛋白含量为27.2%。以上这些突变体可为育种、遗传研究、基因挖掘等提供宝贵的材料。
选择优良株系作为育种候选材料,在M3代和M4代选择的基础上,M5代有8个株行结果较多、荚果整齐、抗病性较强。将这8个株行分别选择最优良单株混收荚果,海南繁种形成株系。2012年在青岛农业大学莱阳实验基地进行产量鉴定试验,以亲本鲁花11号作为对照。收获后称重荚果产量,结果表明,9.7 Gy-1-4-7-3、9.7 Gy-3-2-4-6和14 Gy-4-2-2-3等3个株系荚果产量比鲁花11号增产10%以上,将这3个株系升级为品系。
2.3 高产品系产量品比试验结果及性状分析2013–2014年分别在青岛农业大学莱阳实验基地和山东省招远市毕郭镇进行产量品比试验,并测定农艺性状,以亲本鲁花11号作为对照。农艺性状测定结果见表 1。亲本鲁花11号生育期为133 d,品系9.7 Gy-3-2-4-6与亲本相同,14 Gy-4-2-2-3生育期稍长,为135 d,而9.7 Gy-1-4-7-3生育期仅为120 d,比鲁花11号早熟13 d。3个品系的主茎高、侧枝长、总分枝数、有效分枝数与鲁花11号无明显差异。但9.7 Gy-3-2-4-6和14 Gy-4-2-2-3的荚果较大,百果重分别为275.3 g和275.5 g,百仁重分别为104.7 g和117.0 g。而鲁花11号百果重为235.2 g,百仁重为89.1 g。9.7 Gy-1-4-7-3百果重和百仁重略低于亲本鲁花11号,分别为231.3 g和88.2 g。14 Gy-4-2-2-3出米率最高(75.4%),9.7 Gy-3-2-4-6出米率最低(71.0%),9.7 Gy-1-4-7-3出米率为72.6%,略低于鲁花11号(73.1%)。9.7 Gy-1-4-7-3含油率最低,仅为47.0%,比鲁花11号(52.1%)降低了5.1个百分点,其他2个品系含油率与鲁花11号无明显差异。9.7 Gy-3-2-4-6蛋白含量较低(25.9%),其他2个品系蛋白含量与鲁花11号(27.6%)无明显差异。2013年于青岛农业大学莱阳试验基地进行产量品比试验,2013年莱阳市雨水较多,尤其花生生育中后期降水较多,影响花生生长和产量。观察发现品系9.7 Gy-3-2-4-6、14 Gy-4-2-2-3及亲本鲁花11号均倒伏严重,并且有烂果,而9.7 Gy-1-4-7-3株型直立未观察到倒伏发生,也未观察到烂果,表现出较强的耐涝性和抗倒伏性(表 1)。成熟收获晒干后,称重各小区荚果产量,统计结果见表 2。由表 2可以看出,品系9.7 Gy-1-4-7-3荚果产量最高,平均每公顷荚果产量7 328 kg,比对照鲁花11号增产23.99%,差异达到显著水平。其他2个品系9.7 Gy-3-2-4-6和14 Gy-4-2-2-3平均荚果产量分别为每公顷6 507 kg和6 522 kg,分别比鲁花11号增产10.10%和10.36%,但差异均未达到显著水平。
| Lines | 9.7 Gy-1-4-7-3 | 9.7 Gy-3-2-4-6 | 14 Gy-4-2-2-3 | Luhua 11 |
| Growth period (d) | 120.00 | 133.00 | 135.00 | 133.00 |
| Main stem height (cm) | 41.30 | 45.60 | 43.80 | 46.60 |
| Lateral branch length (cm) | 44.50 | 52.00 | 47.20 | 48.50 |
| Number of lateral branch per plant | 10.00 | 10.00 | 9.50 | 10.00 |
| Number of podding branches per plant | 9.00 | 8.50 | 9.50 | 8.00 |
| Weight per 100 pods (g) | 231.30 | 275.30 | 275.50 | 235.20 |
| Weight per 100 seed kenels (g) | 88.20 | 104.70 | 117.00 | 89.10 |
| Milled rice rate (%) | 72.60 | 71.00 | 75.40 | 73.10 |
| Oil content (%) | 47.00 | 53.70 | 52.80 | 52.10 |
| Protein content (%) | 27.80 | 25.90 | 28.10 | 27.60 |
| Resistance to lodging | High | Middle | Middle | Middle |
| Lines | Average yield (kg/hm2) | Standard deviation | Yield increase (%) |
| Luhua 11 | 5 910.00 | 612.73 | 0.00 |
| 9.7 Gy-1-4-7-3 | 7 328.00* | 514.07 | 23.99 |
| 9.7 Gy-3-2-4-6 | 6 507.00 | 200.81 | 10.10 |
| 14 Gy-4-2-2-3 | 6 522.00 | 708.13 | 10.36 |
| * Stand for significant difference at P < 0.05. | |||
2014年继续进行产量品比试验,试验地点分别在青岛农业大学莱阳实验基地和招远市毕郭镇进行。青岛农业大学莱阳实验基地试验结果列于表 3,3个品系9.7 Gy-1-4-7-3、9.7 Gy-3-2-4-6和14 Gy-4-2-2-3平均荚果产量分别为每公顷6 821 kg、6 701 kg和6 791 kg,均显著高于亲本鲁花11号(5 940 kg/hm2),分别增产14.83%、12.81%和14.32%。
| Lines | Average yield (kg/hm2) | Standard deviation | Yield increase (%) |
| Luhua 11 | 5 940.00 | 93.21 | 0.00 |
| 9.7 Gy-1-4-7-3 | 6 821.00* | 411.82 | 14.83 |
| 9.7 Gy-3-2-4-6 | 6 701.00* | 641.79 | 12.81 |
| 14 Gy-4-2-2-3 | 6 791.00* | 289.93 | 14.32 |
| * Stand for significant difference at P < 0.05. | |||
将2014年招远市毕郭镇试验结果列于表 4,品系9.7 Gy-1-4-7-3和14 Gy-4-2-2-3平均荚果产量分别为每公顷7 075 kg和7 089 kg,比鲁花11号分别增产15.06%和15.29%,达到显著水平。9.7 Gy-3-2-4-6荚果产量为每公顷6 806 kg,比鲁花11号增产10.68%,但未达到显著水平。
| Lines | Average yield (kg/hm2) | Standard deviation | Yield increase (%) |
| Luhua 11 | 6 149.00 | 345.01 | 0.00 |
| 9.7 Gy-1-4-7-3 | 7 075.00* | 635.34 | 15.06 |
| 9.7 Gy-3-2-4-6 | 6 806.00 | 536.13 | 10.68 |
| 14 Gy-4-2-2-3 | 7 089.00* | 122.16 | 15.29 |
| * Stand for significant difference at P < 0.05. | |||
根据2013年和2014年两年3个试验点试验结果,品系9.7 Gy-1-4-7-3产量均显著高于亲本鲁花11号。2016年9.7 Gy-1-4-7-3参加辽宁省非主要农作物品种登记试验,在全省不同地域6个试验点平均荚果产量比对照白沙1017增产13.8%,命名为宇花7号。2017年申请国家非主要农作物品种登记,并获批登记,登记号为“GPD花生(2018) 370105”。
宇花7号为低油早熟大花生品种,全生育期120 d,比亲本鲁花11号生育期缩短13 d。株型直立、疏枝,与亲本鲁花11号相似(图 6)。但宇花7号茎枝韧性好(图 6B),抗倒伏性和耐涝性较强,叶斑病抗性和耐旱性中等。而鲁花11号耐涝性较差,抗旱性较较强。宇花7号荚果普通形,籽仁椭圆形,种皮浅粉红色,比鲁花11号颜色稍浅(图 7)。内种皮桔黄色(图 7B),而鲁花11号内种皮为白色(图 7A)。宇花7号百果重231.3 g,百仁重88.2 g,出米率72.6%,蛋白含量27.8%,含油率47.0%,比鲁花11号含油率降低5.1个百分点(表 1)。

|
| 图 6 宇花7号(B)与亲本鲁花11号(A)植株 Fig. 6 Plants of Yuhua 7 (B) and parent Luhua 11 (A). The digital unit is cm. |
| |
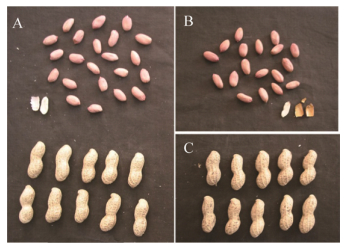
|
| 图 7 宇花7号与亲本鲁花11号荚果、籽仁及内种皮颜色 Fig. 7 Pods, seed kernels and inner seed coat color of Yuhua 7 and parent Luhua 11. (A) Pods, seed kernels and inner seed coat color (white) of Luhua 11. (B) Seed kernels and inner seed coat color (orange) of Yuhua 7. (C) Pods of Yuhua 7. |
| |
辐照与植物组织培养相结合的诱变方法有助于得到丰富的变异体,增加选择几率,诱变材料不受季节限制,并且通过体细胞胚胎发生途径再生植株,能克服突变体的嵌合现象[23]。快中子辐照是一种线性传能密度和相对生物学效应均较高的电离辐射,并能引起较高密度的次级电离,引起植物细胞的基因突变,且这种突变可稳定遗传,是一种有效的物理诱变因素[31]。本研究选用快中子为辐照源,以鲁花11号干种子为试材,经辐照处理后取种子胚小叶进行离体培养,诱导体细胞胚胎发生。体胚萌发再生的植株,经嫁接移栽田间后,83个单株获得了种子,其中24个单株的M2代发生变异和分离,从这些变异植株后代中共获得了各种各样的突变体107份。突变体主茎高变异幅度(35–162) cm,百果重变异幅度为(176.6–330.1) g,百仁重变异幅度为(66.2–122.2) g,籽仁含油率变异幅度为46.62%–56.02%。其中6份突变体含油率超过55%,4份突变体蛋白含量超过30%,分别达到高油和高蛋白标准,另有5份突变体含油率较低,在48%以下。本研究结果表明快中子辐照与组织培养相结合是花生育种的一条有效途径。
目前肥胖、营养过剩等问题备受关注,低脂饮食深受欢迎。花生营养丰富,但花生含油率较高,作为加工或直接食用品种,降低含油率是提高花生品质的重要指标之一。一般花生品种的含油率在50%–52%[32],本研究培育的花生品种宇花7号含油率为47.0%,比诱变亲本鲁花11号低5.1个百分点。宇花7号用于食品加工或作为坚果直接食用将提高产品质量,减少油脂的摄取。
我国南方花生生育中后期降水较多,为避开汛期往往选用早熟的小粒花生品种,并且需耐涝性强。而一般大粒花生的产量高于小粒花生。本研究培育的宇花7号花生品种,生育期比鲁花11号缩短13 d,为早熟大粒耐涝花生品种,2016年参加辽宁省区域试验,平均比对照鲁花8号增产13.8%。2013年在山东省莱阳市降水较多出现涝情的状况下,宇花7号表现出较强的耐涝性、抗倒伏性和高产性,荚果产量比亲本鲁花11号增产达23.99%。2017年花生生育中后期山东胶东半岛降水多,青岛农业大学莱阳实验基地2次被水淹,水深达50 cm以上,播种于基地的大部分花生材料烂果严重,而宇花7号烂果极少,比鲁花11号增产35%以上,表现出较强的耐涝性。由于宇花7号早熟耐涝,适合在安徽省、江苏省、河南省及山东省的鲁西南地区夏直播或在辽宁省种植。
4 结论本研究利用鲁花11号干种子作为辐照诱变材料进行快中子辐照后,取胚小叶进行培养,从再生植株后代中获得了各种各样的突变材料107份,并直接育成了低油早熟耐涝花生品种宇花1号。宇花1号比亲本鲁花11号增产14%以上,比安徽省区试对照品种鲁花8号增产13.08%。文中通过对辐照诱变结合组织培养进行研究,开拓了一条花生种质创新和新品种培育的新途径。
| [1] | Abuagela MO, Iqdiam BM, Baker IV GL, et al. Temperature-controlled pulsed light treatment: impact on aflatoxin level and quality parameters of peanut oil. Food Biopr Technol, 2018, 11(7): 1350–1358. DOI: 10.1007/s11947-018-2105-6 |
| [2] | Yin DM, Wang Y, Zhang XG, et al. Development of chloroplast genome resources for peanut (Arachis hypogaea L.) and other species of Arachis. Sci Rep, 2017, 7(1): 11649. DOI: 10.1038/s41598-017-12026-x |
| [3] | He LQ, Tang RH, Jiang J, et al. Rapid gene expression change in a novel synthesized allopolyploid population of cultivated peanut×Arachis doigoi cross by cDNA-SCoT and HFO-TAG technique. J Integr Agric, 2017, 16(5): 1093–1102. DOI: 10.1016/S2095-3119(16)61462-4 |
| [4] |
Fu C, Zhang XJ, Yue FL, et al. Nutrition and quality analysis of special new peanut varieties.
J China Agric Univ, 2017, 22(5): 32–38.
(in Chinese). 付春, 张小军, 岳福良, 等. 特色花生新品系营养品质解析. 中国农业大学学报, 2017, 22(5): 32-38. |
| [5] |
Lü JZ, Liang H, Zhang ZM, et al. Nutritional ingredients and health value of peanut seed.
Food Nutri China, 2009(2): 50–52.
(in Chinese). 吕巨智, 梁和, 张智猛, 等. 花生仁的营养成分及保健价值. 中国食物与营养, 2009(2): 50-52. DOI:10.3969/j.issn.1006-9577.2009.02.015 |
| [6] |
Zhao GX, Chen X, Liu HF, et al. Advance in study on functional components and nutritive value in peanut and their development utilization.
Anhui Agric Sci Bull, 2011, 17(12): 39–42.
(in Chinese). 赵贵兴, 陈霞, 刘昊飞, 等. 花生的功能成分、营养价值及其开发利用研究. 安徽农学通报, 2011, 17(12): 39-42. DOI:10.3969/j.issn.1007-7731.2011.12.026 |
| [7] |
Yang QL, Zhang CS, Cao YL, et al. The correlation and path analysis between protein content and amino acids composition in peanut seed.
Acta Agric Boreali-Sin, 2009, 24(S1): 72–74.
(in Chinese). 杨庆利, 张初署, 曹玉良, 等. 花生种子蛋白质含量与氨基酸组分相关和通径分析. 华北农学报, 2009, 24(S1): 72-74. DOI:10.7668/hbnxb.2009.S1.018 |
| [8] | Guenther PM, Reedy J, Krebs-Smith SM, et al. Evaluation of the healthy eating index-2005. J Am Diet Assoc, 2008, 108(11): 1896–1901. DOI: 10.1016/j.jada.2008.08.016 |
| [9] | Shatenstein B, Nadon S, Godin C, et al. Diet quality of Montreal-area adults needs improvement: estimates from a self-administered food frequency questionnaire furnishing a dietary indicator score. J Am Diet Assoc, 2005, 105(8): 1251–1260. DOI: 10.1016/j.jada.2005.05.008 |
| [10] | Woodruff SJ, Hanning RM. Development and implications of a revised Canadian Healthy Eating Index (HEJC-2009). Public Health Nutr, 2010, 13(6): 820–825. DOI: 10.1017/S1368980009993120 |
| [11] | Guenther PM, Casavale KO, Reedy J, et al. Update of the healthy eating index: HEI-2010. J Acad Nutr Diet, 2013, 113(4): 569–580. DOI: 10.1016/j.jand.2012.12.016 |
| [12] |
Yu SL.
Genetics and breeding of peanuts in China. Shanghai: Shanghai Science and Technology Press, 2011(in Chinese).
禹山林. 中国花生遗传育种学. 上海: 上海科学技术出版社, 2011. |
| [13] |
Qiao LX, Sui JM, Zhao LL, et al. Agronomic traits of M2 generation by in vitro mutagenesis with pingyangmycin in peanut.
J Nucl Agric Sci, 2014, 28(6): 955–960.
(in Chinese). 乔利仙, 隋炯明, 赵丽兰, 等. 平阳霉素离体诱变花生M2农艺性状分析. 核农学报, 2014, 28(6): 955-960. |
| [14] |
Li G, Wang X, Yin XB, et al. Breeding of peanut variety Yuhua 4 by in vitro mutagenesis.
Chin J Biotech, 2017, 33(5): 766–774.
(in Chinese). 李冠, 王霞, 尹秀波, 等. 利用离体诱变培育花生新品种宇花4号. 生物工程学报, 2017, 33(5): 766-774. |
| [15] |
Wu LR, Li ZC, Qiu QS, et al. Application of mutation techniques in peanut breeding in China.
J Nucl Agric Sci, 2002, 16(5): 334–336.
(in Chinese). 吴兰荣, 李正超, 邱庆树, 等. 我国花生诱变育种技术应用研究概况. 核农学报, 2002, 16(5): 334-336. DOI:10.3969/j.issn.1000-8551.2002.05.019 |
| [16] | Wang JS, Qiao LX, Zhao LS, et al. Performance of peanut mutants and their offspring generated from mixed high-energy particle field radiation and tissue culture. Genet Mol Res, 2015, 14(3): 10837–10848. DOI: 10.4238/2015.September.9.22 |
| [17] |
Zhao LS, Liu LX. Research progresses in irradiation-induced mutation breeding in crop.
Acta Laser Biol Sin, 2017, 26(6): 481–489.
(in Chinese). 赵林姝, 刘录祥. 农作物辐射诱变育种研究进展. 激光生物学报, 2017, 26(6): 481-489. DOI:10.3969/j.issn.1007-7146.2017.06.001 |
| [18] |
Yu M, Zhou QF. Research advances on induced mutation breeding techniques of wheat.
Biotechnol Bull, 2017, 33(3): 45–51.
(in Chinese). 于沐, 周秋峰. 小麦诱发突变技术育种研究进展. 生物技术通报, 2017, 33(3): 45-51. |
| [19] | Muthusamy A, Vasanth K, Sivasankari D, et al. Effects of mutagens on somatic embryogenesis and plant regeneration in groundnut. Biol Plant, 2007, 51(3): 430–435. DOI: 10.1007/s10535-007-0092-y |
| [20] | Sui JM, Wang Y, Wang P, et al. Generation of peanut drought tolerant plants by pingyangmycin-mediated in vitro mutagenesis and hydroxyproline-resistance screening. PLoS ONE, 2015, 10(3): e0119240. DOI: 10.1371/journal.pone.0119240 |
| [21] |
Wang JS, Zhao MX, Qiao LX, et al. Effects of fast neutron irradiation on plant regeneration in embryonic leaflet culture of peanut (Arachis hypogaea L.).
Chin J Oil Crop Sci, 2013, 35(2): 148–152.
(in Chinese). 王晶珊, 赵明霞, 乔利仙, 等. 快中子辐照对花生种子胚小叶植株再生的影响. 中国油料作物学报, 2013, 35(2): 148-152. |
| [22] |
Yu XL, Liu LX, Qiao LX, et al. Effects of mixed high energy particle field on embryonic leaflet culture and plant regeneration of peanut.
J Nucl Agric Sci, 2012, 26(3): 433–438.
(in Chinese). 于新玲, 刘录祥, 乔利仙, 等. 高能混合粒子场辐照对花生胚小叶组织培养及植株再生的影响. 核农学报, 2012, 26(3): 433-438. |
| [23] |
Hong YH, Zhu ZH, Huang H, et al. On tissue culture and irradiation variation of chrysanthemum.
J Hunan Agric Univ: Nat Sci, 2003, 29(6): 457–461.
(in Chinese). 洪亚辉, 朱兆海, 黄璜, 等. 菊花组织培养与辐射诱变的研究. 湖南农业大学学报:自然科学版, 2003, 29(6): 457-461. |
| [24] |
Zhao MX, Sun HY, Sui JM, et al. In vitro Selection for stress-resistant mutants and survey on offspring characteristics of peanut.
J Nucl Agric Sci, 2012, 26(8): 1106–1107.
(in Chinese). 赵明霞, 孙海燕, 隋炯明, 等. 离体筛选花生抗逆突变体及其后代特征特性研究. 核农学报, 2012, 26(8): 1106-1107. |
| [25] | Latado RR, Adames AH, Neto AT. In vitro mutation of chrysanthemum (Dendranthema grandiflora Tzvelev) with Ethylmethanesulphonate (EMS) in immature floral pedicels. Plant Cell Tissue Organ Cult, 2004, 77(1): 103–106. DOI: 10.1023/B:TICU.0000016481.18358.55 |
| [26] |
Li W, Sun ZH, Zhang WC, et al. Studies on screening freezing-resistant regen-erated plants from X-ray irradiated citrus protoplasts.
Acta Botan Sin, 1998, 40(8): 729–733.
(in Chinese). 李卫, 孙中海, 章文才, 等. 柑桔原生质体辐射诱变筛选抗寒再生植株. 植物学报, 1998, 40(8): 729-733. DOI:10.3321/j.issn:1672-9072.1998.08.008 |
| [27] |
Jiang CY, Ning SX, Yang WX, et al. Selective breeding of a new breed of magnolia denudata from radiation-induced mutation of callus.
Acta Horticult Sin, 2002, 29(5): 473–476.
(in Chinese). 姜长阳, 宁淑香, 杨文新, 等. 愈伤组织辐射诱变选育玉兰新品系. 园艺学报, 2002, 29(5): 473-476. DOI:10.3321/j.issn:0513-353X.2002.05.016 |
| [28] |
Gao MW. Hezu 8, a new wheat variety developed with in vitro mutation technique.
Trends Nucl Phys, 1992, 9(4): 45–46.
(in Chinese). 高明尉. 世界上第一个小麦离体诱变新品种--核组8号. 核物理动态, 1992, 9(4): 45-46. |
| [29] | Venkatachalam P, Jayabalam N. Selection and regeneration of groundnut plants resistant to the pathotoxic culture filtrate of Cercosporidium personation through tissue culture technology. Appl Biochem Biotechnol, 1997, 61(3): 351–364. DOI: 10.1007/BF02787807 |
| [30] | Zhao MX, Sun HY, Ji RR, et al. In vitro mutagenesis and directed screening for salt-tolerant mutants in peanut. Euphytica, 2013, 193(1): 89–99. DOI: 10.1007/s10681-013-0956-5 |
| [31] |
Qiu QS, Jing LH, Yang CD, et al. Effect of irradiation with 14 MeV fast neutron on contents of nucleic acids and soluble protein in wheat seedling.
J Nucl Agri Sci, 1993, 7(3): 145–148.
(in Chinese). 邱全胜, 敬兰花, 杨成德, 等. 14MeV快中子辐照对小麦幼苗核酸和可溶性蛋白质含量的影响. 核农学报, 1993, 7(3): 145-148. |
| [32] |
Yu SL.
Varieties and their pedigree of peanuts in China. Shanghai: Shanghai Science and Technology Press, 2008(in Chinese).
禹山林. 中国花生品种及其系谱. 上海: 上海科技出版社, 2008. |
 2019, Vol. 35
2019, Vol. 35




