中国科学院微生物研究所、中国微生物学会主办
文章信息
- 杜娇, 姜淑喆, 未建华, 申玉龙, 倪金凤
- Du Jiao, Jiang Shuzhe, Jianhua Wei, Yulong Shen, Ni Jinfeng
- 白蚁及其共生菌来源的4种木质纤维素酶的共表达
- Co-expression of lignocellulase from termite and their endosymbionts
- 生物工程学报, 2019, 35(2): 244-253
- Chinese Journal of Biotechnology, 2019, 35(2): 244-253
- 10.13345/j.cjb.180235
-
文章历史
- Received: June 8, 2018
- Accepted: August 28, 2018
- Published: September 19, 2018
木质纤维素是地球上最丰富的可再生生物质[1]。天然的木质纤维素材料含有纤维素、半纤维素和木质素等[2]。纤维素在木质纤维素中为最简单的成分,大量的葡萄糖以β-1, 4糖苷键连接形成难以被水解的类似晶体的结构[3]。半纤维素和木质素包裹在纤维素的外面,形成了一种天然屏障。这层天然屏障在保护植物的同时,也使得人工进行生物降解转化的效率很低,无法适应大规模工业化的要求。
纤维素降解酶系从功能上划分,其主要有内切β-1, 4-葡聚糖酶(EGs,EC 3.2.1.4)、外切葡聚糖酶(CBHs,EC 3.2.1.91)和β-葡萄糖苷酶(BGs,EC 3.2.1.21) 3类[4]。内切β-1, 4-葡聚糖酶在纤维素链内部可随机水解β-1, 4-糖苷键,截短长链纤维素分子,率先为外切纤维素酶提供大量的反应末端,对纤维素的酶解至关重要[5]。外切葡聚糖酶作用于纤维素分子的末端,依次切下纤维二糖或者纤维四糖。β-葡萄糖苷酶主要负责将纤维二糖水解成葡萄糖[6],可以缓解内切β-1, 4-葡聚糖酶和外切葡聚糖酶的产物抑制效应,该酶在纤维素水解为单糖的过程中发挥着至关重要的作用。半纤维素在木质纤维素中的含量为20%–30%,其中含量最为丰富的是木聚糖[7]。木聚糖酶是一种可将木聚糖降解成低聚木糖和木糖的多组分复合酶系[8],可促使半纤维素降解[9]。木质素在木质纤维素中的含量为18%–30%[10]。木质素的降解主要有3类酶:木质素过氧化物酶(Lip,EC 1.11.1.14)、锰过氧化物酶(MnPs,EC 1.11.1.13)和漆酶(Lac,EC 1.11.1.14)。
自然界中存在一些天然的高效降解木质纤维素系统,包括白蚁、牛、褐腐菌、白腐菌和一部分细菌等,其中白蚁具有食木性特征[11],有很强的纤维素降解功能,目前认为在白蚁木质纤维素降解中是双重纤维素降解机制——內源纤维素酶(白蚁自身分泌)和外源纤维素酶(共生微生物分泌)[12]。白蚁及其肠道微生物来源的木质纤维素酶具有高酶活和良好的耐碱性等特点。在本实验中,β-葡萄糖苷酶BGDS5[13]和内切β-1, 4-葡聚糖酶EG71[14]是我们通过DNA Shuffling的方法,获得的高活性的白蚁来源的β-葡萄糖苷酶和内切β-1, 4-葡聚糖酶的突变体。漆酶CotA和木聚糖酶XylMb1分别来源于黄翅大白蚁后肠中通过筛选分离得到的高地芽胞杆菌Bacillus altitudinis[15]和类芽胞杆菌Paenibacillus sp. Mb1[16]这两株菌。CotA蛋白耐高温耐碱,有文献报道芽胞杆菌的CotA蛋白是具有高的最适温度和热稳定性的细菌漆酶,在工业上有很大的应用前景[17]。XylMb1木聚糖酶酶活高且具有良好的耐碱性。
近年在木质纤维素酶的相互协同作用方面的研究引起人们的关注,成为一个新的研究热点,因此我们将实验室自主得到的白蚁及其肠道微生物来源的β-葡萄糖苷酶BGDS5、内切β-1, 4-葡聚糖酶EG71、漆酶CotA和木聚糖酶XylMb1这4种酶在大肠杆菌中进行了共表达。
1 材料与方法 1.1 材料 1.1.1 试剂及仪器对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)购自Sigma公司;木聚糖购自Carbosynth化学科技公司;DNA Ladder、限制性内切酶、EazyPfu酶、DNA Ligation Kit均购自TaKaRa公司;Cycle-Pure Kit、Gel Extraction Kit、Plasmid Mini Kit购自OMEGA公司;氨苄青霉素和硫酸卡那霉素购自Invitrogen公司;异丙基-β-D-硫代半乳糖苷(IPTG) 购买自生工生物工程(上海)股份有限公司;蛋白胨、酵母粉和琼脂粉购自OXOID公司;Whatman No.1号滤纸、葡萄糖氧化酶-过氧化物酶(GOD-POD)试剂盒购买自济南朋远生物公司;其他均购买自国药公司。
PCR仪(TaKaRa);CHB-202恒温金属浴(杭州博日科技有限公司);凝胶成像仪(UVItec公司);2802H UV/VIS分光光度计(UNICO);JY92-II超声波细胞粉碎机(宁波新芝生物科技有限公司);HZQ-QX低温振荡培养箱(黑龙江省东联电子技术开发有限公司)。
1.1.2 培养基LB培养基参见文献[18]。若加入氨苄青霉素或硫酸卡那霉素(终浓度100 μg/mL),分别成为LA或LK培养基;若同时加入两种抗生素则成为LAK培养基。固体培养基添加终浓度2%的琼脂粉。
1.1.3 质粒及菌株文中所使用的E. coli BL21(DE3)、表达载体pETDuet-1和pRSFDuet-1购自TaKaRa。白蚁来源的β-葡萄糖苷酶突变体BGDS-5和内切葡聚糖酶突变体EG71由实验室前期通过DNA shuffling的方法获得;黄翅大白蚁后肠细菌来源的木聚糖酶基因XylMb1和漆酶基因CotA均为实验室保存。pETDuet-1和pRSFDuet-1通用引物以及实验过程中所有引物由华大基因测序公司合成。
1.2 构建表达载体以pQE30-BGDS5为模板,DS5-BamHⅠ-F和DS5-Hind Ⅲ-R为引物(表 1),PCR扩增出BGDS5片段,利用BamHⅠ和Hind Ⅲ双酶切后连接到pETDuet-1的多克隆位点Ⅰ (MCSⅠ,Multiple cloning siteⅠ);以pQE30-EG71为模板,EG-NdeⅠ-F和EG-EcoRⅤ-R为引物(表 1),PCR扩增出EG71片段,利用NdeⅠ和EcoRⅤ双酶切后连接到pETDuet-1-BGDS5的多克隆位点Ⅱ (MCSⅡ,Multiple cloning siteⅡ),转入E. coli BL21(DE3)感受态细胞,涂布到LA平板上。以pQE30-CotA为模板,CotA-BamHⅠ-F和CotA-Hind Ⅲ-R为引物(表 1),PCR扩增出CotA片段,利用BamHⅠ和Hind Ⅲ双酶切后连接到pRSFDuet-1的MCSⅠ;以pQE30-XylMb1为模板,XylMb1-NdeⅠ-F和XylMb1-KpnⅠ-R为引物(表 1),PCR扩增出XylMb1片段,利用NdeⅠ和KpnⅠ双酶切后连接到pRSFDuet-1-CotA的MCSⅡ,转入E. coli BL21(DE3)感受态细胞,涂布到LK平板上。挑取单克隆进行测序鉴定,并分别命名为Co-BGEG、Co-CotAXyl。分别取上述构建成功的质粒Co-BGEG和Co-CotAXyl各1 μL,充分混匀后,将混合质粒转化到E. coli BL21(DE3)感受态细胞中,涂布到LAK平板上,筛选阳性克隆并验证酶活,将其命名为Co-BECX。
| Primer name | Primer sequence (5'–3') | Size (bp) |
| DS5-BamHⅠ-F | GAGGATCCGGACGTAGCCTCCAGTGACAC | 29 |
| DS5-Hind Ⅲ-R | GTAAGCTTATCTCTGAAGCGCTCAGGAATC | 30 |
| EG-NdeⅠ-F | GACATATGGCTTACGACTATAAGCAAGTAC | 30 |
| EG-EcoRⅤ-R | CTGATATCTTAATAACCCAACGCGACGAG | 29 |
| CotA-BamHⅠ-F | GCACGGATCCGAACCTAGAAAAATTTGTTG | 30 |
| CotA-Hind Ⅲ-R | CATAAGCTTCTGGATGATATCCATCGG | 27 |
| XylMb1-NdeⅠ-F | CCCATATGGCTACGGATTATTGGCAAAAC | 29 |
| XylMb1-KpnⅠ-R | GGGGTACCCCACACTGTTACGTTAGAAC | 28 |
| Underlines indicate restriction enzyme sites. | ||
分别在LA、LK和LAK平板上挑取阳性单克隆,接种于5 mL含相应抗生素的培养基中,37 ℃、180 r/min培养过夜。按1%的接种量接种于100 mL相应培养基中37 ℃培养至OD600为0.6–0.8时,加入终浓度为1 mmol/L的IPTG,16 ℃、180 r/min进行诱导表达16 h[19]。然后在4 ℃下10 000 r/min离心5 min收集菌体,利用破壁缓冲液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl)洗涤菌体2次,将菌体−20 ℃冻存或立即破壁。向菌体中加入5 mL破壁缓冲液重悬菌体,超声波破壁(功率400 W,超声时间5 s,间隔时间5 s,超声次数120次)。高速离心收集上清(12 000 r/min,4 ℃,10 min),即为粗酶液[20]。使用粗酶液进行酶活测定及SDS-PAGE分析。
1.4 酶活力测定 1.4.1 Na2CO3方法测定β-葡萄糖苷酶酶活以pH 5.5的0.1 mol/L醋酸钠缓冲液(SAB buffer)为溶剂配制5 mmol/L的对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)作为底物,取200 μL底物与50 μL适当稀释的酶液,充分混合后,37 ℃恒温条件下反应30 min。结束后加入1 mL 0.6 mol/L的Na2CO3终止反应[21]。OD410测定吸光值,做3个平行。以灭活的酶液设置对照。1个酶活单位(Unit)定义为:37 ℃、pH 5.5的反应条件下,每分钟产生1 μmol对硝基苯酚所需要的酶量。
1.4.2 DNS方法测定内切β-1, 4-葡聚糖酶和木聚糖酶酶活以pH 5.5的0.1 mol/L SAB缓冲液为溶剂配制底物。EG酶以1% CMC为底物[22],木聚糖酶以1%木聚糖作为底物[23]。取200 µL底物与50 µL适当稀释的粗酶液,充分混合后在37 ℃恒温条件下反应30 min。反应结束后加100 µL的DNS溶液,沸水浴反应10 min,立即置于冰上冷却,补加蒸馏水650 µL使反应体系为1 mL。OD520测定吸光值,做3个平行实验。以灭活的酶液设置对照。1个酶活单位(Unit)定义为:在37 ℃、pH 5.5的反应条件下,每分钟产生1 µmol还原糖所需要的酶量。
1.4.3 以ABTS为底物测定漆酶酶活以pH 5.5的0.1 mol/L SAB buffer为溶剂配制0.5mmol/L的2, 2' -联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)作为底物[24]。取适当稀释的50 μL酶液加入到提前在37 ℃中保温的950 μL的ABTS中,充分混合,37 ℃恒温条件下反应3 min。OD420测定吸光值,做3个平行。以灭活的酶液设置对照。1个酶活单位(Unit)定义为:在37 ℃、pH 5.5的反应条件下,每分钟转化1 µmol底物所需要的酶量。
1.4.4 滤纸酶活的测定使用Whatman 1号滤纸测定粗酶液的滤纸酶活[25]。具体测定方法为:在1.5 mL规格的Eppendorf (EP)管中加入200 µL SAB Buffer,将10 mg Whatman 1号滤纸浸入其中,加入50 µL适当稀释的酶液,37 ℃反应1 h,离心去除不溶物,加入100 µL DNS煮沸10 min,置于冰上冷却2 min,加水至1 mL,测OD520处的吸光度,做3个平行。以灭活酶液作为对照。
1.5 底物处理1%磷酸水解微晶纤维素(PASC)[26]:取0.4 g微晶纤维素置于烧杯中,加入蒸馏水1.2 mL,混匀成糊状物。一边搅拌一边缓慢加入20 mL预冷的浓磷酸,待其成均相物,置于冰上1 h,期间多次搅拌。随后加入80 mL预冷的蒸馏水,离心去上清,反复洗涤。加入2mol/L Na2CO3中和残存的磷酸,用蒸馏水洗涤至pH 5–7,最后用蒸馏水溶解。
1 %磷酸处理玉米芯渣:玉米芯渣经80 ℃高温干燥过夜后,研磨,过40目分样筛,得到的玉米芯渣用磷酸处理,具体参见文献[27]。
1.6 分析共表达酶协同作用以1% PASC、滤纸、1%磷酸处理玉米芯渣作为底物,分别测定共表达粗酶液对上述不同底物的降解作用,并与单独表达酶的混合液进行比较。
在混合酶组合对不同底物的降解中,分别测定共表达系统中4种木质纤维素酶的酶活,50 µL的酶液体系中,保证混合酶组分中添加的相应木质纤维素酶酶活与共表达系统中的一致,若酶液体系不足50 μL则使用SAB缓冲液补齐。
降解滤纸的测定方法同1.4.4。
降解PASC、磷酸处理的玉米芯渣测定:1%的底物200 µL,加入不同组合酶液50 µL,37 ℃反应30 min,离心去除不溶物,其余同滤纸酶活的测定。

|
共表达酶:共表达酶组分降解底物产生还原糖的量;混合酶:混合酶组分降解底物产生还原糖的含量。
反应后测定反应产物中葡萄糖和还原糖的含量,葡萄糖产量的测定使用葡萄糖氧化酶-过氧化物酶(GOD-POD)试剂盒;还原糖产量的测定使用DNS法,通过绘制的标准曲线计算出还原糖产量。
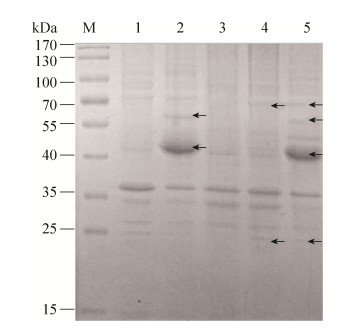
2 结果与分析 2.1 四种木质纤维素酶基因在大肠杆菌中的共表达获得两两酶基因(Co-BGEG,Co-CotAXyl)和4个酶基因(Co-BECX)共表达的粗酶液,进行SDS-PAGE分析和酶活性测定。由SDS-PAGE的结果可以看出(图 1),与含有空载体pETDuet-1的E. coli BL21(DE3)的破壁上清相比,Co-BGEG的破壁上清中含有56 kDa的BGDS5和45 kDa的EG71蛋白条带;与含有空载体pRSFDuet-1的E. coli BL21(DE3)的破壁上清相比,Co-CotAXyl的破壁上清中含有60 kDa的CotA和23 kDa的XylMb1蛋白条带;综合以上作为对照,在Co-BECX的破壁上清中存在BGDS5、EG71、CotA和XylMb1。进行SDS-PAGE蛋白电泳时,每个样品的上样量均为5 μL,从SDS-PAGE的结果来看,在Co-BGEG和Co-BECX中,EG71的蛋白条带比较粗,说明EG71在共表达体系中有较高的表达量;而对于BGDS5、CotA和XylMb1,从SDS-PAGE的结果来看,蛋白条带均比较细,这3种木质纤维素酶在共表达系统中的表达量比较低。酶活测定分析表明大肠杆菌共表达系统中的β-葡萄糖苷酶、内切β-1, 4-葡聚糖酶、漆酶和木聚糖酶的粗酶液酶活分别为14.1 U/mL、28.64 U/mL、19.74 U/mL和18.65 U/mL。
|
| 图 1 SDS-PAGE分析Co-BGEG、Co-CotAXyl和Co-BECX在E. coli BL21(DE3)中的表达 Fig. 1 SDS-PAGE analysis of Co-BGEG, Co-CotAXyl and Co-BECX expressed in E. coli BL21(DE3).M: protein marker; 1: crude extract of E. coli BL21(DE3)/ pETDuet-1; 2: crude extract of Co-BGEG; 3: crude extract of E. coli BL21/pRSFDuet-1; 4: crude extract of Co-CotAXyl; 5: crude extract of Co-BECX. The arrow indicated corresponding protein bands. |
| |
微晶纤维素经过磷酸处理后形成结构松散的PASC,经过酸处理的微晶纤维素在体系中产生了大量的还原糖,也暴露出更多的反应末端,有利于纤维素酶附着于其上发生反应。我们测定了共表达的Co-BGEG粗酶液降解PASC的能力,并将其降解效果与单独表达的BGDS5、EG71这两种酶的混合酶液对PASC降解的协同作用进行了比较。当体系中只存在EG酶时,PASC可被降解并产生少量葡萄糖(图 2);当体系中同时添加EG酶和BG酶时,反应体系中的葡萄糖量明显提高,与体系中只存在EG酶时相比,葡萄糖的产量大大提高。共表达Co-BECX和单独表达的4种纤维素酶的混合酶液相比较,发现共表达酶液体系中还原糖的量提高,对PASC的共表达协同降解作用比4种单独表达纤维素酶的混合酶液大约提高了44%。

|
| 图 2 共表达酶液与单独表达酶液协同降解PASC的比较 Fig. 2 Comparison of the hydrolyzing efficiency of the co-expressed enzyme and the single enzyme mixture by sugar release estimation with PASC as substrate. |
| |
测定了共表达的Co-BECX粗酶液降解滤纸的能力,并与单独表达的BGDS5、EG71、CotA和XylMb1这4种酶组分的混合酶液对滤纸降解的协同作用进行了比较。根据上述材料与方法中的测定方法,我们测定了共表达的Co-BECX粗酶液和单独表达的BGDS5、EG71、CotA和XylMb1这4种酶组分的混合酶液对滤纸的降解作用,并对数据进行了处理,数据处理结果如图 3所示。当酶反应体系中只有EG酶时,对滤纸有降解,产生了一定量的还原糖,产生的葡萄糖的量极少,但当反应体系中再添加BG酶时,反应后产生葡萄糖的量大约是只含有EG的酶反应体系的2.2倍。因为在酶反应体系中添加了BG酶,BG酶将纤维二糖水解为葡萄糖,提高了反应体系中葡萄糖的产量,同时也缓解了EG酶的产物抑制。在以滤纸为底物时酶反应体系中依次添加这4种木质纤维素酶,产生还原糖的含量逐步增多,当这4种木质纤维素酶同时作用于这一反应体系中时,产生的还原糖和葡萄糖的量在组合的混合酶反应中达到最高,与体系中只有EG酶相比分别提高了2倍和2.7倍,这4种酶可以组合成一个协同降解的木质纤维素酶系作用于滤纸。共表达的Co-BECX和单独表达的4种酶的混合酶液相比较,发现共表达酶液体系中还原糖的产量高,对滤纸的协同降解作用比4种单独表达的混合酶液提高了34%,由此,共表达酶液对滤纸的协同降解效果要好。但是从葡萄糖的产量来说,单独表达的4种酶混合酶液的反应体系中葡萄糖的产量要高一些,可能由于单独表达的4种酶混合液和共表达系统中其他3种木质纤维素酶对BG酶产生的影响不同。

|
| 图 3 共表达酶液与单独表达酶液协同降解滤纸的比较 Fig. 3 Comparison of the hydrolyzing efficiency of the co-expressed enzyme and the single enzyme mixture by sugar release estimation with filter paper as substrate. |
| |
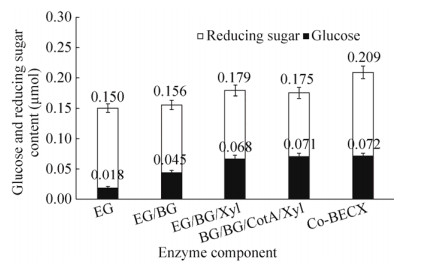
本研究中使用的玉米芯渣经过一定程度的脱木素处理,但是并没有完全去除木质素的成分,同时也使用磷酸对其进行了酸处理,经过简单的脱木素和酸处理后,玉米芯渣的结构疏松,纤维素束和半纤维素暴露出来,有利于木质纤维素酶对其进行降解。结果如图 4所示,当酶反应体系中只有EG酶存在时,可以对玉米芯有降解,产生了一定量的还原糖,但产生的葡萄糖的量很少,但当反应体系中添加BG酶时,反应后产生葡萄糖的量大约是只含有EG的酶反应体系的2.5倍。因为BG酶可以将纤维二糖水解为葡萄糖,提高了反应体系中葡萄糖的产量,同时也缓解了EG酶的产物抑制。由图 4中我们看到第4组数据也就是包含这4种木质纤维素酶的酶反应体系,要比第3组数据即包含EG、BG和Xyl三种木质纤维素酶的酶反应体系产生还原糖的含量少一些,我们认为可能是误差导致。第3组数据与第4组数据相比,在还原糖和葡萄糖的产量上大致相等,产量不再提高,我们推测在以玉米芯为底物时,随着不同酶组分的添加,会产生底物竞争作用[28]。我们发现,共表达的Co-BECX和单独表达的4种酶的混合酶液相比较,共表达酶液体系中葡萄糖的产量两者相一致,但共表达的酶液体系中还原糖的产量高,对玉米芯的协同降解作用大约比4种单独表达的混合酶液提高了20%,由此表明,共表达酶液对玉米芯的协同降解效果要好。
|
| 图 4 共表达酶液与单独表达酶液协同降解磷酸处理的玉米渣的比较 Fig. 4 Comparison of the hydrolyzing efficiency of the co-expressed enzyme and the single enzyme mixture by sugar release estimation with acid treated corn cob as substrate |
| |
随着基因克隆技术的发展,迄今已有很多外源基因被克隆到不同的表达载体中进行了研究,进而应用到工业领域,造福于人类的生产生活。但是很多生物学功能并不是只由一种基因或一种蛋白来控制和完成的,需要由多个基因或蛋白共同作用实现某一生物学功能。在工业领域,多个外源基因在同一表达宿主中实现共表达,能够有效地节约生产成本、提高产量,是生物技术在工业生产领域中应用的又一个新的创新。
白蚁自身及其肠道微生物来源的木质纤维素酶类具有分子量小、活性高等特点。目前为止,很多已发现的白蚁及其肠道微生物来源的木质纤维素酶已经由各种模式微生物单独生产,但关于通过单一微生物有效生产多种木质纤维素酶的报道很少。本研究所采用的共表达策略是在同一宿主中同时使用含有两个多克隆位点的pETDuet1和pRSFDuet-1表达载体,实现了在大肠杆菌表达系统中EG、BG、CotA和XylMb1四种纤维素酶的共表达。使用带有氨苄青霉素抗性的pETDuet-1质粒同时表达得到了EG和BG并都具有相应酶活;使用硫酸卡那霉素抗性的pRSFDuet-1质粒同时表达得到了CotA和XylMb1并都具有酶活;随后我们将上述经过酶活验证后的质粒共同转入到了同一个宿主中,使用氨苄青霉素和硫酸卡那霉素两种抗生素进行初步筛选,随后测定4种木质纤维素酶酶活进行验证。
本研究采用了3种底物来进行上述共表达的木质纤维素酶在协同降解效率方面的测定。在降解过程中,不同种类的酶、不同的酶组分之间具有协同作用,即组合酶组分的降解效率要明显高于单组分降解效率总和。以PASC为底物时,共表达的粗酶液对PASC的降解与单独表达的混合酶液相比较,葡萄糖的产量提高了61%,使PASC降解得更加充分;以滤纸为底物时,共表达的粗酶液对滤纸的降解要比单独表达的混合酶液有所提高,大约提高了34%。对于木质纤维素酶来说,玉米芯是天然的降解底物,但在纤维素束的外围包裹着结构较为复杂的木质素,外围结构紧实,难以被降解。以磷酸处理的玉米芯渣为底物时,共表达的粗酶液对玉米芯的降解与单独表达的混合酶液相比较,大约提高了20%。这是由于Avicel经过磷酸处理后,其纤维束外围复杂而又紧实的结构被酸破坏,从而使结构疏松,暴露出纤维素束,有利于木质纤维素酶附着于其上发挥作用。协同作用的存在与木质纤维素底物结构、成分的复杂性是相适应的,因此其强弱也随着底物性质的变化而呈现出差异[29]。对于3种底物进行协同作用的测定时,我们发现当体系中加入EG和BG的混合酶液时,与降解体系中只有EG时产生的葡萄糖的量有明显提高,推测是由于添加β-葡萄糖苷酶后,β-葡萄糖苷酶降解了EG作用底物后产生的寡糖链,将其分解成葡萄糖,既加大了底物被降解的程度,也缓解了寡糖链对EG的产物抑制效应。在分别以滤纸和玉米芯为底物时,在含有EG和BG的体系中加入CotA或Xyl时,都会使产生的还原糖含量提高,说明CotA或Xyl都对木质纤维素的降解有一定的促进作用。对于单独表达的混合酶来说,在体系中4种酶混合时,其产生还原糖的量最高;从共表达的角度分析,当体系中保证4种木质纤维素酶的酶活分别相一致时,体系中添加共表达的粗酶液要比单独表达的混合酶液产生的还原糖的含量高。不同类型的纤维素酶组分之间,纤维素酶组分与半纤维素酶组分之间均存在协同作用。Fonseca-Maldonado等在毕赤酵母中同时表达木聚糖酶和漆酶时,也得到了类似的结果,酶活比单独表达提高了44%[30]。Kumar等使用pETDuet-1载体在大肠杆菌中同时表达了细菌来源的芽胞漆酶CotA、内切木聚糖酶Xyl以及果胶酶Pel共表达后的混合酶制剂降解橘子皮的能力比单独使用木聚糖酶高出20%[31]。
由此,将共表达策略应用在工业领域,不仅能够提高协同效应,在一个细胞中同时表达多种蛋白,还可以简化表达过程、节约成本。在本研究中,从葡萄糖的产量来分析,以滤纸为底物时,单独表达的4种酶混合酶液的反应体系中葡萄糖的产量要比共表达的酶液高,可能由于单独表达的4种酶混合液和共表达系统中其他3种木质纤维素酶对BG酶产生的影响不同。刘建明等在研究3种外切酶的协同作用时,当多种纤维素酶组合在一起作用底物时要比两种酶组合在一起时产生的还原糖的量少,推测可能是几种酶之间存在相互竞争与底物结合,降低了催化效率[28];当以玉米芯为底物时,单独表达的4种酶混合酶液的反应体系中葡萄糖的产量几乎与共表达的酶液相一致,我们推测产生这种结果的原因,不同的底物有不同的木质纤维素结构,其中半纤维素和纤维素在体系中所占的比例也不同,因此单独表达的4种酶混合液和共表达系统中其他3种木质纤维素酶对BG酶产生的影响不同,导致葡萄糖的产量有所不同,所以对于各酶组分的最佳比例还需要进一步的研究。
| [1] | Ohkuma M. Termite symbiotic systems: efficientbio-recycling of lignocellulose. Appl Microbiol Biotechnol, 2003, 61(1): 1–9. |
| [2] | Li HJ, Yelle DJ, Li C, et al. Lignocellulose pretreatment in a fungus-cultivating termite. Proc Natl Acad Sci USA, 2017, 114(18): 4709. DOI: 10.1073/pnas.1618360114 |
| [3] | Gardner KH, Blackwell J. The structure of native cellulose. Biopolymers, 1974, 13(10): 1975–2001. DOI: 10.1002/(ISSN)1097-0282 |
| [4] | Woodward J, Wiseman A. Fungal and other βD-glucosidases-their properties and applications. Enzyme Microbial Technol, 1982, 4(2): 73–79. DOI: 10.1016/0141-0229(82)90084-9 |
| [5] | Angelov A, Pham VTT, belacker M, et al. A metagenome-derived thermostable βglucanase with an unusual module architecture which defines the new glycoside hydrolase family GH148. Sci Rep, 2017, 7(1): 17306. |
| [6] | Watanabe H, Tokuda G. Cellulolytic systems in insects. Ann Rev Entomol, 2010, 55(1): 609–632. DOI: 10.1146/annurev-ento-112408-085319 |
| [7] | Polizeli MLTM, Rizzatti ACS, Monti R, et al. Xylanases from fungi: properties and industrial applications. Appl Microbiol Biotechnol, 2005, 67(5): 577–591. DOI: 10.1007/s00253-005-1904-7 |
| [8] | Chávez R, Bull P, Eyzaguirre J. The xylanolytic enzyme system from the genus Penicillium. J Biotechnol, 2006, 123(4): 413–433. DOI: 10.1016/j.jbiotec.2005.12.036 |
| [9] | Shang TT, Si DY, Zhang DY, et al. Enhancement of thermoalkaliphilic xylanase production by Pichia pastoris through novel fed-batch strategy in high cell-density fermentation. BMC Biotechnol, 2017, 17: 55. DOI: 10.1186/s12896-017-0361-6 |
| [10] | Raud M, Tutt M, Olt J, et al. Effect of lignin content of lignocellulosic material on hydrolysis efficiency. Agron Res, 2015, 13(2): 405–412. |
| [11] | Donovan SE, Eggleton P, Bignell DE. Gut content analysis and a new feeding group classification of termites. Ecol Entomol, 2001, 26(4): 356–366. DOI: 10.1046/j.1365-2311.2001.00342.x |
| [12] | Nakashima K, Watanabe H, Saitoh H, et al. Dual cellulose-digesting system of the wood-feeding termite, Coptotermes formosanus Shiraki. Insect Biochem Molec Biol, 2002, 32(7): 777–784. DOI: 10.1016/S0965-1748(01)00160-6 |
| [13] | Ni JF, Tokuda G, Takehara M, et al. Heterologous expression and enzymatic characterization of βglucosidase from the drywood-eating termite, Neotermes koshunensis. Appl Entomol Zool, 2007, 42(3): 457–463. DOI: 10.1303/aez.2007.457 |
| [14] | Ni JF, Takehara M, Miyazawa M, et al. Random exchanges of non-conserved amino acid residues among four parental termite cellulases by family shuffling improved thermostability. Protein Eng Des Select, 2007, 20(11): 535–542. DOI: 10.1093/protein/gzm052 |
| [15] |
Ning N. Cloning and expression of lignocellulase genes from termites and their endosymbionts[D]. Ji'nan: Shandong University, 2017 (in Chinese). 宁娜.白蚁及其肠道微生物来源木质纤维素酶基因的克隆与表达[D].济南: 山东大学, 2017. |
| [16] |
Shi XY. Purification and cloning the bacterial xylanase from the hindgut of Macrotermes barneyi and the microbial diversity in combs of fungus-growing termites[D]. Ji'nan: Shandong University, 2015 (in Chinese). 石小玉.黄翅大白蚁后肠细菌来源木聚糖酶的纯化与基因克隆以及培菌白蚁菌圃微生物多样性研究[D].济南: 山东大学, 2015. |
| [17] | Martins LO, Soares CM, Pereira MM, et al. Molecular and biochemical characterization of a highly stable bacterial laccase that occurs as a structural component of the Bacillus subtilis endospore coat. J Biol Chem, 2002, 277(21): 18849–18859. DOI: 10.1074/jbc.M200827200 |
| [18] | Sawant SS, Salunke BK, Kim BS. Degradation of corn stover by fungal cellulase cocktail for production of polyhydroxyalkanoates by moderate halophile Paracoccus sp. LL1. Bioresource Technol, 2015, 194: 247–255. DOI: 10.1016/j.biortech.2015.07.019 |
| [19] | Dong WL, Xue ML, Zhang Y, et al. Characterization of a βglucosidase from Paenibacillus species and its application for succinic acid production from sugarcane bagasse hydrolysate. Bioresource Technol, 2017, 241: 309–316. DOI: 10.1016/j.biortech.2017.05.141 |
| [20] |
Gao HY, Liu ZC, Duan SW, et al. Coexpression of βmannanase and xylanase genes in Escherichia coli.
Microbiology China, 2012, 39(3): 344–352.
(in Chinese). 高海有, 刘正初, 段盛文, 等. β-甘露聚糖酶和木聚糖酶基因在大肠杆菌中共表达. 微生物学通报, 2012, 39(3): 344-352. |
| [21] | Riou C, Salmon JM, Vallier MJ, et al. Purification, characterization, and substrate specificity of a novel highly glucose-tolerant βglucosidase from Aspergillus oryzae. Appl Environ Microbiol, 1998, 64(10): 3607–3614. |
| [22] | Ni JF, Wu Y, Yun C, et al. cDNA cloning and heterologous expression of an endo-β1, 4-glucanase from the fun-growing termite Macrotermes barneyi. Arch Insect Biochem Physiol, 2014, 86(3): 151–164. |
| [23] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem, 1959, 31(3): 426–428. |
| [24] | Geng AL, Wu J, Xie RR, et al. Characterization of a laccase from a wood-feeding termite, Coptotermes formosanus. Insect Sci, 2018, 25(2): 251–258. DOI: 10.1111/1744-7917.12415 |
| [25] | Yu XX, Liu Y, Cui YX, et al. Measurement of filter paper activities of cellulase with microplate-based assay. Saudi J Biol Sci, 2016, 23(S1). |
| [26] | Zhang YHP, Cui JB, Lynd LR, et al. A transition from cellulose swelling to cellulose dissolution by o-phosphoric acid: evidence from enzymatic hydrolysis and supramolecular structure. Biomacromolecules, 2006, 7(2): 644–648. DOI: 10.1021/bm050799c |
| [27] | Banerjee G, Car S, Scott-Craig JS, et al. Alkaline peroxide pretreatment of corn stover: effects of biomass, peroxide, and enzyme loading and composition on yields of glucose and xylose. Biotechnol Biofuels, 2011, 4: 16. DOI: 10.1186/1754-6834-4-16 |
| [28] |
Liu JM. Screening for cellobiohydrolase genes and the secretion of thermostable cellulase in Bacillus subtilis[D]. Shanghai: East China University of Science and Technology, 2011 (in Chinese). 刘建明.细菌纤维素外切酶基因的筛选及耐热纤维素酶基因在枯草杆菌系统里的表达[D].上海: 华东理工大学, 2011. |
| [29] | Zhang YHP, Lynd LR. Toward an aggregated understanding of enzymatic hydrolysis of cellulose: noncomplexed cellulase systems. Biotechnol Bioeng, 2004, 88(7): 797–824. DOI: 10.1002/(ISSN)1097-0290 |
| [30] | Fonseca-Maldonado R, Ribeiro LF, Furtado GP, et al. Synergistic action of co-expressed xylanase/laccase mixtures against milled sugar cane bagasse. Process Biochem, 2014, 49(7): 1152–1161. DOI: 10.1016/j.procbio.2014.03.027 |
| [31] | Kumar S, Jain KK, Bhardwaj KN, et al. Multiple genes in a single host: cost-effective production of bacterial laccase (cotA), pectate lyase (pel), and endoxylanase (xyl) by simultaneous expression and cloning in single vector in E. coli. PLoS ONE, 2015, 10(12): e0144379. DOI: 10.1371/journal.pone.0144379 |
 2019, Vol. 35
2019, Vol. 35




