中国科学院微生物研究所、中国微生物学会主办
文章信息
- 郭苗苗, 杨理凯, 杜伟立, 张涛, 路宏朝, 王令
- Guo Miaomiao, Yang Likai, Du Weili, Zhang Tao, Lu Hongzhao, Wang Ling
- CRISPR/Cas9介导的外源基因靶向插入鸡EAV-HP基因组
- CRISPR/Cas9-mediated foreign gene targeted knock-in into the chicken EAV-HP genome
- 生物工程学报, 2019, 35(2): 236-243
- Chinese Journal of Biotechnology, 2019, 35(2): 236-243
- 10.13345/j.cjb.180224
-
文章历史
- Received: May 31, 2018
- Accepted: November 5, 2018
- Published: November 26, 2018
基因编辑技术可以实现生物体基因组特定DNA序列靶向性修饰,其作为强大的现代生物技术,涉及到生物学基础研究和生物医学等诸多领域,具有广阔的应用前景和商业价值[1-2]。精准的基因编辑技术对生物学研究具有重要意义,且是基因疾病治疗的有效途径[3-4]。最新的基因编辑技术CRISPR/Cas9是在细菌和古菌的免疫系统基础上优化改造而来,因简便、高效且成本低的优点,已被研究者广泛使用。CRISPR/Cas9可通过单个引导RNA (sgRNA)介导Cas9蛋白识别目标序列并切断DNA双链,使机体以同源重组或非同源末端连接的方式修复受损DNA,从而实现对目标基因的靶向敲除、敲入和修正等目的[5-8]。人们对基因编辑的产物安全性质疑主要是外源基因的插入影响整合位点附近基因序列、染色体结构的改变是否造成内源基因的破坏以及是否会激活原本己关闭的基因等不确定因素[9]。所以在基因编辑技术中,编辑位点尤为重要[10-11]。
相对于小鼠等模式生物的基因组编辑研究,鸡转基因研究发展比较滞后[12-13]。目前,人基因组中腺相关病毒整合位点1 (Adeno-associated virus integration site 1, AAVS1)和小鼠的ROSA26位点已被证实是安全可靠的外源基因整合位点,且小鼠还有更多的位点正在被发掘,如MYH9基因位点[14]。但鸟类模式生物——鸡的转基因安全位点的相关报道较少,因此限制了转基因鸡的研究。
鸡基因组中含有多种内源性病毒,与鸡协同进化而稳定存在于鸡基因组中[15-16]。但将这些内源性病毒位点作为外源基因整合位点而制备转基因鸡的相关研究还未见报道。本研究针对鸡内源性病毒中的一个亚科EAV-HP基因组序列,设计靶向位点,用CRISPR/Cas9剪切EAV-HP基因序列并插入供体基因,探索EAV-HP是否为鸡基因组编辑的有效位点,为转基因鸡的研究提供新思路。
1 材料与方法 1.1 实验材料CRISPR/Cas9骨架载体pX330-U6-CBh-hSpCas9购自Addgene公司;表达EAV-HP靶序列HPT1 sgRNA的CRISPR/Cas9表达载体pX330-U6- HPT1-CBh-hSpCas9由本实验室构建[17];质粒pCD513B、HEK293T细胞系和鸡DF-1细胞系由本实验室保存;大肠杆菌TOP10感受态细胞由本实验室制备。
2 ×Taq PCR MasterMix,Taq DNA聚合酶,Hind Ⅲ、EcoRⅠ、BamHⅠ、NotⅠ内切酶购自NEB公司;TA克隆试剂盒购自西安宝生物公司;DMEM培养基、Superfect细胞转染试剂、OPTI-MEM、青霉素和链霉素、DNA回收试剂盒、质粒提取试剂盒等购自西安沃尔森生物技术有限公司;高糖DMEM培养基、胎牛血清均购自Gibco公司;0.25%胰酶购自Invitrogen公司;增强型绿色荧光蛋白鼠源多克隆抗体购自ABclonal生物技术公司;辣根过氧化物标记羊抗鼠二抗购自康为世纪生物科技有限公司。
1.2 供体载体的构建 1.2.1 PCR引物设计根据鸡EAV-HP基因组序列(GenBank登录号NC_005947)和增强型绿色荧光蛋白(eGFP)表达盒序列特征,利用软件Primer Premier 5.0设计扩增同源臂和eGFP基因的特异引物,引物信息见表 1。
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| ArmL-F | cccAAGCTTTGTTCCAGCAACACGACGGGTT | 490 |
| ArmL-R | GTGTCCTCCAGCATCGCATTCA | |
| ArmR-F | GGGATGTGTTGCTTCAATCTCA | 300 |
| ArmR-R | gcGAATTCAGCTGCTCCCTAATTCTATGAT | |
| eGFP-F | TGAATGCGATGCTGGAGGACACTAGTAATCAATTACGGGGTC | 1 579 |
| eGFP-R | TGAGATTGAAGCAACACATCCCGATACATTGATGAGTTTGGACA | |
| chF | ATTGGTGTAGTTCAAA AAGGGG | 1 222 |
| chR | ACTTGTGGCCGTTTACGTCG | |
| Note: the underlined part of the eGFP-F primer sequence is the EAV-HP left homologue arm downstream sequence; the underlined part of the eGFP-R primer sequence is the EAV-HP right homology arm upstream part sequence. | ||
以鸡基因组DNA为模板,使用特异性引物ArmL-F和ArmL-R扩增EAV-HP左侧同源臂片段;ArmR-F和ArmR-R引物扩增EAV-HP右侧同源臂DNA片段。同时,以eGFP-F和eGFP-R为引物,质粒pCD513B为模板,扩增eGFP表达盒DNA片段。PCR产物经10 g/L琼脂糖凝胶电泳检测,然后用DNA回收试剂盒纯化3种PCR产物,测浓度后保存备用。
1.2.3 重叠PCR连接DNA片段将EAV-HP左右同源臂和eGFP基因的PCR产物以分子个数比1:1:1的原则混合后作为模板,加入引物ArmL-F、ArmR-R,利用重叠延伸PCR将eGFP与左右同源臂连接,形成DNA长片段,简称LER。琼脂糖凝胶电泳检测重叠延伸PCR产物LER,并将纯化的LER片段TA克隆至pMD19-T载体,筛选阳性克隆并提取质粒,通过酶切和测序鉴定,获得供体载体pMDT-LER。
1.3 eGFP表达验证HEK293T细胞培养于DMEM培养基(10% FBS,青、链霉素双抗),37 ℃、5% CO2条件下培养。转染前一天,胰酶消化HEK293T细胞并传代至6孔板,当细胞密度达到60%–80%时,分别配置质粒pCD513B和pMDT-LER与Superfect转染试剂混合液,并分别加入细胞培养板中,完成转染。转染24 h后在荧光显微镜下观察绿色荧光阳性细胞,以验证供体载体中eGFP基因表达情况。
1.4 打靶载体和供体载体共转染鸡细胞系DF-1细胞培养于DMEM培养基(10% FBS,青、链霉素双抗),37 ℃、5% CO2条件下培养。转染前,将细胞传代至6孔板中,待细胞密度达到60%时即可转染。打靶载体pX330-U6-HPT1- CBh-hSpCas9[17]和供体载体pMDT-LER各取1 μg,制备质粒和转染试剂混合液,混合液加入DF-1细胞培养板中,轻轻摇晃培养板使其混匀后置于CO2培养箱。以转染空载体pX330-U6-CBh-hSpCas9和pMD19-T的细胞为对照。转染24 h后更换新鲜培养基,在倒置荧光显微镜下观察细胞的绿色荧光情况。细胞转染72 h后,收集细胞,用0.25%胰酶消化细胞,吹打形成单个细胞,PBS清洗2次,1 000 r/min离心5 min后弃上清,再用PBS重新清洗2次;调整细胞密度为106个/mL,用流式细胞仪检测阳性细胞率,同时以未转染的细胞作为阴性对照。
提取转染细胞基因组,利用检测引物chF和chR (表 1)检测eGFP基因是否整合至DF-1细胞基因组中。为验证外源基因在细胞增殖过程中是否稳定遗传并表达,将转染细胞传代至第7代,再次收集细胞,提取基因组,用引物ArmL-F与ArmR-R检测eGFP靶向插入,同时提取细胞总蛋白,以增强型绿色荧光蛋白鼠源多克隆抗体为一抗,以羊抗鼠IgG为二抗,利用Western blotting检测蛋白表达。
2 结果与分析 2.1 供体载体构建及鉴定本研究构建的供体载体含eGFP表达盒,其两边携带EAV-HP同源序列。首先利用PCR扩增EAV-HP的左右同源臂以及eGFP表达盒,然后通过重叠延伸PCR将3个DNA片段连接,其PCR产物简称LER。最后利用TA克隆将LER片段插入T载体pMD19-T,经菌落PCR、酶切鉴定和DNA测序,证明LER片段成功克隆至T载体,且无突变,获得重组载体pMDT-LER (图 1A)。该重组载体将为CRISPR/Cas9介导eGFP基因靶向插入鸡EAV-HP位点提供供体DNA (图 1B)。

|
| 图 1 CRISPR/Cas9介导外源基因eGFP插入鸡EAV-HP位点示意图(A:供体载体结构示意图;B:供体载体整合至鸡基因组原理示意图) Fig. 1 Schematic diagram of CRISPR/Cas9-mediated foreign gene targeted knock-in into the chicken genomic EAV-HP locus.(A) Schematic diagram of donor vector. (B) Schematic diagram of donor vector integration. |
| |
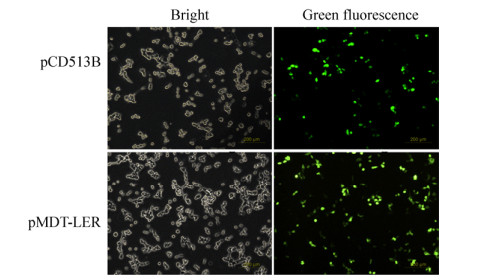
转染pCD513B质粒的阳性对照细胞观察到绿色荧光,同时转染供体载体pMDT-LER的HEK293T细胞亦观察到明显的绿色荧光,结果表明,pMDT-LER重组载体携带的外源基因eGFP可在HEK293T细胞中表达(图 2)。
|
| 图 2 HEK293T细胞水平验证eGFP表达 Fig. 2 Detection of eGFP expression in HEK293T cells. pCD513B: positive control group; pMDT-LER: experiment group. |
| |
将CRISPR/Cas9表达载体和供体DNA共转染至DF-1细胞,24 h后观察绿色荧光,并利用流式细胞仪检测绿色荧光阳性细胞。结果显示,阳性细胞约占50%,说明供体载体成功导入DF-1细胞,eGFP基因获得表达(图 3A)。PCR结果显示实验组获得特异性DNA条带,而对照组无条带,与理论相符,在DNA水平确定了外源eGFP基因的靶向整合(图 3B)。
将转染细胞传代至第7代,收集细胞,分别提取细胞基因组和总蛋白,再次利用PCR和Western blotting检测eGFP基因及表达产物。PCR结果表明外源基因eGFP在DF-1细胞增殖过程中没有丢失(图 4A)。Western blotting结果显示,eGFP在转基因鸡细胞中高效表达(图 4B)。上述结果进一步表明,外源基因eGFP通过同源重组的方式成功整合进鸡细胞EAV-HP基因组中,并稳定存在和高效表达。

|
| 图 3 转eGFP基因的DF-1细胞检测(A:荧光观察eGFP基因表达;B:PCR检测eGFP基因) Fig. 3 Detection of eGFP in the transgenic DF-1 cells.(A) Fluorescence observation of eGFP expression. (B) PCR detection of eGFP gene. M: 5 000 bp DNA marker; 1: PCR results of control group cells; 2: PCR results of experiment group cells. |
| |

|
| 图 4 第7代转基因DF-1细胞检测(A:PCR检测目标基因;B:Western blotting检测绿色荧光蛋白) Fig. 4 Detection of eGFP in the 7th-generation transgenic DF-1cells.(A) PCR detection of eGFP gene. (B) Western blotting detection of eGFP |
| |
鸡作为世界上存在数量最多的禽类,与人们的生活密切相关[18]。与转基因牛、羊等哺乳动物相比,转基因鸡可以作为更快速和更丰富的生物制药来源[12, 19-20]。但是自20世纪80年代开始,禽类的转基因研究进展一直较为缓慢,其主要问题是外源基因的转入无法有效地整合进基因组中,大多以游离状态存在于细胞中,在遗传过程中出现丢失现象,不能稳定遗传给下一代。所以在转基因鸡的研究中,寻找到能完整整合、表达并能稳定遗传的外源基因插入位点是关键性问题。
内源性逆转录病毒基因EAV-HP属于内源性禽逆转录病毒科的一个亚科。家鸡EAV-HP的基因缺失表现为部分gag基因、整个pol基因和部分env基因的缺失,野鸡的EAV-HP含有完整的pol基因[21-22],这些缺失和突变导致EAV-HP基因组不转录或以极低的水平转录部分mRNA,且不能翻译形成活性蛋白,不产生病毒体[23]。上述研究结果表明,在进化过程中EAV-HP稳定存在于鸡基因组,无病毒活性,且不影响鸡的正常生长发育,是潜在的外源基因插入的安全位点。基于上述发现,本研究将外源基因eGFP整合至EAV-HP位点,在DNA和蛋白水平证明了eGFP能稳定遗传和高效表达。2003年有研究发现,鸡SLCO1B3基因5' 端区域整合的EAV-HP 3' LTR序列增强了SLCO1B3的表达,使鸡蛋表现出绿壳性状[24],此研究结果说明,EAV-HP基因组部分元件可能对临近的基因表达有增强作用。但是,其元件是否对整合的外源基因表达有调控作用尚不清楚,外源基因插入位点的不同和外源基因启动子的差异是否会影响整合效率及遗传稳定性也有待进一步研究。
基因组编辑技术是指在细胞基因组靶位点引入核酸序列变化的一类技术,包括碱基的插入、缺失、替换等,从而达到编辑基因的目的[25]。ZFNs和TALENs是较早的两代基因编辑技术,ZFN方法中模块组装的锌指蛋白活性低,有效锌指蛋白不易获得,此法成本高;TALEN技术需要组装多个重复模块,过程繁琐。与前两代基因编辑技术相比,新一代基因编辑技术CRISPR/Cas9应用领域更广[5],其载体构建简单易操作,最重要的是其编辑精确性高、效率高[26]。故本研究采用CRISPR/Cas9靶向切断鸡EAV-HP基因组的DNA双链,基于细胞同源重组修复机制,携带eGFP的供体载体将整合至DNA断裂处,在细胞水平上实现定点整合。
在供体载体整合至EAV-HP位点时,供体载体的类型也对整合效率有着一定的影响。有研究报道同源序列长度一致时,插入型载体的整合效率要高于置换型载体[27],但是由于置换型载体的装载量大,整合精确,所以目前使用的供体载体多为置换型载体。本研究设计的供体载体为置换型载体,同源臂的长度约300–500 bp,此长度既保证了同源重组的效率,亦控制了供体DNA大小,左右同源臂和外源基因eGFP共约2 kb,利于供体DNA转染至DF-1细胞。
本研究首次利用CRISPR/Cas9体系将外源基因整合至鸡内源性病毒中的EAV-HP位点,且外源基因能高效表达、稳定遗传,在细胞水平初步证明EVA-HP基因位点是鸡基因组中可供选择的外源基因整合位点,为转基因鸡的研究以及禽类育种提供新策略。
| [1] |
Chen YL, Yao SZ. Research progress in the application of CRISPR/Cas9 gene editing technology.
J Int Reprod Health/Family Plann, 2017, 36(6): 482–487.
(in Chinese). 陈怡李, 姚书忠. CRISPR/Cas9基因编辑技术的应用研究进展. 国际生殖健康/计划生育杂志, 2017, 36(6): 482-487. DOI:10.3969/j.issn.1674-1889.2017.06.010 |
| [2] |
Liu B, Wei W, Wang LH. Progress in new techniques of gene editing.
Subtrop Agric Res, 2013, 9(4): 262–269.
(in Chinese). 刘蓓, 尉玮, 王丽华. 基因编辑新技术研究进展. 亚热带农业研究, 2013, 9(4): 262-269. |
| [3] |
Ji HY, Zhu HZ. Progress of genome editing approaches towards gene therapy.
Chin Bull Life Sci, 2015, 27(1): 71–82.
(in Chinese). 季海艳, 朱焕章. 基因编辑技术在基因治疗中的应用进展. 生命科学, 2015, 27(1): 71-82. |
| [4] | Men K, Duan XM, He ZY, et al. CRISPR/Cas9- mediated correction of human genetic disease. Sci China Life Sci, 2017, 60(5): 447–457. DOI: 10.1007/s11427-017-9032-4 |
| [5] |
Zhou WL, Tang L, Cheng K, et al. Construction of prototrophic glutathione-high-producing yeast strain mediated by CRISPR/Cas9.
Chin J Biotech, 2017, 33(12): 1999–2008.
(in Chinese). 周文龙, 唐亮, 成凯, 等. CRISPR/Cas9介导的高产谷胱甘肽原养型酵母工程菌的构建. 生物工程学报, 2017, 33(12): 1999-2008. |
| [6] |
Li JH, Shou J, Wu Q. DNA fragment editing of genomes by CRISPR/Cas9.
Hereditas (Beijing), 2015, 37(10): 992–1002.
(in Chinese). 李金环, 寿佳, 吴强. CRISPR/Cas9系统在基因组DNA片段编辑中的应用. 遗传, 2015, 37(10): 992-1002. |
| [7] | Hsu PD, Lander ES, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering. Cell, 2014, 157(6): 1262–1278. DOI: 10.1016/j.cell.2014.05.010 |
| [8] | Jao LE, Wente SR, Chen WB. Efficient multiplex biallelic zebrafish genome editing using a CRISPR nuclease system. Proc Natl Acad Sci USA, 2013, 110(34): 13904–13909. DOI: 10.1073/pnas.1308335110 |
| [9] |
Xu JX, Li N. Biosafety assessment of genetically engineered animals.
Chin J Biotech, 2012, 28(3): 267–281.
(in Chinese). 许建香, 李宁. 转基因动物生物安全研究与评价. 生物工程学报, 2012, 28(3): 267-281. |
| [10] |
Wu B, Zhu ZY. Integration sites of transgenes in transgenic animals.
Hereditas (Beijing), 2003, 25(1): 77–80.
(in Chinese). 吴波, 朱作言. 转基因动物整合位点的研究进展. 遗传, 2003, 25(1): 77-80. |
| [11] | Ma LY, Wang YZ, Wang HT, et al. Screen and verification for transgene integration sites in pigs. Sci Rep, 2018, 8(1): 7433. |
| [12] |
Liu WL, Li H. Production and research prospect of transgenic chickens.
China Poult, 2013, 35(18): 2–5.
(in Chinese). 刘文利, 李辉. 转基因鸡的制作及研究展望. 中国家禽, 2013, 35(18): 2-5. DOI:10.3969/j.issn.1004-6364.2013.18.002 |
| [13] | Woodcock ME, Idoko-Akoh A, McGrew MJ. Gene editing in birds takes flight. Mamm Genome, 2017, 28(7/8): 315–323. |
| [14] | Liu TB, Hu Y, Guo SY, et al. Identification and characterization of MYH9 locus for high efficient gene knock-in and stable expression in mouse embryonic stem cells. PLoS ONE, 2018, 13(2): e192641. |
| [15] |
Wang L, Zhang T, Yin YJ. Research progress of retroviral vector-mediated generation of transgenic chicken.
China Poultry, 2015, 37(14): 44–48.
(in Chinese). 王令, 张涛, 尹亚军. 逆转录病毒载体介导的转基因鸡研究进展. 中国家禽, 2015, 37(14): 44-48. |
| [16] |
Man CL, Chen Y. Retrovirus and transgenic chicken.
China Biotechnol, 2007, 27(7): 117–121.
(in Chinese). 满朝来, 陈岩. 逆转录病毒与转基因鸡. 中国生物工程杂志, 2007, 27(7): 117-121. |
| [17] |
Wang L, Zhang T, Lu HZ, et al. Rapid construction of CRISPR/Cas9 system for target genomic editing.
Chin J Biochem Mol Biol, 2015, 31(10): 1117–1124.
(in Chinese). 王令, 张涛, 路宏朝, 等. 快速构建CRISPR/Cas9基因组靶向编辑系统. 中国生物化学与分子生物学报, 2015, 31(10): 1117-1124. |
| [18] | Andrew L. Why Did the Chicken Cross the World? Translated by Xiao Aoran. China: CITIC Press Group, 2017: 1–11. |
| [19] |
Li N, Sun YM, Zhao BH. Cloning of F gene of newcastle diseasa virus HeB02 isolate and the study of its DNA vaccine.
Chin J Biotech, 2006, 22(3): 445–450.
(in Chinese). 李楠, 孙一敏, 赵宝华. 鸡新城疫病毒HeB02分离株F基因的克隆及其DNA疫苗的研究. 生物工程学报, 2006, 22(3): 445-450. DOI:10.3321/j.issn:1000-3061.2006.03.016 |
| [20] |
Liu TX. Oviduct-specific expression of human neutrophil defensin 4 in transgenic chickens[D]. Beijing: China Agricultural University, 2015 (in Chinese). 刘同欣.输卵管特异性表达人防御素4基因转基因鸡的制备[D].北京: 中国农业大学, 2015. |
| [21] | Sacco MA, Flannery DMJ, Howes K, et al. Avian endogenous retrovirus EAV-HP shares regions of identity with avian leukosis virus subgroup J and the avian retrotransposon ART-CH. J Virol, 2000, 74(3): 1296–1306. DOI: 10.1128/JVI.74.3.1296-1306.2000 |
| [22] | Sacco MA, Howes K, Venugopal K. Intact EAV-HP endogenous retrovirus in Sonnerat's jungle fowl. J Virol, 2001, 75(4): 2029–2032. DOI: 10.1128/JVI.75.4.2029-2032.2001 |
| [23] | Sacco MA, Howes K, Smith LP, et al. Assessing the roles of endogenous retrovirus EAV-HP in avian leukosis virus subgroup J emergence and tolerance. J Virol, 2004, 78(19): 10525–10535. DOI: 10.1128/JVI.78.19.10525-10535.2004 |
| [24] | Wang ZP, Qu LJ, Yao JF, et al. An EAV-HP insertion in 5ʹ flanking region of SLCO1B3 causes blue eggshell in the chicken. PLoS Genet, 2013, 9(1): e1003183. DOI: 10.1371/journal.pgen.1003183 |
| [25] |
Zhou CC, Liu XX, Xie HH, et al. The new member of CRISPR family, CRISPR-Cpf1.
Progr Biochem Biophys, 2018, 45(6): 582–592.
(in Chinese). 周晨晨, 刘写写, 谢海华, 等. CRISPR家族新成员: CRISPR-Cpf1. 生物化学与生物物理进展, 2018, 45(6): 582-592. |
| [26] |
Wang C, Wang KJ. Advances in CRISPR-Cas-mediated genome editing system in plants.
Chin J Biotech, 2017, 33(10): 1712–1722.
(in Chinese). 王春, 王克剑. CRISPR-Cas系统在植物基因组编辑中的研究进展. 生物工程学报, 2017, 33(10): 1712-1722. |
| [27] | Hasty P, Rivera-Pérez J, Chang C, et al. Target frequency and integration pattern for insertion and replacement vectors in embryonic stem cells. Mol Cellular Biol, 1991, 11(9): 4509–4517. DOI: 10.1128/MCB.11.9.4509 |
 2019, Vol. 35
2019, Vol. 35




