中国科学院微生物研究所、中国微生物学会主办
文章信息
- 孟婷婷, 马乐凡, 李洪兵
- Meng Tingting, Ma Lefan, Li Hongbing
- 生物酶控制纸浆树脂障碍的研究进展
- Progress in pitch control in pulp by enzymes
- 生物工程学报, 2019, 35(2): 226-235
- Chinese Journal of Biotechnology, 2019, 35(2): 226-235
- 10.13345/j.cjb.180145
-
文章历史
- Received: April 17, 2018
- Accepted: August 13, 2018
- Published: August 28, 2018
2. 湖南鸿鹰生物科技有限公司, 湖南 常德 415400
2. Hunan Hong Ying Biotech Co., LTD, Changde 415400, Hunan, China
树脂是植物生长过程中的分泌物,广泛存在于植物中。虽然纸浆中树脂的含量比较低,但是会对制浆造纸生产过程造成很大的影响,主要表现在以下方面:1)树脂沉积在制浆造纸设备上,增加设备停机清洗的次数,影响生产操作和设备的运行效率,严重时甚至损伤设备;2)树脂沉积在纸页的表面,造成孔洞,影响纸张的质量,并且造成纸页的断头;3)树脂存在于造纸废水中,增加废水的毒性[1]。因此,将这种因树脂沉积而影响制浆造纸生产过程,进而影响产品质量的状态,统称为树脂障碍。目前,控制纸浆中树脂障碍的措施主要有原料贮存过程中自然风化和生物降解、纸浆化学控制法和生物控制法:原料贮存过程中自然风化和生物降解对纸浆中树脂的去除量有限,还会影响纸浆的得率和白度;纸浆化学法控制通常只是改变纸浆中树脂粒子的表面性质,不能从根本上去除纸浆中的树脂,而且化学药品的加入通常会带来一些负面的影响,例如,造成生产设备的磨损和腐蚀,增加纸浆中的灰分,影响填料和细小纤维的留着以及纸页的施胶等;生物控制法包括微生物菌处理和生物酶处理,其中,生物酶处理与制浆造纸生产过程兼容性好,能够有效地降解树脂成分,不影响纸页的质量和设备的运行,是控制纸浆树障碍最理想的方法,也是纸浆树脂障碍控制技术研究的热点[2-3]。
1 纸浆中树脂成分及其存在形式木材中的树脂主要包括甘油三酯、脂肪酸、树脂酸、烷烃、脂肪醇、甾醇、甾醇酯以及少量的蜡状物(表 1),其含量占木材总量的2%–8%。树脂成分因树种、树龄、季节、部位、制浆、漂白方式的不同而存在差异。在制浆造纸过程中,树脂主要以3种形式存在:1)形成胶体液滴分散在白水中,甘油三酸酯、甾醇酯形成胶体液滴的内核,而树脂酸、脂肪酸、甾醇因具有羧基和羟基形成胶体液滴的外表面,胶体液滴的稳定性和溶解性受到pH、温度、剪切力等因素影响[4];2)以球状颗粒形式分布在纸浆中的纤维上,影响纤维之间的结合性能和成纸强度[5-6];3)存在于纸浆薄壁细胞的内部[1]。这3种形式在制浆造纸的过程中会发生相互转换。
| Softwoods | Hardwoods | ||||
| Pinus sylvestris | Picea abies | Betula verrucosa | Populus tremula | Eucalyptus globulus | |
| Free fatty acids | 1.73 | 0.78 | − | 1.06 | 0.28 |
| Resin acids | 6.65 | 2.85 | 0.06 | 0.17 | 0.00 |
| Hydrocarbons | 0.74 | 0.19 | 0.40 | 1.14 | 0.17 |
| Waxes or sterol esters | 0.83 | 0.87 | 1.96 | 3.07 | 0.57 |
| Monoglycerides | 0.18 | 0.55 | 2.24 | 1.18 | 0.02 |
| Diglycerides | 0.32 | 0.55 | 1.72 | 0.58 | 0.02 |
| Triglycerides | 8.74 | 1.94 | 8.10 | 10.37 | 0.13 |
| Higher alcohols or sterols | 1.39 | 1.00 | 1.56 | 2.40 | 0.68 |
| Oxidized compounds | 0.43 | 1.36 | 2.94 | 1.53 | 0.22 |
| Lipophilic compounds | 22.90 | 10.40 | 20.30 | 22.70 | 2.60 |
| Total acetone extract | 31.00 | 22.20 | 34.60 | 45.30 | 15.20 |
在机械法制浆过程中,树脂成分以及性质并未发生变化而容易形成沉积;在硫酸盐法制浆过程中,甘油三酯、脂肪酸、树脂酸因发生皂化反应而溶解,而甾醇、甾醇酯、蜡状物、脂肪醇等因不易发生皂化反应而容易形成沉积,从而造成树脂障碍[7-8]。
漂白方法对纸浆中树脂的去除影响较大,在无元素氯(ECF)漂白过程中,二氧化氯的强氧化作用可以使纸浆中的甾醇、脂肪酸、脂肪醇分别降低70%、70%、90%,但是采用二氧化氯进行漂白会产生有机卤化物,增加废水处理的难度[9]。在全无氯漂白方法中,采用过氧化氢进行漂白的方法只能去除极少量甾醇、甾醇酯,因此漂白后纸浆中残留的树脂仍然具有明显的沉积趋势;而采用臭氧进行漂白的方法对甾醇具有较好的处理效果(β-谷甾醇被完全去除),但是对于脂肪酸的处理效果比较差[10-12]。
2 控制纸浆中树脂障碍的生物酶目前,应用于控制纸浆树脂障碍的生物酶主要分为两类:水解酶和氧化酶。水解酶主要包括脂肪酶和甾醇酯酶,主要作用于甘油三酯和甾醇酯;氧化酶主要包括漆酶和脂氧合酶,主要作用于甾醇和甾醇酯以及树脂酸等。
2.1 脂肪酶 2.1.1 脂肪酶控制树脂障碍反应机理脂肪酶(Lipase,E.C. 3.1.1.3)是一种水解酶,能在油-水界面上催化甘油三酯的水解[13-14]。脂肪酶催化甘油三酯水解的反应过程可以分为4步(图 1):催化位点羟基氧攻击甘油三酯的酯键,与甘油三酯的羰基形成酰基-酶中间体(图 1A);电子通过酰基-酶中间体的酰基氧原子转移到主链残基的氮原子上,导致甘油二酯的释放(图 1B);水作为亲核体攻击酰基-酶中间体,从而形成新的酰基-酶中间体结构(图 1C);电子通过酰基-酶中间体转移到主链残基的氮原子上,释放出脂肪酸[15-16] (图 1D)。脂肪酶催化效率与甘油三酯和脂肪酸、树脂酸的比例有关,比值越大,脂肪酶的处理效果越好,而脂肪酸、树脂酸易与浆料系统中的Ca2+反应形成钙皂,进而形成树脂沉积[17]。
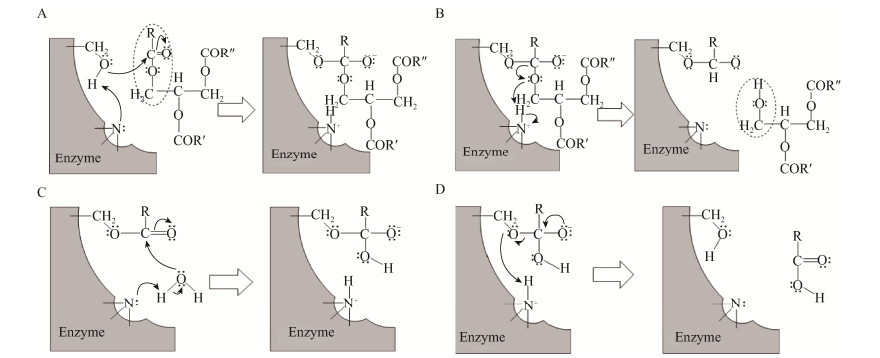
|
| 图 1 脂肪酶水解甘油三酯的催化机制 Fig. 1 Reaction mechanism of lipase-catalyzed triglyceride hydrolysis |
| |
影响脂肪酶控制树脂障碍效果的因素主要包括浆种、酶源、酶用量、温度、pH值、时间和纸浆浓度等。脂肪酶控制树脂障碍的工艺条件及处理效果见表 2。
| Enzyme species or source | Pulp species or substrate | Condition | Results | Reference |
| Burkholderia sp. | Pinus massoniana thermomechanical pulp (TMP) | Dosage of lipase 20 U/g oven-dried pulp, at a pulp consistency of 6%, 65 ℃, 30 min, pH 7.5. | Triglyceride removal rate of 39%. | [18] |
| Novozymes | TMP | Dosage of lipase 25 U/g oven-dried pulp, at a pulp consistency of 0.4%, 40 ℃, 2 h. | Neutral component in lipophilic extractives removal rate of 60%. | [19] |
| Restinase HT | Model lipids | Dosage of lipase 10 U/g lipids, 50 ℃, 3 h. | Pentadecanoic acid, linolenic acid, and oleic acid removal rate of 49.4%, 92.5%, and 97.8% respectively. | [20] |
脂肪酶控制树脂障碍已在国内外制浆造纸工厂中得到了广泛应用。日本的JuJo造纸厂首次采用脂肪酶处理针叶木TMP[21]。随后,国内的很多造纸厂采用脂肪酶处理机械浆中的树脂。福建南平纸业采用脂肪酶处理马尾松TMP,发现脂肪酶结合硫酸铝处理后,有害树脂降解率达70%以上[22];岳阳林氏集团采用Resinase A脂肪酶处理漂白磨木浆,发现树脂平均降解率达22.1%,最高降解率达30.8%[2]。
一些研究表明表面活性剂能提高脂肪酶的树脂障碍控制效果。徐丽丽等[23]采用猪胰脂肪酶结合表面活性剂对马尾松TMP进行处理,研究了脂肪酶结合表面活性剂对树脂的处理效果,得出在酶用量为5 U/g、pH值为7.5、温度为40 ℃、纸浆浓度为3%、处理时间为3 h的条件下,脂肪醇聚氧乙烯醚结合脂肪酶处理纸浆的效果最好,其降解率为脂肪酶单独处理的3倍。Dubé等[24]采用了一种新型可生物降解的非离子型表面活性剂烷基二乙醇酰胺与来自变铅青链霉菌Streptomyces lividans的脂肪酶处理混合针叶木TMP,研究了脂肪酶结合表面活性剂对于树脂控制的效果,得出在酶用量为10 U/g、温度为60 ℃、纸浆浓度为4%、表面活性剂用量为0.1% (V/V)条件下,树脂酸、甾醇、甘油三酯的降解率分别48%、32%和78%,而表面活性剂单独处理时,树脂酸、甾醇、甘油三酯的降解率分别为32%、17%和39%,可以看出表面活性剂和脂肪酶结合处理效果要优于表面活性剂单独处理的效果。由上可知,脂肪酶的处理效果不仅仅与表面活性剂的性质有关,而且与酶源、纸浆的种类也是相关的。
全细胞技术因为能够保持原有细胞所处的状态,具有稳定性好、适应性强的特点,而应用于树脂障碍的控制[25]。眭梁梁[26]采用米曲霉全细胞催化技术来处理造纸白水中的树脂,研究了固定化米曲霉对于造纸白水的处理效果,发现将0.1 g脂肪酶米曲霉全细胞冻干粉加入到5 mL的白水中,在温度为50 ℃、反应时间为3 h的条件下,白水中树脂沉积物的平均粒径从534 nm下降到356 nm,证明了米曲霉全细胞技术具有控制树脂障碍的潜力。虽然全细胞催化技术能够催化甘油三酸酯的水解,但是催化效率不及脂肪酶与底物直接接触的作用效果。
2.1.3 脂肪酶控制树脂障碍技术存在的主要问题尽管脂肪酶控制树脂障碍技术已实现了产业化,并在国内外得到了广泛应用,但在该领域目前还存在很多问题,有待进一步研究,这些问题主要包括:1)脂肪酶控制树脂障碍技术主要应用于磨石磨木浆和热磨机械浆,对于其他浆种例如硫酸盐浆是否适用有待研究;2)制浆造纸环境的温度和pH较高,脂肪酶并不能发挥其最佳效果,因此需要筛选出耐高温耐碱的菌种;3)与化学制剂相比,使用脂肪酶控制树脂障碍的成本比较高,可以采用基因工程将产酶基因转入工程菌中大量产酶,从而降低成本。
2.2 甾醇酯酶 2.2.1 甾醇酯酶控制树脂障碍反应机理甾醇酯酶(Sterol esterse,EC 3.1.1.13)是一种水解酶,能够水解纸浆中的甾醇酯(有些甾醇酯酶也可以水解甘油三酯),属于α/β水解酶家族,具有催化三联体结构(由丝氨酸、组氨酸、谷氨酸/天冬氨酸组成),其催化底物水解的过程可以分为4步:1)丝氨酸中的羟基氧首先攻击底物,发生亲核反应,形成酰基-酶复合物;2)酰基-酶中间体被水解,释放出脂肪醇;3)新的酰基-酶中间体的形成;4)酰基-酶中间体被水解,释放出脂肪酸以及酶还原为游离态[27-28]。
曾诚[29]对于来自不同菌种的甾醇酯酶酶学特性进行研究,得出来自金黄杆菌Chryseobacterium sp.的甾醇酯酶对于不同碳链长度脂肪酸胆固醇酯有很好的水解效率,对胆固醇亚油酸酯表现出最强的酶活性,具有广泛的底物谱宽。Calero-Rueda等[30]采用来自线嘴壳菌Ophiostoma piceae的甾醇酯酶分别处理甾醇酯和甘油三酯,测定其米氏常数和反应速率常数分别在0.9–1.1 mmol/L和70–300/s范围之内,说明了甾醇酯酶与底物具有很好的结合能力。另外,一些脂肪酶也具有水解甾醇酯的能力,Kontkanen等[31]发现来自皱褶假丝酵母菌Candida rugosa、染色粘性菌Chromobacterium viscosum的脂肪酶能够水解甾醇酯。
2.2.2 甾醇酯酶控制树脂障碍的工艺影响甾醇酯酶控制树脂障碍效果的因素主要包括酶种、酶用量、pH、温度、时间等。甾醇酯酶控制树脂障碍的工艺条件及处理效果见表 3。
| Enzyme species or source | Pulp species or substrate | Condition | Results | Reference |
| Melanocarpus albomyces | Unbleached Norway spruce TMP pulp | Dosage of sterol esterase 1.5 U/g oven-dried pulp, at a pulp consistency of 1%, 50℃, 20 h, pH 5. | The tensile index of pulp was increased by 24.28%, and its optical properties were not influenced nearly. Triglyceride could be hydrolyzed by sterol esterase. | Kontkanen et al[32] |
| Ophiostoma piceae | Lipophilic extractives from Eucalyptus globulus and Pinus sylvestris wood | Dosage of sterol esterase 0.37 U/mg lipophilic extractives, 37 ℃, 3 h, pH 7. | Eucalypt sterol esters and pine triglycerides removal rate of 70% and 40% respectively. | Calero-Rueda et al[33] |
目前,甾醇酯酶用于控制树脂障碍仍然处于实验室研究的起步阶段,存在较多的问题有待研究解决:1)甾醇酯酶的水解产物仍然具有较强的黏性,容易形成树脂沉积,如何将水解产物降解或者分散有待解决;2)影响甾醇酯酶处理效果的因素仍需进一步研究;3)根据目前的研究发现,有些甾醇酯酶具有水解甘油三酯的活性,那么甾醇酯酶是否可以替代脂肪酶而应用于树脂障碍的控制有待研究。
2.3 漆酶 2.3.1 漆酶控制树脂障碍反应机理漆酶(Laccase,EC 1.10.3.2)是一种含铜的多酚氧化酶,可以通过活性位点的铜离子和底物之间的电子传递实现对底物的催化氧化,主要作用于纸浆中脂肪酸、树脂酸、甾醇、甾醇酯等不饱和脂类物质。漆酶的氧化还原电位低(0.5–0.8 V),只能氧化酚醛类木质素结构。而低分子量介体的出现扩大了漆酶的作用范围,例如2-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、1-羟基苯并三唑(HBT),其原因在于介体提高了漆酶的氧化还原电势并且减少了漆酶与底物之间的空间阻碍[34]。漆酶-介体系统的催化过程如图 2所示,可以分为2步:1)在分子氧作为氧化剂的条件下,漆酶将介体氧化为具有高氧化还原电位的稳定中间体;2)氧化介质被底物还原[35-36]。
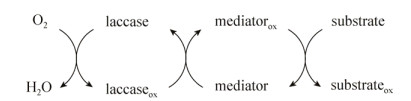
|
| 图 2 漆酶-介体反应机制 Fig. 2 Reaction mechanism of susbstrate oxidation by laccase-mediator systems |
| |
影响漆酶控制树脂障碍效果的主要因素包括酶种、酶用量、介体的种类及用量、pH、温度、时间以及浆浓。漆酶控制树脂障碍的工艺条件及处理效果见表 4。
| Enzyme species or source | Pulp species or substrate | Mediator | Condition | Results | Reference |
| Pycnoporus cinnabarinus | Model lipids | HBT | Dosage of laccase 0.5 U/mg lipids, dosage of HBT 1 U/mg lipids, 50 ℃, 2 h, pH 4. | Oleic acid, linoleic acid, abietic acid, sitosterol, cholesteryl palmitate, oleate linoleate, and trilinolein removal rate of 60%–100%. Octadecane, hexadecanol, palmitic acid, and triheptadecanoin not any removal. | [37] |
| Trametes villosa | Eucalyptus globulus kraft pulp | HBT | Dosage of laccase 16 U/g oven-dried pulp, dosage of HBT 0.5% oven-dried pulp, at a consistency pulp of 5%, 30 ℃, 4 h, pH 4. | Sterols removal rate of almost 100%. | [38] |
| Novozymes | Dissolved and colloidal substances (DCS) from aspen bleached chemithermomechanical pulp | 5-hydroxyiminobarbituric acid | Dosage of laccase 120 U/L DCS, at 5-hydroxyiminobarbituric acid concentration of 0.1 g/L, 55 ℃, 2 h, pH 5.5. | Triglyceride and fatty acid removal rate of almost 100% and 33% respectively. | [39] |
| Myceliophthora thermophila | Eucalyptus globulus unbleached kraft pulp | Syringaldehyde/ methyl syringate | Dosage of laccase 20 U/g oven-dried pulp, at syringaldehyde and methyl syringate concentration of 6.75 mmol/L, pulp of 3%, 50 ℃, 12 h, pH 6.5. | In the presence of syringaldehyde, free sterols, sterol glycosides, and sterol esters removal rate of 73%, 91% and 89% respectively. Sterol esters and free sterols removal rate of 92% and 48% respectively in the presence of methyl syringate. | [40] |
| Pycnoporus cinnabarinus | Encalytus gloulus unbleached kraft pulp | Syringaldelyde/acetosyrmgone/p-coumaric | Dosage of laccase 20 U/g oven-dried pulp, at syringaldehyde, methyl syringate, and p-coumaric concentration of 6.75 mmol/L, HBT of 3.33 mmol/L, pulp of 3%, 50 ℃, 12 h, pH 4. | The syringaldehyde had the similar effect to HBT. | [41] |
研究发现,无论是采用合成介体还是天然介体,漆酶-介体系统均可以很大程度上去除纸浆中的亲脂性物质和木素,提高了纸浆的白度。虽然天然介体在改善纸张性能方面不及人工介体的作用效果,但是可以减轻纸浆粘度的损失[41]。
2.3.3 漆酶控制树脂障碍技术存在的主要问题目前,漆酶-介体系统处理仍处于实验室研究阶段,尚存在一些问题有待研究:1)大多数漆酶最适pH值为酸性,而造纸过程一般处于碱性环境,漆酶不能发挥最大的氧化效果,因此需要筛选出抗碱性的漆酶菌种;2)漆酶能够氧化纸浆中的树脂,其反应产物主要为醛、酮和环氧类物质,但是缺乏对于反应产物性质的探究,不能确定产物是否仍然具有沉积的趋势;3)目前,用于树脂控制的人工介体对环境有不利影响,因此需要开发更多的环境兼容性好的介体;4)漆酶生产成本比较高,因此需要采用基因工程、酶工程等筛选出产酶量多、稳定性好的漆酶菌种。
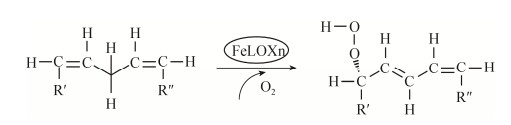
2.4 脂氧合酶 2.4.1 脂氧合酶控制树脂障碍反应机理脂氧合酶(Lipoxygenase, EC1.13.11.12)是一类催化不饱和脂肪酸及其酯氧化的含铁氧化还原酶,能催化具有顺, 顺-1, 4-戊二烯结构的不饱和脂肪酸加氧反应,生成具有共轭双键的不饱和酸的氢过氧化物[42]。一般来说,脂氧合酶氧化降解脂肪酸的过程可以分为2步,即底物活化和氧加成:1)酶中的Fe3+从脂肪酸中的烯丙基结构得到一个电子,产生自由基和Fe2+;2)分子氧与自由基反应形成氢过氧化物(图 3),而氢过氧化物可以被金属离子分解形成更小的碎片,从而进一步降低氧化产物的黏性[43]。
2.4.2 脂氧合酶控制树脂障碍的工艺影响脂氧合酶控制树脂障碍效果的因素主要包括酶种、酶用量、介体的用量、温度、处理时间、pH、浆浓。脂氧合酶控制树脂障碍的工艺条件及处理效果见表 5。
| Enzyme species or source | Pulp species or substrate | Condition | Results | Reference |
| Gaeumannomyces graminis | Unbleached kraft eucalypt pulp | Dosage of lipoxygenases 10 mg/g oven-dried pulp, dosage of linoleic acid 0.1 mg/g oven-dried pulp, at a pulp consistency of 1%, 30 ℃, 4 h, pH 7. | Sterol esters and glycosides removal rate of 29% and 24% respectively, and free sterols not any removal. | [45] |
| Soybean lipoxygenase | A mixture of black spruce and jack pine | Dosages of lipoxygenases 1 mg/g oven-dried pulp and 10 mg/g oven-dried pulp respectively, at a pulp consistency of 1%, 30 ℃, 2 h, pH 9. | Lipophilic extractive removal rate of 10% and 15% respectively. | [43] |
针对脂氧合酶处理树脂障碍研究现状,仍然有几点需要关注:1)脂氧合酶氧化效果不及漆酶,如何提高脂氧合酶氧化活性有待研究;2)脂氧合酶的介体比较单一,只有亚油酸,需要探究不同的介体。
2.5 其他酶的作用以及酶的复配除了脂肪酶、甾醇酯酶、漆酶以及脂氧合酶可以直接作用于树脂外,其他酶也可以起到辅助的作用。木聚糖酶可以催化降解纤维细胞壁上的木聚糖,因为树脂容易与木聚糖等碳水化合物聚集,导致部分树脂随着木聚糖的降解而被除去[46]。蛋白酶可以使树脂松散地附着在纤维上,提高了脂肪酶、漆酶等对于纸浆中树脂的降解效果。
由于酶的专一性,只能针对一种或者是一类物质发生反应。两种或者两种以上的酶协同作用可以克服单一酶种的局限性。例如:脂肪酶和脂氧合酶复配,脂肪酶可以有效地降解甘油三酯,而且其水解产物对于脂氧合酶氧化反应具有促进作用;脂肪酶或者甾醇酯酶与漆酶复配,可以有效地除去脂肪酶或者甾醇酯酶的水解产物。
目前,酶复配控制纸浆树脂障碍并未实现工厂化的应用,主要原因如下:1)该技术开发的研究内容多、难度大、需要时间;2)随着原料的种类、产地、贮存时间、制浆方法、漂白方法等不同,各种纸浆中树脂的组成差别很大;3)纸浆中树脂的成分复杂,这些成分分别采用什么酶处理比较合适、用哪些酶复配等问题还需要进行大量的研究;4)该领域属于学科交叉,需要生物技术进步来提升酶的性能,并降低应用成本。
3 展望尽管生物酶用于控制树脂障碍具有催化效率高、环境兼容性好等许多优点,并已在生产上得到了应用,如脂肪酶用于控制甘油三酯含量较高的针叶木机械浆的树脂障碍已在生产上取得了良好的效果。由于纸浆中树脂的组成复杂,不同原料和不同制浆方法生产的纸浆中树脂的组成不同;而生物酶催化降解纸浆中树脂具有很强的专一性,同时这些生化反应研究的难度大,因此,目前生物酶控制纸浆树脂技术开发还存在很多亟待解决的问题,比如对于树脂主要成分不同的其他原料、其他浆种的树脂控制则需要根据其树脂的成分不同进一步研究脂肪酶和其他酶的复配;甾醇酯酶可水解阔叶木浆中含量较高的甾醇酯,但其水解产物仍然具有较强的黏性,如何将水解产物进一步降解仍有待解决;漆酶能够氧化纸浆树脂中不饱和脂类物质,而且天然介体的开发为其控制树脂障碍的产业化应用创造了良好的条件,但漆酶的生产成本较高。随着这些问题的逐步解决,用生物酶控制纸浆中树脂障碍和胶粘物的技术将不断完善,并在制浆造纸工业中得到更多的推广应用。
| [1] |
Hu KX. Pitch control technology and its application in pulp.
Hunan Papermak, 2004(3): 9–12.
(in Chinese). 胡可信. 纸浆中的树脂障碍及其控制技术与应用. 湖南造纸, 2004(3): 9-12. DOI:10.3969/j.issn.1672-3066.2004.03.003 |
| [2] |
Li SS. The application of biological enzyme in pitch control.
China Pulp Paper Ind, 2003, 24(7): 32–34.
(in Chinese). 李胜树. 生物酶树脂控制的实践. 中华纸业, 2003, 24(7): 32-34. DOI:10.3969/j.issn.1007-9211.2003.07.009 |
| [3] | Bajpai P. Application of enzymes in the pulp and paper industry. Biotechnol Prog, 1999, 15(2): 147–157. DOI: 10.1021/bp990013k |
| [4] | Qin MH, Hannuksela T, Holmbom B. Physico-chemical characterisation of TMP resin and related model mixtures. Colloids Surf A: Physicochem Eng Aspects, 2003, 221(1/3): 243–254. |
| [5] | Koljonen K, sterberg M, Kleen M, et al. Precipitation of lignin and extractives on kraft pulp: effect on surface chemistry, surface morphology and paper strength. Cellulose, 2004, 11(2): 209–224. |
| [6] | B r s L, Gatenholm P. Surface composition and morphology of CTMP fibers. Holzforschung, 1999, 53(2): 188–194. |
| [7] | Gutiérrez A, Del Río JC, Martı́nez MJ, et al. The biotechnological control of pitch in paper pulp manufacturing. Trends Biotechnol, 2001, 19(9): 340–348. DOI: 10.1016/S0167-7799(01)01705-X |
| [8] | Gutiérrez A, Del Río JC, González-Vila FJ, et al. Chemical composition of lipophilic extractives from Eucalyptus globulus Labill. wood. Holzforschung, 1999, 53(5): 481–486. |
| [9] | Freire CSR, Silvestre AJD, Neto CP. Lipophilic extractives in Eucalyptus globulus kraft pulps. Behavior during ECF bleaching. J Wood Chem Technol, 2005, 25(1/2): 67–80. |
| [10] | Del Río JC, Romero J, Gutiérrez A. Analysis of pitch deposits produced in kraft pulp mills using a totally chlorine free bleaching sequence. J Chromatogr A, 2000, 874(2): 235–245. DOI: 10.1016/S0021-9673(00)00111-4 |
| [11] | Gutiérrez A, Romero J, Del Río JC. Lipophilic extractives from Eucalyptus globulus pulp during kraft cooking followed by TCF and ECF bleaching. Holzforschung, 2001, 55(3): 260–264. |
| [12] | Freire CSR, Silvestre AJD, Neto CP, et al. Effect of oxygen, ozone and hydrogen peroxide bleaching stages on the contents and composition of extractives of Eucalyptus globulus kraft pulps. Bioresour Technol, 2006, 97(3): 420–428. DOI: 10.1016/j.biortech.2005.03.006 |
| [13] | Ramnath L, Sithole B, Govinden R. Classification of lipolytic enzymes and their biotechnological applications in the pulping industry. Can J Microbiol, 2016, 63(3): 179–192. |
| [14] | Gupta R, Gupta N, Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties. Appl Microbiol Biotechnol, 2004, 64(6): 763–781. DOI: 10.1007/s00253-004-1568-8 |
| [15] | Mendes AA, Oliveira PC, de Castro HF. Properties and biotechnological applications of porcine pancreatic lipase. J Mol Catal B: Enzym, 2012, 78: 119–134. DOI: 10.1016/j.molcatb.2012.03.004 |
| [16] |
Liu YX. Hydrolysis reaction of soybean oil catalyzed by lipase in ultrasonic irradiation[D]. Wuxi: Jiangnan University, 2008 (in Chinese). 刘亚轩.超声作用下脂肪酶催化豆油水解反应的研究[D].无锡: 江南大学, 2008. |
| [17] | Fleet C, Breuil C. High concentrations of fatty acids affect the lipase treatment of softwood thermomechanical pulps. Appl Microbiol Biotechnol, 1998, 49(5): 517–522. DOI: 10.1007/s002530051207 |
| [18] | Shu ZY, Wu JG, Chen D, et al. Optimization of Burkholderia sp. ZYB002 lipase production for pitch control in thermomechanical pulping (TMP) processes. Holzforschung, 2012, 66(3): 341–348. |
| [19] |
Wang SL, Hu HR. Separation and analysis of the pitch components from thermo-mechanical pulp.
Trans China Pulp Paper, 2008, 23(1): 18–20.
(in Chinese). 王松林, 胡惠仁. 机械浆中树脂类物质脂肪酶处理的变化. 中国造纸学报, 2008, 23(1): 18-20. DOI:10.3321/j.issn:1000-6842.2008.01.004 |
| [20] |
Shan X. Biological modification of lipophilic resin and the mechanistic study on biological treatment on DCS in white water[D]. Tianjin: Tianjin University of Science & Technology, 2009. 单旭.亲油性树脂的生物改性及白水中DCS生物控制的机理研究[D].天津: 天津科技大学, 2009. |
| [21] | Fujita Y, Awaji H, Taneda H, et al. Recent advances in enzymatic pitch control. Tappi J, 1992, 75(4): 117–122. |
| [22] |
Chen XX. The mechanism and practice of pitch control with enzyme.
World Pulp Paper, 2001, 20(2): 17–19.
(in Chinese). 陈秀霞. 生物酶控制树脂的机理与实践. 国际造纸, 2001, 20(2): 17-19. |
| [23] |
Xu LL, Lin L, Chen P, et al. Pitch control of TMP of Masson pine by lipase combining with surfactant.
Trans China Pulp Paper, 2007, 22(1): 28–31.
(in Chinese). 徐丽丽, 林鹿, 陈鹏, 等. 脂肪酶结合表面活性剂控制树脂障碍. 中国造纸学报, 2007, 22(1): 28-31. DOI:10.3321/j.issn:1000-6842.2007.01.007 |
| [24] | Dubé E, Shareck F, Hurtubise Y, et al. Enzyme-based approaches for pitch control in thermomechanical pulping of softwood and pitch removal in process water. J Chem Technol Biotechnol, 2008, 83(9): 1261–1266. DOI: 10.1002/jctb.v83:9 |
| [25] |
Wan HG, Zhao ZS, Jiang DH, et al. The application research of microbial whole cell catalysis techniques.
J Anhui Agric Sci, 2011, 39(4): 1917–1919.
(in Chinese). 万红贵, 赵宗松, 蒋导航, 等. 微生物全细胞催化技术在工业生产中的应用. 安徽农业科学, 2011, 39(4): 1917-1919. DOI:10.3969/j.issn.0517-6611.2011.04.012 |
| [26] |
Gui LL. Treatment of whitewater in papermaking with whole-cells biocatalysts Aspergillus oryzae and Aspergillus niger[D]. Guangzhou: South China University of Technology, 2016 (in Chinese). 眭梁梁.米曲霉/黑曲霉全细胞催化剂在造纸白水处理中的应用研究[D].广州: 华南理工大学, 2016. |
| [27] |
Ren NN, Wang XH, Chi NY, et al. Research advance in sterol esterase from microorganisms.
China Brewing, 2017, 36(6): 9–13.
(in Chinese). 任楠楠, 王晓辉, 迟乃玉, 等. 微生物甾醇酯酶的研究进展. 中国酿造, 2017, 36(6): 9-13. |
| [28] | Kontkanen H, Tenkanen M, Reinikainen T. Purification and characterisation of a novel steryl esterase from Melanocarpus albomyces. Enzyme Microb Technol, 2006, 39(2): 265–273. DOI: 10.1016/j.enzmictec.2005.10.013 |
| [29] |
Zeng C. Screening of sterol esterase-producing strain and study on its enzymatic properties[D]. Nanjing: Nanjing Forestry University, 2012 (in Chinese). 曾诚.甾醇酯酶产生菌的筛选、鉴定及酶学性质研究[D].南京: 南京林业大学, 2012. |
| [30] | Calero-Rueda O, Gutiérrez A, Del Río JC, et al. Hydrolysis of sterol esters by an esterase from Ophiostoma piceae: application to pitch control in pulping of Eucalyptus globulus wood. Int J Biotechnol, 2004, 6(4): 367–375. DOI: 10.1504/IJBT.2004.005519 |
| [31] | Kontkanen H, Tenkanen M, Fagerstr m R, et al. Characterisation of steryl esterase activities in commercial lipase preparations. J Biotechnol, 2004, 108(1): 51–59. DOI: 10.1016/j.jbiotec.2003.11.003 |
| [32] | Kontkanen H, Saloheimo M, Pere J, et al. Characterization of Melanocarpus albomyces steryl esterase produced in Trichoderma reesei and modification of fibre products with the enzyme. Appl Microbiol Biotechnol, 2006, 72(4): 696–704. DOI: 10.1007/s00253-006-0321-x |
| [33] | Calero-Rueda O, Gutiérrez A, Del Río JC, et al. Isolation of an Ophiostoma piceae esterase: effect on sterol ester and triglycerides involved in pitch deposition. Int Conf Biotechnol Pulp Pap Ind, 2001, 8: 187–188. |
| [34] | Kudanga T, Nyanhongo GS, Guebitz GM, et al. Potential applications of laccase-mediated coupling and grafting reactions: a review. Enzyme Microb Technol, 2011, 48(3): 195–208. DOI: 10.1016/j.enzmictec.2010.11.007 |
| [35] |
Tao GX, Li AX, Luo L, et al. Advances in research on mediators in laccase-mediator system and their application.
J Prev Med Chin PLA, 2017, 35(1): 65–68.
(in Chinese). 陶国翔, 李爱秀, 罗力, 等. 漆酶-介质体系中介质的研究进展及应用. 解放军预防医学杂志, 2017, 35(1): 65-68. |
| [36] | Christopher LP, Yao B, Ji Y. Lignin biodegradation with laccase-mediator systems. Front Energy Res, 2014, 2(12): 1–13. |
| [37] | Molina S, Rencoret J, Del Río JC, et al. Oxidative degradation of model lipids representative for main paper pulp lipophilic extractives by the laccase-mediator system. Appl Microbiol Biotechnol, 2008, 80(2): 211–222. DOI: 10.1007/s00253-008-1547-6 |
| [38] | Valls C, Molina S, Vidal T, et al. Influence of operation conditions on laccase-mediator removal of sterols from eucalypt pulp. Process Biochem, 2009, 44(9): 1032–1038. DOI: 10.1016/j.procbio.2009.05.002 |
| [39] |
Miao QX, Chen LH, Huang LL, et al. Treatment of dissolved and colloidal substances in aspen BCTMP with laccase and laccase/violuric acid.
J Northeast Forest Univ, 2013, 41(11): 86–89.
(in Chinese). 苗庆显, 陈礼辉, 黄六莲, 等. 漆酶和漆酶/介体处理杨木BCTMP中溶解与胶体物质. 东北林业大学学报, 2013, 41(11): 86-89. DOI:10.3969/j.issn.1000-5382.2013.11.021 |
| [40] | Babot ED, Rico A, Rencoret J, et al. Towards industrially-feasible delignification and pitch removal by treating paper pulp with Myceliophthora thermophila laccase and a phenolic mediator. Bioresour Technol, 2011, 102(12): 6717–6722. DOI: 10.1016/j.biortech.2011.03.100 |
| [41] | Gutiérrez A, Rencoret J, Ibarra D, et al. Removal of lipophilic extractives from paper pulp by laccase and lignin-derived phenols as natural mediators. Environ Sci Technol, 2007, 41(11): 4124–4129. DOI: 10.1021/es062723+ |
| [42] |
Qu QL, Fu MR, Dai HF. Research progress of effect of lipoxygenase (LOX) on fatty acid oxidation.
Food Res Dev, 2015, 36(10): 137–142.
(in Chinese). 曲清莉, 傅茂润, 代红飞. 脂氧合酶(LOX)在脂肪酸氧化中的作用研究进展. 食品研究与开发, 2015, 36(10): 137-142. DOI:10.3969/j.issn.1005-6521.2015.10.037 |
| [43] | Zhang X, Nguyen D, Paice MG, et al. Degradation of wood extractives in thermo-mechanical pulp by soybean lipoxygenase. Enzyme Microb Technol, 2007, 40(4): 866–873. DOI: 10.1016/j.enzmictec.2006.06.021 |
| [44] | Tayeb AH, Sadeghifar H, Hubbe MA, et al. Lipoxygenase-mediated peroxidation of model plant extractives. Ind Crop Prod, 2017, 104: 253–262. DOI: 10.1016/j.indcrop.2017.04.041 |
| [45] | Marques G, Molina S, Babot ED, et al. Exploring the potential of fungal manganese-containing lipoxygenase for pitch control and pulp delignification. Bioresour Technol, 2011, 102(2): 1338–1343. DOI: 10.1016/j.biortech.2010.08.112 |
| [46] | Lei XC, Lin L, Li KC. Effect of xylanase pretreatment of wood chips on fiber separation in CTMP refining process. Bioresources, 2008, 3(3): 801–815. |
 2019, Vol. 35
2019, Vol. 35