中国科学院微生物研究所、中国微生物学会主办
文章信息
- 卞化, 孙新晓, 袁其朋
- Bian Hua, Sun Xinxiao, Yuan Qipeng
- 代谢工程改造异养微生物固定CO2研究进展
- Advances in metabolic engineering of heterotrophic microorganisms for CO2 fixation: a review
- 生物工程学报, 2019, 35(2): 195-203
- Chinese Journal of Biotechnology, 2019, 35(2): 195-203
- 10.13345/j.cjb.180267
-
文章历史
- Received: June 29, 2018
- Accepted: September 11, 2018
温室气体排放造成的全球气候变化是人类面临的巨大挑战。为了缓解这一趋势,需要大幅度减少化石燃料的消耗,并且开发替代能源技术[1]。将CO2转化为燃料或化学品,是CO2资源化利用的途径之一。在过去几年中,研究者们通过工程自养微生物如蓝细菌和藻类,利用光能固定CO2合成乙醇[2-4]、正丁醇[5-8]、丙酮[9]、异丁醛[5]、乳酸[10-12]、异戊二烯[13]、1, 2-丙二醇[14]、甲烷[15]和生物柴油[16-17]等化学品。除了光能之外,自养微生物还可以在温和条件下使用氢气或硫磺作为CO2同化的能源[18]。
自然界已发现的天然固碳途径主要有6条,包括卡尔文(CBB)循环、3-羟基丙酸双循环、Wood-Ljungdahl (WL)途径、还原性(逆向) TCA循环、二羧酸/4-羟基丁酸循环和3-羟基丙酸/4-羟基丁酸循环。天然固碳的主要限制在于途径自身的代谢速率较低,以及需要较高的能量供给。研究者通过表达关键酶或重构固碳途径提高固碳速率。关于CO2固定途径及其关键酶以及利用自养微生物固定CO2已有相关综述进行了系统总结[19-20]。
在异氧微生物中构建高效稳定的CO2固定途径成为最近的研究热点,旨在提高燃料或化学品的产量及得率。另外,为了提高CO2固定的总体效率,研究者还探索了不依赖于1, 5-二磷酸核酮糖羧化酶(RuBisCO)的CO2固定途径,设计构建与电催化结合的生物合成途径来协同改善CO2固定。因此,本文对近年来改造异养微生物(如大肠杆菌或酿酒酵母)固定CO2生产燃料及化学品的研究进展进行了总结。
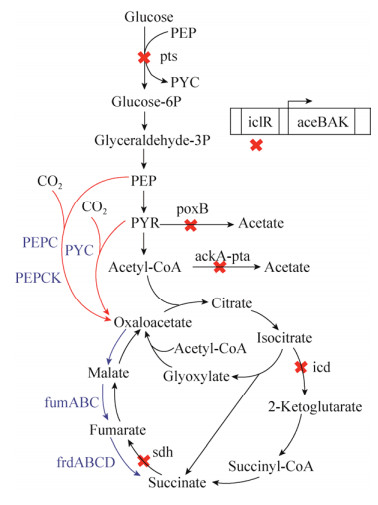
1 CO2固定合成化学品 1.1 CO2固定应用于琥珀酸生产琥珀酸及其衍生物广泛用于食品、化妆品和制药领域[21]。美国能源部将其确定为可从生物质中大量生产的12种高附加值化学品之一[22]。由于石油化学工艺生产琥珀酸会导致严重污染,研究者通过代谢工程改造提高生物法琥珀酸的产量。采取的策略包括消除竞争途径[23-25]、破坏磷酸转移酶系统(PTS)以增加磷酸烯醇式丙酮酸(PEP)供应[26-27]、激活乙醛酸途径[28-29],并结合定向进化改善琥珀酸生产[30-32]。其中,通过表达磷酸烯醇式丙酮酸羧化酶(PEPC)、磷酸烯醇式丙酮酸羧激酶(PEPCK)或者丙酮酸羧化酶(PYC)固定CO2合成草酰乙酸是提高琥珀酸的产量和得率的关键步骤[25, 27, 31, 33](图 1)。
|
| 图 1 有氧、厌氧以及双相发酵条件下大肠杆菌生产琥珀酸的代谢工程策略 Fig. 1 Metabolic engineering strategies for succinic acid production by Escherichia coli under aerobic, anaerobic and biphasic fermentation conditions. The red arrows represent CO2 fixation steps |
| |
PEPC广泛存在于光合生物如植物、藻类、蓝细菌、光合细菌以及许多非光合细菌中。PEPC催化PEP和CO2生成草酰乙酸和无机磷酸。PEPC催化的反应为细胞各种组分的生物合成提供四碳二羧酸,参与维持柠檬酸循环,在初级代谢中有重要的补给作用,在光合作用中是催化大气中CO2固定的第一步反应,是C4植物光合作用途径中最重要的酶之一[34]。PYC广泛存在于动物、霉菌和酵母中,而植物和大部分细菌不含有该酶。它催化丙酮酸和CO2生成草酰乙酸和无机磷酸,在三羧酸循环中是供给草酰乙酸的主要反应。PEPCK广泛存在于动植物和细菌中,可催化PEP和CO2生成草酰乙酸并产生1分子ATP。
琥珀酸是TCA循环的中间体,在有氧条件下积累量很低。为了实现有氧条件琥珀酸的生产,对其生产途径进行了改造。琥珀酸可经乙醛酸旁路和TCA氧化分支两条途径生成,最大理论产量为1 mol/mol葡萄糖。敲除葡萄糖磷酸转移酶基因(ptsG)缺失PTS系统,失活丙酮酸氧化酶基因(poxB)和乙酸激酶-磷酸转乙酰化酶基因(ackA-pta)缺失副产物乙酸生成途径,灭活aceBAK操纵子抑制子基因(iclR),敲除异柠檬酸脱氢酶基因(icd)激活乙醛酸旁路,敲除琥珀酸脱氢酶基因(sdh),并在大肠杆菌中过表达来自高粱的PEPC,琥珀酸得率达到0.94 mol/mol葡萄糖[35]。在谷氨酸棒杆菌中过表达内源PEPC和PYC,琥珀酸比生产率达到1.60 mmol/(g·cdw·h)[36]。
在厌氧条件下,如果不提供外源电子,琥珀酸最大理论产量为1.714 mol/mol葡萄糖[21, 33]。与有氧条件不同的是,琥珀酸主要经逆向TCA循环生成。对菌株进行与有氧发酵条件类似的改造,在大肠杆菌中过表达枯草芽孢杆菌的PYC基因,琥珀酸得率达到1.29 mol/mol葡萄糖[37];为了进一步提高琥珀酸产量,将更多的碳定向到磷酸戊糖途径以及消除竞争途径后,引入产琥珀酸放线杆菌Actinobacillus succinogenes的PEPCK基因和谷氨酸棒杆菌的PYC基因,最终琥珀酸产量高达1.54 mol/mol葡萄糖,达到最大理论产量的90%[38]。值得一提的是,PEPCK固定CO2的同时生成ATP,ATP的增加导致更高的生物量和琥珀酸产量[39]。
无氧条件下细胞生长相对缓慢,为此研究者采用“双相”发酵,即先在有氧条件下积累足够的生物量,再转换到厌氧条件下生产琥珀酸。在大肠杆菌中“双相”发酵时,缺失乳酸、甲酸等副产物竞争途径和PTS系统,失活丙酮酸羧化酶,当过表达来自A. succinogenes的PEPCK,琥珀酸的产量比未表达PEPCK的对照菌株提高60%[25]。为了最小化副产物甲酸的产量,缺失副产物途径后在大肠杆菌中导入博伊斯假丝酵母Candida boidinii的NAD+依赖性甲酸脱氢酶基因(fdh1)增加NADH的供应,并激活乙醛酸途径,过表达乳酸乳球菌Lactococcus lactis PYC,在补料分批发酵的条件下,琥珀酸生产力达到2 g/(L·h)[40]。
通过基因工程手段引入关键酶或外源途径重构CO2固定途径,在大肠杆菌或谷氨酸棒状杆菌中过表达PYC、PEPC或PEPCK,使目标产物琥珀酸的产量在有氧、无氧或是“双相”的发酵条件下都有显著提高,显示出CO2固定在琥珀酸生产上的巨大潜力。
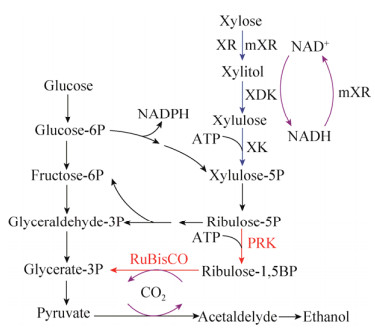
1.2 CO2固定应用于乙醇生产为了限制化石燃料的燃烧,减少温室气体的排放,人们已开始使用生物燃料作为替代能源[41]。生物乙醇是目前在工业规模生产和使用最广泛的生物燃料[42-43]。酿酒酵母是生物乙醇生产的最常用宿主。然而,在酵母发酵产乙醇的过程中,生成1分子乙醇的同时释放1分子CO2,造成碳损失及温室气体排放。另外,过量NADH导致副产物甘油大量积累。研究者将异源的磷酸核酮糖激酶(PRK)和RuBisCO导入酿酒酵母中构建CBB循环固定CO2,提高了乙醇产量并减少了副产物甘油积累[1, 44-45] (图 2)。
|
| 图 2 CO2固定提高酿酒酵母乙醇得率 Fig. 2 Improve S. cerevisiae ethanol yield through CO2 fixation. The red arrows represents the heterologous carbon fixation pathway |
| |
PRK催化5-磷酸核酮糖(R5P)转化为1, 5-二磷酸核酮糖(RuBP)作为RuBisCO固定CO2的底物。RuBisCO广泛存在于真核生物如植物和原核生物中,在光合生物中,RuBisCO是同化大气CO2到生物圈的主要酶[46]。该酶催化光合作用CO2固定的第一步反应,使CO2和RuBP转变成2个分子的3-磷酸甘油酸,是碳同化的限速酶。
研究者在酿酒酵母中共表达了菠菜的PRK和脱氮假单胞菌Thiobacillus denitrificans的RuBisCO。T. denitrificans RuBisCO由8个大亚基组成,属于Ⅱ型,其活性表达需要大肠杆菌伴侣蛋白GroEL和GroES的辅助。通过固定代谢途径中产生的CO2生成3-磷酸甘油酸,进而增加了乙醇产量。在含有葡萄糖和半乳糖的培养基上,与原始菌株相比,PRK和RuBisCO的共表达使副产物甘油减少90%,乙醇产量增加10%[44]。使用甘蔗和玉米淀粉为原料生产乙醇存在“与人争粮”的问题[47]。为此研究者使用木质纤维素水解生成的木糖为原料,在酿酒酵母中构建异源木糖途径即木糖还原酶(XR)/木糖醇脱氢酶(XDH)途径[48],使酿酒酵母能够以木糖为碳源产乙醇,并引入菠菜的PRK和深红红螺菌Rhodospirillum rubrum的RuBisCO实现CO2的固定。R. rubrum中RuBisCO也由8个大亚基组成,属于Ⅱ型,其活性表达同样需要大肠杆菌分子伴侣的辅助。实验结果表明工程酵母净乙醇产量增加,副产物减少,且生成单位乙醇的CO2释放量减少,证明固定途径的引入实现了CO2的再循环[1]。
此外,研究者还将PRK-RuBisCO模块与木糖还原酶-木糖醇脱氢酶(mXR-XDH)模块构建到酿酒酵母中,利用木糖和麦芽糖共同发酵产乙醇。在酿酒酵母中共表达真氧产碱杆菌Ralstonia eutropha H16的PRK和RuBisCO[49]。R. eutropha H16 RuBisCO由8个大亚基和8个小亚基组成,属于Ⅰ型。为了确保其活性,共表达了酿酒酵母的内源性伴侣(Hsp60-HSP10)。结果显示,乙醇的生产率比对照菌株即未构建CO2固定系统的菌株高出15%,且CO2固定速率达到336.6–436.3 mg CO2/(L·h),显著高于以往的天然或工程微生物(5.8–147.0 mg CO2/(L·h))。值得一提的是,实验证明,Ⅰ型RuBisCO的羧化活性高于Ⅱ型,可能是由于小亚基具有富集CO2的能力,提高了酶分子周围CO2的浓度[45]。
在这几项研究中,通过在酿酒酵母引入RuBisCO和PRK,实现生物乙醇生产过程中CO2的原位固定,提高目标产物乙醇的产量,为利用木质纤维素生产其他燃料及化学品奠定了基础。
1.3 构建非氧化糖酵解途径实现完全碳转化糖酵解途径是存在于几乎所有生物中的基础代谢途径。然而,天然糖酵解途径(EMP)产生1分子乙酰辅酶A的同时释放1分子CO2,导致理论碳收率仅有66.7%。为此,研究者设计构建了一条环形非氧化糖酵解(NOG)途径(图 3)。该途径中,磷酸转酮酶将3分子6-磷酸果糖(F6P)分解成3分子乙酰磷酸(AcP)和3分子4-磷酸赤藓糖(E4P)。3分子E4P通过碳重排重新生成2分子F6P。净反应是1分子F6P生成3分子AcP而没有碳损失。过表达磷酸酮醇酶(Fpk/Xpk),删除琥珀酸、乳酸、乙醇、甲酸等竞争途径,得到的工程大肠杆菌菌株发酵木糖产乙酸的得率达到2.2 mol/mol,接近理论最大得率(2.5 mol/mol),超过木糖由EMP途径生成乙酸的最大理论值(1.67 mol/mol)[50]。
然而,NOG循环自身不能支持细胞在以糖为唯一碳源的最小培养基中生长,需要EMP途径的辅助以产生丙酮酸及其他合成代谢前体。为克服该挑战,研究者进一步构建了不使用EMP进行糖分解代谢的大肠杆菌菌株。构建的菌株包含11个基因过表达,10个基因缺失,并通过定向进化得到超过50个基因突变(包括3个整体调节因子)。该菌株可在葡萄糖基本培养基中有氧生长,并且厌氧发酵葡萄糖产乙酸的碳转化率接近100%[51]。
1.4 应用Wood-Ljungdahl途径提高碳转化率除了利用上述NOG途径实现碳的完全转化外,研究者还将糖酵解途径与WL途径相结合,进行混合营养发酵,也可实现糖到乙酰辅酶A的化学计量转化。
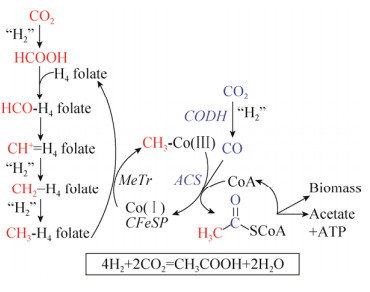
WL途径也称还原性乙酰辅酶A途径,主要存在于厌氧的产乙酸菌及产甲烷菌中。与其他环形固碳途径不同,该途径可将2分子CO2直接还原生成1分子乙酸(图 4)。由于途径的两个关键酶CO脱氢酶(CODH)和乙酰辅酶A合成酶(ACS)的极度氧敏感性,该途径需在严格厌氧条件下进行。与其他固碳途径相比,WL途径对ATP的需求较低且消耗NADH的量恰好等于糖酵解途径产生的NADH的量。因此,通过WLP驱动的混合营养发酵,1分子的己糖可以产生3分子乙酰辅酶A及1分子ATP。作为概念验证,改造永达尔梭菌Clostridium ljungdahlii产丙酮的得率为先前最大理论得率的138%。此外,当提供足够的还原力(即H2)时,发酵过程可不排放CO2[52]。
|
| 图 4 Wood-Ljungdahl途径 Fig. 4 The Wood-Ljungdahl pathway |
| |
能否通过进化改造实现异养微生物直接由CO2合成生物质?最近的一项研究表明,经过合理代谢网络改造、异源重组表达和实验室进化,重构完整功能的CBB循环可以实现大肠杆菌利用CO2合成糖和其他生物质成分。通过引入来自聚球藻Synechococcus sp. PCC7002的RuBisCO和S. elongatus PCC7942的PRK[53],并删除磷酸甘油变位酶基因来切断糖异生,将中枢代谢分成两个独立的子网络。网络一包含上游糖酵解、磷酸戊糖途径和重组CBB循环酶(RuBisCO和PRK);网络二是含有下游糖酵解和TCA循环的能量模块,为模块一的碳固定提供ATP和还原力。
虽然初始菌株不能以丙酮酸为唯一碳源生长,但是在木糖限制的恒化器中培养,进化后的菌株能够在高CO2的浓度下,仅以丙酮酸为碳源生长。进一步质谱分析表明,CO2是进化菌株中糖合成的唯一碳源,证明了在大肠杆菌中完整功能的CBB循环能直接从CO2合成糖。经过全基因组测序,prs基因(编码核糖磷酸焦磷酸激酶)是3次恒化实验中出现的唯一的共同突变基因。该酶是CBB循环模块的主要分支酶。该研究表明CBB循环的功能性不仅取决于异源酶RuBisCO和PRK,而且取决于与其相互作用的内源组分,主要是循环碳库中的生物合成酶[54]。
通过合理的代谢网络设计,在大肠杆菌中实现了完全功能和自催化的碳固定循环,能够在没有向循环中输入有机碳的情况下合成己糖、戊糖和丙糖。所有糖类都是由CO2和所需的辅因子合成。合理的代谢设计和实验室进化两者之间的协同作用,有助于优化代谢网络,推动可持续性能源的发展。
2 电化学在CO2固定上的应用目前,受到关键酶活性的限制,生物固碳的总体效率仍然较低[55-56]。为此,研究者尝试开发了电生化混合系统,较传统生物系统可能具有更高的效率。
研究者开发了一种将电能储存为高级醇化学能的方法,高级醇可以用作液体运输燃料。通过基因工程改造了一种石油自养微生物R. eutropha H16,在使用CO2作为唯一碳源和电作为唯一能量输入的电生物反应器中生产高级醇。电力驱动阴极上的CO2还原成甲酸,甲酸被R. eutropha H16转化为异丁醇和3-甲基-1-丁醇。该工艺整合了CO2固定、电化学甲酸生产以及高级醇合成,为电驱动CO2转化成商业化学品开创了可能性[57]。虽然这项工作证明了电化学固定CO2的可行性,但是由于缺乏对宿主生物的充分认识,且生产过程中产生过氧化氢影响细胞生长,限制了该系统的持续改进。
为了避免上述问题,研究者选择大肠杆菌作为电生化混合生产系统的宿主,因为其具有无氧代谢能力并拥有许多生产所需的酶[58]。类似地,首先使用电催化将CO2还原成甲酸,并在大肠杆菌中重构CO2和甲酸固定途径,通过甘氨酸和L-丝氨酸将两个甲酸和一个CO2转化为一个丙酮酸。结果表明,使用CO2和电可支持大肠杆菌的生长。该系统的产物是一种中心代谢物,因此几乎可以与所有的生化途径相连接,由CO2和电产生各种化合物,显示出良好的应用前景。
3 展望CO2固定在化学品和燃料生产上的应用越来越广泛。为了提高目标产物的产量,对天然CO2固定途径的改造研究日益增多,主要集中于CBB循环,尤其是对关键酶RuBisCO的改造方面[19]。RuBisCO在自然界中含量丰富,是植物中可溶性蛋白含量最多的酶,是调节植物的光合作用和光呼吸的双功能酶。因此,对该酶的研究具有重要的理论及实际应用价值。进一步提高RuBisCO本身的活性难度较高。为此,一方面可以筛选不同来源的RuBisCO,获得活性较高的酶;另一方面作为RuBisCO的低羧化活性的补偿,一些自养微生物通过形成物理屏障(例如,蓝细菌中的半渗透性羧基体和C4植物中的束鞘细胞)以浓缩CO2,提高其在RuBisCO周围的浓度。受此启发,未来可将CO2和CO2固定酶限制在亚细胞空间中(例如,在大肠杆菌中重建羧基体)或者利用蛋白质或RNA支架实现CO2产生酶和固定酶的共定位,有望进一步提高CO2固定效率。通过外部补充CO2的实验也证明,增加CO2浓度也会带来有益的效果[44],因此可以通过表达多相性碳酸酐酶(CA)[53],其催化CO2和HCO3−的可逆转化,进一步优化RuBisCO的羧化效率。
CO2性质稳定,不易活化,从无机碳固定到有机碳的过程中需要消耗大量的能量。天然生物固碳的效率目前不能满足工业化的要求。生物固碳能量消耗高、固定效率低,设计低耗高效的固碳途径是未来的研究方向。合理的代谢设计和实验室进化有望创造出更稳定的固碳途径。
改造异养微生物固定CO2最大的挑战是如何真正实现从“异养”到“自养”。目前的研究要么是利用有机碳源代谢过程中释放的CO2,要么是需要在利用CO2时补充有机碳源作为能量,均未实现真正意义上的“自养固碳”。因此,在大肠杆菌或酿酒酵母等异养微生物体内重构来自于自养菌的代谢体系是未来极具挑战性的工作。
电生化合成系统与传统的生物合成相比具有一定的优势,相比于CBB循环更容易改进,并且在热力学上是有利的。最重要的是,因为不涉及到对氧敏感的酶,在有氧或无氧的条件下均能进行。混合电生化系统将有助于解决可再生能源高效生产的问题。然而,该系统也存在反应界面有限、装置不易放大等不足,是未来实现工业应用需要解决的问题。
| [1] | Xia PF, Zhang GC, Walker B, et al. Recycling carbon dioxide during xylose fermentation by engineered Saccharomyces cerevisiae. ACS Synth Biol, 2016, 6(2): 276–283. |
| [2] | Dexter J, Fu PC. Metabolic engineering of cyanobacteria for ethanol production. Energy Environ Sci, 2009, 2(8): 857–864. DOI: 10.1039/b811937f |
| [3] | Deng MD, Coleman JR. Ethanol synthesis by genetic engineering in Cyanobacteria. Appl Environ Microbiol, 1999, 65(2): 523–528. |
| [4] | Luo DX, Hu ZS, Choi DG, et al. Life cycle energy and greenhouse gas emissions for an ethanol production process based on blue-green algae. Environ Sci Technol, 2010, 44(22): 8670–8677. DOI: 10.1021/es1007577 |
| [5] | Atsumi S, Higashide W, Liao JC. Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde. Nat Biotechnol, 2009, 27(12): 1177–1180. DOI: 10.1038/nbt.1586 |
| [6] | Lan EI, Liao JC. Metabolic engineering of cyanobacteria for 1-butanol production from carbon dioxide. Metab Eng, 2011, 13(4): 353–363. |
| [7] | Lan EI, Liao JC. ATP drives direct photosynthetic production of 1-butanol in cyanobacteria. Proc Natl Acad Sci USA, 2012, 109(16): 6018–6023. DOI: 10.1073/pnas.1200074109 |
| [8] | Li H, Opgenorth PH, Wernick DG, et al. Integrated electromicrobial conversion of CO2 to higher alcohols. Science, 2012, 335(6076): 1596. DOI: 10.1126/science.1217643 |
| [9] | Zhou J, Zhang HF, Zhang YP, et al. Designing and creating a modularized synthetic pathway in cyanobacterium Synechocystis enables production of acetone from carbon dioxide. Metab Eng, 2012, 14(4): 394–400. |
| [10] | Niederholtmeye H, Wolfst dter BT, Savage DF, et al. Engineering cyanobacteria to synthesize and export hydrophilic products. Appl Environ Microbiol, 2010, 76(11): 3462–3466. DOI: 10.1128/AEM.00202-10 |
| [11] | Angermayr SA, Paszota M, Hellingwerf KJ. Engineering a cyanobacterial cell factory for production of lactic Acid. Appl Environ Microbiol, 2012, 78(19): 7098–7106. DOI: 10.1128/AEM.01587-12 |
| [12] | Joseph A, Aikawa S, Sasaki K, et al. Utilization of lactic acid bacterial genes in Synechocystis sp. PCC 6803 in the production of lactic acid. Biosci Biotechnol Biochem, 2013, 77(5): 966–970. DOI: 10.1271/bbb.120921 |
| [13] | Bentley FK, Melis A. Diffusion-based process for carbon dioxide uptake and isoprene emission in gaseous/aqueous two-phase photobioreactors by photosynthetic microorganisms. Biotechnol Bioeng, 2012, 109(1): 100–109. DOI: 10.1002/bit.v109.1 |
| [14] | Li H, Liao JC. Engineering a cyanobacterium as the catalyst for the photosynthetic conversion of CO2 to 1, 2-propanediol. Microb Cell Fact, 2013, 12(1): 4. DOI: 10.1186/1475-2859-12-4 |
| [15] | Günther A, Jakob T, Goss R, et al. Methane production from glycolate excreting algae as a new concept in the production of biofuels. Bioresour Technol, 2012, 121: 454–457. DOI: 10.1016/j.biortech.2012.06.120 |
| [16] | Deng XD, Li YJ, Fei XW. Microalgae: a promising feedstock for biodiesel. African J Microbiol Res, 2009, 3(13): 1008–1014. |
| [17] | Tang HY, Abunasser N, Garcia MED, et al. Potential of microalgae oil from Dunaliella tertiolecta as a feedstock for biodiesel. Appl Energy, 2011, 88(10): 3324–3330. DOI: 10.1016/j.apenergy.2010.09.013 |
| [18] | Boyle NR, Morgan JA. Computation of metabolic fluxes and efficiencies for biological carbon dioxide fixation. Metab Eng, 2011, 13(2): 150–158. DOI: 10.1016/j.ymben.2011.01.005 |
| [19] |
Gong FY, Cai Z, Li Y. Synthetic biology for CO2 fixation.
Sci China Life Sci, 2015, 45(10): 993–1002.
(in Chinese). 巩伏雨, 蔡真, 李寅. CO2固定的合成生物学. 中国科学:生命科学, 2015, 45(10): 993-1002. |
| [20] |
Ge XZ, Zhao YX, Liu XY, et al. Research advances in biological CO2 fixation pathways and key enzymes.
J Beijing Union Univ, 2013, 27(1): 63–68.
(in Chinese). 葛喜珍, 赵有玺, 刘晓宇, 等. 生物固定CO2代谢途径及关键酶的研究进展. 北京联合大学学报, 2013, 27(1): 63-68. DOI:10.3969/j.issn.1005-0310.2013.01.012 |
| [21] | McKinlay JB, Vieille C, Zeikus JG. Prospects for a bio-based succinate industry. Appl Microbiol Biotechnol, 2007, 76(4): 727–740. DOI: 10.1007/s00253-007-1057-y |
| [22] | Werpy T, Petersen G, Added TV, et al. Top value added chemicals from biomass. Nato Adv Sci Inst, 2004, 1(12): 263–275. |
| [23] | Stols L, Kulkarni G, Harris BG, et al. Expression of Ascaris suum malic enzyme in a mutant Escherichia coli allows production of succinic acid from glucose. Appl Biochem Biotechnol, 1997, 63(1): 153–158. |
| [24] | Jantama K, Haupt MJ, Svoronos SA, et al. Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains of Escherichia coli C that produce succinate and malate. Biotechnol Bioeng, 2008, 99(5): 1140–1153. DOI: 10.1002/(ISSN)1097-0290 |
| [25] | Singh A, Soh KC, Hatzimanikatis V, et al. Manipulating redox and ATP balancing for improved production of succinate in E. coli. Metab Eng, 2011, 13(1): 76–81. |
| [26] | Lu J, Tang JL, Liu Y, et al. Combinatorial modulation of galP and glk gene expression for improved alternative glucose utilization. Appl Microbiol Biotechnol, 2012, 93(6): 2455–2462. DOI: 10.1007/s00253-011-3752-y |
| [27] | Tan ZG, Zhu XN, Chen J, et al. Activating phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase in combination for improvement of succinate production. Appl Environ Microbiol, 2013, 79(16): 4838–4844. DOI: 10.1128/AEM.00826-13 |
| [28] | Sánchez AM, Bennett GN, San KY. Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity. Metab Eng, 2005, 7(3): 229–239. DOI: 10.1016/j.ymben.2005.03.001 |
| [29] | Zhu LW, Li XH, Zhang L, et al. Activation of glyoxylate pathway without the activation of its related gene in succinate-producing engineered Escherichia coli. Metab Eng, 2013, 20: 9–19. DOI: 10.1016/j.ymben.2013.07.004 |
| [30] | Jantama K, Zhang XL, Moore JC, et al. Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C. Biotechnol Bioeng, 2008, 101(5): 881–893. DOI: 10.1002/bit.v101:5 |
| [31] | Zhang XL, Jantama K, Moore JC, et al. Metabolic evolution of energy-conserving pathways for succinate production in Escherichia coli. Proc Natl Acad Sci USA, 2009, 106(48): 20180–20185. DOI: 10.1073/pnas.0905396106 |
| [32] | Zhu XN, Tan ZG, Xu HT, et al. Metabolic evolution of two reducing equivalent-conserving pathways for high-yield succinate production in Escherichia coli. Metab Eng, 2014, 24: 87–96. DOI: 10.1016/j.ymben.2014.05.003 |
| [33] | Vemuri GN, Eiteman MA, Altman E. Effects of growth mode and pyruvate carboxylase on succinic acid production by metabolically engineered strains of Escherichia coli. Appl Environ Microbiol, 2002, 68(4): 1715–1727. DOI: 10.1128/AEM.68.4.1715-1727.2002 |
| [34] | O'Leary MH. Phosphoenolpyruvate carboxylase: an enzymologist's view. Annu Rev Plant Physiol, 1982, 33(1): 297–315. DOI: 10.1146/annurev.pp.33.060182.001501 |
| [35] | Lin H, Bennett GN, San KY. Fed-batch culture of a metabolically engineered Escherichia coli strain designed for high-level succinate production and yield under aerobic conditions. Biotechnol Bioeng, 2005, 90(6): 775–779. DOI: 10.1002/(ISSN)1097-0290 |
| [36] | Litsanov B, Kabus A, Brocker M, et al. Efficient aerobic succinate production from glucose in minimal medium with Corynebacterium glutamicum. Microb Biotechnol, 2012, 5(1): 116–128. |
| [37] | Wang QZ, Chen X, Yang YD, et al. Genome-scale in silico aided metabolic analysis and flux comparisons of Escherichia coli to improve succinate production. Appl Microbiol Biotechnol, 2006, 73(4): 887–894. DOI: 10.1007/s00253-006-0535-y |
| [38] | Meng J, Wang BY, Liu DY, et al. High-yield anaerobic succinate production by strategically regulating multiple metabolic pathways based on stoichiometric maximum in Escherichia coli. Microb Cell Fact, 2016, 15(1): 141. DOI: 10.1186/s12934-016-0536-1 |
| [39] | Feist AM, Henry CS, Reed JL, et al. A genome-scale metabolic reconstruction for Escherichia coli K-12 MG1655 that accounts for 1260 ORFs and thermodynamic information. Mol Syst Biol, 2007, 3(1): 121. |
| [40] | Balzer GJ, Thakker C, Bennett GN, et al. Metabolic engineering of Escherichia coli to minimize byproduct formate and improving succinate productivity through increasing NADH availability by heterologous expression of NAD+-dependent formate dehydrogenase. Metab Eng, 2013, 20: 1–8. DOI: 10.1016/j.ymben.2013.07.005 |
| [41] | Caspeta L, Buijs NAA, Nielsen J. The role of biofuels in the future energy supply. Energy Environ Sci, 2013, 6(4): 1077–1082. DOI: 10.1039/c3ee24403b |
| [42] | Nielsen J, Larsson C, van Maris A, et al. Metabolic engineering of yeast for production of fuels and chemicals. Curr Opin Biotechnol, 2013, 24(3): 398–404. DOI: 10.1016/j.copbio.2013.03.023 |
| [43] | Rabinovitch-Deere CA, Oliver JWK, Rodriguez GM, et al. Synthetic biology and metabolic engineering approaches to produce biofuels. Chem Rev, 2013, 113(7): 4611–4632. DOI: 10.1021/cr300361t |
| [44] | Guadalupe-Medina V, Wisselink HW, Luttik MA, et al. Carbon dioxide fixation by Calvin-Cycle enzymes improves ethanol yield in yeast. Biotechnol Biofuels, 2013, 6(1): 125. |
| [45] | Li YJ, Wang MM, Chen YW, et al. Engineered yeast with a CO2-fixation pathway to improve the bio-ethanol production from xylose-mixed sugars. Sci Rep, 2017, 7(1): 43875. DOI: 10.1038/srep43875 |
| [46] | Andersson I, Backlund A. Structure and function of Rubisco. Plant Physiol Biochem, 2008, 46(3): 275–291. DOI: 10.1016/j.plaphy.2008.01.001 |
| [47] | Tilman D, Socolow R, Foley JA, et al. Beneficial biofuels-the food, energy, and environment trilemma. Science, 2009, 325(5938): 270–271. DOI: 10.1126/science.1177970 |
| [48] | Hahn-H gerdal B, Karhumaa K, Jeppsson M, et al. Metabolic engineering for pentose utilization in Saccharomyces cerevisiae//Olsson L, Ed. Biofuels. Berlin Heidelberg: Springer, 2007: 147-177. https://link.springer.com/chapter/10.1007%2F10_2007_062 |
| [49] | Pohlmann A, Fricke WF, Reinecke F, et al. Genome sequence of the bioplastic-producing "Knallgas" bacterium Ralstonia eutropha H16. Nat Biotechnol, 2006, 24(10): 1257–1262. DOI: 10.1038/nbt1244 |
| [50] | Bogorad IW, Lin TS, Liao JC. Synthetic non-oxidative glycolysis enables complete carbon conservation. Nature, 2013, 502(7473): 693–697. DOI: 10.1038/nature12575 |
| [51] | Lin PP, Jaeger AJ, Wu TY, et al. Construction and evolution of an Escherichia coli strain relying on nonoxidative glycolysis for sugar catabolism. Proc Natl Acad Sci USA, 2018, 115(14): 3538–3546. DOI: 10.1073/pnas.1802191115 |
| [52] | Jones SW, Fast AG, Carlson ED, et al. CO2 fixation by anaerobic non-photosynthetic mixotrophy for improved carbon conversion. Nat Commun, 2016, 7: 12800. DOI: 10.1038/ncomms12800 |
| [53] | Gong FY, Liu GX, Zhai XY, et al. Quantitative analysis of an engineered CO2-fixing Escherichia coli reveals great potential of heterotrophic CO2 fixation. Biotechnol Biofuels, 2015, 8(1): 86. |
| [54] | Antonovsky N, Gleizer S, Noor E, et al. Sugar synthesis from CO2 in Escherichia coli. Cell, 2016, 166(1): 115–125. DOI: 10.1016/j.cell.2016.05.064 |
| [55] | Raines CA. Increasing photosynthetic carbon assimilation in C3 plants to improve crop yield: current and future strategies. Plant Physiol, 2011, 155(1): 36–42. |
| [56] | Whitney SM, Houtz RL, Alonso H. Advancing our understanding and capacity to engineer nature's CO2-sequestering enzyme, Rubisco. Plant Physiol, 2011, 155(1): 27–35. |
| [57] | Li H, Opgenorth PH, Wernick DG, et al. Integrated electromicrobial conversion of CO2 to higher alcohols. Science, 2012, 335(6076): 1596. DOI: 10.1126/science.1217643 |
| [58] | Tashiro Y, Hirano S, Matson MM, et al. Electrical-biological hybrid system for CO2 reduction. Metab Eng, 2018, 47: 211–218. DOI: 10.1016/j.ymben.2018.03.015 |
 2019, Vol. 35
2019, Vol. 35





