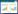中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陈曦, 陈亮, 李大力
- Chen Xi, Chen Liang, Li Dali
- 基因治疗在临床应用中的研究进展
- Research progress of gene therapy in clinical application
- 生物工程学报, 2019, 35(12): 2295-2307
- Chinese Journal of Biotechnology, 2019, 35(12): 2295-2307
- 10.13345/j.cjb.190363
-
文章历史
- Received: October 10, 2019
- Accepted: November 25, 2019
针对遗传疾病的基因治疗旨在通过向细胞递送治疗性基因来实现基因的持久表达,并以最低的安全风险为前提使治疗基因的表达足以达到改善或治愈疾病的水平。20世纪60年代美国分子生物学家Lederberg J首次提出基因治疗的初步概念,为基因治疗的发展奠定了基础[1]。1972年基因疗法被正式提出,并被认可作为人类遗传疾病的一种治疗方式[2]。基因治疗根据载体的给药途径可分为离体和在体基因治疗两种类别(图 1):1)离体基因治疗(Ex vivo)是直接取自异体正常细胞或患者自身的病变细胞,体外通过基因导入的方式修饰细胞,将修饰后的细胞体外扩增后回输到病人体内,从而达到治疗疾病的目的。2)在体基因治疗(In vivo)则是利用非病毒或病毒载体直接将治疗基因递送到患者体内的方式来治疗疾病。临床试验针对个体差异和疾病类型的不同而选择最佳的治疗方式:离体基因治疗可通过体外筛选的方式获得更多高效转导且无脱靶效应的细胞。此外,自体细胞的使用不会诱导免疫反应,可实现安全有效的治疗效果。然而,离体基因治疗由于步骤繁琐,细胞的离体操作容易导致其活力低下,且一些整合型病毒的使用更易引起体内的随机插入,进而诱发癌变,因此这一方法的应用受到诸多局限;相比离体基因治疗,在体基因治疗的操作相对简便,对于一些体外无法培养的细胞来说无疑是最佳的选择。但体内编辑的不确定性导致这一方法无法避免随机整合和脱靶效应的发生,并且一些病毒载体还有可能在体内出现严重的免疫反应,因此合理地优化编辑的方法和改造递送的载体将会大大降低这一方法的风险。

|
| 图 1 基因治疗原理示意图:在体(左)和离体(右)基因治疗 Fig. 1 The principle diagram of gene therapy: in vivo (left) and ex vivo (right). |
| |
基因治疗在临床前研究中的突破性进展促使科学家们在20世纪90年代初开始进行临床试验。第一个获得授权的基因治疗研究诞生于1989年美国国立卫生研究院(National Institutes of Health, NIH),研究人员收集了肿瘤浸润的淋巴细胞,使用逆转录病毒载体(Retrovirus, RV)进行基因标记的方式在体内检测“肿瘤归巢”的功能。这项研究为证明“人类细胞可以被体外基因改造并安全地回输给患者”提供了一个直接证据[3]。基因治疗第一个成功的临床案例为1995年报道的一例通过体内回输RV纠正自体白细胞来治疗重度联合免疫缺陷综合征(Severe combined immunedeficiency, SCID)的临床试验,这一案例被认为是基因治疗发展史上一个重要的里程碑[4]。自1990年开始,全世界有数百个实验室陆续开展了各种基因治疗的临床试验,据统计截止当前已有超过4 000位病人参与了500多项临床试验[5]。
然而,1999年在宾夕法尼亚大学的James Wilson医生开展的一项腺病毒基因治疗临床试验中,受试者由于腺病毒诱发的致命性免疫反应而致死。随后一系列的早期试验结果接连暴露基因治疗严重的副作用,包括针对载体的免疫反应以及载体介导的原癌基因插入激活引起的恶性肿瘤等,这一系列的负面报道无疑给基因治疗的发展蒙上了巨大的阴影[6]。这些失败的案例让研究者们开始反思基因治疗的风险因素,从而陆续推动了更多基础研究的快速发展,包括病毒学、免疫学、细胞生物学、动物模型构建和疾病靶向治疗等。伴随着这些领域的快速发展,基因治疗于21世纪初开始逐渐走出困境。慢病毒(Lentivirus, LV)等新型载体的问世提高了外源基因递送到非分裂细胞的效率和安全性。在早期临床试验中,这些安全有效的载体被用于自体造血干细胞(Hematopoietic stem cells, HSCs)的转导,对于患有免疫缺陷、血红蛋白病、代谢和储存障碍的患者而言,这些载体显得更加安全有效。基于此,美国食品药品监督管理局(Food and Drug Administration, FDA)于2017年批准了首个基因治疗产品,包括嵌合抗原受体T (Chimeric antigen receptor T, CAR-T)细胞免疫疗法治疗B细胞恶性肿瘤(Kymriah和Yescarta)和AAV载体体内治疗先天性失明(Luxturna)。针对神经肌肉疾病和血友病等更多遗传疾病的基因治疗药品也有望在将来获得更多的批准许可。
近年来,基于工程化核酸酶的基因组编辑技术得到了快速发展。与传统的基因治疗不同,基因组编辑技术可实现精确的基因插入、敲除以及“修正”。基因组编辑技术可以在离体细胞上进行,也可以通过载体递送的方式在体内实现原位基因组的编辑。通过基因编辑技术修饰的细胞不存在插入突变致癌的风险,由于外源基因的定点整合,治疗效果不会随着细胞的增殖而丢失,能够实现长期安全有效的治疗效果。目前,基因组编辑技术的临床转化尚处于初级阶段,预计在未来的10年内将开展多项临床基因组编辑试验。
最初基因治疗仅被用于遗传性疾病的治疗,而现在正被广泛用于肿瘤、感染性疾病、心血管疾病和自身免疫性疾病的治疗,如CAR-T细胞免疫疗法。随着基因治疗的快速发展,更多诸如多基因遗传病、神经遗传性疾病等目前医学上束手无策的疾病将有望被根治。在经历了30多年的曲折发展后,基因治疗正迅速成为各种人类遗传性和获得性疾病的有效治疗方法。
2 基因治疗临床试验的进展随着基础研究的快速发展,从20世纪90年代早期开始,基因治疗开始进入临床试验阶段。截至2018年末,基因治疗已在38个国家进行了2 930项试验,这些早期阶段的试验为基因治疗提供了重要的临床指导意见[5] (图 2)。
临床实验的结果不断重复着“乐观-失望”的反复循环,良好的治疗效果也会伴随着严重的副作用。尽管越来越多的临床试验证明基因治疗的低效性,但基因治疗的研究势头仍迅猛增长。其中最突出的试验包括几种原发性遗传疾病Leber先天性黑蒙症[8-10]、B型血友病[11]和X-连锁肾上腺脑白质营养不良(X-linked adrenoleukodystrophy, X-ALD)[12]的治疗。根据Pharmaprojects在2018年的报告显示,癌症和罕见病是当前基因治疗临床研究最多的两个领域,下图展示了截止2018年底基因治疗临床试验适应症占比(图 3)。
3 基因治疗临床试验在癌症领域的研究进展目前基因治疗在肿瘤领域的应用,主要借助CAR-T或者T细胞受体(TCR)嵌合型T细胞(TCR-T)的形式以离体基因治疗的方式达到杀伤肿瘤的目的。以CAR-T为例,这是一种新型的细胞免疫疗法,利用白细胞分离技术从患者的血液中提取免疫T细胞,体外通过基因工程技术给T细胞整合一个能识别肿瘤细胞,并且同时激活T细胞杀死肿瘤细胞的嵌合抗体基因,再进行体外扩增改造的T细胞并回输到癌症患者体内,从而识别并攻击自身的肿瘤细胞,达到肿瘤治疗的目的。
基于CAR-T的细胞免疫疗法已于2011年开展了临床试验,3例慢性淋巴细胞白血病患者接受了自体改造的T细胞治疗,治疗初期显示了有利的治疗效果[13]。2014年,CAR-T细胞治疗在急性淋巴细胞白血病(Acute lymphoblastic leukemia, ALL)中取得了显著疗效,给血液恶性肿瘤的治疗带来新的曙光。目前已有数百名患者采用这一方式进行了多次临床试验,在白血病或淋巴瘤患者中观察到了前所未有的缓解率,特别是急性淋巴细胞白血病[14]。随着更多的临床试验取得了积极的治疗效果,癌症免疫疗法在临床的成功转化被Science杂志编辑评为2013年年度科学突破。随后,两种免疫细胞疗法于2017年获得美国FDA批准上市,即Novartis的Kymriah和Kite Pharmar的Yescarta,这两款CAR-T疗法主要针对罹患B细胞前急性淋巴细胞白血病及复发或难治性大B细胞淋巴瘤的成人患者。但令人遗憾的是,国内至今尚无批准上市的细胞免疫疗法。
尽管目前基于CAR和TCR的细胞免疫疗法在血液肿瘤的治疗中具有巨大的潜力,但其面临的一个重大问题就是细胞因子风暴。当这些工程化的T细胞靶向清除癌细胞的同时,大量产生的细胞因子也会对宿主的其他组织器官进行攻击,导致患者出现高烧、低压、休克甚至死亡。虽然基于CAR和TCR的T细胞免疫疗法在某些特定肿瘤中的疗效显著,但我们仍需要更多的研究来理解不良反应发生的机制,进而开发相应的对策来规避这一风险。
4 基因治疗在遗传罕见病中的临床应用基因治疗在遗传疾病中的应用主要针对单基因遗传疾病,目前临床试验主要以基因增补的方式实现疾病的治疗。截至2018年11月,针对单基因遗传疾病的临床试验占比11.5% (图 3)。一项随机、双盲、有安慰剂对照的2b期临床试验首次概念性地证明了通过非病毒基因治疗的方法能够改善囊性纤维化病人的肺功能[15]。在这项研究中,78名患者在肺部接受了递送编码CFTR质粒的阳离子脂质体的治疗。尽管治疗的效果并不显著,但这一治疗总体来说是安全的,并为后来临床试验的改进提供了建议,比如增加脂质体制剂的剂量以及使用频率等。针对原发性免疫缺陷病的临床试验显示出了良好的治疗效果,目前已有超过150名患者使用γ-逆转录病毒或慢病毒为载体的基因递送策略来治疗这类疾病[16]。腺苷脱氨酶缺乏症(Adenosine deaminase deficiency-related severe combined immune-deficiency, ADA-SCID)作为此类疾病的代表,已有超过40名患者接受了基因治疗,且生存率可达70%以上[17]。基于这一结果,2016年欧洲药品管理局(European Medicines Agency, EMA)批准了针对ADA-SCID疾病的首个基因治疗产品Strimvelis,这也是第一个获批的针对干细胞的离体基因治疗产品。相比于20年前利用γ-逆转录病毒载体在ADA-SCID患儿中开展的首项离体基因治疗研究[18-19],Strimvelis在临床试验取得的成功主要得益于移植前使用化疗进行了清髓处理,为基因修饰的自体干细胞创造了扩增的空间[20]。尽管ADA-SCID的基因治疗临床试验尚未观察到与载体遗传毒性有关的不良事件,但目前仍在开展基于慢病毒载体的临床试验,以期获得更为安全有效的治疗效果[21]。
由于慢病毒载体可作用于细胞周期的G0/G1期,并且具有更加安全的整合方式,因而成为目前基因治疗中应用较为广泛的载体[22]。针对原发性免疫缺陷病、X连锁严重联合免疫缺陷(X-SCID)和Wiskott-Aldrich综合征的慢病毒基因递送治疗已有报道,并且与其γ-逆转录病毒载体治疗相比,安全性更高[23]。使用慢病毒载体基因改造HSCs治疗遗传性神经系统疾病(Adrenoleukodystrophy, ALD)和异染性脑白质营养不良(Metachromatic leukodystrophy, MLD)也显示出了积极的治疗效果[24-27],类似的方法也被用于血红蛋白病的治疗,其中包括一例针对镰状细胞病的患者[28]。此前一项针对β-地中海贫血的临床试验已证明,使用慢病毒载体将基因引入自体HSCs来实现珠蛋白的稳定特异性表达是可行的,该患者自停止输血后已安全存活达6年之久[29]。
腺相关病毒(Adeno-associated virus, AAV)是一类单链线状DNA缺陷型病毒,因其具有高效的转导能力、非整合性以及能特异性感染各组织器官,已被作为一种安全有效的病毒载体用于基因治疗的临床试验。基于AAV的临床试验展现出了令人振奋的结果,这些试验中最值得关注的包括基于α-1抗胰蛋白酶缺乏症[30]、A型[31]和B型[32-33]血友病以及眼科疾病[34-35]的基因治疗。UniQure公司开发的基于AAV载体用于治疗脂蛋白脂肪酶缺乏的基因治疗产品Glybera早在2012年就获得了EMA的许可。而美国第一个基于AAV的基因治疗产品是由Spark Therapeutics推出的Luxturna,于2017年12月19日获得了FDA的正式批准。然而,首例利用AAV载体针对B型血友病的临床治疗以失败告终,究其原因在于患者本身存在的AAV抗体会中和载体的疗效,以及载体输注后AAV病毒衣壳会引起迟发型的细胞免疫应答,进而导致转导细胞被免疫系统破坏而失效[11]。通过筛选没有抗体的患者作为受试对象以及进行皮质类固醇药物处理可以解决这些问题[36]。目前针对A型血友病的临床试验主要使用AAV载体递送编码截短因子Ⅷ的cDNA进行治疗。近期的结果显示了因子Ⅷ水平的短期提升,但随着时间的推移而下降。尽管如此,在随访的3年内仍能观察到患者年出血率的稳健降低[37]。此外,基于AAV9血清型的重组AAV载体也被用于脊髓性肌萎缩症(Spinal muscular atrophy, SMA)[38]和Sanfilippo综合征A型(Mucopolysaccharidosis IIIA, MPS IIIA)[39]的临床治疗,初步的临床治疗结果已显示出该方法的有效性,这充分说明该载体能够有效地穿过血脑屏障,转导神经细胞和脊髓,在治疗神经系统疾病上拥有极大的潜力。
随着基因治疗的飞速发展,进入临床试验阶段的基因治疗药物层出不穷。在进行基因治疗的临床试验之前,研究人员会从理论上推测该试验的潜在风险。这些风险主要分为两大类:1)整合型载体存在插入突变的风险,这在临床试验中已得到证实,即治疗X-连锁严重联合免疫缺陷(X-SCID)的儿童最终引发T细胞白血病[40-41]。2)基因治疗会引起自身免疫反应和炎症反应,包括中和抗体引起的细胞免疫反应和病毒衣壳引起的体液免疫反应[42]。对于癌症基因治疗,风险还与过度激活的T细胞有关。虽然通过降低病毒载体的注射剂量以及进行免疫抑制类药物的适当处理可以减轻这些风险,但更为安全有效的治疗策略仍需进一步的优化和完善。
5 基因治疗上市药物基因治疗产品应该是迄今为止人类开发的最为复杂的“药物”。中国是世界上第一个批准商业基因治疗产品的国家,首个基因治疗产品Gendicine于2003年获得我国国家食品药品监督管理局批准上市。Glybera是欧洲第一个获批的基因治疗产品,于2012年获得欧洲EMA有条件的上市许可。随着基因治疗在临床试验上的突破性进展,自2012年以来,美国FDA和欧洲EMA共分别批准了8种基因治疗产品:5种用于治疗严重单基因疾病的产品、2种用于治疗B细胞癌的嵌合抗原受体T细胞产品以及一种用于治疗黑色素瘤的转基因疱疹病毒产品,上述单基因疾病包括β地中海贫血、Leber先天性黑朦症、脊髓性肌萎缩和一种罕见的原发性免疫缺陷和脂蛋白脂肪酶缺乏症。下图展示了自2003年以来全球范围内市场上获批的基因治疗产品(图 4),以下根据治疗原理分别简单介绍一下目前市场上比较经典的几款基因治疗产品。
|
| 图 4 医药市场基因治疗药物的发展概况 Fig. 4 Development of gene therapy drugs in the pharmaceutical market. |
| |
Imlygic[43]是一种用于治疗通过手术无法去除的黑色素瘤的转基因疱疹病毒(Herpes simplex virus, HSV)疗法,于2015年上市,命名为T-Vec,是第一个FDA批准的可直接注入黑色素瘤的基因药物。T-Vec是一种基因工程疱疹病毒(HSV-1),在肿瘤细胞中复制并合成粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor, GM-CSF),导致肿瘤抗原的裂解和释放,从而引发免疫反应杀死转移性的黑色素瘤细胞。研究显示,Imlygic治疗后约16.3%的患者病灶缩小,且持续效果可达6个月以上。
Zalmoxis[44]是首个基于供者来源T细胞的自杀基因免疫疗法,于2016年被EMA有条件批准用于治疗部分白血病和淋巴瘤。通过γ-逆转录病毒载体将诱导型“自杀基因” (Herpes simplex virus thymidine kinase, HSV-TK)整合到异体来源的T细胞中,可通过服用更昔洛韦药物来消灭引起免疫排斥反应的T细胞。带有“自杀基因”的T细胞表达前药转换酶HSV-TK,后者可磷酸化激活更昔洛韦的细胞毒性,从而诱导T细胞“自杀”,防止潜在的移植物抗宿主病(Graft-versus-host disease, GVHD)进一步恶化。根据临床实验结果显示,Zalmoxis能有效恢复患者的免疫系统,明显延长患者的生存周期,使部分匹配的HSCs的移植更加安全和有效。
Yescarta[45]是一种基于逆转录病毒的CAR-T细胞免疫疗法,于2017年获得FDA批准用于治疗成年特定类型的大B细胞淋巴瘤患者。该疗法使用患者自身的T细胞通过逆转录病毒进行遗传修饰,使T细胞产生与CD28和CD3-zeta共刺激结构域连接的抗CD19的CAR,以帮助对抗淋巴瘤,完全缓解率可达58%。Yescarta于2018年获EMA批准上市,用于治疗成年两次或以上系统性治疗复发或难治性弥漫性大B细胞淋巴瘤(Diffuse large B-cell lymphoma, DLBCL)和原发性纵隔大B细胞淋巴瘤(Primary mediastinal large B-cell lymphoma, PMBCL)的患者。
Kymriah[46]是一种基于慢病毒的CAR-T细胞免疫疗法,于2017年获美国FDA批准上市,用于治疗不符合自体干细胞移植要求的非霍奇金淋巴瘤(Non-Hodgkin’s lymphoma, NHL)和B细胞急性淋巴细胞白血病患者。该疗法在其CAR中使用4-1BB共刺激结构域来增强细胞的扩增和持久性,使用患者自身重编程的T细胞编码转基因CAR来鉴定和消除表达CD19的恶性和非恶性肿瘤细胞,整体的治疗缓解率可达83%。
Strimvelis[47]是第一个用于治疗因腺苷脱氨酶缺乏引起ADA-SCID的体外干细胞基因疗法,于2016年获EMA批准上市。该疗法利用γ逆转录病毒将ADA基因拷贝整合入患者提取的CD34+ HSCs中,然后将HSCs以静脉注射的方式重新输入患者体内,复制并产生具有正常功能的腺苷脱氨酶蛋白的细胞,成功修复患者的免疫缺陷表型。根据临床实验的结果,经治疗的患者没有出现白血病转化或骨髓增生异常的事件。
Luxturna[48]于2017年被FDA批准作为治疗Leber先天性黑朦症的孤儿药,也是目前FDA唯一批准的在体基因疗法。Luxturna是一种基于腺相关病毒2型(AAV2)的治疗方法,通过AAV载体将人视网膜色素上皮特异性蛋白65 kDa (RPE65)基因递送至视网膜营养不良患者的视网膜内,体内表达视力所必需的全反式视黄基酯异构酶,可在几个月内恢复患者视力,从而有效地治疗双等位基因RPE65突变相关的视网膜营养不良患者。
Spinraza[49]是一种反义寡核苷酸(Antisense oligonucleotides, ASOs)基因疗法,于2016年被EMA批准用于治疗SMN1基因突变所引起的脊髓性肌萎缩症,也是首个且唯一在美国获批的SMA基因治疗药物。Spinraza通过反义寡核苷酸调控SMN2前mRNA的拼接,有效地增加患者全长SMN蛋白的表达,改善患者肌无力的症状。目前的临床数据显示Spinraza在SMA的治疗中疗效显著,且具有广泛的适用性。此外,由AveXis公司开发的基于AAV介导体内表达SMN1蛋白的药物Zolgensma也已于2019年被美国FDA批准用于治疗SMA[50]。
Zynteglo[51-52]是由BlueBird Bio公司开发的一款基于慢病毒载体的离体基因疗法,于2019年获EMA批准用于治疗输血依赖型β地中海贫血(Trans-fusion-dependent β thalassemia, TDT)。该疗法先从患者骨髓分离HSCs,体外利用慢病毒载体向HSCs递送患者缺少的β珠蛋白基因,为确保回输移植的成功性,患者需预先接受化疗为回输的“健康细胞”留出生长空间。Zynteglo已成功帮助数名患者脱离输血依赖长达5年之久。
6 基于新兴基因组编辑技术的临床治疗进展由于传统的基因治疗仅靠添加正常功能的基因对于显性疾病的治疗往往束手无策,因此更多的研究开始聚焦基因增补策略的替代方案,包括靶向重组技术和基因组编辑技术等。基于同源重组修复(Homology directed repair, HDR)的传统基因编辑技术虽然解决了缺陷基因定点修复和外源基因靶向插入的难题,但其体内编辑的低效性极大地限制了其在临床试验中的应用。
人工核酸酶技术的开发极大地推动了基因编辑技术的发展,自第一个核酸内切酶被证明可定点切割DNA产生双链断裂以来,特定位点的基因组编辑技术备受青睐[53]。通过核酸酶诱导的双链断裂(Double strand breaks, DSBs)不仅可用于基因敲除或基因敲入,还可用于精准的基因修复,拓展了基因治疗的应用范围。目前新一代基因组编辑工具(如锌指核酸酶ZFN、转录激活因子样效应物核酸酶TALEN和规律成簇间隔短回文重复序列(CRISPR)/Cas9系统)正被科学家们作为一种精准靶向的技术手段陆续用于遗传疾病的临床试验治疗。如图 5所示,新型基因组编辑技术的核心思路是通过基因工程的方法针对目标位点设计并构建特定的核酸内切酶,使其能特异性识别、结合并切割靶向序列,在基因组的特定位点产生DSBs,通过非同源末端整合(Non-homologous end joining, NHEJ)的方式产生插入或缺失(Insertions and deletions, Indels)导致基因的敲除,在提供外源模板的条件下可通过NHEJ或HDR的方式发生靶向整合,将治疗基因靶向整合到基因组或对突变基因进行定点修复,成功编辑的细胞可传递给子代,以实现疾病的长期修复效果[54]。目前基于基因组编辑技术的临床试验的相关报道展示了良好的治疗效果,其中包括利用ZFN治疗HIV-193的临床试验,以及3项针对粘液多发性硬化症Ⅰ/Ⅱ型和B型血友病的临床试验,均是通过ZFN递送治疗基因定点整合到肝细胞白蛋白位点的方式[55-56]。此外,针对急性髓性白血病和母细胞性浆细胞样树突状细胞肿瘤的早期临床试验则是利用TALEN编辑的靶向CD123的同种异体CAR-T细胞进行治疗[57]。相比于ZFN和TALEN,CRISPR/Cas9基因编辑系统以其简易性、高效性及安全性被认为是当前最有潜力的基因编辑工具[58]。前不久,美国生物科技公司Editas与制药公司Allergan联合开展了通过AAV递送CRISPR体内敲除CEP290突变内含子的方式治疗先天性黑朦10 (LCA10)的1/2期临床试验[59]。近日,由北京大学邓宏魁研究组等多个研究团队首次利用CRISPR/Cas9基因编辑的成体HSCs治疗艾滋病和白血病患者,实现了CCR5突变的HSPCs在患有艾滋病合并急性淋巴细胞患者中同种异体移植,急性淋巴母细胞性白血病仅在移植后4周就得到了完全缓解。由于CRISPR/Cas9体外敲除效率偏低,移植后的受体反应效率还不足以达到治愈HIV-1的水平,因此,提高CRISPR/Cas9系统的基因编辑效率以及安全性仍需进一步的研究来改进和优化[60]。此外,目前还有很多基于基因编辑的临床试验尚处于前期研究阶段,未来有希望获得批准用于更多疾病的临床治疗。
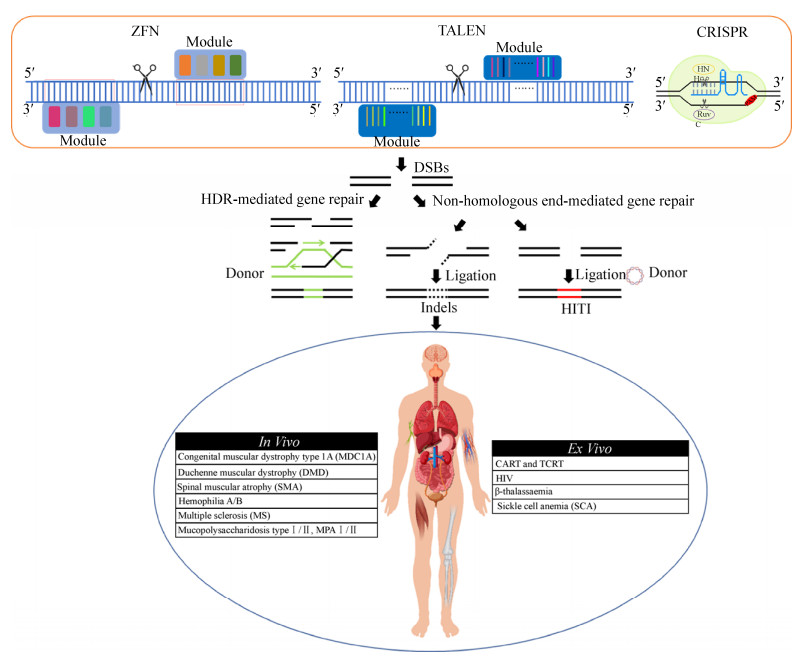
|
| 图 5 基于基因组编辑技术的临床试验 Fig. 5 Clinical trials based on genome-editing technology. |
| |
与经典的基因递送疗法相比,基因组编辑治疗正处于临床转化的初级阶段,目前仍存在很多可能影响临床应用的潜在风险,迫切需要在合适的动物模型和更多的临床试验中进行进一步的探索。例如,由核酸酶介导的DSBs在其他位点产生的脱靶效率亟待得到解决,此外递送核酸酶的病毒载体的转导效率和安全性也需要进一步的优化提升。目前正在开展的工作主要集中在如何设计合适的CRISPR/Cas9系统来避免off-target以及在临床应用之前如何预测、筛选以及检测靶向和脱靶对基因组的改变[61]。最近开发的高保真CRISPR/Cas9核酸酶变体,被证明可显著降低编辑后的脱靶效应[62]。然而,不可否认的是,在一味降低off-target效率的同时,也不可避免地会降低on-target的效率,如何平衡这一效果对于基因组编辑安全有效地用于临床试验至关重要。
7 结语与展望回顾基因治疗过去30年的发展历程,临床应用的成败很大程度上取决于基础研究的深度,正所谓“工欲善其事,必先利其器”,在大规模开展临床试验的过程中,仍需把注意力重新集中到基础研究的发展上来。目前基因治疗仍然存在诸多挑战,其中包括对整合载体或基因组编辑脱靶引起的细胞毒性的认识和预防,提高基因递送和编辑效率以治疗更多类型的遗传疾病,防止载体或基因组编辑复合物引起的体内免疫反应等。基因治疗的突破很大程度上取决于基础学科的发展,包括病毒学、免疫学、细胞生物学以及动物模型构建等,目前的研究主要针对以下几个方面:1)针对病毒载体的优化改造可以进一步提高外源基因的高效转导以及降低机体的免疫原性;2)基于基因编辑工具的升级改造可以提高靶向切割的效率以及降低脱靶效应的产生;3)开发高效精准的靶向基因组整合策略将有助于外源基因的长期稳定整合,实现遗传疾病的长期有效治疗。过去十几年里科学技术的快速进步和临床试验的重大突破充分展示了基因治疗能够为人类健康提供持久的益处,越来越多的努力朝着这个方向迈进。在不久的将来,基因治疗或将成为人类疾病治疗不可或缺的一部分。
| [1] |
Lederberg J. Biological future of man//Man and His Future. London:UK Churchill Ltd, 1963, 263-273. |
| [2] |
Friedmann T, Roblin R. Gene therapy for human genetic disease?. Science, 1972, 175(4025): 949-955. DOI:10.1126/science.175.4025.949 |
| [3] |
Rosenberg SA, Aebersold P, Cornetta K, et al. Gene transfer into humans-immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med, 1990, 323(9): 570-578. DOI:10.1056/NEJM199008303230904 |
| [4] |
Blaese RM, Culver KW, Miller AD, et al. T lymphocyte-directed gene therapy for ADA- SCID:initial trial results after 4 years. Science, 1995, 270(5235): 475-480. DOI:10.1126/science.270.5235.475 |
| [5] |
Ginn SL, Amaya AK, Alexander IE, et al. Gene therapy clinical trials worldwide to 2017:An update. J Gene Med, 2018, 20(5): e3015. DOI:10.1002/jgm.3015 |
| [6] |
Jenks S. Gene therapy death-"everyone has to share in the guilt". J Natl Cancer Inst, 2000, 92(2): 98-100. DOI:10.1093/jnci/92.2.98 |
| [7] |
Gene Therapy Clinical Trials Worldwide Provided by the Journal of Gene Medicine.[2018-12]. http://www.abedia.com/wiley/indications.php.
|
| [8] |
Bainbridge JWB, Smith AJ, Barker SS, et al. Effect of gene therapy on visual function in Leber's congenital amaurosis. N Engl J Med, 2008, 358(21): 2231-2239. DOI:10.1056/NEJMoa0802268 |
| [9] |
Maguire AM, Simonelli F, Pierce EA, et al. Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med, 2008, 358(21): 2240-2248. DOI:10.1056/NEJMoa0802315 |
| [10] |
Maguire AM, High KA, Auricchio A, et al. Age-dependent effects of RPE65 gene therapy for Leber's congenital amaurosis:a phase 1 dose-escalation trial. Lancet, 2009, 374(9701): 1597-1605. DOI:10.1016/S0140-6736(09)61836-5 |
| [11] |
Nathwani AC, Tuddenham EGD, Rangarajan S, et al. Adenovirus-associated virus vector-mediated gene transfer in hemophilia B. N Engl J Med, 2011, 365(25): 2357-2365. DOI:10.1056/NEJMoa1108046 |
| [12] |
Cartier N, Hacein-Bey-Abina S, Bartholomae CC, et al. Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy. Science, 2009, 326(5954): 818-823. DOI:10.1126/science.1171242 |
| [13] |
Kalos M, Levine BL, Porter DL, et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia. Sci Transl Med, 2011, 3(95): 95ra73. |
| [14] |
Zhang CC, Wang Z, Yang Z, et al. Phase Ⅰ Escalating-dose trial of CAR-T therapy targeting CEA+ metastatic colorectal cancers. Mol Ther, 2017, 25(5): 1248-1258. DOI:10.1016/j.ymthe.2017.03.010 |
| [15] |
Alton EWFW, Armstrong DK, Ashby D, et al. Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis:a randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Respir Med, 2015, 3(9): 684-691. DOI:10.1016/S2213-2600(15)00245-3 |
| [16] |
Wang XY, Rivière I. Clinical manufacturing of CAR T cells:foundation of a promising therapy. Mol Ther Oncolytics, 2016, 3: 16015. DOI:10.1038/mto.2016.15 |
| [17] |
Thrasher AJ, Williams DA. Evolving gene therapy in primary immunodeficiency. Mol Ther, 2017, 25(5): 1132-1141. DOI:10.1016/j.ymthe.2017.03.018 |
| [18] |
Kohn DB, Weinberg KI, Nolta JA, et al. Engraftment of gene-modified umbilical cord blood cells in neonates with adenosine deaminase deficiency. Nat Med, 1995, 1(10): 1017-1023. DOI:10.1038/nm1095-1017 |
| [19] |
Bordignon C, Notarangelo LD, Nobili N, et al. Gene therapy in peripheral blood lymphocytes and bone marrow for ADA- immunodeficient patients. Science, 1995, 270(5235): 470-475. DOI:10.1126/science.270.5235.470 |
| [20] |
Cicalese MP, Ferrua F, Castagnaro L, et al. Update on the safety and efficacy of retroviral gene therapy for immunodeficiency due to adenosine deaminase deficiency. Blood, 2016, 128(1): 45-54. DOI:10.1182/blood-2016-01-688226 |
| [21] |
Carbonaro DA, Zhang L, Jin XY, et al. Preclinical demonstration of lentiviral vector-mediated correction of immunological and metabolic abnormalities in models of adenosine deaminase deficiency. Mol Ther, 2014, 22(3): 607-622. DOI:10.1038/mt.2013.265 |
| [22] |
Montini E, Cesana D, Schmidt M, et al. The genotoxic potential of retroviral vectors is strongly modulated by vector design and integration site selection in a mouse model of HSC gene therapy. J Clin Invest, 2009, 119(4): 964-975. DOI:10.1172/JCI37630 |
| [23] |
De Ravin SS, Wu X, Moir S, et al. Lentiviral hematopoietic stem cell gene therapy for X-linked severe combined immunodeficiency. Sci Transl Med, 2016, 8(335): 335ra57. DOI:10.1126/scitranslmed.aad8856 |
| [24] |
Abina SHB, Gaspar HB, Blondeau J, et al. Outcomes following gene therapy in patients with severe Wiskott-Aldrich syndrome. JAMA, 2015, 313(15): 1550-1563. DOI:10.1001/jama.2015.3253 |
| [25] |
Biffi A, Montini E, Lorioli L, et al. Lentiviral hematopoietic stem cell gene therapy benefits metachromatic leukodystrophy. Science, 2013, 341(6148): 1233158. DOI:10.1126/science.1233158 |
| [26] |
Biffi A. Hematopoietic stem cell gene therapy for storage disease:current and new indications. Mol Ther, 2017, 25(5): 1155-1162. DOI:10.1016/j.ymthe.2017.03.025 |
| [27] |
Eichler F, Duncan C, Musolino PL, et al. Hematopoietic stem-cell gene therapy for cerebral adrenoleukodystrophy. N Engl J Med, 2017, 377(17): 1630-1638. DOI:10.1056/NEJMoa1700554 |
| [28] |
Badat M, Davies J. Gene therapy in a patient with sickle cell disease. N Engl J Med, 2017, 376(21): 2093-2094. DOI:10.1056/NEJMc1704009 |
| [29] |
Cavazzana-Calvo M, Payen E, Negre O, et al. Transfusion independence and HMGA2 activation after gene therapy of human β-thalassaemia. Nature, 2010, 467(7313): 318-322. DOI:10.1038/nature09328 |
| [30] |
Mueller C, Gernoux G, Gruntman AM, et al. 5 Year expression and neutrophil defect repair after gene therapy in Alpha-1 antitrypsin deficiency. Mol Ther, 2017, 25(6): 1387-1394. DOI:10.1016/j.ymthe.2017.03.029 |
| [31] |
Rangarajan S, Walsh L, Lester W, et al. AAV5-factor Ⅷ gene transfer in severe Hemophilia A. N Engl J Med, 2017, 377(26): 2519-2530. DOI:10.1056/NEJMoa1708483 |
| [32] |
Nathwani AC, Reiss UM, Tuddenham EGD, et al. Long-term safety and efficacy of factor Ⅸ gene therapy in hemophilia B. N Engl J Med, 2014, 371(21): 1994-2004. DOI:10.1056/NEJMoa1407309 |
| [33] |
George LA, Sullivan SK, Giermasz A, et al. Hemophilia B gene therapy with a high-specific-activity factor Ⅸ variant. N Engl J Med, 2017, 377(23): 2215-2227. DOI:10.1056/NEJMoa1708538 |
| [34] |
Bennett J, Wellman J, Marshall KA, et al. Safety and durability of effect of contralateral-eye administration of AAV2 gene therapy in patients with childhood-onset blindness caused by RPE65 mutations:a follow-on phase 1 trial. Lancet, 2016, 388(10045): 661-672. DOI:10.1016/S0140-6736(16)30371-3 |
| [35] |
Rakoczy EP, Lai CM, Magno AL, et al. Gene therapy with recombinant adeno-associated vectors for neovascular age-related macular degeneration:1 year follow-up of a phase 1 randomised clinical trial. Lancet, 2015, 386(10011): 2395-2403. DOI:10.1016/S0140-6736(15)00345-1 |
| [36] |
Manno CS, Pierce GF, Arruda VR, et al. Successful transduction of liver in hemophilia by AAV-Factor Ⅸ and limitations imposed by the host immune response. Nat Med, 2006, 12(3): 342-347. DOI:10.1038/nm1358 |
| [37] |
Valoctocogene roxaparvovec phase 2 and phase 3 update. Novato, CA: BioMarin Pharmaceutical, [2019-05-28] https://investors.biomarin.com/2019-05-27-BioMarin-to-Host-Conference-Call-Tuesday-May-28-2019-to-Provide-a-Valoctocogene-Roxaparvovec-Phase-2-and-Phase-3-Update
|
| [38] |
Mendell JR, Al-Zaidy S, Shell R, et al. Single-dose gene-replacement therapy for spinal muscular atrophy. N Engl J Med, 2017, 377(18): 1713-1722. DOI:10.1056/NEJMoa1706198 |
| [39] |
Therapeutics A. Abeona therapeutics receives regulatory approval to initiate clinical trial in Australia with ABO‐102 gene therapy for patients with MPS ⅢA: Clinical Trial Notification (CTN) enables initiation at 3rd global site and accelerates enrollment in the ABO‐102 MPS ⅢA gene therapy program[EB/OL].[2018-04-03]. https://investors.abeonatherapeutics.com/press-releases/detail/84/abeona-therapeutics-receives-regulatory-approval-to.
|
| [40] |
Hacein-Bey-Abina S, Von Kalle C, Schmidt M, et al. LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1. Science, 2003, 302(5644): 415-419. DOI:10.1126/science.1088547 |
| [41] |
Howe SJ, Mansour MR, Schwarzwaelder K, et al. Insertional mutagenesis combined with acquired somatic mutations causes leukemogenesis following gene therapy of SCID-X1 patients. J Clin Invest, 2008, 118(9): 3143-3150. DOI:10.1172/JCI35798 |
| [42] |
George LA. Hemophilia gene therapy comes of age. Blood Adv, 2017, 1(26): 2591-2599. DOI:10.1182/bloodadvances.2017009878 |
| [43] |
Fukuhara H, Ino Y, Todo T. Oncolytic virus therapy:A new era of cancer treatment at dawn. Cancer Sci, 2016, 107(10): 1373-1379. DOI:10.1111/cas.13027 |
| [44] |
Harrison RP, Ruck S, Rafiq QA, et al. Decentralised manufacturing of cell and gene therapy products:Learning from other healthcare sectors. Biotechnol Adv, 2018, 36(2): 345-357. DOI:10.1016/j.biotechadv.2017.12.013 |
| [45] |
Axicabtagene ciloleucel (Yescarta) for B-cell lymphoma. Med Lett Drugs Ther, 2018, 60(1551): e122-e123.
|
| [46] |
Ruella M, Kenderian SS. Next-generation chimeric antigen receptor T-cell therapy:going off the shelf. BioDrugs, 2017, 31(6): 473-481. DOI:10.1007/s40259-017-0247-0 |
| [47] |
Aiuti A, Roncarolo MG, Naldini L. Gene therapy for ADA-SCID, the first marketing approval of an ex vivo gene therapy in Europe:paving the road for the next generation of advanced therapy medicinal products. EMBO Mol Med, 2017, 9(6): 737-740. DOI:10.15252/emmm.201707573 |
| [48] |
Darrow JJ. Luxturna:FDA documents reveal the value of a costly gene therapy. Drug Discov Today, 2019, 24(4): 949-954. DOI:10.1016/j.drudis.2019.01.019 |
| [49] |
F AQ. Nusinersen (Spinraza) for spinal muscular atrophy. Med Lett Drugs Ther, 2017, 59(1517): 50-52. |
| [50] |
Zolgensma - one-time gene therapy for spinal muscular atrophy. Med Lett Drugs Ther, 2019, 61(1577): 113-114.
|
| [51] |
Thompson AA, Walters MC, Kwiatkowski J, et al. Gene therapy in patients with transfusion-dependent β-Thalassemia. N Engl J Med, 2018, 378(16): 1479-1493. DOI:10.1056/NEJMoa1705342 |
| [52] |
Marktel S, Scaramuzza S, Cicalese MP, et al. Intrabone hematopoietic stem cell gene therapy for adult and pediatric patients affected by transfusion-dependent ß-thalassemia. Nat Med, 2019, 25(2): 234-241. DOI:10.1038/s41591-018-0301-6 |
| [53] |
Baker M. Gene-editing nucleases. Nat Methods, 2012, 9(1): 23-26. DOI:10.1038/nmeth.1807 |
| [54] |
Nemudryi AA, Valetdinova KR, Medvedev SP, et al. TALEN and CRISPR/Cas genome editing systems:tools of discovery. Acta Naturae, 2014, 6(3): 19-40. DOI:10.32607/20758251-2014-6-3-19-40 |
| [55] |
Reardon S. Leukaemia success heralds wave of gene-editing therapies. Nature, 2015, 527(7577): 146-147. |
| [56] |
Anguela XM, High KA. Entering the modern era of gene therapy. Annu Rev Med, 2019, 70: 273-288. DOI:10.1146/annurev-med-012017-043332 |
| [57] |
Qasim W, Zhan H, Samarasinghe S, et al. Molecular remission of infant B-ALL after infusion of universal TALEN gene-edited CAR T cells. Sci Transl Med, 2017, 9(374): eaaj2013. DOI:10.1126/scitranslmed.aaj2013 |
| [58] |
Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems. Science, 2013, 339(6121): 819-823. DOI:10.1126/science.1231143 |
| [59] |
Ruan GX, Barry E, Yu D, et al. CRISPR/Cas9-mediated genome editing as a therapeutic approach for leber congenital amaurosis 10. Mol Ther, 2017, 25(2): 331-341. DOI:10.1016/j.ymthe.2016.12.006 |
| [60] |
Xu L, Wang J, Liu Y, Xie LL, et al. CRISPR-edited stem cells in a patient with HIV and acute lymphocytic leukemia. N Engl J Med, 2019, 381: 1240-1247. DOI:10.1056/NEJMoa1817426 |
| [61] |
Tsai SQ, Joung JK. Defining and improving the genome-wide specificities of CRISPR-Cas9 nucleases. Nat Rev Genet, 2016, 17(5): 300-312. DOI:10.1038/nrg.2016.28 |
| [62] |
Kleinstiver BP, Pattanayak V, Prew MS, et al. High-fidelity CRISPR-Cas9 nucleases with no detectable genome-wide off-target effects. Nature, 2016, 529(7587): 490-495. DOI:10.1038/nature16526 |
 2019, Vol. 35
2019, Vol. 35