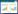中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张晋瑄, 罗建泉, 任重远, 张昊, 陈向荣, 万印华
- Zhang Jinxuan, Luo Jianquan, Ren Zhongyuan, Zhang Hao, Chen Xiangrong, Wan Yinhua
- 膜技术在生物检测中的应用研究进展
- Advanced applications of membrane technology in biological detection
- 生物工程学报, 2019, 35(12): 2257-2268
- Chinese Journal of Biotechnology, 2019, 35(12): 2257-2268
- 10.13345/j.cjb.190229
-
文章历史
- Received: June 2, 2019
- Accepted: September 10, 2019
- Published: October 10, 2019
随着生活水平的提高,人们对生命健康和医疗保障日益关注。现代生物检测技术在临床疾病诊断、药物开发、医疗保健、食品安全、环境监测等领域都发挥着至关重要的作用,特别是早期疾病诊断、生物标志物的筛选、致病细菌监测等等。因此,精准、高效的生物检测技术研发受到研究者们的广泛关注。
生物检测技术发展到现在,涉及的内容越来越广泛,关注热点除了生物体的特有功能和特征外,还强调生物体本质过程的研究以及基因工程、蛋白质工程和组学(如基因组学、蛋白组学、肽组学、代谢学)等的检测,目前涉及的关键词包括生物检测(Biodetection)、生物监测(Biomonitor,Biosurvey)、生物分析、生物传感器、生物芯片、生物信息学等。
膜技术作为一项绿色分离技术,在生物检测中得到广泛应用。以分离膜作为选择性屏障,可控制膜两侧的物质传输[1]。膜分离过程无需添加剂,高效低耗。并且,膜技术易于与其他分离或反应过程相结合,分离膜的结构、性质和功能也有极大可设计、可加工的空间。因此,大量具有各种新颖功能的吸附膜、催化膜、传输膜等被开发出来,以满足生物检测过程中的不同需求,如样品分离纯化、样品消解与浓缩、生物体检测、提高检测系统的生物相容性等。通常,利用膜材料的高比表面积、良好的机械性能和生物相容性,膜技术可被直接作为检测系统的辅助和集成部分,起到保护、支撑、分散和分离屏障等作用。进一步对分离膜功能化修饰后,可以改善其性能或赋予其更多功能(特异选择性、分子识别、催化等)。因此通过对膜材料进行结构和功能的理性设计,可满足不同检测需求,使膜技术在生物检测过程中发挥更重要的作用。
吸附膜被广泛用于生物样品的分离纯化,具有高选择性和高通量的优点,样品损失少,适合处理微量、敏感的生物样品[2];催化膜在生物样品消解及检测中发挥了重要作用,主要是通过将化学催化剂或生物酶固定于膜表面或孔内,将分离与反应相集成[3],提高反应效率、可控性以及催化剂的重复利用性;传输膜可以利用电荷作用、差异迁移率等实现样品在线分离,使检测器件小型化[4];膜技术还可以作为检测系统与外界环境之间的友好屏障,选择性地透过待分析物并隔绝干扰物,保障检测系统的稳定性[5]。
本文首先介绍了分离膜的功能化方法,然后概述了目前膜技术在样品制备和检测过程中的应用以及最新科研进展,侧重于功能膜在生物检测中的作用方式和功能集成,以期对功能膜的设计和制备及其在生物检测中的应用提供新思路。
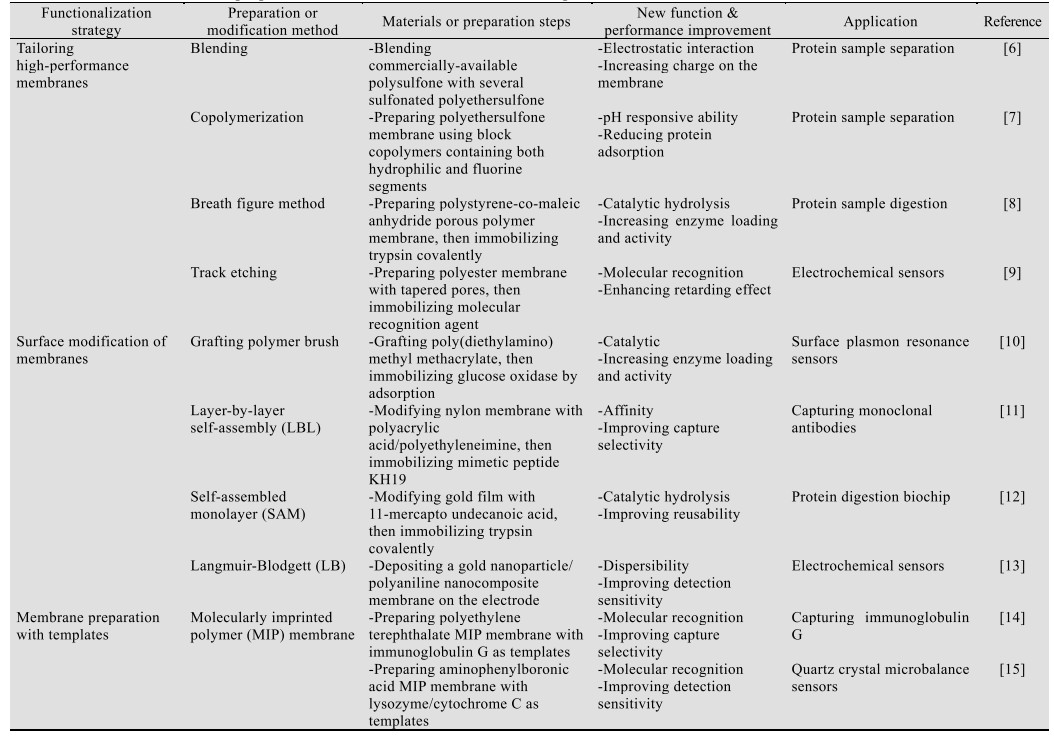
1 分离膜的功能化方法分离膜的材料和结构具有较高的可设计和可加工性,可根据不同的分离和传输需求,改善膜的特异选择性、渗透性和稳定性,或引入额外的相互作用(分子识别、亲和、催化或响应)以提高分离选择性或赋予新的功能。对分离膜的加工和修饰通常有以下3个方向:1)设计具有不同化学性质或特定结构的高性能膜材料;2)对膜表面或孔内进行功能化,赋予膜特定的功能;3)利用模板定制特定形态和结构的功能膜。
对膜材料进行设计,可将不同材料的功能进行组合,制备有机-无机杂化、混合基质或复合膜;对膜功能进行理性设计,可令膜具有特定的分离选择性、表面性质和传输机制;对膜结构进行设计,可定制膜孔几何形状、孔隙率和膜厚度,满足特定的检测需求。
表面功能化可以引入多种相互作用来赋予膜新的功能。可利用膜材料本身的电荷性质或反应性侧基、末端基团直接键合选择性配基或催化剂,也可以先对膜进行改性,即在膜表面偶联聚合物,提供更多的氨基、醛基、环氧基和羧基等反应性基团以提高装载密度。将膜表面活化后可进一步结合亲和配体、生物酶、金属、纳米颗粒等,赋予其分子识别、亲和、催化或响应等功能。
利用模板定制特定结构的功能膜,如分子印迹(Molecularly imprinted polymer,MIP)膜,使用模板分子在聚合物基质上创造空腔,通过形状互补性和多种非共价相互作用(例如氢键、疏水和静电相互作用)的组合提供识别作用。表 1对功能膜的制备和修饰方法进行总结,并结合生物检测中的应用研究,分析其引入的新功能以及对性能的提升。
|
表 1汇总的功能化方法体现了膜技术在生物检测中发挥作用的主要方式和途径。除了引入其他功能,分离膜功能化也需关注其分离选择性的提升和渗透性能的保持,并将膜污染趋势最小化,减少或防止其他物质与膜之间不必要的相互作用,以保障功能膜可以稳定有效地发挥作用。
2 膜技术用于生物样品的前处理基于质谱的蛋白质组学分析中,蛋白质样品的制备非常关键,它决定了分析的灵敏度、准确性和稳定性。样品制备通常包括以下步骤:蛋白质提取、溶解、变性、还原和烷基化以及酶解[16],整个过程极其繁琐,涉及多种溶剂的置换,易造成样品损失和污染。而膜技术可用于蛋白质的分离、酶解以及多肽的富集和纯化,极大地改进了蛋白质样品的制备过程。
2.1 过滤辅助样品制备过滤辅助样品制备(Filter-aided sample preparation,FASP)是一种普遍使用的样品制备方法。利用超滤装置简单离心,使低于切割分子量的变性剂和其他低分子量污染物与蛋白质样品分离。蛋白质大分子被截留在膜上,随后进行酶解处理。在此基础上,研究者利用大孔疏水的聚偏氟乙烯或[17]聚醚砜微滤膜[18]替代亲水的纤维素超滤膜制备过滤器(分离机理从筛分作用变为疏水吸附),降低过滤阻力,以提高分离效率并改善器件的机械性能,改进的96孔板FASP法(称为MStern blotting)能够同步平行处理多个样本(图 1)。尽管FASP减少了溶液置换步骤,可有效防止污染引入,但后续的酶解等步骤仍需要很长时间,且FASP处理微量样品时,会造成一定的肽损失,同时存在洗涤剂未完全去除的问题。

|
| 图 1 改进的96孔板FASP法——聚偏氟乙烯膜通过疏水吸附作用分离蛋白质(该方法源自Western blotting,被称为“MStern blotting”)[17] Fig. 1 Improved fast 96-well plate compatible filter-aided sample processing—polyvinylidene fluoride membrane separates protein by hydrophobic adsorption (This method is derived from the Western blotting process and named"MStern blotting")[17]. |
| |
长时间的酶解过程是样品制备的瓶颈,目前的酶固定化技术可以将消解时间从过夜处理(约15 h)减少到几分钟甚至几秒。已有大量研究将酶固定在有机、无机整体柱、多孔微球等多种载体上,但生物大分子需经过缓慢扩散才能到达结合位点,限制了蛋白质的消解和纯化效率。
酶膜反应器(Enzymatic membrane reactor,EMR)以分离膜作为固定载体,将膜分离过程与酶促反应耦合,利用对流作用加速底物传质同时保证蛋白质消解效率,显著减少死体积,适于微量蛋白质样品的快速消解和分离。Cooper等[19]在毛细管末端插入疏水的多孔聚偏氟乙烯膜,通过疏水吸附在膜上固定胰蛋白酶,该EMR可直接与质谱仪器结合,在几秒内快速水解蛋白质,并证实亚微米级膜孔内的对流传质能够有效消除扩散控制反应动力学的限制。由于膜材料易于整合到在线系统中,EMR可进一步减少繁琐的样品处理步骤和样品损失风险,提高检测精度。Tyan等[12]用两种烷硫醇溶液在镀金膜上形成单层自组装(Self-assembled monolayer,SAM)膜,以1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐/N-羟基琥珀酰亚胺作为偶联剂在SAM膜上固定胰蛋白酶,用二维纳升液相色谱串联质谱技术检测得到的红细胞水解片段,可鉴定出272种红细胞蛋白质(图 2)。此外,EMR改善了酶稳定性和消解效率,可以实现酶的再生和重复使用。Qiao等[8]通过多孔聚合物膜上的马来酸酐基团共价固定胰蛋白酶,重复使用9次后酶活仍能保持在96%以上。通过酶固定化能够改善酶与蛋白质的接触方式,减少酶的自溶,使得消解效率明显提高。膜过滤操作也提供了更加可控的操作方式,通过控制样品在膜面和孔内的停留时间,可限制蛋白质消解以增加序列覆盖。Tan等[20]通过增加单位膜面积的酶固定化密度,同时减少膜厚度,以毫秒级停留时间来限制蛋白质消解,使质谱检测时BSA酶解产物中的大分子肽(3−10 kDa)的序列覆盖率从53% (2 s停留时间)增加至82% (0.05 s) (图 3)。
利用膜的选择性分离功能可实现蛋白质样品的高效浓缩和纯化。参考早期的DNA预浓缩研究,Foote等[21]在微流控装置上利用多孔二氧化硅膜作为相邻通道间的选择性屏障,使得缓冲液通过但截留蛋白质,经过浓缩后的蛋白质样品信号强度提高约600倍左右。Bruening等通过层层自组装(Layer-by-layer self-assembly,LBL)技术开发了一系列功能膜,可用于富集磷酸化肽[22]、纯化多组氨酸标记(His标记)蛋白[23-24]、蛋白酶消解蛋白质样品[20, 25],并将功能膜与其他组件耦合,开发出多种可商业化的蛋白质样品制备器件,如移液吸头[26]、FASP法超滤离心过滤器[27] (图 4)。Liu等[11]使用固定模拟肽段KH19的多孔尼龙膜,可以在5 min甚至更短时间内高选择性地捕获人体血清中的赫赛汀,未来可以进一步开发制成旋转膜或96孔板等器件。
总之,对膜进行不同的功能化设计,可以完成分离纯化、富集、消解、脱盐等蛋白质样品制备步骤,并且易于整合到商业化在线检测系统,简化样品处理步骤并且避免样品损失。Yang等[28]通过制备两个热响应聚苯乙烯马来酸酐共聚物多孔膜反应器,固定胰蛋白酶、凝集素,可分别完成蛋白质酶解和富集处理,通过全自动连续操作,整个预处理可以在1 h内完成(图 5)。
基于膜的多功能特征,膜技术被广泛应用于生物传感器、生物芯片中。首先,膜材料可提供选择性通道,控制分析物或分子探针的传输效率,排除其他非特异物质的信号干扰。一些导电聚合物膜由于其良好的电子转移效率,在检测中发挥信号传输作用。此外,良好的生物相容性,使得膜材料可作为检测元件与外部环境的屏障,以获得稳定的检测性能。同时,膜材料也作为固定受体或功能化的基质,集成整个检测系统。进一步优化膜材料的某一功能,或充分发挥以上功能的协同作用,可制备出具有高性能的生物检测元件。
3.1 传质响应膜利用功能膜(修饰抗体、酶、互补DNA、纳米颗粒等),能够对分析物进行识别和选择性分离[11, 29]。同时,膜材料具有高比表面积,离子在膜孔内的对流传质会由于相互作用的改变(孔径筛分和电荷排斥等)产生显著变化。生物大分子在功能膜表面发生特异性结合后,可产生阻滞效应,改变离子传输通量,从而产生信号响应。因此,可通过设计膜材料的孔尺寸和形状来控制传输通量,实现定量检测。Martin等[9]制备了具有锥形孔的聚酯功能膜,当蛋白质分析物与识别位点特异性结合时,可导致离子电流在锥形孔处完全堵塞,扩大了离子传输时的变化通量,提高了传感器的灵敏度。利用免疫球蛋白G等不同分子识别剂修饰锥形孔膜,可有效检测相应的蛋白质分析物。Zhou等[30]制备了可特异性识别李斯特菌的多孔阳极氧化铝膜,当李斯特菌与适体结合时,会造成膜孔堵塞和表面电荷增加,从而降低电化学探针Fe(CN)63-的扩散通量,产生信号响应,该传感器可在10 min内快速检测细菌,灵敏度高达100 CFU/mL,线性范围介于100到1 250 CFU/mL之间。在之后研究中,他们使用电沉积的方法,在电极表面形成纳米孔阵列的阳极氧化铝膜,通过控制膜的孔径、孔密度以及膜厚度,扩大了空间阻滞和电荷排斥作用,在检测miRNA-155时显示出优异的灵敏度和选择性[31] (图 6)。
导电聚合物薄膜,例如聚噻吩[32-33]、聚苯胺[13]、聚吡咯[34-36]、Nafion[36-37]等,具有良好的生物相容性、电子转移效率和环境稳定性,已被广泛作为传感器中的响应元件[29]。将导电聚合物与金、碳纳米管等有机或无机材料掺杂制备出复合膜[13, 33],可以进一步改善原始单一材料的表面性质、导电和机械性能、生物相容性等。Zou等[13]通过Langmuir-Blodgett (LB)技术将金纳米颗粒/聚苯胺纳米复合薄膜沉积在玻碳电极的表面,制备用于检测肾上腺素和尿酸的新型伏安传感器,导电聚苯胺薄膜可以在不损失金纳米颗粒良好导电性的条件下,控制颗粒间距,提供更好的电极性能。导电聚合物薄膜层易于固定生物分子,同时,可排除其他非特异物质的信号干扰,维持生物分子的稳定性[38]。Dadarwal等[34]在聚吡咯改性的聚碳酸酯膜电极上通过静电吸附固定沙门氏菌宿主细胞,噬菌体存在时会裂解膜电极上的宿主细胞,裂解产物导致聚吡咯的阻抗增加,据此检测环境中噬菌体的浓度。Canovas等[37]利用涂有Nafion膜的铂化滤纸构建快速、灵敏检测人体葡萄糖的纸基电位计。用两层Nafion膜以“三明治”结构固定葡萄糖氧化酶(Glucose oxidase,GOx),通过酶促反应产生电位变化,同时,Nafion可以有效防止氧化还原阴离子(如抗坏血酸)的干扰作用,显著提高电位响应[39],获得高灵敏度的电位传感器,在0.3–3 mmol/L范围内,将底物稀释10倍可引起(–95.9±4.8) mV的信号响应变化。这种简单、稳定、低成本的电位测量装置,也体现出以膜技术集成整个检测系统的优势。
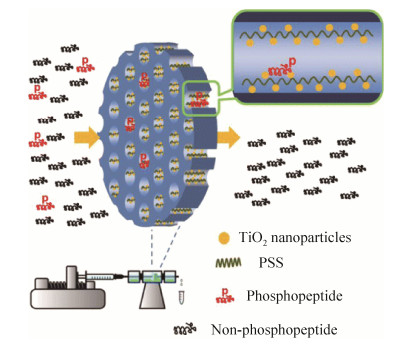
3.3 生物相容保护膜生物样品成分复杂,会对检测器的长期使用稳定性产生负面影响。因此,膜材料的生物相容性和防污性能也引起许多研究者的关注,其目的是改善膜材料与生物样品的接触方式,最小化蛋白质的非特异性吸附,避免额外的生物排异反应。Liu等[40]在聚砜膜上接枝磺化羟丙基壳聚糖,大幅提高膜的亲水性,使膜材料具有良好的抗菌性能和血液相容性。构建仿生涂层也是一种优化生物相容性且不损失灵敏度的方法(图 7)。Liu等[41]通过电沉积方法,用仿生聚合物-两性离子磷酸胆碱功能化碳纤维微电极表面,形成超薄仿生膜,两性离子磷酸胆碱涂层不仅能抵抗蛋白质吸附,还能保持灵敏度和长时间稳定响应。
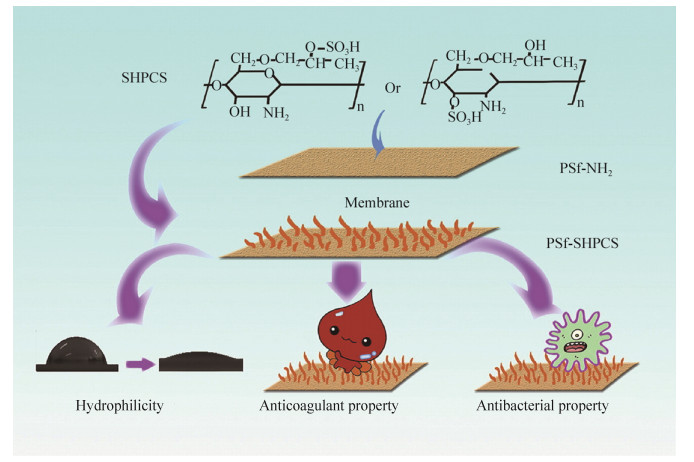
前两部分指出了膜技术在生物检测中的多种功能,也有研究将两种以上的功能集成,充分发挥各功能之间的协同作用,利用膜集成技术制备出多种可原位或植入检测的高效生物传感器。Chu等[42]设计了具有分离层(致密微孔)和传感层(孔径较大)的新型传感膜,可同步实现血液分离和检测。分离层利用膜孔筛分作用,仅允许血清进入内部通道,固定GOx的传感层具有良好电导率可有效地进行电子传输(图 8)。Fang等[43]使用聚苯胺纳米纤维膜作为酶固定化材料,聚氨酯/环氧改性聚氨酯双层涂层作为保护膜,制备皮下微创葡萄糖生物传感器。高孔隙率的聚苯胺纳米纤维能够固定更多GOx,并保持传感器的灵敏度。引入环氧改性聚氨酯涂层与聚氨酯层结合可以增强膜的机械稳定性和生物相容性,该传感器在体内实验中可对血糖变化作出灵敏响应,持续稳定工作26 d。Chen等[44]通过在聚苯胺纳米纤维膜上进行铂纳米颗粒、葡萄糖氧化酶的逐层沉积来制作针电极,掺入铂纳米颗粒的聚苯胺膜通过静电吸附固定GOx,可提供高比表面积和良好导电性,保持GOx的电催化活性。引入多孔聚偏氟乙烯和纳米球Nafion两种生物相容的复合涂层可以控制葡萄糖以稳定扩散速率与电极接触,并有效防止阴离子物质和蛋白质粘附引起的干扰,增加了传感器的体内检测寿命。在体内实验中,该传感器具有3周以上的寿命及优异的重现性(图 9)。Zhou等[45]在以上研究的基础上,设计了可穿戴在GOx酶固定化针孔电极上的复合保护膜。以聚砜中空纤维膜为外膜,通过LBL方法在聚砜中空纤维膜内表面形成壳聚糖和海藻酸钠内膜。调整外膜的孔径和孔隙率,通过限域传质和催化来优化反应,使传感器保持最佳性能。壳聚糖/海藻酸钠内膜可以促进膜与电极之间的电子传输作用,并且提供更好的生物相容微环境,使酶保持最佳活性。
膜本身的多种功能以及通过修饰赋予的新功能使膜技术在生物样品制备和检测中的应用越来越广泛,但现代生物检测技术对其提出了更高的要求,比如:1)更精确地控制膜的微观结构,更高效地修饰膜表面和负载配体或催化剂,并保持固定化酶的稳定性,这需要更深入地对膜材料结构和功能进行理性设计。2)进一步精简处理步骤(蛋白质变性、脱盐等),避免稀释或对样品进行其他操作,消除杂质干扰。未来可继续开展膜集成技术方面的研究,建立可同步分离纯化、酶解、富集的膜集成平台;也可以进一步开发可在线处理或易于商业化的膜组件,使样品处理更适合于后续的仪器分析,提高分析方法的选择性、灵敏度和准确度,保证检测结果的重现性。3)改善检测系统的灵敏度和线性范围,简化检测流程,使检测过程更加智能化,使设备易于小型化、便携化。这要求进一步提升膜材料的导电性、生物相容性、防污性能等。同时,开发“适应”检测环境的新型功能化膜也是一个重要思路,如制备选择性和渗透性可变化的“智能”响应性膜,以及通过特定的孔结构和配体协同作用的“仿生”膜。
总之,构建更加灵敏和实用的生物检测器件,建立更“适应”检测环境的高效、稳定检测平台是未来研究关注的重点。更好地发挥膜材料多层次结构和多功能的优势,可对生物检测平台的构建提供极大便利,因此未来膜技术将成为生物检测技术研究和应用中的重要部分。
| [1] |
Ulbricht M. Advanced functional polymer membranes. Polymer, 2006, 47(7): 2217-2262. DOI:10.1016/j.polymer.2006.01.084 |
| [2] |
Svec F, Frechet JMJ. New designs of macroporous polymers and supports: from separation to biocatalysis. Science, 1996, 273(5272): 205-211. DOI:10.1126/science.273.5272.205 |
| [3] |
Sirkar KK, Shanbhag PV, Kovvali AS. Membrane in a reactor: a functional perspective. Ind Eng Chem Res, 1999, 38(10): 3715-3737. DOI:10.1021/ie990069j |
| [4] |
Mohammad M, Razmjou A, Liang K, et al. Metal-Organic-Framework-based enzymatic microfluidic biosensor via surface patterning and biomineralization. ACS Appl Mater Interfaces, 2019, 11(2): 1807-1820. DOI:10.1021/acsami.8b16837 |
| [5] |
Lopes IC, Zebda A, Vadgama P. New directions in membrane designs for biosensors. Curr Opin Electrochem, 2018, 12: 107-112. DOI:10.1016/j.coelec.2018.07.009 |
| [6] |
Emin C, Kurnia E, Katalia I, et al. Polyarylsulfone-based blend ultrafiltration membranes with combined size and charge selectivity for protein separation. Sep Purif Technol, 2018, 193: 127-138. DOI:10.1016/j.seppur.2017.11.008 |
| [7] |
Zhao XT, Su YL, Chen WJ, et al. pH-responsive and fouling-release properties of PES ultrafiltration membranes modified by multi-functional block-like copolymers. J Membr Sci, 2011, 382(1/2): 222-230. |
| [8] |
Qiao J, Kim JY, Wang YY, et al. Trypsin immobilization in ordered porous polymer membranes for effective protein digestion. Anal Chim Acta, 2016, 906: 156-164. DOI:10.1016/j.aca.2015.11.042 |
| [9] |
Siwy Z, Trofin L, Kohli P, et al. Protein biosensors based on biofunctionalized conical gold nanotubes. J Am Chem Soc, 2005, 127(14): 5000-5001. DOI:10.1021/ja043910f |
| [10] |
Del Castillo GFD, Koenig M, Müller M, et al. Enzyme immobilization in polyelectrolyte brushes: high loading and enhanced activity compared to monolayers. Langmuir, 2019, 35(9): 3479-3489. DOI:10.1021/acs.langmuir.9b00056 |
| [11] |
Liu WJ, Bennett AL, Ning WJ, et al. Monoclonal antibody capture and analysis using porous membranes containing immobilized peptide mimotopes. Anal Chem, 2018, 90(20): 12161-12167. DOI:10.1021/acs.analchem.8b03183 |
| [12] |
Tyan YC, Jong SB, Liao JD, et al. Proteomic profiling of erythrocyte proteins by proteolytic digestion chip and identification using two-dimensional electrospray ionization tandem mass spectrometry. J Proteome Res, 2005, 4(3): 748-757. DOI:10.1021/pr0497780 |
| [13] |
Zou LN, Li YF, Cao SK, et al. Gold nanoparticles/polyaniline langmuir-blodgett film modified glassy carbon electrode as voltammetric sensor for detection of epinephrine and uric acid. Talanta, 2013, 117: 333-337. DOI:10.1016/j.talanta.2013.09.035 |
| [14] |
Yin DX, Ulbricht M. Antibody-imprinted membrane adsorber via two-step surface grafting. Biomacromolecules, 2013, 14(12): 4489-4496. DOI:10.1021/bm401444y |
| [15] |
Rick J, Chou TC. Imprinting unique motifs formed from protein-protein associations. Anal Chim Acta, 2005, 542(1): 26-31. DOI:10.1016/j.aca.2004.12.051 |
| [16] |
Kulak NA, Pichler G, Paron I, et al. Minimal, encapsulated proteomic-sample processing applied to copy-number estimation in eukaryotic cells. Nat Methods, 2014, 11: 319-324. DOI:10.1038/nmeth.2834 |
| [17] |
Berger ST, Ahmed S, Muntel J, et al. MStern blotting-high throughput polyvinylidene fluoride (PVDF) membrane-based proteomic sample preparation for 96-well plates. Mol Cell Proteomics, 2015, 14(10): 2814-2823. DOI:10.1074/mcp.O115.049650 |
| [18] |
Potriquet J, Laohaviroj M, Bethony JM, et al. A modified FASP protocol for high-throughput preparation of protein samples for mass spectrometry. PLoS ONE, 2017, 12(7): e0175967. DOI:10.1371/journal.pone.0175967 |
| [19] |
Cooper JW, Chen JZ, Li Y, et al. Membrane-based nanoscale proteolytic reactor enabling protein digestion, peptide separation, and protein identification using mass spectrometry. Anal Chem, 2003, 75(5): 1067-1074. DOI:10.1021/ac025768b |
| [20] |
Tan YJ, Wang WH, Zheng Y, et al. Limited proteolysis via millisecond digestions in protease-modified membranes. Anal Chem, 2012, 84(19): 8357-8363. DOI:10.1021/ac3019153 |
| [21] |
Foote RS, Khandurina J, Jacobson SC, et al. Preconcentration of proteins on microfluidic devices using porous silica membranes. Anal Chem, 2005, 77(1): 57-63. DOI:10.1021/ac049136w |
| [22] |
Tan YJ, Sui D, Wang WH, et al. Phosphopeptide enrichment with TiO2-modified membranes and investigation of tau protein phosphorylation. Anal Chem, 2013, 85(12): 5699-5706. DOI:10.1021/ac400198n |
| [23] |
Bhattacharjee S, Dong JL, Ma YD, et al. Formation of high-capacity protein-adsorbing membranes through simple adsorption of poly(acrylic acid)-containing films at low pH. Langmuir, 2012, 28(17): 6885-6892. DOI:10.1021/la300481e |
| [24] |
Ning WJ, Wijeratne S, Dong JL, et al. Immobilization of carboxymethylated polyethylenimine-metal-ion complexes in porous membranes to selectively capture His-tagged protein. ACS Appl Mater Interfaces, 2015, 7(4): 2575-2584. DOI:10.1021/am507607j |
| [25] |
Xu F, Wang WH, Tan YJ, et al. Facile trypsin immobilization in polymeric membranes for rapid, efficient protein digestion. Anal Chem, 2010, 82(24): 10045-10051. DOI:10.1021/ac101857j |
| [26] |
Ning WJ, Bruening ML. Rapid protein digestion and purification with membranes attached to pipet tips. Anal Chem, 2015, 87(24): 11984-11989. DOI:10.1021/acs.analchem.5b03679 |
| [27] |
Liu WJ, Pang YL, Tan HY, et al. Enzyme-containing spin membranes for rapid digestion and characterization of single proteins. Analyst, 2018, 143(16): 3907-3917. DOI:10.1039/C8AN00969D |
| [28] |
Yang JS, Qiao J, Kim JY, et al. Online proteolysis and glycopeptide enrichment with thermoresponsive porous polymer membrane reactors for nanoflow liquid chromatography-tandem mass spectrometry. Anal Chem, 2018, 90(5): 3124-3131. DOI:10.1021/acs.analchem.7b04273 |
| [29] |
Prajapati DG, Kandasubramanian B. Progress in the development of intrinsically conducting polymer composites as biosensors. Mcromol Cem Pys, 2019, 220(10): 1800561. |
| [30] |
Zhou CX, Mo RJ, Chen ZM, et al. Quantitative label-free Listeria analysis based on aptamer modified nanoporous sensor. ACS Sens, 2016, 1(8): 965-969. DOI:10.1021/acssensors.6b00333 |
| [31] |
Li CY, He L, Jiang SQ, et al. Ultrasensitive detection of microRNA using an array of Au nanowires deposited within the channels of a porous anodized alumina membrane. Electrochem Commun, 2019, 102: 19-24. DOI:10.1016/j.elecom.2019.03.008 |
| [32] |
Fabiano S, Tran-Minh C, Piro B, et al. Poly 3, 4-ethylenedioxythiophene as an entrapment support for amperometric enzyme sensor. Mater Sci Eng C, 2002, 21(1/2): 61-67. |
| [33] |
Rahman MM, Shiddiky MJA, Rahman MA, et al. A lactate biosensor based on lactate dehydrogenase/nictotinamide adenine dinucleotide (oxidized form) immobilized on a conducting polymer/multiwall carbon nanotube composite film. Anal Biochem, 2009, 384(1): 159-165. DOI:10.1016/j.ab.2008.09.030 |
| [34] |
Dadarwal R, Namvar A, Thomas DF, et al. Organic conducting polymer electrode based sensors for detection of Salmonella infecting bacteriophages. Mater Sci Eng C, 2009, 29(3): 761-765. DOI:10.1016/j.msec.2008.07.010 |
| [35] |
Arora K, Chaubey A, Singhal R, et al. Application of electrochemically prepared polypyrrole-polyvinyl sulphonate films to DNA biosensor. Biosens Bioelectron, 2006, 21(9): 1777-1783. DOI:10.1016/j.bios.2005.09.002 |
| [36] |
Cordeiro CA, de Vries MG, Cremers TIFH, et al. The role of surface availability in membrane-induced selectivity for amperometric enzyme-based biosensors. Sens Actuat B: Chem, 2016, 223: 679-688. DOI:10.1016/j.snb.2015.09.029 |
| [37] |
Cánovas R, Parrilla M, Blondeau P, et al. A novel wireless paper-based potentiometric platform for monitoring glucose in blood. Lab Chip, 2017, 17(14): 2500-2507. DOI:10.1039/C7LC00339K |
| [38] |
Cosnier S. Biosensors based on electropolymerized films: new trends. Anal Bioanal Chem, 2003, 377(3): 507-520. DOI:10.1007/s00216-003-2131-7 |
| [39] |
Parrilla M, Cánovas R, Andrade FJ. Enhanced Potentiometric detection of hydrogen peroxide using a platinum electrode coated with nafion. Electroanalysis, 2017, 29(1): 223-230. DOI:10.1002/elan.201600403 |
| [40] |
Liu TM, Xu JJ, Qiu YR. A novel kind of polysulfone material with excellent biocompatibility modified by the sulfonated hydroxypropyl chitosan. Mater Sci Eng: C, 2017, 79: 570-580. DOI:10.1016/j.msec.2017.05.103 |
| [41] |
Liu XM, Xiao TF, Wu F, et al. Ultrathin cell-membrane-mimic phosphorylcholine polymer film coating enables large improvements for in vivo electrochemical detection. Angewand Chem Int Ed, 2017, 56(39): 11802-11806. DOI:10.1002/anie.201705900 |
| [42] |
Chu ZY, Li LL, Liu GP, et al. A novel membrane with heterogeneously functionalized nanocrystal layers performing blood separation and sensing synchronously. Chem Commun, 2016, 52(86): 12706-12709. DOI:10.1039/C6CC05334C |
| [43] |
Fang L, Liang B, Yang G, et al. A needle-type glucose biosensor based on PANI nanofibers and PU/E-PU membrane for long-term invasive continuous monitoring. Biosensors Bioelectron, 2017, 97: 196-202. DOI:10.1016/j.bios.2017.04.043 |
| [44] |
Chen DJ, Wang C, Chen W, et al. PVDF-nafion nanomembranes coated microneedles for in vivo transcutaneous implantable glucose sensing. Biosens Bioelectron, 2015, 74: 1047-1052. DOI:10.1016/j.bios.2015.07.036 |
| [45] |
Zhou J, Ma Z, Hong X, et al. Top-down strategy of implantable biosensor using adaptable, Porous Hollow Fibrous Membrane. ACS Sens, 2019, 4(4): 931-937. DOI:10.1021/acssensors.9b00035 |
 2019, Vol. 35
2019, Vol. 35