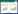中国科学院微生物研究所、中国微生物学会主办
文章信息
- 董子阳, 胡佳杰, 胡宝兰
- Dong Ziyang, Hu Jiajie, Hu Baolan
- 微生物铁载体转运调控机制及其在环境污染修复中的应用
- Regulation of microbial siderophore transport and its application in environmental remediation
- 生物工程学报, 2019, 35(11): 2189-2200
- Chinese Journal of Biotechnology, 2019, 35(11): 2189-2200
- 10.13345/j.cjb.190163
-
文章历史
- Received: April 25, 2019
- Accepted: June 25, 2019
- Published: July 22, 2019
铁(Fe)是几乎所有微生物生长所必需的元素,在氧代谢、电子转移以及DNA和RNA合成等过程中起着催化剂的作用[1]。铁对生物膜的形成也是必不可少的,它起着调节表面运动和稳定多糖基质的作用[2-3];在缺铁的生长条件下,微生物表面疏水性降低,导致生物膜的形成受到限制[4]。尽管铁是地壳中第四大元素,但由于铁大多以氧化态或氢氧化态的形式存在,其溶解度极低。环境中的游离铁离子浓度为皮摩尔级别,而微生物生长需要毫摩尔级别浓度的铁[5]。因此,微生物进化出了多种吸收铁的途径,其中最主要的途径是铁载体依赖的铁吸收途径。铁载体是由微生物产生的高亲和力低分子量的金属螯合剂(200–2 000 Da)[6]。铁载体的作用主要是螯合铁,但它也与环境中的其他金属元素(例如Mo、Mn、Co和Ni)螯合[7-8],研究表明,铁载体不仅在微生物营养方面起着重要作用,而且在环境应用中也起着重要的作用。比如,铁载体对一些金属离子在环境中的迁移性有影响[9-11],因此其能够用来修复重金属污染。在这篇综述中,我们将讨论微生物铁载体的转运调控机制及其在环境污染修复领域中的应用进展。
1 铁载体的种类铁载体根据化学性质的差异可分为氧肟酸盐、儿茶酚盐和羧酸盐三类。除上述类型外,某些铁载体也可归为混合型(表 1)。
| Types of siderophore | Name of siderophore | Siderophore-producing microorganism | References |
| Hydroxamic salt type | Pvoverdine | Pseudomonas fluorescens | [12] |
| Fusarinine C | Aspergillus nidulans | [13] | |
| Catechol salt type | Enterobactin | Escherichia coli | [15] |
| Salmochelin | Klebsiella pneumoniae | [15] | |
| Carboxylates type | Rhizobactin | Rhizobium meliloti | [16] |
| Staphyloferrin A | Staphylococcus aureus | [16] | |
| Mixed type | Heterobactin | Rhodococcus erythropolis | [15] |
| Aerobactin | Escherichia coli | [15] |
氧肟酸盐型铁载体是自然界中最常见的铁载体,这些铁载体由细菌和真菌产生。在细菌中,这些亲水性的铁载体是由酰化和羟化的烷胺组成的,比如由荧光假单胞菌Pseudomonas fluorescens产生的铁载体荧光嗜铁素pyoverdine;而在真菌中,它们是由羟基化和烷基化鸟氨酸组成的[12],比如由木霉菌Trichoderma spp.产生的粪生素coprogens。除了由烟曲霉菌Aspergillus nidulans产生的含有酯键的铁载体镰菌素fusarinine C,其他的氧肟酸盐铁载体都含有肽链[13]。氧肟酸盐铁载体上的羟甲酸基团的2个氧分子和铁之间形成一个双齿配体,每种氧肟酸盐铁载体都能与铁离子形成六齿八面体配合物,其结合常数在1022–1032 L/mol之间[14]。
1.2 儿茶酚盐型铁载体儿茶酚盐型铁载体只存在于细菌中,如由大肠杆菌Escherichia coli产生的肠杆菌素enterobactin、由肺炎克雷伯菌Klebsiella pneumoniae分泌的salmochelin[15]。这种类型的铁载体由儿茶酚酸酯和羟基组成,具有与氨基酸偶联的二羟基苯甲酸(DHBA),相邻的羟基或邻苯二酚末端可以与Fe3+结合[16]。这种铁载体具有亲脂性、与铁亲和力极高、对环境pH变化抵抗力强等特点[17]。儿茶酚酸盐铁载体基团通过提供2个氧原子与铁螯合形成六齿八面体配合物,肠杆菌素enterobactin与铁的结合常数高达1052 L/mol。
1.3 羧酸盐型铁载体羧酸盐型铁载体由少数细菌产生,如由苜蓿根瘤菌Rhizobium meliloti产生的根瘤菌素rhizobactin。这些铁载体由柠檬酸或β-羟基天冬氨酸组成,例如由金黄色葡萄球菌Staphylococcus aureus产生的staphyloferrin A中含有1个D-鸟氨酸和2个由2个酰胺键连接的柠檬酸残基。这些铁载体可以通过羧基和羟基与铁原子结合。
有些生物能够产生既含有儿茶酚盐又含有氧肟酸盐的混合型铁载体,例如由硫红球菌Rhodococcus erythropolis产生的heterobactin[16],由大肠杆菌E. coli产生的气杆菌素aerobactin[15]。
2 铁载体转运机制 2.1 铁载体的吸收机制在革兰氏阴性细菌中,每个铁-铁载体复合物都被一个特定的外膜受体(OMR)识别,虽然OMR极其多样,不同的细菌种类和不同的铁载体类别有不同的受体,但普遍模式是,OMR与内膜蛋白TonB相互作用,以促进铁-铁载体复合体的吸收。目前的模型表明,TonB将内膜蛋白ExbB和ExbD以及正常细胞呼吸时在周质中产生的电化学质子动力势产生的能量传递给OMR,从而导致OMR的构象变化。OMR的构象变化促进铁-铁载体复合物向细胞内转运(图 1)[18]。在大肠杆菌E. coli中,铁载体肠杆菌素enterobactin被外膜受体FepA识别,一旦肠杆菌素enterobactin穿过外膜,周质结合蛋白(PBP) FepB就会将其运送到内膜,在内膜上,由FepC、FepD和FepG组成的复合物将肠杆菌素enterobactin运输到细胞质中。其他铁载体的吸收机制略有不同,例如铜绿假单胞菌Pseudomonas aeruginosa的铁-pyoverdine被OMR吸收后,在周质结合蛋白FpvC和FpvF的作用下,荧光嗜铁素pyoverdine在周质内被水解。铁被ABC转运体复合体FpvDE泵入细胞质,而没有铁结合的荧光嗜铁素pyoverdine被分泌回环境中以收集更多的铁[19]。
革兰氏阳性菌,如金黄色葡萄球菌S. aureus,只有一层细胞膜,因此具有更简单的铁载体吸收系统。一般来说,革兰氏阳性菌表达铁载体结合蛋白(SBP)及其相应的通透酶。SBP与胞外铁载体的结合导致SBP-通透酶复合物的构象改变,从而使铁载体跨膜进入细胞质。在金黄色葡萄球菌S. aureus中,羧酸盐型铁载体staphyloferrin A和staphyloferrin B分别被膜结合蛋白HtsA和SirA识别。当staphyloferrin与SBP结合时,这些蛋白质发生构象变化,激活通透酶HtsBC或SirBC,使staphyloferrin穿过细胞膜[15]。
2.2 铁载体的外排机制在生物合成之后,铁载体被分泌到培养基中以获取铁[15]。铁载体的分泌是微生物铁获取过程中研究较少的一个步骤。有几种不同的分泌系统参与了这一过程,包括主要协同转运超家族转运蛋白MFS (Major facilitator superfamily)和耐药、结瘤和细胞分裂超家族RND (Resistance- nodulation-division)外排泵。许多依赖NRPS合成途径的铁载体基因簇都含有MFS转运蛋白编码基因。MFS家族蛋白是最大的一类转运蛋白,大多数MFS蛋白含有12个跨膜α螺旋,有些MFS蛋白具有14个甚至更多的跨膜α螺旋[20]。MFS家族蛋白负责转运离子、碳水化合物、脂质、肽、核苷和其他初级和次生代谢产物等,从细菌到人类其氨基酸序列都是保守的[21]。
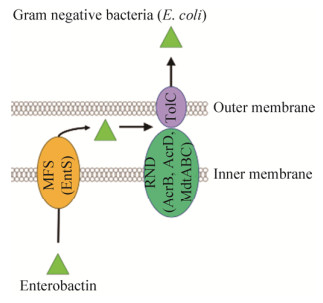
在革兰氏阴性菌大肠杆菌E. coli中,apo-enterobactin是由受Fur蛋白调节的ent-fep基因簇编码的43 kDa的MFS转运蛋白Ents转运的(图 2)[22]。Ents通过细胞质膜外排肠杆菌素enterobactin,突变株ΔentSΔfepA显著减少了肠杆菌素enterobactin的分泌。革兰氏阳性菌枯草芽孢杆菌Bacillus subtilis的MFS蛋白YmfE参与了铁载体bacillibactin的分泌[23]。YmfE突变株的bacillibactin分泌不足,不能在缺铁培养基中生长。
除了MFS家族蛋白外,RND超家族蛋白是一组普遍存在的质子反转运蛋白,在革兰氏阴性细菌中尤为常见。该家族蛋白促进了重金属、外源化合物和铁载体的主动外流[24]。铜绿假单胞菌P. aeruginosa铁调节的MexAB-OprM系统是在铁载体荧光嗜铁素pyoverdin分泌中发现的第一个RND泵[25]。在大肠杆菌E. coli中,TolC与MFS转运蛋白互补,负责将铁载体肠杆菌素enterobactin流出外膜[26-27]。TolC是一种跨外膜蛋白,是RND泵AcrAB-TolC的重要组成部分,该复合物是一种细菌抗生素的通用转运体,并具有对有毒物质的耐受性,该复合物的结构已经被解析清楚[28]。AcrAB-TolC泵由AcrB、AcrA、TolC三种蛋白以3:6:3的比例组成。AcrA通过发夹结构域与TolC相互作用,并通过β桶状结构域和膜近端结构域与AcrB连接。AcrAB在大肠杆菌E. coli肠杆菌素enterobactin分泌中发挥的作用尚不完全清楚,三重突变株ΔacrBΔacrDΔmdtABC会导致肠杆菌素enterobactin分泌减少[29],说明EntS在肠杆菌素enterobactin分泌过程中发挥着重要作用。AcrAD和MdtABC是另外两个依赖于TolC的RND外排泵。此外,MmpS5-MmpL5 (或4)RND外排泵是AcrAB的同源物,已被确认为是结核分枝杆菌Mycobacterium tuberculosis中一个重要的铁载体外排系统[30],MmpS5-MmpL5受转录调节因子Rv0678的调节[31]。缺少mmpS4和mmpS5基因的突变体不会影响铁载体羧基分枝杆菌素carboxymycobactin[32]的吸收,但会在低铁条件下使细胞生长速度变慢[32]。
3 铁载体合成与转运调控机制 3.1 铁吸收调控蛋白调控铁载体合成与转运微生物通过铁载体来获得生长所需要的铁,然而过量的铁对细胞是有毒的,因此微生物必须严格控制胞内的铁含量。在革兰氏阴性和低GC含量革兰氏阳性菌中,调节胞内铁平衡和铁载体利用的蛋白是Fur蛋白[33]。在GC含量较高的革兰氏阳性菌如链霉菌Streptomyces和分枝杆菌Mycobacteriums中,DtxR家族蛋白起着调控胞内铁平衡和铁载体利用的作用[33]。而在真菌酿酒酵母Saccharomyces cerevisiae中AFT1/2蛋白发挥着铁吸收调控蛋白的作用[34]。目前研究得比较清楚的铁吸收调控系统是大肠杆菌E. coli中的Fur (Ferric uptake regulation)系统[35]。在高浓度铁的条件下,过量的铁离子与Fur蛋白结合,Fur具有活性,与铁载体合成基因和铁转运基因上游的特异序列结合,从而抑制铁载体合成和铁转运基因的转录,同时Fur通过小RNA RyhB来间接促进储铁蛋白的表达,以防止胞内过量的铁发生芬顿反应产生羟基自由基损伤细胞;而在低铁浓度条件下,Fur蛋白上没有铁离子结合,Fur失去了活性,从而解除了对铁载体合成基因和铁转运基因转录的阻遏,间接抑制了储铁蛋白的表达[33](图 3)。

|
| 图 3 铁吸收蛋白调控示意图 Fig. 3 Schematic diagram of ferrous uptake regulator regulation. |
| |
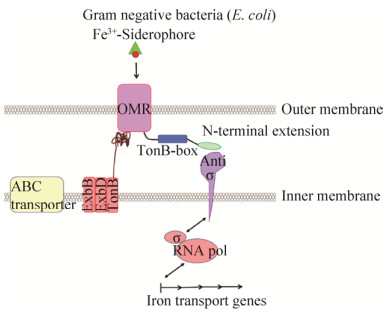
σ因子几乎存在于所有的细菌中,调节许多基因的转录,包括周质蛋白和外膜蛋白的基因转录[36],一个共同的特征是σ因子的活性受抗σ因子的调节,σ因子和抗σ因子通常是共表达的。一般来说,在没有外界刺激的情况下,抗σ因子通常抑制σ因子;而在外界特定的刺激下,该种抑制解除。σ因子参与了铁载体的合成和吸收(图 4)[37],例如铜绿假单胞菌P. aeruginosa的PvdS、荧光假单胞菌Pseudomonas fluorescens的PbrA、恶臭假单胞菌Pseudomonas putida的PfrI和PupI以及大肠杆菌E. coli K-12的FecI[38]。大肠杆菌E. coli K-12中σ因子调节铁载体合成和吸收机制研究得比较清楚,FecA是大肠杆菌E. coli K-12中转运citrate-Fe的受体,fecA是属于fecABCDE操纵子的,而fecABCDE的转录依赖于σ因子FecI。当胞外铁载体结合到受体FecA之后,FecA将信号传递到内膜蛋白FecR,FecR将信号穿过内膜传递到FecI,随后FecI指导RNA聚合酶转录fecABCDE操纵子,FecI的活性受抗σ因子FecR的调控,FecA与FecR和FecR与FecI之间的相互作用已经在体内被证明,其中FecA的N-末端和FecR的C-末端相互作用,而FecR的胞质部分和FecI相互作用。
除了铁吸收调控蛋白依赖的调节和σ因子依赖的调节,一些细菌还根据群体感应信号来调节铁载体产生。细菌通过感应群体信号来判断菌群密度和周围环境变化,来调节细胞内不同的功能,并产生相应的表型,如生物膜形成[39-40]、群集运动[41]、生物发光[42]、抗生素的产生和抗药性[43]、药物[44]和毒素的生产[45]。
群体感应调节铁载体产生的具体机制还不清楚,但铁载体的产生明显受某些细菌群体感应的影响,特别是病原菌。在铜绿假单胞菌P. aeruginosa不能产生群体感应信号的突变株ΔlasR中,铁载体荧光嗜铁素pyoverdine的产生受到了影响,而铜绿假单胞菌P. aeruginosa产生的另一种铁载体绿脓杆菌螯铁蛋白pyochelin却不受群体感应信号的影响[46]。相比之下,将洋葱伯克氏菌Burkholderia cepacia产生群体感应信号的基因敲除后,能够产生更多的铁载体ornibactin[47],将群体感应信号的基因回补后,细菌的铁载体产生量又恢复到原来的水平。在哈维氏弧菌Vibrio harveyi中,群体感应信号抑制过量的铁载体产生[48]。
铁载体也可螯合除Fe3+以外的其他金属,但亲和力较低。例如,氧肟酸盐型铁载体去铁胺desferrioxamine B与Ga3+、Al3+和In 3+的形成常数在1020–1028 L/mol之间,而与Fe3+的形成常数为1030 L/mol。荧光嗜铁素pyoverdine与Zn2+、Cu2+和Mn2+的形成常数在1017–1022 L/mol之间,与Fe3+的形成常数为1032 L/mol[49]。绿脓杆菌螯铁蛋白pyochelin的外膜转运蛋白FptA只有当绿脓杆菌螯铁蛋白pyochelin与Fe3+结合时才能高效地转运,尽管Co2+、Ga3+和Ni2+也被转运,但它们的吸收速率比Fe3+低23–35倍。此外,荧光嗜铁素pyoverdine外膜转运蛋白FpvA也能够转运多种金属,但只有Fe3+被高效转运,转运Cu2+、Ga3+、Mn2+、Mn2+、Cu2+和Ni2+的转运效率比转运铁低7–42倍[49]。因此,铁载体的这种结合和转运的特异性可以保证在不妨碍细菌必需元素铁吸收的同时还可以用来去除环境中的重金属。此外,铁载体还可以通过促进微生物的铁吸收,乳化污染物等方式来促进微生物对污染物的降解(表 2)。
| Strain | Type of siderophore | Environmental application | Reference |
| Vibrio sp. S2A Vibrio sp. S1B |
Amphibactin | Promote the degradation petroleum hydrocarbons | [50] |
| Pseudomonas aeruginosa NY3 | Pyochelin | Promote the degradation petroleum hydrocarbons | [54] |
| Streptomyces acidiscabies E13 | Desferrioxamine B, desferrioxamine E, coelichelin | Increase the absorption of Cd in plants | [64] |
| Pseudomonas aeruginosa | Pyoverdine, pyochelin | Increase the absorption of Cr and Pb in plants | [65] |
| Gloephyllum trabeum | NR | Degrade pulps | [75] |
| Coriolus versicolor | NR | Alter the lignin structure | [76] |
海洋生态系统中的石油碳氢化合物污染是主要的环境问题之一。微生物在修复海洋环境中的石油烃起着重要的作用[50]。微生物铁载体通过间接机制参与了石油烃的生物降解,在铁限制条件下促进了降解微生物对铁的获取。Petrobactin是第一个鉴定出的由海洋石油降解菌Marinobacter hydrocarbonoclacticus产生的铁载体[51]。Hickford等[52]从一种石油降解海洋细菌中分离出另一种磺化铁载体petrobactin sulfonate,该铁载体可促进石油降解菌的铁吸收,使用铁载体可能是清除溢油污染的一种良好策略。2010年Gauglitz等[53]在深水地平线石油泄漏后的墨西哥湾分离出来一种海洋弧菌Vibrio spp.,这种菌能够产生一种既亲水又亲油的两亲性铁载体ochrobactins,这种铁载体可有效促进石油碳氢化合物的降解。海洋弧菌Vibrio sp. S2A和Vibrio sp. S1B产生的另一种两亲性铁载体amphibactin通过乳化石油来促进对石油的降解[50]。Zhao等研究发现铁载体绿脓杆菌螯铁蛋白pyochelin能够促进铜绿假单胞菌P. aeruginosa NY3对石油烃的降解[54]。
4.2 重金属污染修复金属在人类文明的发展中起着至关重要的作用[55]。但是,制造业、污泥应用、核电站和采矿等导致了金属污染[56]。铁载体对多种金属如Cr、Cu、Ni、Pb、Zn以及锕系元素Th4+、U4+和Pu4+具有极强的增溶作用[11],同时重金属也可以影响铁载体的产生量,在铜污染的场地中,土壤产铁载体的微生物丰度及铁载体总量增加[57]。铁载体的这种螯合重金属能力主要取决于铁载体与金属形成配合物的稳定常数[58]。铁载体修复重金属污染具有成本低、效率高、无环境污染的优点。近年来,人们对铁载体在金属生物修复中的应用越来越感兴趣。Neubauer及其同事[59]指出,在高pH条件下,铁载体去铁胺desferrioxamine B螯合Co3+的能力比螯合Fe3+的能力更强。褐色固氮菌Azotobacter vinelandii能够产生两种铁载体,即azotochelin和azotobactin,这两种铁载体都能够用来获得金属Mo和V[8]。铜绿假单胞菌P. aeruginosa产生的铁载体绿脓杆菌螯铁蛋白pyochelin可与Ag+、Al3+、Cd2+、Co2+、Cr2+、Cu2+、Eu3+、Ga3+、Hg2+、Mn2+、Ni2+、Pb2+、Sn2+、Tb3+、Tl+、Zn2+等多种金属离子发生螯合反应,然而除Fe3+以外其他金属并不能被细胞所吸收[8],铜绿假单胞菌P. aeruginosa产生的另一种铁载体荧光嗜铁素pyoverdines能从铀矿山废渣中活化U6+、Np5+等金属[60]。Hong等[61]报道了镰刀菌Fusarium solani产生的铁载体在体外对铜和锌的溶解作用。荧光假单胞菌P. fluorescens产生的铁载体能够溶解铀矿山废料(酸浸矿石)中的Fe、Ni和Co。铁载体和重金属螯合后,一种是被超积累植物吸收,例如唐德链霉菌Streptomyces tendae F4通过分泌去铁胺desferrioxamine B、desferrioxamine E、coelichelin来促进向日葵对Cd的吸收[62],铜绿假单胞菌P. aeruginosa分泌的荧光嗜铁素pyoverdine、绿脓杆菌螯铁蛋白pyochelin能够促进玉米对Cr和Pb的吸收[63]。另一种是储存在细菌体内,在被金属污染的土壤中,由放射杆菌Agrobacterium radiobacter产生的铁载体可以去除大约54%的砷[64]。腐皮镰孢菌Fusarium solani和红树林真菌Hypocrea lixii通过分泌铁载体在体内富集铜和锌[1]。
4.3 纸浆生物漂白纸浆和造纸工业能够引起很多环境问题,例如全球变暖、人类毒性、生态毒性、光化学氧化、酸化、硝化和固废等[65-66]。制浆造纸生产中主要产生环境问题的工艺是漂白工艺,该工艺产生的污染物污染空气和水。铁载体被认为是纸浆处理中的有效试剂,它可以使漂白硫酸盐纸浆过程中化学试剂的使用量降低70%[67],这使得铁载体成为造纸工业中环境友好型的试剂。褐腐菌是腐朽木材中主要的微生物类群,褐腐菌能够产生儿茶酚酸盐和羟肟酸盐铁载体[68-69]。例如,从褐腐菌Gloephyllum trabeum中分离到的异羟肟酸盐类铁载体具有介导氧化还原循环过程中还原铁的能力,还原后的铁可以与过氧化氢反应生成氧自由基,分解纤维素、半纤维素和木质纤维素。这种解聚过程被认为是铁载体在纸浆生物漂白中的主要作用[70-71]。此外,Milagres等[72]报道了不同微生物种类产生的铁载体在纸浆生物漂白过程中降低纸浆粘度的能力,他们发现褐腐菌G. trabeum产生的铁载体能降低纸浆粘度,降低幅度为10.8%,而多年生孢子菌Perenniporia medula-panis和花斑癣Tinea versicolor产生的铁载体降解纸浆的降解率分别为13.6%和14.4%。研究还发现,云芝Coriolus versicolor产生的铁载体可以改变木质素的结构,使其更容易降解,从而降低木质素的含量[73]。
5 展望近年来,越来越多的研究表明,铁载体在许多微生物铁吸收过程中发挥着重要作用。人们在解析不同铁载体的化学结构和铁转运所涉及的膜蛋白方面取得了很大进展。铁载体的重要性是显而易见的,它们在环境应用中起着重要的作用,然而还有许多问题需要回答。在铁载体对金属选择性吸收的过程中,微生物的具体作用是什么?为什么微生物会分泌不止一种类型的铁载体来满足它们的矿物质营养需求?在环境应用中,不同铁载体结构的作用是什么?铁是参与碳氮循环微生物生长及发挥正常生理功能所必需的辅因子,关于参与碳氮循环微生物的铁载体的种类及其转运过程的研究目前还很少,微生物的铁载体受体多于它自身能够合成的铁载体种类,这是因为多余的铁载体受体是用来吸收其他微生物合成的铁载体,因此铁载体的生态意义不容忽视。铁载体是否可以通过影响碳氮循环微生物的活性、群落结构及丰度来影响全球微生物的碳氮循环过程?目前已有在脱氮反应器中加入铁来提高脱氮效率的报道,是否可以通过加入铁载体来特异性提高反应器中功能微生物的铁利用效率,在提高其活性的同时提高其丰度?
更多的研究需要集中在寻找有效的方法来利用铁载体进行生物修复,要根据不同污染场地中的污染物种类、微生物群落等因素应用不同种类的铁载体,做到因地制宜,以拓展其在环境中的应用范围并提高修复效率;研究铁载体的结构和含量与微生物的群落结构和功能特征的相互影响,以促进铁载体在环境中的应用。将宏基因组学与化学分析相结合可揭示重要的信息,这些信息可增强目前铁载体环境应用现状,并开发出铁载体的新应用。同时,利用基因工程手段调控铁载体的合成与转运,提高微生物铁载体的产量,降低其应用成本,改造铁载体的结构,使其更适用于环境领域。
| [1] |
Ahmed E, Holmstrom SJM. Siderophores in environmental research: roles and applications. Microb Biotechnol, 2014, 7(3): 196-208. DOI:10.1111/1751-7915.12117 |
| [2] |
Oliveira F, França Â, Cerca N. Staphylococcus epidermidis is largely dependent on iron availability to form biofilms. Int J Med Microbiol, 2017, 307(8): 552-563. DOI:10.1016/j.ijmm.2017.08.009 |
| [3] |
Chung PY. The emerging problems of Klebsiella pneumoniae infections: carbapenem resistance and biofilm formation. FEMS Microbiol Lett, 2016, 363(20): fnw219. DOI:10.1093/femsle/fnw219 |
| [4] |
Liu S, Gunawan C, Barraud N, et al. Understanding, monitoring, and controlling biofilm growth in drinking water distribution systems. Environ Sci Technol, 2016, 50(17): 8954-8976. DOI:10.1021/acs.est.6b00835 |
| [5] |
de Serrano LO, Camper AK, Richards AM. An overview of siderophores for iron acquisition in microorganisms living in the extreme. BioMetals, 2016, 29(4): 551-571. DOI:10.1007/s10534-016-9949-x |
| [6] |
Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores. Anal Biochem, 1987, 160(1): 47-56. |
| [7] |
Bellenger JP, Wichard T, Kustka AB, et al. Uptake of molybdenum and vanadium by a nitrogen-fixing soil bacterium using siderophores. Nat Geosci, 2008, 1(4): 243-246. DOI:10.1038/ngeo161 |
| [8] |
Braud A, Jézéquel K, Bazot S, et al. Enhanced phytoextraction of an agricultural Cr- and Pb-contaminated soil by bioaugmentation with siderophore-producing bacteria. Chemosphere, 2009, 74(2): 280-286. DOI:10.1016/j.chemosphere.2008.09.013 |
| [9] |
Renshaw JC, Robson GD, Trinci APJ, et al. Fungal siderophores: structures, functions and applications. Mycol Res, 2002, 106(10): 1123-1142. DOI:10.1017/S0953756202006548 |
| [10] |
Dahlheimer SR, Neal CR, Fein JB. Potential mobilization of platinum-group elements by siderophores in surface environments. Environ Sci Technol, 2007, 41(3): 870-875. DOI:10.1021/es0614666 |
| [11] |
Schalk IJ, Hannauer M, Braud A. New roles for bacterial siderophores in metal transport and tolerance. Environ Microbiol, 2011, 13(11): 2844-2854. DOI:10.1111/j.1462-2920.2011.02556.x |
| [12] |
Baakza A, Vala AK, Dave BP, et al. A comparative study of siderophore production by fungi from marine and terrestrial habitats. J Exp Mar Biol Ecol, 2004, 311(1): 1-9. DOI:10.1016/j.jembe.2003.12.028 |
| [13] |
Oberegger H, Schoeser M, Zadra I, et al. SREA is involved in regulation of siderophore biosynthesis, utilization and uptake in Aspergillus nidulans. Mol Microbiol, 2001, 41(5): 1077-1089. |
| [14] |
Saha M, Sarkar S, Sarkar B, et al. Microbial siderophores and their potential applications: a review. Environ Sci Pollut Res, 2016, 23(5): 3984-3999. DOI:10.1007/s11356-015-4294-0 |
| [15] |
Wilson BR, Bogdan AR, Miyazawa M, et al. Siderophores in iron metabolism: from mechanism to therapy potential. Trends Mol Med, 2016, 22(12): 1077-1090. DOI:10.1016/j.molmed.2016.10.005 |
| [16] |
Paul A, Dubey R. Characterization of protein involved in nitrogen fixation and estimation of Co-factor. Int J Curr Res Biosci Plant Biol, 2015, 2(1): 89-97. |
| [17] |
Winkelmann G. Microbial siderophore-mediated transport. Biochem Soc Trans, 2002, 30(4): 691-696. DOI:10.1042/bst0300691 |
| [18] |
Klebba PE. ROSET model of TonB action in Gram-negative bacterial iron acquisition. J Bacteriol, 2016, 198(7): 1013-1021. DOI:10.1128/JB.00823-15 |
| [19] |
Schalk IJ, Guillon L. Fate of ferrisiderophores after import across bacterial outer membranes: different iron release strategies are observed in the cytoplasm or periplasm depending on the siderophore pathways. Amino Acids, 2013, 44(5): 1267-1277. DOI:10.1007/s00726-013-1468-2 |
| [20] |
Li K, Chen WH, Bruner SD. Microbial siderophore-based iron assimilation and therapeutic applications. Biometals, 2016, 29(3): 377-88. DOI:10.1007/s10534-016-9935-3 |
| [21] |
Miethke M, Marahiel MA. Siderophore-based iron acquisition and pathogen control. Microbiol Mol Biol Rev, 2007, 71(3): 413-451. DOI:10.1128/MMBR.00012-07 |
| [22] |
Reddy VS, Shlykov MA, Castillo R, et al. The major facilitator superfamily (MFS) revisited. FEBS J, 2012, 279(11): 2022-2035. DOI:10.1111/j.1742-4658.2012.08588.x |
| [23] |
Furrer JL, Sanders DN, Hook-Barnard IG, et al. Export of the siderophore enterobactin in Escherichia coli: involvement of a 43 kDa membrane exporter. Mol Microbiol, 2002, 44(5): 1225-1234. DOI:10.1046/j.1365-2958.2002.02885.x |
| [24] |
Miethke M, Schmidt S, Marahiel MA. The major facilitator superfamily-type transporter YmfE and the multidrug-efflux activator Mta mediate bacillibactin secretion in Bacillus subtilis. J Bacteriol, 2008, 190(15): 5143-5152. DOI:10.1128/JB.00464-08 |
| [25] |
Nikaido H, Pagès JM. Broad-specificity efflux pumps and their role in multidrug resistance of Gram-negative bacteria. FEMS Microbiol Rev, 2012, 36(2): 340-363. DOI:10.1111/j.1574-6976.2011.00290.x |
| [26] |
Li XZ, Nikaido H, Poole K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrob Agents Chemother, 1995, 39(9): 1948-1953. DOI:10.1128/AAC.39.9.1948 |
| [27] |
Bleuel C, Große C, Taudte N, et al. TolC is involved in enterobactin efflux across the outer membrane of Escherichia coli. J Bacteriol, 2005, 187(19): 6701-6707. DOI:10.1128/JB.187.19.6701-6707.2005 |
| [28] |
Pei XY, Hinchliffe P, Symmons MF, et al. Structures of sequential open states in a symmetrical opening transition of the TolC exit duct. Proc Natl Acad Sci USA, 2011, 108(5): 2112-2117. DOI:10.1073/pnas.1012588108 |
| [29] |
Du DJ, Wang Z, James NR, et al. Structure of the AcrAB-TolC multidrug efflux pump. Nature, 2014, 509(7501): 512-515. DOI:10.1038/nature13205 |
| [30] |
Horiyama T, Nishino K. AcrB, AcrD, and MdtABC multidrug efflux systems are involved in enterobactin export in Escherichia coli. PLoS ONE, 2014, 9(9): e108642. DOI:10.1371/journal.pone.0108642 |
| [31] |
Wells RM, Jones CM, Xi Z, et al. Discovery of a siderophore export system essential for virulence of Mycobacterium tuberculosis. PLoS Pathog, 2013, 9(1): e1003120. DOI:10.1371/journal.ppat.1003120 |
| [32] |
Radhakrishnan A, Kumar N, Wright CC, et al. Crystal structure of the transcriptional regulator Rv0678 of Mycobacterium tuberculosis. J Biol Chem, 2014, 289(23): 16526-16540. DOI:10.1074/jbc.M113.538959 |
| [33] |
Hantke K. Iron and metal regulation in bacteria. Curr Opin Microbiol, 2001, 4(2): 172-177. DOI:10.1016/S1369-5274(00)00184-3 |
| [34] |
Matsuo R, Mizobuchi S, Nakashima M, et al. Central roles of iron in the regulation of oxidative stress in the yeast Saccharomyces cerevisiae. Curr Genet, 2017, 63(5): 895-907. DOI:10.1007/s00294-017-0689-4 |
| [35] |
de Lorenzo V, Perez-Martin J, Escolar L, et al. Mode of binding of the fur protein to target DNA: negative regulation of iron-controlled gene expression//Crosa JH, Mey AR, Payne SM, Eds. Iron Transport in Bacteria. Washington: ASM Press, 2004, 1: 185-196.
|
| [36] |
Staroń A, Sofia HJ, Dietrich S, et al. The third pillar of bacterial signal transduction: classification of the extracytoplasmic function (ECF) σ factor protein family. Mol Microbiol, 2009, 74(3): 557-581. DOI:10.1111/j.1365-2958.2009.06870.x |
| [37] |
Noinaj N, Guillier M, Barnard TJ, et al. TonB-dependent transporters: regulation, structure, and function. Annu Rev Microbiol, 2010, 64: 43-60. DOI:10.1146/annurev.micro.112408.134247 |
| [38] |
Bashyam MD, Hasnain SE. The extracytoplasmic function sigma factors: role in bacterial pathogenesis. Infect Genet Evol, 2004, 4(4): 301-308. DOI:10.1016/j.meegid.2004.04.003 |
| [39] |
Christiaen SEA, Matthijs N, Zhang XH, et al. Bacteria that inhibit quorum sensing decrease biofilm formation and virulence in Pseudomonas aeruginosa PAO1. Pathog Dis, 2014, 70(3): 271-279. DOI:10.1111/2049-632X.12124 |
| [40] |
Kadirvel M, Fanimarvasti F, Forbes S, et al. Inhibition of quorum sensing and biofilm formation in Vibrio harveyi by 4-fluoro-DPD; a novel potent inhibitor of Al-2 signalling. Chem Commun, 2014, 50(39): 5000-5002. DOI:10.1039/C3CC49678C |
| [41] |
Vasavi HS, Arun AB, Rekha PD. Anti-quorum sensing activity of Psidium guajava LL. flavonoids against Chromobacterium violaceum and Pseudomonas aeruginosa PAO1. Microbiol Immunol, 2014, 58(5): 286-293. DOI:10.1111/1348-0421.12150 |
| [42] |
Kalia VC, Patel SKS, Kang YC, et al. Quorum sensing inhibitors as antipathogens: biotechnological applications. Biotechnol Adv, 2019, 37(1): 68-90. DOI:10.1016/j.biotechadv.2018.11.006 |
| [43] |
Busetti A, Shaw G, Megaw J, et al. Marine-derived quorum-sensing inhibitory activities enhance the antibacterial efficacy of tobramycin against Pseudomonas aeruginosa. Mar Drugs, 2015, 13(1): 1-28. |
| [44] |
Barriuso J, Hogan DA, Keshavarz T, et al. Role of quorum sensing and chemical communication in fungal biotechnology and pathogenesis. FEMS Microbiol Rev, 2018, 42(5): 627-638. DOI:10.1093/femsre/fuy022 |
| [45] |
Wen YC, Kim IH, Kim KS. Iron- and quorum-sensing signals converge on small quorum-regulatory RNAs for coordinated regulation of virulence factors in Vibrio vulnificus. J Biol Chem, 2016, 291(27): 14213-14230. DOI:10.1074/jbc.M116.714063 |
| [46] |
Stintzi A, Evans K, Meyer JM, et al. Quorum-sensing and siderophore biosynthesis in Pseudomonas aeruginosa: lasR/lasI mutants exhibit reduced pyoverdine biosynthesis. FEMS Microbiol Lett, 1998, 166(2): 341-345. DOI:10.1111/j.1574-6968.1998.tb13910.x |
| [47] |
Lewenza S, Conway B, Greenberg EP, et al. Quorum sensing in Burkholderia cepacia: identification of the LuxRI homologs CepRI. J Bacteriol, 1999, 181(3): 748-756. |
| [48] |
McRose DL, Baars O, Seyedsayamdost MR, et al. Quorum sensing and iron regulate a two-for-one siderophore gene cluster in Vibrio harveyi. Proc Natl Acad Sci USA, 2018, 115(29): 7581-7586. DOI:10.1073/pnas.1805791115 |
| [49] |
Braud A, Geoffroy V, Hoegy F, et al. Presence of the siderophores pyoverdine and pyochelin in the extracellular medium reduces toxic metal accumulation in Pseudomonas aeruginosa and increases bacterial metal tolerance. Environ Microbiol Rep, 2010, 2(3): 419-425. DOI:10.1111/j.1758-2229.2009.00126.x |
| [50] |
Das N, Chandran P. Microbial degradation of petroleum hydrocarbon contaminants: an overview. Biotechnol Res Int, 2011, 2011: 941810. |
| [51] |
Kurth C, Kage H, Nett M. Siderophores as molecular tools in medical and environmental applications. Org Biomol Chem, 2016, 14(35): 8212-8227. DOI:10.1039/C6OB01400C |
| [52] |
Hickford SJH, Küpper FC, Zhang GP, et al. Petrobactin sulfonate, a new siderophore produced by the marine bacterium Marinobacter hydrocarbonoclasticus. J Nat Prod, 2004, 67(11): 1897-1899. DOI:10.1021/np049823i |
| [53] |
Gauglitz JM, Zhou HJ, Butler A. A suite of citrate-derived siderophores from a marine Vibrio species isolated following the Deepwater Horizon oil spill. J Inorg Biochem, 2012, 107(1): 90-95. |
| [54] |
Zhao BJ, Nie MQ, Nie HY, et al. Secretion of pyochelin & its effects on alkanes degradation by Pseudomonas aeruginosa NY3. J Microbiol, 2018, 38(1): 76-82 (in Chinese). 赵碧洁, 聂麦茜, 聂红云, 等. 绿脓杆菌螯铁蛋白分泌及其对铜绿假单胞菌NY3降解烃类的影响作用. 微生物学杂志, 2018, 38(1): 76-82. DOI:10.3969/j.issn.1005-7021.2018.01.011 |
| [55] |
Johnson GV, Lopez A, Foster NLV. Reduction and transport of Fe from siderophores. Plant Soil, 2002, 241(1): 27-33. DOI:10.1023/A:1016007708926 |
| [56] |
Wasi S, Tabrez S, Ahmad M. Toxicological effects of major environmental pollutants: an overview. Environ Monit Assess, 2013, 185(3): 2585-2593. DOI:10.1007/s10661-012-2732-8 |
| [57] |
Hesse E, O'Brien S, Tromas N, et al. Ecological selection of siderophore-producing microbial taxa in response to heavy metal contamination. Ecol Lett, 2018, 21(1): 117-127. DOI:10.1111/ele.12878 |
| [58] |
Hernlem BJ, Vane LM, Sayles GD. The application of siderophores for metal recovery and waste remediation: examination of correlations for prediction of metal affinities. Water Res, 1999, 33(4): 951-960. DOI:10.1016/S0043-1354(98)00293-0 |
| [59] |
Wichard T, Bellenger JP, Morel FMM, et al. Role of the siderophore azotobactin in the bacterial acquisition of nitrogenase metal cofactors. Environ Sci Technol, 2009, 43(19): 7218-7224. DOI:10.1021/es8037214 |
| [60] |
Behrends T, Krawczyk-B rsch E, Arnold T. Implementation of microbial processes in the performance assessment of spent nuclear fuel repositories. Appl Geochem, 2012, 27(2): 453-462. DOI:10.1016/j.apgeochem.2011.09.014 |
| [61] |
Hong JW, Park JY, Gadd GM. Pyrene degradation and copper and zinc uptake by Fusarium solani and Hypocrea lixii isolated from petrol station soil. J Appl Microbiol, 2010, 108(6): 2030-2040. |
| [62] |
Dimkpa CO, Merten D, Svatos A, et al. Siderophores mediate reduced and increased uptake of cadmium by Streptomyces tendae F4 and sunflower (Helianthus annuus), respectively. J Appl Microbiol, 2009, 107(5): 1687-96. DOI:10.1111/j.1365-2672.2009.04355.x |
| [63] |
Ullah A, Heng S, Munis MFH, et al. Phytoremediation of heavy metals assisted by plant growth promoting (PGP) bacteria: a review. Environ Exp Bot, 2015, 117: 28-40. DOI:10.1016/j.envexpbot.2015.05.001 |
| [64] |
Wang Q, Xiong D, Zhao P, et al. Effect of applying an arsenic-resistant and plant growth-promoting rhizobacterium to enhance soil arsenic phytoremediation by Populus deltoides LH05-17. J Appl Microbiol, 2011, 111(5): 1065-1074. DOI:10.1111/j.1365-2672.2011.05142.x |
| [65] |
Vashi H, Iorhemen OT, Tay JH. Aerobic granulation: a recent development on the biological treatment of pulp and paper wastewater. Environ Technol Innov, 2018, 9: 265-274. DOI:10.1016/j.eti.2017.12.006 |
| [66] |
Patel A, Arora N, Pruthi V, et al. Biological treatment of pulp and paper industry effluent by oleaginous yeast integrated with production of biodiesel as sustainable transportation fuel. J Clean Prod, 2017, 142: 2858-2864. DOI:10.1016/j.jclepro.2016.10.184 |
| [67] |
Bajpai P. Biological bleaching of chemical pulps. Crit Rev Biotechnol, 2004, 24(1): 1-58. DOI:10.1080/07388550490465817 |
| [68] |
Fekete FA, Chandhoke V, Jellison J. Iron-binding compounds produced by wood-decaying basidiomycetes. Appl Environ Microbiol, 1989, 55(10): 2720-2722. |
| [69] |
Fekete FA. Assays for microbial siderophores// Barton LL, Hemming BC, Eds. Iron Chelation in Plants and Soil Microorganisms. New York: Academic Press, 1993: 399-417.
|
| [70] |
Xu G, Goodell B. Mechanisms of wood degradation by brown-rot fungi: chelator-mediated cellulose degradation and binding of iron by cellulose. J Biotechnol, 2001, 87(1): 43-57. |
| [71] |
Arantes V, Milagres AMF. The effect of a catecholate chelator as a redox agent in Fenton-based reactions on degradation of lignin-model substrates and on COD removal from effluent of an ECF kraft pulp mill. J Hazard Mater, 2007, 141(1): 273-279. DOI:10.1016/j.jhazmat.2006.06.134 |
| [72] |
Milagres AMF, Arantes V, Medeiros CL, et al. Production of metal chelating compounds by white and brown-rot fungi and their comparative abilities for pulp bleaching. Enzyme Microb Technol, 2002, 30(4): 562-565. DOI:10.1016/S0141-0229(02)00015-7 |
| [73] |
Wang L, Yan WC, Chen JC, et al. Function of the iron-binding chelator produced by Coriolus versicolor in lignin biodegradation. Sci China Ser C Life Sci, 2008, 51(3): 214-221. DOI:10.1007/s11427-008-0033-9 |
 2019, Vol. 35
2019, Vol. 35