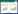中国科学院微生物研究所、中国微生物学会主办
文章信息
- 顾怡然, 黄文聪, 李菊英, 李猛
- Gu Yiran, Huang Wencong, Li Juying, Li Meng
- 多溴联苯醚的微生物降解机制研究进展
- Advances in microbial degradation of polybrominated diphenyl ethers (PBDEs)
- 生物工程学报, 2019, 35(11): 2121-2132
- Chinese Journal of Biotechnology, 2019, 35(11): 2121-2132
- 10.13345/j.cjb.190186
-
文章历史
- Received: May 13, 2019
- Accepted: July 22, 2019
2. 深圳大学 化学与环境工程学院,广东 深圳 518000
2. College of Chemistry and Environmental Engineering, Shenzhen University, Shenzhen 518000, Guangdong, China
多溴联苯醚(Polybrominated diphenyl ethers, PBDEs)是电子行业广泛使用的阻燃剂,具有阻燃性能优异、价格低廉等优点。但它同时在环境中作为一种毒素存在,在水体、土壤和空气中都能被检测到。此外,PBDEs半衰期长,自然条件下可达277.3 d[1],在非生物条件下极难降解。目前国际上已尝试包括物理、化学、生物在内的许多方法,以减少环境中多溴联苯醚的含量,其中生物降解法由于具有环境友好性和实用性的优势,被认为是一种相对更为有效的方法。本综述将结合国内外研究进展着重探讨PBDEs微生物降解机制,并对相关研究趋势和应用作出展望。
1 多溴联苯醚的污染状况多溴联苯醚(PBDEs)是一种多溴代芳香族化合物,由于苯环上取代的溴原子的数量和位置不同,共有209种化合物,遵循国际纯化学和应用化学联合会(IUPAC)命名法的命名规则,其中最低取代的同系物1-溴-2-二苯醚命名为BDE-1,全取代的同系物十溴二苯醚为BDE-209[2]。以最常见的BDE-209,即十溴联苯醚为例,其化学式如图 1所示。
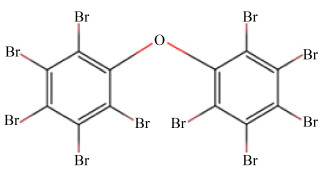
|
| 图 1 BDE-209结构式 Fig. 1 Structural formula for BDE-209. |
| |
自20世纪70年代被制造出来后,PBDEs作为阻燃剂在世界电子行业得到了广泛应用,故经常作为电子废料释放进入环境,引发环境污染。此外,由于加入阻燃剂可以降低可燃材料的可燃性,在火灾时能提供更长的逃生时间[3],PBDEs除应用于电子工业外,同样也被广泛应用于各种纺织品和家具[4]。由于PBDEs与含有它们的聚合物没有化学键连接,故易在生产、销售、使用和回收过程中排放进入环境[3],成为环境PBDEs的另一个主要来源。五溴二苯醚、八溴二苯醚和十溴二苯醚是目前使用较高的几种PBDEs[5]。其中,五溴二苯醚和八溴二苯醚的制造和流通于2004年被欧盟全面禁止,如今已被提名列入《斯德哥尔摩公约》[5]。而造价低廉、阻燃效果良好、毒性相对较小的十溴联苯醚(BDE-209)仍在广泛使用中。研究表明在世界范围,PBDEs正在作为有机污染物在环境中不断积累,在空气、水、土壤、沉积物和生物群中都发现了PBDEs的污染。泰晤士河[6]、加拿大海域[7]甚至北极[8]都出现了PBDEs污染的相关报道[9]。比利时、日本、瑞典等地部分水体中检测出的PBDEs浓度高达10 000 ng/g[10]。PBDEs污染问题在中国尤其严重,20世纪80年代,全世界有70%的电子垃圾被运往中国处理,而电子垃圾的简单处理方式造成了严重且持久的生态污染[11]。在中国,PBDEs的污染主要集中在东南地区,如广东省、江苏省和浙江省[10]。
环境中PBDEs的来源除工业垃圾排放外,也可由部分生物自身合成。已有研究显示海洋中许多海绵-蓝藻共生体可分泌大量PBDEs,其中海洋环境中最重要的PBDEs天然来源是一种底栖海绵(Dysideidae porifera)[12]。经共生体生物代谢后,产生的PBDEs有时也会以OH-PBDEs或MeO-PBDEs的形式存在[13-14]。但目前尚不清楚其合成PBDEs的机制和作用。
目前国际上各领域对于PBDEs的降解从物理、化学和生物学等方面做了大量的工作[13]。其中生物降解由于高效且成本低廉被普遍看好。尽管在过去几十年,人们越来越关注污染物在水和食物中的存在,但污染物摄入不仅仅取决于膳食暴露,人为化学污染物也可通过吸入或皮肤接触受污染的土壤和灰尘等环境介质被吸收。PBDEs可以粉尘形式在空气中迁移[10]。PBDEs在水中溶解性较弱,主要以固相为主[15],故在污水处理阶段可以先通过去除悬浮固体颗粒方式进行预处理。在生物降解的污水处理阶段,可通过添加表面活性剂增加PBDEs在水中的溶解性,便于生物降解[16]。
2 多溴联苯醚毒理学效应PBDEs具有较强的生物毒性。目前的实验研究显示,对于浮游生物,PBDEs的繁殖毒性较强[17];对于鱼类,PBDEs毒性主要表现在神经毒性[18]和氧胁迫[19];对于大鼠,主要表现在肝脏毒性和肿瘤[20];对于人体而言,PBDEs的毒性主要表现在发育神经毒性和内分泌毒性。已有研究显示PBDEs可通过母乳进入婴幼儿体内[21]。孕妇在产前和产后期间暴露于PBDEs,可导致胎儿神经发育受损,影响其记忆力[22],同时生殖系统[23]和内分泌系统[24]也会受到影响。某些PBDEs同源物被人体细胞色素P450 (Cyps)氧化后能形成具有更高生物毒性的代谢物,造成对机体的进一步损伤。此外,由于肠道微生物组与PBDEs间存在相互作用,可以显著影响异源生物转化和肝脏的中间代谢途径[25]。对于人体免疫系统而言,PBDEs的其中一种同系物——四溴联苯醚(BDE-47)可以改变巨噬细胞关键的免疫相关基因表达的调控,并抑制激活嗜碱性粒细胞,严重扰乱天然免疫反应[26]。
3 PBDEs的微生物降解特性许多不同种类的微生物都具有一定PBDEs的降解能力,如白腐真菌(White rot fungi)[27]等可以通过脱溴、羟基化和开环反应降解BDE-209[28]。目前对于微生物PBDEs降解的研究有两种方式:微生物群落原位降解研究和纯菌株实验室降解研究[29]。对微生物群落原位降解的研究可以为对污染物进行原位生物修复打下基础[30],而纯菌株实验室降解研究则能更好地探究关于降解机制机理方面的问题。目前实验室研究细菌降解PBDEs的途径主要是使用气相色谱法[29]在一段时间内依次测定溶液中底物的同系物,并与数据库比对该物质结构,以此推断出可能的降解途径。近年来,人们对PBDEs的生物降解研究主要集中在基于土壤样本的微生物厌氧途径上,故这方面的降解途径已经了解得相对清楚。但事实上,在沉淀到深层厌氧层之前,PBDEs会长时间暴露在有氧环境中。因此,近年来,越来越多的学者将PBDEs生物降解的研究重心转移到有氧降解上来,有氧降解途径也得到了一定的阐释。本文将展开阐述厌氧菌和好氧菌对PBDEs的降解机制,并展望了古菌对PBDEs的降解。
3.1 厌氧菌对PBDEs的降解在厌氧条件下,PBDEs的降解途径主要是还原脱溴,包括邻位、间位和对位脱溴[31]。不同的微生物种群对PBDEs的降解会因卤素取代位置和卤素原子数不同存在一定的差异,产生不同的脱卤作用。以溴代程度最高的、也是环境中最常见的PBDEs之一十溴联苯醚(BDE-209)为例,其最常见的多步脱溴主要过程如图 2所示。
厌氧菌对PBDEs的脱溴过程同时有邻位、间位和对位脱溴的可能。大多数厌氧菌会率先进行BDE-209的单一脱溴,生成BDE-206、BDE-207等物质[32]。随后,单脱溴的降解产物发生再次脱溴,生成双脱溴的产物,如BDE-196[33]、BDE-197[34]、BDE-203[35-36]等,它们又可以被降解成为溴代程度更低的产物,如BDE-196可以脱溴生成BDE-182[31]、BDE-191[31]、BDE-183和BDE-184[35]。七溴联苯醚BDE-183是一个极为普遍的中间产物,许多厌氧细菌都可将更高溴代的PBDEs还原至BDE-183,并将还原脱溴过程继续进行下去,如Dehalococcoides菌株可将BDE-183脱溴成为BDE-154[36],厌氧微生物群落仍可将其进一步还原为BDE-139、BDE-149、BDE-144等降解产物[31]。七溴联苯醚还可被进一步降解,如BDE-138脱溴成为BDE-85,BDE-153脱溴为BDE-99[35],BDE-99再脱溴成为BDE-49和BDE-47[36]。极少有厌氧菌能将多溴联苯醚还原到二苯醚状态,仅少数研究证明部分经过半年以上BDE适应的沉积物中菌株可将其降解到二溴联苯醚(BDE-7、BDE-15)甚至单溴联苯醚(BDE-3)[33]。由于该降解途径不具有普适性,故未将其列入图中。
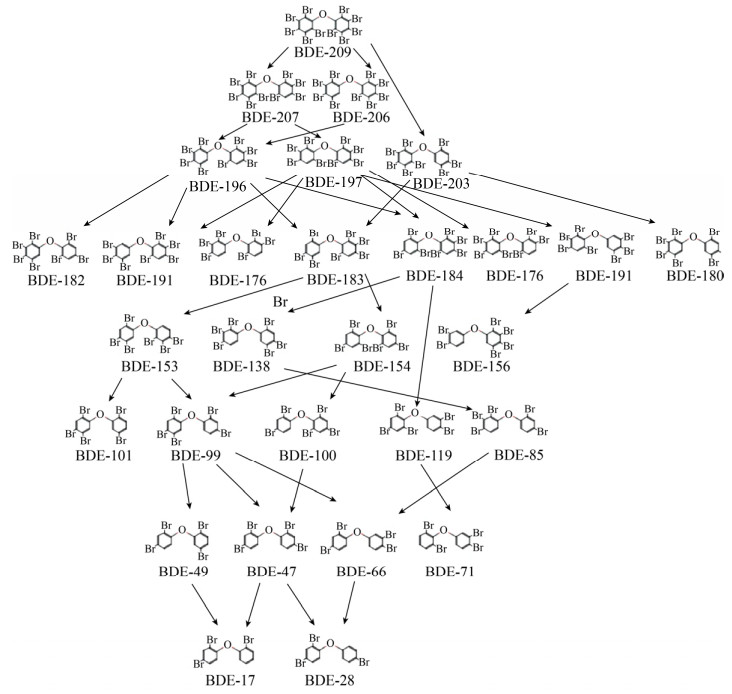
对于其他PBDEs同系物作为降解底物的降解研究主要围绕八溴联苯醚和五溴联苯醚进行。其中,八溴二苯醚的脱溴在没有更容易被利用的电子受体的情况下更易发生[37]。对于五溴联苯醚,其常见的多步脱溴过程如图 3所示。
在厌氧条件下,五溴联苯醚通过多次脱溴后可以生成溴代程度极低的芳香族化合物。BDE-47是五溴联苯醚还原的一个重要途径,许多降解菌都表现出了以此为中间产物的降解途径[1, 38-40]。Dehalobacter restrictus PER-K23和Desulfitobacterium hafniense PCP-1菌株可以将BDE-100和BDE-99脱溴至BDE-47,随后发生两个连续的邻位脱溴步骤,生成BDE-28和BDE-3,并最终将其还原成二苯醚[1]。BDE-99可以被还原为BDE-47、BDE-48和BDE-49[38],且可进一步还原生成BDE-18[39]。一项在中国华南地区取样的红树林沉积物降解研究表明,在红树林微生物群落中,BDE-47的降解率远大于BDE-209[40]。
由于参与反应的厌氧菌多为严格的自养生物,其生长速率和代谢速率都较慢[41],对其的研究也主要围绕群落降解研究为主,极少见单菌落分离培养。土壤群落降解研究表明PBDEs在厌氧土壤中的半衰期平均为14年,最长可达50年之久[42]。而缺乏合适的电子受体是厌氧条件下生物难降解化合物的主要限制因素之一,故推测在体系中添加一些如乙酸盐、丙酮酸盐、硫酸盐等电子供体可提高其生物降解速率。目前已知的具有较强降解能力的厌氧菌主要有嗜木杆菌Xylophilus ampelinus[43]等。
3.2 好氧微生物降解PBDEs研究进展——常见降解菌种、降解途径和机理PBDEs的厌氧降解存在一定的局限性,即大多数厌氧降解菌仅能实现脱卤,但无法降解芳香环。好氧菌降解则具有此优势,其降解过程通常具有环裂解能力。
以BDE-209为例,在好氧降解菌作用下,BDE-209首先会被肽聚糖中的磷壁酸和N-乙酰葡糖胺侧链吸收,然后经过3个途径进行转运和脱溴[28]。好氧菌能将PBDEs脱卤并开环,并将降解产物作为三羧酸循环的底物利用[44]。但由于不同微生物种群在卤素取代位置、数目及开环位点和步骤上有较高特异性,导致好氧细菌的降解途径具有比厌氧菌降解途径更高的多样性。在进入开环阶段之前,好氧菌的脱卤途径与厌氧菌降解过程类似。有些好氧菌在降解时会将PBDEs羟基化[44],生成具有更高水溶性的降解产物,使其更易发生代谢。OH-PBDEs作为PBDEs降解途径中的代谢物不仅发生在好氧微生物中,在植物中也有研究证实了此种途径的出现[45]。好氧菌部分常见开环机制如图 4所示。
在好氧条件下,PBDEs被逐级降解脱溴到溴代程度较低时,好氧降解菌能通过单加氧、双加氧等反应在苯环上羟基化并开环,开环产物最终进入TCA循环[42, 49-50]。PBDEs的降解过程很可能不会完全脱卤,大多数细菌在降解至余下2个卤素取代基时便可发生羟基化或开环反应[47]。在多环芳烃化合物的生物降解过程中,细菌氧合系统可分为两种不同的类型:侧向双氧化,即其中一个芳环被羟基化;角度双加氧,即其中与杂原子键合的碳原子和芳环中的相邻碳均被氧化成半缩醛,半缩醛自发断裂,生成2个苯衍生物[48]。在PBDEs的好氧菌开环降解中,这两类生物降解途径都有所体现。如鞘氨醇单胞菌Sphingomonas sp. strain RW1降解BDE-3,可检测到生成了4-溴苯酚和4-溴邻苯二酚[49],并能将BDE-28降解生成2, 4-二溴苯酚[50]。恶臭假单胞菌Pseudomonas putida菌株在降解时主要是让底物的醚键裂解,即角型双氧化,它可以将BDE-47降解为2, 4-二溴苯酚[44]。当PBDEs被降解至苯酚时,P. putida DSM 548等菌株还可进一步将其降解开环[47]。事实上,好氧菌的代谢产物可能具有比厌氧菌代谢产物更强的生物毒性,因为羟基化的多溴联苯醚比非羟基化的多溴联苯醚对高等生物内分泌系统的影响更大[51]。
在有外加碳源的情况下,细菌降解PBDEs的能力会显著增加,降解效率提高1%–6%[52],如添加酵母提取物[53]等。这也符合自然条件下,细菌在多碳源环境下进行降解的场景。由于PBDEs在水体中多为疏水性,故具有较高细胞表面疏水性的细菌会具有更强的降解能力[54]。在相同条件下,溴代程度越低,PBDEs的降解效率越高[55]。此外,研究表明环境中存在一定镉离子浓度时,PBDEs的降解能力会被增强,但当镉离子浓度过高时,降解则会被抑制[56]。目前部分已知的具有高效PBDEs降解能力、获得了实验室纯培养并进行了降解能力测试的好氧菌菌株如表 1所示。
| PBDEs | Incubation time (days) | Percentage of PBDEs degradation (%) | Bacteria strain | Isolation source | Reference |
| BDE 209 | 30 | 55.15 | Stenotrophomonas sp. strain WZN-1 | Soil from E-waste Recycling Area, Tianjin, China | [57] |
| BDE 209 | 7 | 52.20 | E. casseliflavus | Soil from E-waste Recycling Area, Guangdong Province, China | [54] |
| BDE 209 | 12 | 31.80 | Staphylococcus haemolyticus LY1 | River Sediment from North of China | [47] |
| BDE 209 | 12 | 42.50 | Bacillus pumilus LY2 | River Sediment from North of China | [47] |
| BDE 209 | 6 | 65.10 | Rhodococcus sp. | Soil from Electronic Waste Dismantling Plant in Zhejiang Province, China | [58] |
| BDE 207 | 33 | 75.00 | Acetobacterium sp. AG | Riverside Soil from Wisconsin, USA | [38] |
| BDE 47 | 7 | 49.96 | Pseudomonas putida TZ-1 | River sediment from Electronic Waste Recycling Area river in Zhejiang Province, China | [59] |
| BDE 47 | 2 | 97.94 | Pseudomonas stutzeri | Soil from Flame Retardant Manufacturing Plant in Shandong Province, China | [61] |
有研究通过测序后对已被注释的降解基因进行筛选并通过qPCR进行验证,观察在降解过程中基因的表达情况,以此推测该功能基因是否参与降解过程。如Stenotrophomonas菌中水解酶基因(基因ID: CCR98_00905)、双加氧酶基因(基因ID: CCR98_02495)和脱卤酶基因(基因ID: CCR98_02005、CCR98_19135)的表达量都在降解过程中显著提高[57]。也有研究者从酶学角度入手,研究了生物提取物的潜在降解潜力,如使用铜绿假单胞菌Pseudomonas aeruginosa的粗酶提取物进行BDE-209的降解,在5 h内便可降解92.77%[60]。目前,基因水平的研究还相对较少,酶学等相关研究也有所欠缺。因此,深入探讨功能菌群基因和降解机制之间的关系,是研究PBDEs微生物降解的重要方向之一。本课题组将基于前期研究已分离到的对BDE-209具有较好降解性能的好氧菌种(如红球菌Rhodococcus ruber、戈登氏菌Gordonia paraffinvorans等),综合分析化学、环境化学和现代分子生物学等手段在基因层面上研究上述菌株对BDE-209的降解机制和功能基因的表达差异,深入探讨功能菌群基因和降解机制之间的相关关系。
3.3 古菌对于PBDEs的降解潜能由于古菌生长条件特殊、生长周期长,故难以实现实验室的纯培养,对古菌的污染物降解研究方式通常为微生物群落原位降解研究,并通过荧光原位杂交(FISH)和16S rRNA高通量测序等方式进行分析。古菌在土壤中呈垂直分布,一些古菌如亚硝化螺菌Nitrososphaera、氨氧化古菌Nitrosopumilus、甲烷食甲基菌Methanomethylovorans等,在厌氧环境下都表现出对PBDEs的生物降解潜能[61]。其中亚硝化螺菌Nitrososphaera和氨氧化古菌Nitrosopumilus可能是介导BDE-99生物降解的关键古菌类群[59]。
此外,在不同的垂直高度,细菌和古菌之间有着不同的微生物群落结构。古菌抗逆性强,在PBDEs浓度增加的情况下,其群落组成变化较之于同地区的细菌群落组成变化要小得多[62]。
4 应用前景微生物在PBDEs的降解中展示出极强的应用潜能,为减少环境中PBDEs的浓度,将物理、化学、生物法搭配设计,寻找高效且价格低廉的污染物处理装置,或许是一个行之有效的选择。从物理和生物结合的角度看,国际上已有纳米级零价铁(nZVI)与厌氧菌结合用于地下水修复的生物物理系统相关的研究。nZVI可以为厌氧细菌的生长和活动创造合适的生存条件,但由于nZVI本身具有细胞毒性,故其剂量和种类的设定起着至关重要的作用[63]。PBDEs可被光解,即通过紫外线辐射产生活性自由基,使得其自然脱溴[64]。因此微生物和紫外线结合脱溴也是一个处理多溴联苯醚的经济有效的方法。微生物聚生体对于降解污染物则另有优势:聚生体具有丰富的混合菌种和酶,因此它可以具有比单一栽培更广泛和更强的降解效率。但是,由于其物种的复杂性,微生物聚生体对多溴联苯醚的生物降解取得的成果寥寥无几,也缺少对降解细菌富集过程中微生物群落的变化和功能转换的研究。因此,目前对具有优良降解能力的功能菌株进行筛选仍是PBDEs微生物降解的有效方法之一,深入探索降解菌群落的演变,从基因角度推断更好的组合方式,为PBDEs生物降解的潜在机制提供新的见解。此外,探究出其基因后,也可通过设计基因工程菌等高效菌株,与其他降解方法搭配,继而形成一套性能优良的污染物处理系统。
5 结论与展望PBDEs的污染范围广、降解难度大、毒性强,解决其降解难题已经成了世界性的燃眉之急。为解决环境中PBDEs污染问题,各领域还需对其开展进一步的研究工作。
第一,从微生物降解角度而言,由于目前对微生物降解过程的酶促降解机理和基因表达层面的研究不算深入,对于除十溴联苯醚外的其他PBDEs为底物的降解途径及其与十溴联苯醚降解过程的区别和分析相对较少,对降解过程中功能基因的研究和验证实验则更加匮乏,降解过程中各种酶的功能机制也不甚清楚,故深入探究降解的生物机制,从具有降解能力的细菌和古菌入手,进行不同底物的降解实验、同时加强基因层面和酶学方面的探究,则是未来研究中亟待突破的重点。
第二,从应用层面来看,对PBDEs降解过程中各种酶的机理进行更深层次的了解并进行降解测试,筛选更高效的降解菌或通过基因工程设计高效降解菌株,辅以生物与物理的结合或多种生物种群的搭配选择,设计协同高效的降解系统,也是促进PBDEs降解的一个有效手段。
综上,随着PBDEs在环境中的不断积累,探寻更为高效的PBDEs降解方法,突破PBDEs降解难关,对有效解决日益严重的环境问题至关重要。此外,对PBDEs微生物降解的深入研究不仅能解决PBDEs所造成的环境危害,还能为揭示微生物降解其他有机污染物打下基础,具有广泛而重要的科学意义。
| [1] |
Lee LK, Ding C, Yang KL, et al. Complete debromination of tetra-and penta-brominated diphenyl ethers by a coculture consisting of Dehalococcoides and Desulfovibrio species. Environ Sci Technol, 2011, 45(19): 8475-8482. DOI:10.1021/es201559g |
| [2] |
Boon JP, Lewis WE, Tjoen-A-Choy MR, et al. Levels of polybrominated diphenyl ether (PBDE) flame retardants in animals representing different trophic levels of the North Sea food web. Environ Sci Technol, 2002, 36(19): 4025-4032. DOI:10.1021/es0158298 |
| [3] |
Domingo JL. Polybrominated diphenyl ethers in food and human dietary exposure: a review of the recent scientific literature. Food Chem Toxicol, 2012, 50(2): 238-249. |
| [4] |
Stubbings WA, Harrad S. Extent and mechanisms of brominated flame retardant emissions from waste soft furnishings and fabrics: a critical review. Environ Int, 2014, 71: 164-175. DOI:10.1016/j.envint.2014.06.007 |
| [5] |
La Guardia MJ, Hale RC, Harvey E. Detailed polybrominated diphenyl ether (PBDE) congener composition of the widely used penta-, octa-, and deca-PBDE technical flame-retardant mixtures. Environ Sci Technol, 2006, 40(20): 6247-6254. DOI:10.1021/es060630m |
| [6] |
Ganci AP, Vane CH, Abdallah MAE, et al. Legacy PBDEs and NBFRs in sediments of the tidal River Thames using liquid chromatography coupled to a high resolution accurate mass Orbitrap mass spectrometer. Sci Total Environ, 2019, 658: 1355-1366. DOI:10.1016/j.scitotenv.2018.12.268 |
| [7] |
Gentes ML, Mazerolle MJ, Giroux JF, et al. Tracking the sources of polybrominated diphenyl ethers in birds: Foraging in waste management facilities results in higher DecaBDE exposure in males. Environ Res, 2015, 138: 361-371. DOI:10.1016/j.envres.2015.02.036 |
| [8] |
Zhu CF. Bioaccumulation and biomagnification of typical POPs in the Arctic and e-waste recycling regions[D]. Beijing: University of Chinese Academy of Sciences, 2015 (in Chinese). 朱超飞.北极地区和电子垃圾拆解地典型POPs生物累积放大效应[D].北京: 中国科学院大学, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2852062 |
| [9] |
Zhao CH, Yan M, Zhong H, et al. Biodegradation of polybrominated diphenyl ethers and strategies for acceleration: A review. Int Biodeterior Biodegrad, 2018, 129: 23-32. DOI:10.1016/j.ibiod.2017.12.010 |
| [10] |
Yu G, Bu QW, Cao GZ, et al. Brominated flame retardants (BFRs): A review on environmental contamination in China. Chemosphere, 2016, 150: 479-490. DOI:10.1016/j.chemosphere.2015.12.034 |
| [11] |
Hao D, Yi RH, Wu Y. Pollution characteristics and exposure risk assessment of polybrominated diphenyl ethers in different types agricultural soils in Guiyu area. J Agric Environ Sci, 2015, 34(5): 882-890 (in Chinese). 郝迪, 亦如瀚, 吴俣, 等. 贵屿地区不同类型农业土壤多溴联苯醚的污染特征和暴露评估. 农业环境科学学报, 2015, 34(5): 882-890. |
| [12] |
Agarwal V, Blanton JM, Podell S, et al. Metagenomic discovery of polybrominated diphenyl ether biosynthesis by marine sponges. Nat Chem Biol, 2017, 13(5): 537-543. DOI:10.1038/nchembio.2330 |
| [13] |
Yu Y, Yin H, Peng H, et al. Biodegradation of decabromodiphenyl ether (BDE-209) using a novel microbial consortium GY1: Cells viability, pathway, toxicity assessment, and microbial function prediction. Sci Total Environ, 2019, 668: 958-965. DOI:10.1016/j.scitotenv.2019.03.078 |
| [14] |
Malmvärn A, Zebühr Y, Kautsky L, et al. Hydroxylated and methoxylated polybrominated diphenyl ethers and polybrominated dibenzo-p-dioxins in red alga and cyanobacteria living in the Baltic Sea. Chemosphere, 2008, 72(6): 910-916. DOI:10.1016/j.chemosphere.2008.03.036 |
| [15] |
Trinh MM, Tsai CL, Chang MB. Characterization of polybrominated diphenyl ethers (PBDEs) in various aqueous samples in Taiwan. Sci Total Environ, 2019, 649: 388-395. DOI:10.1016/j.scitotenv.2018.08.204 |
| [16] |
Ye D. The repair of polybrominated diphenyl ether contaminated soil by surfactant[D]. Zhenjiang: Jiangsu University, 2015 (in Chinese). 叶丹.表面活性剂对多溴联苯醚污染土壤的修复研究[D].镇江: 江苏大学, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2798859 |
| [17] |
Han WL, Zheng XY. Toxicity of decabromodiphenyl ether and its degradation products to plankton. J Enviro Sci, 2018, 38(2): 821-828 (in Chinese). 韩文亮, 郑小燕. 十溴二苯醚及其降解产物对浮游生物的毒性. 环境科学学报, 2018, 38(2): 821-828. |
| [18] |
Chen LG, Yu K, Huang CJ, et al. Prenatal transfer of polybrominated diphenyl ethers (PBDEs) results in developmental neurotoxicity in zebrafish larvae. Environ Sci Technol, 2012, 46(17): 9727-9734. DOI:10.1021/es302119g |
| [19] |
Usenko CY, Hopkins DC, Trumble SJ, et al. Hydroxylated PBDEs induce developmental arrest in zebrafish. Toxicol Appl Pharmacol, 2012, 262(1): 43-51. DOI:10.1016/j.taap.2012.04.017 |
| [20] |
Darnerud PO. Toxic effects of brominated flame retardants in man and in wildlife. Environ Int, 2003, 29(6): 841-853. DOI:10.1016/S0160-4120(03)00107-7 |
| [21] |
Iszatt N, Janssen S, Lenters V, et al. Environmental toxicants in breast milk of Norwegian mothers and gut bacteria composition and metabolites in their infants at 1 month. Microbiome, 2019, 7: 34. DOI:10.1186/s40168-019-0645-2 |
| [22] |
Cowell WJ, Margolis A, Rauh VA, et al. Associations between prenatal and childhood PBDE exposure and early adolescent visual, verbal and working memory. Environ Int, 2018, 118: 9-16. DOI:10.1016/j.envint.2018.05.004 |
| [23] |
Kim S, Park J, Kim HJ, et al. Association between several persistent organic pollutants and thyroid hormone levels in serum among the pregnant women of Korea. Environ Int, 2013, 59: 442-448. DOI:10.1016/j.envint.2013.07.009 |
| [24] |
Reverte I, Domingo JL, Colomina MT. Neurodevelopmental effects of decabromodiphenyl ether (BDE-209) in APOE transgenic mice. Neurotoxicol Teratol, 2014, 46: 10-17. DOI:10.1016/j.ntt.2014.08.003 |
| [25] |
Li Y. Gut-liver axis on biotransformation of environmental chemicals polybrominated diphenyl ethers (PBDEs)[D]. Seattle: University of Washington, 2017. https: //digital.lib.washington.edu/researchworks/handle/1773/41774
|
| [26] |
Longo V, Longo A, Di Sano C, et al. In vitro exposure to 2, 2', 4, 4'-tetrabromodiphenyl ether (PBDE-47) impairs innate inflammatory response. Chemosphere, 2019, 219: 845-854. DOI:10.1016/j.chemosphere.2018.12.082 |
| [27] |
Zhou J, Jiang WJ, Ding J, et al. Effect of Tween 80 and β-cyclodextrin on degradation of decabromodiphenyl ether (BDE-209) by white rot fungi. Chemosphere, 2007, 70(2): 172-177. DOI:10.1016/j.chemosphere.2007.06.036 |
| [28] |
Xu GY, Wang J. Biodegradation of decabromodiphenyl ether (BDE-209) by white-rot fungus Phlebia lindtneri. Chemosphere, 2014, 110: 70-77. DOI:10.1016/j.chemosphere.2014.03.052 |
| [29] |
Huang CC, Zeng YH, Luo XJ, et al. In situ microbial degradation of PBDEs in sediments from an e-waste site as revealed by positive matrix factorization and compound-specific stable carbon isotope analysis. Environ Sci Technol, 2019, 53(4): 1928-1936. DOI:10.1021/acs.est.8b06110 |
| [30] |
Chen J, Wang PF, Wang C, et al. Spatial distribution and diversity of organohalide-respiring bacteria and their relationships with polybrominated diphenyl ether concentration in Taihu Lake sediments. Environ Pollut, 2018, 232: 200-211. DOI:10.1016/j.envpol.2017.08.124 |
| [31] |
Robrock KR, Korytár P, Alvarez-Cohen L. Pathways for the anaerobic microbial debromination of polybrominated diphenyl ethers. Environ Sci Technol, 2008, 42(8): 2845-2852. DOI:10.1021/es0720917 |
| [32] |
Chang YT, Lo T, Chou HL, et al. Anaerobic biodegradation of decabromodiphenyl ether (BDE-209)-contaminated sediment by organic compost. Int Biodeterior Biodegradt, 2016, 113: 228-237. DOI:10.1016/j.ibiod.2016.04.017 |
| [33] |
Huang HW, Chang BV, Lee CC. Reductive debromination of decabromodiphenyl ether by anaerobic microbes from river sediment. Int Biodeterior Biodegrad, 2014, 87: 60-65. DOI:10.1016/j.ibiod.2013.10.011 |
| [34] |
Orihel DM, Bisbicos T, Darling CTR, et al. Probing the debromination of the flame retardant decabromodiphenyl ether in sediments of a boreal lake. Environ Toxicol Chem, 2016, 35(3): 573-583. DOI:10.1002/etc.3229 |
| [35] |
Gerecke AC, Hartmann PC, Heeb NV, et al. Anaerobic degradation of decabromodiphenyl ether. Environ Sci Technol, 2005, 39(4): 1078-1083. DOI:10.1021/es048634j |
| [36] |
He JZ, Robrock KR, Alvarez-Cohen L. Microbial reductive debromination of polybrominated diphenyl ethers (PBDEs). Environ Sci Technol, 2006, 40(14): 4429-4434. DOI:10.1021/es052508d |
| [37] |
Lee LK, He JZ. Reductive debromination of polybrominated diphenyl ethers by anaerobic bacteria from soils and sediments. Appl Environ Microbiol, 2010, 76(3): 794-802. DOI:10.1128/AEM.01872-09 |
| [38] |
Ding C, Chow WL, He JZ. Isolation of Acetobacterium sp. strain AG, which reductively debrominates octa-and pentabrominated diphenyl ether technical mixtures. Appl Environ Microbiol, 2013, 79(4): 1110-1117. DOI:10.1128/AEM.02919-12 |
| [39] |
Zhu HW, Wang Y, Tam NFY. Microcosm study on fate of polybrominated diphenyl ethers (PBDEs) in contaminated mangrove sediment. J Hazard Mater, 2014, 265: 61-68. DOI:10.1016/j.jhazmat.2013.11.046 |
| [40] |
Yan YL, Ma MS, Liu X, et al. Vertical distribution of archaeal communities associated with anaerobic degradation of pentabromodiphenyl ether (BDE-99) in river-based groundwater recharge with reclaimed water. Environ Sci Pollut Res, 2018, 25(6): 5154-5163. DOI:10.1007/s11356-017-0034-y |
| [41] |
Qiu MD, Chen XJ, Deng DY, et al. Effects of electron donors on anaerobic microbial debromination of polybrominated diphenyl ethers (PBDEs). Biodegradation, 2012, 23(3): 351-361. DOI:10.1007/s10532-011-9514-9 |
| [42] |
Tokarz Ⅲ JA, Ahn MY, Leng J, et al. Reductive debromination of polybrominated diphenyl ethers in anaerobic sediment and a biomimetic system. Environ Sci Technol, 2008, 42(4): 1157-1164. DOI:10.1021/es071989t |
| [43] |
Song MK, Luo CL, Li FB, et al. Anaerobic degradation of Polychlorinated Biphenyls (PCBs) and Polychlorinated Biphenyls Ethers (PBDEs), and microbial community dynamics of electronic waste-contaminated soil. Sci Total Environ, 2015, 502: 426-433. DOI:10.1016/j.scitotenv.2014.09.045 |
| [44] |
Lv YC, Li LH, Chen YC, et al. Effects of glucose and biphenyl on aerobic cometabolism of polybrominated diphenyl ethers by Pseudomonas putida: Kinetics and degradation mechanism. Int Biodeterior Biodegrad, 2016, 108: 76-84. DOI:10.1016/j.ibiod.2015.12.004 |
| [45] |
Huang HL, Zhang SZ, Christie P, et al. Behavior of decabromodiphenyl ether (BDE-209) in the soil-plant system: Uptake, translocation, and metabolism in plants and dissipation in soil. Environ Sci Technol, 2009, 44(2): 663-667. |
| [46] |
Monteiro ÁAMG, Boaventura RAR, Rodrigues AE. Phenol biodegradation by Pseudomonas putida DSM 548 in a batch reactor. Biochem Eng J, 2000, 6(1): 45-49. |
| [47] |
Wang LQ, Li Y, Zhang WL, et al. Isolation and characterization of two novel psychrotrophic decabromodiphenyl ether-degrading bacteria from river sediments. Environ Sci Pollut Res, 2016, 23(11): 10371-10381. DOI:10.1007/s11356-015-5660-7 |
| [48] |
Bressler DC, Fedorak PM. Bacterial metabolism of fluorene, dibenzofuran, dibenzothiophene, and carbazole. Can J Microbiol, 2000, 46(5): 397-409. DOI:10.1139/w00-017 |
| [49] |
Schmidt S, Wittich RM, Erdmann D, et al. Biodegradation of diphenyl ether and its monohalogenated derivatives by Sphingomonas sp. strain SS3. Appl Environ Microbiol, 1992, 58(9): 2744-2750. |
| [50] |
Kim YM, Nam IH, Murugesan K, et al. Biodegradation of diphenyl ether and transformation of selected brominated congeners by Sphingomonas sp. PH-07. Appl Microbiol Biotechnol, 2007, 77(1): 187-194. |
| [51] |
Meerts IA, Letcher RJ, Hoving S, et al. In vitro estrogenicity of polybrominated diphenyl ethers, hydroxylated PDBEs, and polybrominated bisphenol A compounds. Environ Health Perspect, 2001, 109(4): 399-407. DOI:10.1289/ehp.01109399 |
| [52] |
Zhang SW, Xia XH, Xia N, et al. Identification and biodegradation efficiency of a newly isolated 2, 2', 4, 4'- tetrabromodiphenyl ether (BDE-47) aerobic degrading bacterial strain. Int Biodeterior Biodegrad, 2013, 76: 24-31. DOI:10.1016/j.ibiod.2012.06.020 |
| [53] |
Stiborova H, Vrkoslavova J, Lovecka P, et al. Aerobic biodegradation of selected polybrominated diphenyl ethers (PBDEs) in wastewater sewage sludge. Chemosphere, 2015, 118: 315-321. DOI:10.1016/j.chemosphere.2014.09.048 |
| [54] |
Tang SY, Yin H, Chen SN, et al. Aerobic degradation of BDE-209 by Enterococcus casseliflavus: Isolation, identification and cell changes during degradation process. J Hazard Mater, 2016, 308: 335-342. DOI:10.1016/j.jhazmat.2016.01.062 |
| [55] |
Yang CW, Huang HW, Chao WL, et al. Bacterial communities associated with aerobic degradation of polybrominated diphenyl ethers from river sediments. Environ Sci Pollut Res, 2015, 22(5): 3810-3819. DOI:10.1007/s11356-014-3626-9 |
| [56] |
Shi GY, Yin H, Ye JS, et al. Aerobic biotransformation of decabromodiphenyl ether (PBDE-209) by Pseudomonas aeruginosa. Chemosphere, 2013, 93(8): 1487-1493. DOI:10.1016/j.chemosphere.2013.07.044 |
| [57] |
Wu ZN, Xie MM, Li Y, et al. Biodegradation of decabromodiphenyl ether (BDE 209) by a newly isolated bacterium from an e-waste recycling area. AMB Expr, 2018, 8: 27. DOI:10.1186/s13568-018-0560-0 |
| [58] |
Liu LL, Zhang YC, Liu RH, et al. Aerobic debromination of BDE-209 by Rhodococcus sp. coupled with zerovalent iron/activated carbon. Environ Sci Pollut Res, 2016, 23(4): 3925-3933. DOI:10.1007/s11356-015-5663-4 |
| [59] |
Xin J, Liu X, Liu W, et al. Aerobic transformation of BDE-47 by a Pseudomonas putida sp. strain TZ-1 isolated from PBDEs-contaminated sediment. Bull Environ Contaminat Toxicol, 2014, 93(4): 483-488. DOI:10.1007/s00128-014-1306-6 |
| [60] |
Liu Y, Gong AJ, Qiu LN, et al. Biodegradation of decabromodiphenyl ether (BDE-209) by crude enzyme extract from Pseudomonas aeruginosa. Int J Environ Res Public Health, 2015, 12(9): 11829-11847. DOI:10.3390/ijerph120911829 |
| [61] |
Yan YL, Ma MS, Liu X, et al. Effect of biochar on anaerobic degradation of pentabromodiphenyl ether (BDE-99) by archaea during natural groundwater recharge with treated municipal wastewater. Int Biodeterior Biodegrad, 2017, 124: 119-127. DOI:10.1016/j.ibiod.2017.04.019 |
| [62] |
Wang LQ, Li Y, Niu LH, et al. Response of ammonia oxidizing archaea and bacteria to decabromodiphenyl ether and copper contamination in river sediments. Chemosphere, 2018, 191: 858-867. DOI:10.1016/j.chemosphere.2017.10.067 |
| [63] |
Dong HR, Li L, Lu Y, et al. Integration of nanoscale zero-valent iron and functional anaerobic bacteria for groundwater remediation: a review. Environ Int, 2019, 124: 265-277. DOI:10.1016/j.envint.2019.01.030 |
| [64] |
Chen F, Yang Q, Wang SN, et al. Graphene oxide and carbon nitride nanosheets co-modified silver chromate nanoparticles with enhanced visible-light photoactivity and anti-photocorrosion properties towards multiple refractory pollutants degradation. Appl Catal B: Environ, 2017, 209: 493-505. DOI:10.1016/j.apcatb.2017.03.026 |
 2019, Vol. 35
2019, Vol. 35