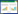中国科学院微生物研究所、中国微生物学会主办
文章信息
- 房皓, 闫永全, 居子逸, 廉昇阳, 裴晓芳, 马桥, 曲媛媛
- Fang Hao, Yan Yongquan, Ju Ziyi, Lian Shengyang, Pei Xiaofang, Ma Qiao, Qu Yuanyuan
- Mariannaea sp. HJ合成纳米金银合金的特性考察
- Characterization of Au-Ag nanoparticles biosynthesized by fungus Mariannaea sp. HJ
- 生物工程学报, 2019, 35(11): 2061-2068
- Chinese Journal of Biotechnology, 2019, 35(11): 2061-2068
- 10.13345/j.cjb.190160
-
文章历史
- Received: April 25, 2019
- Accepted: August 19, 2019
2. 大连海事大学 环境科学与工程学院 环境系统生物学研究所, 辽宁 大连 116026
2. Institute of Environmental Systems Biology, College of Environmental Science and Engineering, Dalian Maritime University, Dalian 116026, Liaoning, China
近年来,纳米材料凭借其独特的物理化学性质备受关注,广泛应用于催化、能源、生物医学、光学和传感器等诸多领域。传统的纳米材料合成方法主要为能耗较高的物理合成法和使用大量试剂的化学合成法[1],而生物合成法凭借操作简便、反应条件温和及生态友好等特点,成为当前纳米材料合成领域的研究热点[2]。目前已报道的生物合成资源包括细菌、真菌、藻类等,但真菌的相关报道相对较少[3-4]。在众多纳米材料中,纳米贵金属复合材料如纳米金银合金呈现出高催化活性和抗菌活性[5],得到研究者的广泛青睐。2004年Shanker等首次利用印度楝树Azadirachta indica叶子提取物作为天然的还原剂和稳定剂成功合成纳米金银合金[6],开启了生物合成纳米复合贵金属材料的新篇章。然而迄今为止,对于生物合成纳米金银合金的研究报道仍较少,因此尚有很大的探索空间。
众所周知,污水中诸如硝基苯酚和偶氮染料等污染物难以生物降解且具有较强的生物毒性[7]。对于此类污染物传统的治理方法包括化学沉淀、离子交换、吸附和过滤等,但是这些方法很难将污染物完全降解且易造成二次污染[8]。许多研究表明,金属纳米颗粒在污水处理方面,能够作为有效的催化剂,催化硝基苯酚和彻底降解偶氮染料[9-10],其催化活性依赖于纳米金属的尺寸、形状和用量[11]。生物纳米贵金属复合材料不仅整合了单金属纳米材料的功能,而且大大增加了其独特的结构特性和表面活性,在环境领域具有潜在的应用价值。探究利用生物合成纳米金银合金的可行性,并对其催化还原特性进行考察,将有助于为污染物降解提供绿色无毒、高效可行的新方法。
本实验室前期从活性污泥中分离得到一株真菌Mariannaea sp. HJ[12],通过相关实验已验证其同时具有合成纳米金及纳米银的能力。本研究首先考察菌株HJ合成纳米金银合金的能力,随后考察不同金银离子浓度比例对合成纳米金银合金过程的影响,通过紫外-可见光谱扫描、透射电子显微镜、X射线衍射和傅里叶红外光谱等手段对纳米金银合金进行表征和分析,并选取4-硝基苯酚为底物探究纳米金银合金的催化活性。
1 材料与方法 1.1 实验材料 1.1.1 菌株本实验所用菌株Mariannaea sp. HJ为本实验室前期从活性污泥中筛选分离得到[12],现保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No. 10030。菌株HJ的26S rRNA基因序列(521 bp)已提交到GenBank数据库,登录号为KP330204[12]。
1.1.2 实验所用试剂实验所用氯金酸购自百灵威科技有限公司(纯度99.9%,Au 49%最低),硝酸银和4-硝基苯酚购自国药集团化学试剂有限公司。其余使用的药品均为分析纯及以上。
1.1.3 溶液配制HAuCl4溶液:称取1 g HAuCl4溶于超纯水中,定容至50 mL,得到浓度为50 mmol/L的HAuCl4溶液,4 ℃条件下避光保存备用。
AgNO3溶液:称取0.169 9 g AgNO3溶于超纯水中,定容至10 mL,得到浓度为100 mmol/L的AgNO3溶液,4 ℃条件下避光保存备用。
4-硝基苯酚溶液:称取0.002 8 g 4-硝基苯酚溶于10 mL去离子水中,配制浓度为2 mmol/L的溶液,于4 ℃冰箱内保存备用。
NaBH4溶液:称取0.189 2 g NaBH4溶于10 mL去离子水中,得到浓度为50 mmol/L的溶液,现配现用。
1.2 实验方法 1.2.1 菌株培养Mariannaea sp. HJ采用改良马丁培养基(MMB)培养,培养基主要成分包括:(NH4)2SO4 1.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,葡萄糖1.0 g/L,pH 7.0,培养基于115 ℃、15 min灭菌后使用。接菌量为1%,接菌后的培养基于30 ℃、150 r/min恒温摇床中振荡培养。
1.2.2 纳米金银合金的合成收集培养24 h的菌株HJ进行实验,用定性滤纸过滤菌体,超纯水冲洗数次以去除残余培养基组分。称取适量清洗后的菌体,加入适量磷酸盐缓冲溶液(PBS,50 mmol/L,pH 7.0)重悬,利用超声破碎仪(Ultrasonic Processor CPX 750,美国)破碎40 min。将破碎后得到的混合液于10 000 r/min、4 ℃条件下离心10 min,取上清液过膜3次后(0.45 μm,水膜),得到菌株HJ的细胞提取物。
利用考马斯亮蓝法测定提取物中的蛋白浓度,并用PBS溶液调节蛋白浓度为300 mg/L。取5 mL细胞提取物于10 mL小管中,加入HAuCl4与AgNO3溶液,将小管密封后置于30 ℃、150 r/min摇床中避光反应。Au:Ag浓度分别为0.5:0.5、0.5:1.0、0.5:1.5、0.5:2.0、0.5:3.0,以及不加入HAuCl4与AgNO3的细胞提取物作为空白对照。
1.2.3 纳米金银合金的表征紫外-可见分光光度计:将合成的纳米金银合金用紫外-可见光分光光度计(UV-vis,JASCO V-560,日本)在250–500 nm波长范围进行全波长扫描,扫描间隔1 nm。
透射电子显微镜:取适量纳米金银合金溶液于10 000 r/min条件下离心5 min,弃上清,沉淀用去离子水清洗3遍以去除游离蛋白,将得到的样品于80 ℃下干燥24 h备用。另取菌株HJ破碎后的提取物于80 ℃下干燥24 h作为对照。最后将样品进行透射电子显微镜(TEM, Tecnai G220 S-Twin型,美国FEI公司)表征分析。
傅立叶红外光谱仪:将干燥后的纳米金银合金和提取物分别与溴化钾混合,于玛瑙研钵中充分混合研磨,将研磨好的粉末压片,在室温下用傅立叶红外光谱仪(FTIR, Shimadzu IR Prestige-21, 日本岛津公司) 400–4 000 cm–1范围内测量其吸收光谱,扫描速度为5 kHz。
X射线衍射光谱:使用X-射线衍射仪(XRD,DMAX-2000,Rigaku公司)进行纳米金银合金样品的物相分析,射线源为Cu-Kα辐射(λ=1.541 8 ),Ni滤液,石墨单色器,管电流40–60 mA,管电压40 kV。在测样前把催化剂样品研磨成粉末状,然后固定在载玻片上测定,扫描速率为4°/min。
1.2.4 纳米金银合金对4-硝基芳烃的催化还原利用4-硝基苯酚的催化还原反应考察合成的纳米金银合金催化特性。取100 μL的4-硝基苯酚溶液(2 mmol/L)与400 μL的NaBH4溶液(50 mmol/L)混合。由TEM图分析可知,当加入金银离子比例为0.5:1.5时,合成的纳米金银合金平均粒径最小,相对表面积大,表面共振等离子体效应强,据文献报道纳米粒子粒径越小催化性能越强,故我们选择加入金银离子比例为0.5:1.5合成的纳米金银合金催化降解4-硝基苯酚。加入10 μL纳米金银合金溶液,最后用超纯水调节反应体系总体积为2 mL。使用紫外可见分光光度计监测这一反应过程,于250–500 nm处定时连续全波扫描,扫描间隔1 nm。
2 结果与分析 2.1 不同金银离子比例对合成产物的影响本实验探究了不同比例的Au、Ag离子浓度对真菌Mariannaea sp. HJ合成纳米金银合金的影响。在实验中分别选取Au:Ag离子浓度比为0.5:0.5、0.5:1.0、0.5:1.5、0.5:2.0、0.5:3.0时加入反应体系,待稳定后观察其颜色变化以及UV-vis光谱图的变化。结果如图 1A所示,在不同比例的金银离子浓度条件下合成的纳米金银合金有明显的颜色差异,与空白组对照可观察到反应体系中均产生了紫色及深紫色的物质。当金银离子浓度比为0.5:0.5、0.5:1.0时溶液呈现浅紫色和紫色,而随着银离子浓度的增加,反应后体系颜色逐渐变深,当金银离子浓度比为0.5:3.0时,反应体系颜色最深,呈棕色。不同反应体系的UV-vis如图 1B所示,当金银离子浓度比为0.5:0.5和0.5:1.0时,反应体系在550 nm 左右有明显的特征吸收峰,而当金银离子浓度比为0.5:1.5、0.5:2.0和0.5:3.0时,反应体系在530 nm左右有明显的特征吸收峰。通常纳米金的特征吸收峰值范围为500–600 nm,而纳米银的特征吸收峰值范围为400–500 nm[13]。而我们观察到随着混合体系中银离子浓度的增加,其特征吸收峰值发生明显的蓝移,从550 nm变为530 nm,结合纳米金和纳米银的特征吸收峰值的范围推测这是由于合成的纳米金银合金中银的比例逐渐增加而形成的。

|
| 图 1 不同金银离子浓度比例下菌株HJ合成纳米金银合金的颜色(A)及UV-vis光谱图(B) Fig. 1 Color (A) and UV-vis spectra (B) of nano-gold and silver alloy synthesized by strain HJ under different concentration ratios of gold and silver ions |
| |
为进一步观察合成的纳米合金的形貌,本研究利用透射电子显微镜对合成的纳米金银合金进行表征,结果如图 2所示。该方法合成的纳米金银合金尺寸与形貌都较为均一且分散性良好,主要为球形和伪球形。利用粒径分析软件计算可得菌株HJ在3种不同的金银离子浓度比例下合成的纳米颗粒的平均粒径分别约为19.24 nm、15.98 nm和19.33 nm。
|
| 图 2 不同金银离子浓度条件下菌株HJ合成纳米金银合金的TEM图及其尺寸分布 Fig. 2 TEM images of Au-AgNPs produced by strain HJ with different concentration of gold ions and silver ions and its size distribution |
| |
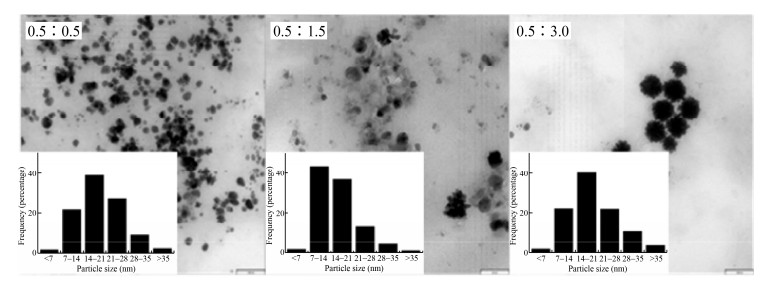
对合成的纳米金银合金进行XRD表征分析,结果如图 3所示。其2θ在26.38°、33.28°、38.62°、44.83°、65.69°以及78.79°处出现的6个衍射峰分别与金银合金面心立方(FCC)结构标准对比卡(ICDD card No. 87-0597)的(111)、(200)、(111)、(220)、(311)晶面相对应,以(200)晶面为主,说明菌株HJ合成的纳米金银合金晶体结构为面心立方结构[14-15]。
|
| 图 3 菌株HJ合成纳米金银合金的XRD光谱图 Fig. 3 XRD spectra of Au-Ag NPs by strain HJ |
| |
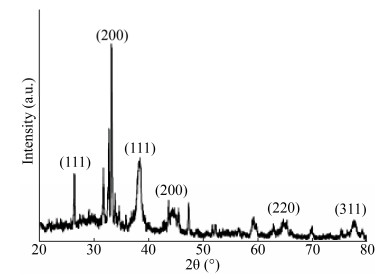
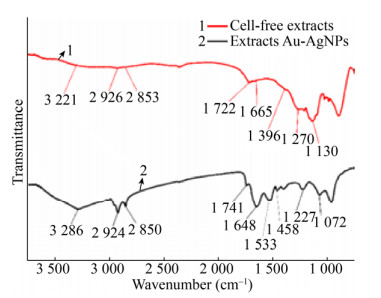
为探索在合成纳米金银合金过程中所起作用的生物大分子,本研究利用FTIR分别对菌株HJ胞内提取物以及纳米金银合金的表面官能团进行检测,表征结果如图 4所示。菌株HJ胞内提取物在~3 300 cm–1、~2 920 cm–1、~2 850 cm–1、~1 740 cm–1、~1 650 cm–1、~1 400 cm–1、~1 300 cm–1和~1 080 cm–1处出现特征吸收峰。其中,~3 300 cm–1可能是-OH伸缩振动产生;~2 920 cm–1和~2 850 cm–1可能是-CH3与-CH2伸缩振动峰;~1 740 cm–1可能为-COOH或-COOR特征吸收峰;~1 650 cm–1处的特征吸收峰可能为氨基Ⅰ的特征峰;~1 400 cm–1可能是-C-H的变形振动产生的结果;~1 080 cm–1处可能为-C-N的伸缩振动的特征吸收峰[16]。通过对比发现与菌株HJ胞内提取物相比合成的纳米金银合金在~1 540 cm–1出现了特异的特征吸收峰,其对应的官能团为氨基Ⅱ。由此可以推断,在纳米金银合金合成与稳定的过程中-OH、-NH3、-COOH等官能团可能参与反应[17-18]。
|
| 图 4 菌株HJ合成纳米金银合金的FTIR光谱图 Fig. 4 FTIR spectra of Au-Ag NPs by strain HJ |
| |
4-硝基苯酚是环境中常见的一种有机污染物,由于该类污染物存在高毒性、难降解等问题,在我国被列为水中优先控制的污染物之一[19]。在许多研究中,4-硝基苯酚的还原反应常常被用于检验催化材料的活性。本实验选取4-硝基苯酚(4-NP)作为底物,考察菌株HJ胞内提取物合成的纳米金银合金的催化性能。在常温条件下4-NP呈现淡黄色,特征吸收峰位于320 nm处,加入NaBH4后混合溶液变为深黄色,同时特征吸收峰位置由320 nm转移至400 nm,对应生成的新物质——4-硝基苯酚钠[20],如图 5A所示。加入纳米金银合金后,400 nm处的特征吸收峰迅速下降,同时在310 nm处出现新的特征吸收峰,其对应产物为4-氨基苯酚。反应360 s后,反应体系黄色完全消退,400 nm处的特征吸收峰完全消失,证明该反应结束。由于该反应中NaBH4的浓度远高于4-NP的浓度,因此可以认为NaBH4的浓度在整个反应中始终保持不变,该反应服从假一级反应。该反应A/A0-t关系如图 5B所示,90 s时4-NP的去除率达到50%,300 s时4-NP去除率为90%。根据反应动力学方程计算可知,该反应的催化反应速率常数k为7.85×10–3 s–1。2017年Pei等利用Mariannaea sp. HJ合成的纳米金颗粒催化还原4-NP的催化速率常数为5.7×10–3 s–1[18]。Narayanan等利用Cylindrocladium floridanum sp.合成的纳米金颗粒在硼氢化钠的作用下催化还原4-NP的催化速率常数为4.45×10–4 s–1[21],与本实验结果相比较说明利用菌株HJ胞内提取物合成的纳米金银合金的催化性能优于单金属的纳米金颗粒。

|
| 图 5 纳米合金催化4-NP的UV-vis光谱(A)及速率曲线(B) Fig. 5 UV-vis spectra (A) and rate curves (B) of 4-NP catalyzed by Au-AgNPs |
| |
本研究利用菌株Mariannaea sp. HJ胞内提取物合成纳米金银合金,采用UV-vis、TEM、XRD、FTIR等方法对纳米金银合金的特性进行表征,最后考察了纳米合金对4-硝基苯酚催化还原能力,得出如下结论:1)菌株HJ胞内提取物能够合成纳米金银合金,反应体系中金银离子比例不同会对纳米金银合金的组成产生一定影响,银离子比例越大,合金中纳米银所占比例也越大。2)在本实验中合成的纳米金银合金主要为球形和伪球形,晶型为面心立方结构。通过FTIR分析,推测菌株HJ的胞内提取物中含-OH、-NH3、-COOH等官能团的物质,在其合成过程中起到重要作用。3)本实验合成的纳米金银合金对4-硝基苯酚具有良好的催化还原活性,其催化速率常数为7.85×10–3 s–1,通过比较可知在相同条件下菌株HJ合成的纳米金银合金的催化性能优于单金属的纳米金颗粒。
本文利用绿色低毒的生物法成功制备了纳米金银合金,为绿色合成贵金属以及合金纳米材料的发展提供了一定的参考。同时我们发现纳米金银合金对4-硝基苯酚还原的催化能力相较于单金属的纳米金及纳米银颗粒更好,对污水中难降解有机污染物的高效处理开辟了新的思路和方向。
| [1] |
Senapati S, Ahmad A, Khan MI, et al. Extracellular biosynthesis of bimetallic Au-Ag alloy nanoparticles. Small, 2005, 1(5): 517-520. DOI:10.1002/smll.200400053 |
| [2] |
Godipurge SS, Yallappa S, Biradar NJ, et al. A facile and green strategy for the synthesis of Au, Ag and Au-Ag alloy nanoparticles using aerial parts of R. hypocrateriformis extract and their biological evaluation. Enzyme Microb Technol, 2016, 95: 174-184. DOI:10.1016/j.enzmictec.2016.08.006 |
| [3] |
Kuppusamy P, Ilavenil S, Srigopalram S, et al. Synthesis of bimetallic nanoparticles (Au-Ag Alloy) using Commelina nudiflora L. plant extract and study its on oral pathogenic bacteria. J Inorg Organomet Polym Mater, 2017, 27(2): 562-568. DOI:10.1007/s10904-017-0498-8 |
| [4] |
Liu ZY, Zhou H, Shen E, et al. Recent advances in microbes-mediated biosynthesis of gold nanoparticles. Microbiol China, 2015, 42(8): 1584-1592 (in Chinese). 刘紫嫣, 周豪, 沈娥, 等. 微生物介导的金纳米颗粒合成. 微生物学通报, 2015, 42(8): 1584-1592. |
| [5] |
Philip D. Biosynthesis of Au, Ag and Au-Ag nanoparticles using edible mushroom extract. Spectrochim Acta A Mol Biomol Spectrosc, 2009, 73(2): 374-381. DOI:10.1016/j.saa.2009.02.037 |
| [6] |
Ganaie SU, Abbasi T, Abbasi SA, et al. Rapid and green synthesis of bimetallic Au-Ag nanoparticles using an otherwise worthless weed Antigonon leptopus. J Exp Nanosci, 2016, 11(6): 395-417. DOI:10.1080/17458080.2015.1070311 |
| [7] |
Qu YY, Pei XF, Shen WL, et al. Biosynthesis of gold nanoparticles by Aspergillum sp. WL-Au for degradation of aromatic pollutants. Phys E: Low-Dimens Syst Nanostruct, 2017, 88: 133–141.
|
| [8] |
Shen WL, Qu YY, Pei XF, et al. Green synthesis of gold nanoparticles by a newly isolated strain Trichosporon montevideense for catalytic hydrogenation of nitroaromatics. Biotechnol Lett, 2016, 38(9): 1503-1508. DOI:10.1007/s10529-016-2120-5 |
| [9] |
Han QY, Zhang CY, Gao W, et al. Ag-Au alloy nanoparticles: synthesis and in situ monitoring SERS of plasmonic catalysis. Sens Actuators B Chem, 2016, 231: 609-614. DOI:10.1016/j.snb.2016.03.068 |
| [10] |
Shen WL, Qu YY, Pei XF, et al. Catalytic reduction of 4-nitrophenol using gold nanoparticles biosynthesized by cell-free extracts of Aspergillus sp. WL-Au. J Hazard Mater, 2017, 321: 299-306. DOI:10.1016/j.jhazmat.2016.07.051 |
| [11] |
Hu F, Meng W, Zhang Y, et al. Synthesis of Au-Ag alloy nanoparticles. J Wuyi Univ: Nat Sci Ed, 2011, 25(1): 33-36 (in Chinese). 胡芳, 孟卫, 张燕, 等. 金银合金纳米粒子的制备. 五邑大学学报:自然科学版, 2011, 25(1): 33-36. DOI:10.3969/j.issn.1006-7302.2011.01.008 |
| [12] |
Li HJ. Characterization of gold nanoparticles synthesized by fungus Mariannaea sp. HJ[D]. Dalian: Dalian University of Technology, 2016 (in Chinese). 李会杰. Mariannaea sp. HJ合成金纳米颗粒的特性研究[D].大连: 大连理工大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10141-1016217504.htm |
| [13] |
Jin YL. Preparation of Au-Ag alloy nanoparticles and its application studies[D]. Suzhou: Suzhou University, 2008 (in Chinese). 金毅亮.金银合金纳米粒子的制备及其应用研究[D].苏州: 苏州大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1296801 |
| [14] |
Shankar SS, Rai A, Ahmad A, et al. Rapid synthesis of Au, Ag, and bimetallic Au core-Ag shell nanoparticles using Neem (Azadirachta indica) leaf broth. J Colloid Interface Sci, 2004, 275(2): 496-502. DOI:10.1016/j.jcis.2004.03.003 |
| [15] |
Proen a M, Borges J, Rodrigues MS, et al. Nanocomposite thin films based on Au-Ag nanoparticles embedded in a CuO matrix for localized surface plasmon resonance sensing. Appl Surf Sci, 2019, 484: 152-168. DOI:10.1016/j.apsusc.2019.04.085 |
| [16] |
Sawle BD, Salimath B, Deshpande R, et al. Biosynthesis and stabilization of Au and Au-Ag alloy nanoparticles by fungus, Fusarium semitectum. J Hazard Mater, 2008, 9(3): 035012. |
| [17] |
Shankar PD, Shobana S, Karuppusamy I, et al. A review on the biosynthesis of metallic nanoparticles (gold and silver) using bio-components of microalgae: Formation mechanism and applications. Enzyme Microb Technol, 2016, 95: 28-44. DOI:10.1016/j.enzmictec.2016.10.015 |
| [18] |
Pei XF, Qu YY, Shen WL, et al. Green synthesis of gold nanoparticles using fungus Mariannaea sp. HJ and their catalysis in reduction of 4-nitrophenol. Environ Sci Pollut Res Int, 2017, 24(27): 21649-21659. DOI:10.1007/s11356-017-9684-z |
| [19] |
Shen WL. Characteristics and morphology regulation of gold nanoparticles synthesized by different fungi[D]. Dalian: Dalian University of Technology, 2018 (in Chinese). 沈文丽.不同真菌合成纳米金的特性及其调控[D].大连: 大连理工大学, 2018. |
| [20] |
Zhang XW, Qu YY, Shen WL, et al. Biogenic synthesis of gold nanoparticles by yeast Magnusiomyces ingens LH-F1 for catalytic reduction of nitrophenols. Colloids Surf A Physicochem Eng Asp, 2016, 497: 280-285. DOI:10.1016/j.colsurfa.2016.02.033 |
| [21] |
Narayanan KB, Sakthivel N. Synthesis and characterization of nano-gold composite using Cylindrocladium floridanum and its heterogeneous catalysis in the degradation of 4-nitrophenol. J Hazard Mater, 2011, 189(1/2): 519-525. |
 2019, Vol. 35
2019, Vol. 35