中国科学院微生物研究所、中国微生物学会主办
文章信息
- 刘波, 陶勇
- Liu Bo, Tao Yong
- 生物制造“细胞工厂”的设计与组装
- Design and assembly of bio-manufacturing "cell factory"
- 生物工程学报, 2019, 35(10): 1942-1954
- Chinese Journal of Biotechnology, 2019, 35(10): 1942-1954
- 10.13345/j.cjb.190270
-
文章历史
- Received: June 22, 2019
- Accepted: August 23, 2019
作为一种原料可再生和环境友好型的生产方式,生物制造得到了越来越多的关注和研发投入,生物制造可利用诸如淀粉、木质纤维素和油脂等生物质资源合成能源化学品和平台化合物。早在20世纪早期,由于市场对丙酮和丁醇等化学品有强烈的需求,从而促进了ABE (Acetone-butanol- ethanol)发酵的发展。1916年以丙酮丁醇梭菌Clostridium acetobutylicum为宿主的ABE发酵首次实现了工业化生产[1, 2],至20世纪中期,采用ABE发酵生产方式大约占66%的丁醇和10%的丙酮的市场份额[8],随着石油化工的迅速发展,ABE发酵的生产方式已不具备成本优势,逐渐被石油化工替代。当前,出于对资源短缺和环境问题的考虑,以及得益于代谢工程的发展,ABE发酵重新得到重视,代谢工程改造的菌株以葡萄糖为原料生产丁醇的生产强度达到了10.7 g/(L·h)[4-5],据估算当前丁醇生物制造的成本根据原料的不同大约为0.8至2美元每千克[6],在不久的将来有可能实现工业化应用。生物制造丁醇的发展经历了一百多年,从ABE发酵的建立与工业化应用,到被石油化工生产所替代,再到如今重新得到重视,生产成本一直是影响生物制造工业化应用的关键因素。作为生物制造的核心,细胞工厂(菌株)的性能决定着产品生物合成的生产强度、效价和转化率等,这些指标又直接影响着产品的发酵成本和提取成本。因此高效率细胞工厂的设计与组装是生物制造实现工业化应用的前提与关键。在本文,我们结合当前常用的代谢工程改造策略以及实例,阐述在细胞工厂设计和组装中所要遵循的一些准则。
1 途径设计与石化工厂中某个化学品单一的生产线不同,细胞工厂是一个多种化合物和生化反应共存的混合体,所有这些化合物组成一个复杂的代谢网络,它的本能是满足细胞自身的生存和分裂。要在这么复杂的体系中合成目标化学品,首先需要设计一条最优的合成途径。途径设计有两种方法,一种是基于已知的生化反应途径进行设计,这方面有许多可供参考的数据库,例如综合了基因、酶、化合物、生化反应和代谢途径的KEGG数据库[20],以生化反应数据为基础的BRENDA数据库[32],以及整理了各种生物基因的功能与调控的数据库Metacyc[3]等;另一种是在已有认知的基础上,通过建立代谢网络模型,进行合理的推测,该方法主要应用于新合成途径的设计与构建。目前已有许多模型建立,例如RDM方法[28]、PPS系统结合UMBBD数据库[17]和BNICE框架结合ATLAS数据库[10, 13]等。所有这些方法均通过设定一些规则来计算得到新的反应和代谢途径,其中PPS系统是基于已知的生化反应数据库来演算,其生化反应的预测规则存在局限;RDM与上述方法则不同,它基于化合物的分子结构进行推演,结果具有更广泛的预测性,但可靠度有所降低;同样是基于已有的数据库来演算,BNICE框架采取了多样性的规则来囊括已有的生化反应和预测新的生化反应,从而使其能够更加有效地预测新的生化反应和代谢途径。
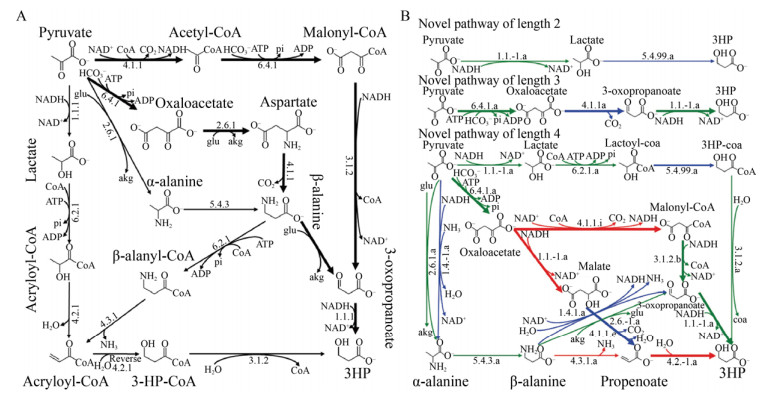
以3-羟基丙酸的途径设计为例,Henry等[15]采用BNICE框架以丙酮酸为出发前体进行推演,不仅重现了已知的合成途径(图 1A),还成功地预测了若干新的合成途径(图 1B)。以丙酮酸为出发前体,已知的合成途径中,无论是经过Malonyl-CoA、β-丙氨酸中间体,亦或者是Acryloyl-CoA中间体,合成途径至少需要四步酶催化,而采用BNICE框架预测的代谢途径最短可由两步反应完成。假设n步生化反应的代谢途径中某一步生化反应的实际摩尔转化率为Yn,那么由原料至终产品的实际转化率Y=Y1·Y2·Y3·...·Yn,由于Yn≤1,那么代谢途径越长,实际可实现的转化率越低,也就暗示生产成本越高,而途径越短实际转化率提升的难度也就越小,因此在化学品合成的途径设计中,应尽可能地选择较短的合成途径,但这一原则并非一成不变的,因为有些较短的合成途径从热力学上来讲并非是有利的。
采用eQuilibrator来计算图 1B中两步反应和三步反应的标准吉布斯自由能变(ΔG°, equilibrator.weizmann.ac.il)[11],经乳酸的两步反应途径ΔG° = +29.6 kJ/mol,经草酰乙酸的三步反应途径ΔG° = −10.1 kJ/mol。虽然丙酮酸和3-羟基丙酸之间转化的ΔG° = +29.5 kJ/mol,但是由于代谢途径不同,所以整体上的能量变化也有所差异。因此从计算的角度来讲经草酰乙酸中间体合成3-羟基丙酸的途径具有较大的优势,新设计的代谢途径需要新的生化反应才能实现,该三步反应代谢途径中,催化草酰乙酸至丙二酸半醛的反应理论上存在,但至今仍未被发现,未来或许可通过新酶设计等手段实现该代谢途径。总体上来讲,代谢途径的设计要依次考虑途径中的生化反应数量、热力学可行性以及生化反应实际的可执行性。
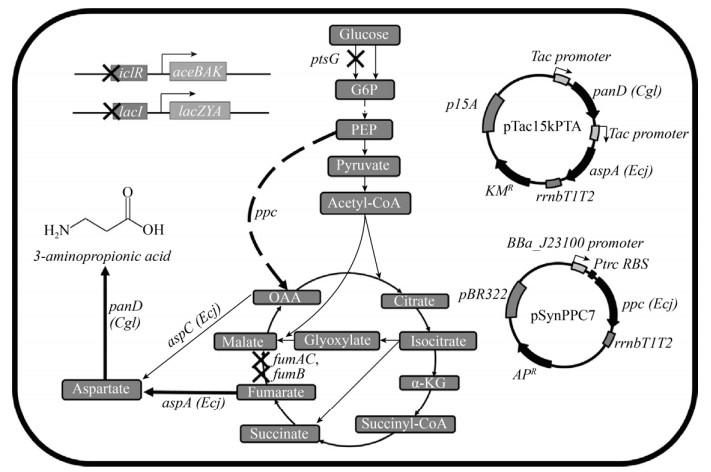
2 代谢流平衡生物依赖初级代谢来合成胞内各种前体化合物和提供能量,用于维持细胞的生存和分裂,对于微生物来说,过多的合成氨基酸、有机酸和某种蛋白等并不利于其生存,生物可通过调控基因的表达和酶的催化活力来控制碳代谢流分布,使其在诸如糖酵解、三羧酸(TCA)循环和磷酸戊糖途径等初级代谢中的比例处于最有利于生长的状态,这也被称作是“初级代谢网络的刚性”[34],当目标化学品为参与初级代谢的化合物时,细胞工厂的构建就无法避免地要考虑初级代谢和化学品合成途径间的平衡,初级代谢的刚性会使改造存在一定困难。例如2015年Song等[33]改造大肠杆菌合成β-丙氨酸过程中发现,单纯过表达来源于大肠杆菌的天冬氨酸脱羧酶PanD,并没有检测到β-丙氨酸的生成,因此他们对初级代谢途径进行了一系列的改造,包括敲除乙醛酸途径负调控因子基因iclR和延胡索酸酶基因fumABC,此时仍未检测到β-丙氨酸的生成,直至他们过表达天冬氨酸合酶AspA,才检测到了0.855 g/L的β-丙氨酸。由此可见初级代谢网络具有较强的刚性,碳代谢流的分布对目标化合物产量的提升有较大的影响,随后他们采用不同强度过表达的PEP羧化酶(由ppc基因编码),将碳代谢流尽可能地引向L-天冬氨酸,最终可合成3.94 g/L的β-丙氨酸(图 2)。
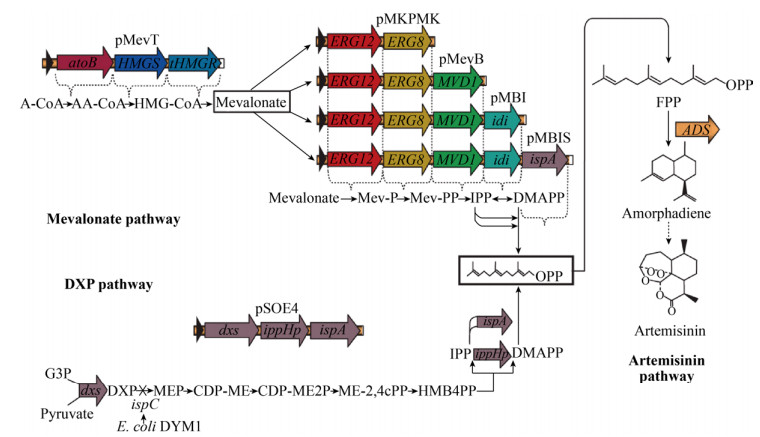
在细胞工厂的构建过程中,除了要考虑基础代谢与合成途径的平衡,合成途径中的每一步反应也需要优化与调整,以防止某一中间体过多的积累,对细胞产生负面的影响。2003年Jay D Keasling实验室首次公开报道了在大肠杆菌中构建外源MVA途径(甲羟戊酸类异戊二烯合成途径),通过将外源基因引入大肠杆菌,他们成功地构建了一条由七步生化反应组成的DMAPP合成途径,并以此为基础合成了青蒿素的前体化合物紫穗槐二烯(图 3)。他们对该菌株进行分析后发现:1)途径中代谢中间体的积累限制合成途径通量的提升;2)过表达MVA途径中的酶会抑制大肠杆菌的生长[29]。通过LC/GC-MS和实验设计分析胞内化合物含量后发现,HMG-CoA的积累导致大肠杆菌生长被抑制,这可能是由于HMG-CoA影响了脂肪酸的合成;此外细胞中某一基础代谢中间体过度的消耗会竞争细胞生长的资源,同时也有可能引发细胞对过多外源蛋白产生压力响应机制[14],正如Pitera等所发现的,MVA途径的不平衡,导致中间体和副产物的积累,进而抑制了途径中酶的活力以及对细胞产生了毒性,使得终产物难以高效率地合成,在他们的实验中,提高tHMGR的表达量即可解除HMG-CoA对细胞的毒性。2009年Jay D Keasling团队通过代谢通路分析、阻断代谢旁路、消除有毒中间体积累、基因密码子优化和提高限速酶活力等手段,使MVA途径的代谢流更为畅通,并将紫穗槐二烯的产量提高了7倍[12]。
随着合成生物学技术的发展,许多新的调控手段被应用于代谢工程改造。为了使细胞在不同时期更好地分配资源,以满足生长与生产的需求,以传感-调控系统(Sensor-regulator system)为基础的动态调控手段已被应用于“细胞工厂”的构建,该调控方式以代谢物响应的转录因子为基本的工具,可构建一套自适应和自主控制的系统,缩减成本同时提高目标化合物的产量[38]。此外群感效应(Quorum sensing, QS)由于在微生物群体中广泛存在,并且在调控群体生物学功能中有重要作用,也被应用于代谢工程改造。2016年,Sun等对肺炎克雷伯氏菌Klebsiella pneumoniae响应信号分子呋喃酰硼酸二酯(Furanosyl borate diester, AI-2)的群感响应系统进行了研究,该群感响应系统在次级代谢产物积累方面扮演着重要角色。他们通过敲除基因luxS以阻断该群感响应系统,降低了副产物羟基丁酮、乙醇和乙酸的含量,同时使2, 3-丁二醇的产量提高了23.8%,达到了54.93 g/L[35]。
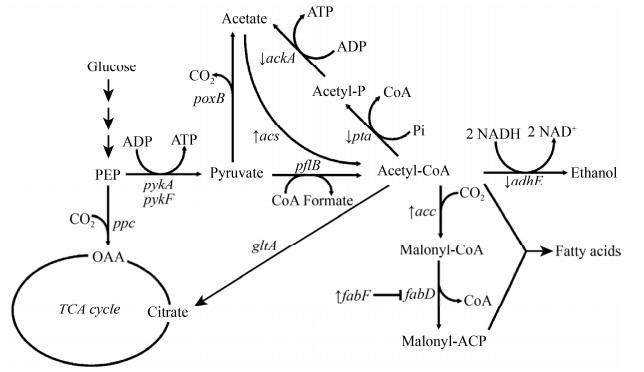
3 前体供应即便是合成途径代谢流很通畅,有时目标化学品的产量仍难以提升,这时需考虑化学品的合成前体是否得到了足量的供应。与丙酮酸和Acetyl-CoA等容易从葡萄糖快速获得的中间体不同,一些化合物合成中间体需要经过特别的优化才能得到足够的供应,例如聚酮和黄酮类化合物合成前体Malonyl-CoA,需要由Acetyl-CoA经过CO2固定的羧化反应获得,在大肠杆菌胞内Malonyl-CoA被维持在很低的水平[36],对聚酮化合物的生物制造来讲是一种障碍。Huimin Zhao实验室曾对大肠杆菌的Malonyl-CoA供应进行了系统性地改造(图 4),研究人员首先过表达了Acetyl-CoA羧化酶基因acc,使Malonyl-CoA的胞内含量提高了3倍,进而敲除了ackA、pta和adhE基因,同时过表达了acs和fabF基因,以增加Acetyl-CoA的供应和削弱Malonyl-CoA代谢旁路,最终使得Malonyl- CoA的胞内含量提高了15倍,这一系列的改造使间苯三酚的产量大幅度提升了4倍[40]。
化学品合成前体不仅需要足量的供应,对于需要多个前体的合成途径,不同前体需要协同供应才能使途径更顺畅。B1a是阿维菌素中最为有效的组分,一分子B1a母核的合成需要以一分子的Methylbutanoyl-CoA (甲基丁酰CoA)为起始单元,同时还需要5分子的Methylmalonyl-CoA (甲基丙二酸单酰CoA)和7分子的Malonyl-CoA (丙二酸单酰CoA)为延伸单元[19, 39],上述3种代谢中间体以1︰5︰7比例聚合成糖苷配基,进而形成B1a母核。虽然至今尚未在大肠杆菌中实现阿维菌素的异源合成,但有许多工作已经为其异源合成作了前体供应的准备。2017年Cui等尝试在大肠杆菌中过表达来源于阿维链霉菌的支链α-酮酸脱氢酶复合体,同时强化异亮氨酸的合成途径,调整部分碳代谢通路(图 5A),以提供Methylbutanoyl- CoA、Malonyl-CoA和Methylmalonyl-CoA,得到的工程菌株Methylbutanoyl-CoA含量提升了632倍,Malonyl-CoA含量提升了13倍,Methylmalonyl-CoA含量提升了7.5倍,此外还能使大肠杆菌合成Isovaleryl-CoA,为阿维菌素及其他聚酮化合物的异源合成奠定了基础。在此工程菌株的基础上,他们构建了同样需要协同两个前体的PIVP (3-甲基-异丁酰间苯三酚)合成途径,一分子该化合物的合成需要一分子的Isovaleryl-CoA和3分子的Malonyl-CoA,优化多种前体供应可使PIVP产量大幅度提升了13.9倍(图 5B)。
在化学品的生物制造中,理想的状态是细胞工厂以最大的速率将碳流引向目标化学品,且在此过程中包括还原力在内的辅因子维持一个相对平衡的状态。由于一条完整的代谢途径往往伴随着还原力的消耗或释放,虽然维持胞内还原力平衡是细胞的基本需求之一[18],但在细胞工厂中,单纯依赖细胞自身调节是很难维持这种平衡状态的,需要人为地进行干预。作为胞内最重要的辅因子之一,FAD(H2)、NAD(P)+和NAD(P)H既可作为氧化反应的电子受体,又可作为还原反应的推动力,在细胞代谢中扮演者重要的角色。以酿酒酵母为例,胞内NADH/NADPH含量是影响酿酒酵母发酵产物的主要因素,Heux等将来源于乳酸乳球菌Lactococcus lactis的NADH氧化酶(生成水)引入酿酒酵母,使NADH的胞内浓度下降了5倍,NADH/NAD+的比率下降了6倍,结果使乙醇、甘油和丁二酸的产量急剧下降,相应的具有更高氧化态的化合物如丁二酮、乙醛和乙酸有了更多的积累[16]。类似的例子还有乳酸菌的发酵,de Felipe等将NADH氧化酶引入乳酸乳杆菌后,菌株从单纯的乳酸发酵变成了混合酸发酵,更有利于多种其他化学品的合成[25]。由此可见,细胞的氧化还原平衡状态决定了碳代谢流的方向,对于有过多还原力释放的代谢途径,过表达NADH氧化酶是一种必然的选择。
而对于合成途径需要大量NADPH的途径,需要加强NADH向NADPH转换,2017年Qiao等构建了13株解脂耶氏酵母Yarrowia lipolytica,将糖酵解过程产生的NADH转变为NADPH,用于脂肪酸甲酯的合成,最终使脂肪酸甲酯的生产强度提高至1.2 g/(L·h),转化率达到了0.27 g脂肪酸甲酯/g葡萄糖,相比改造之前提高了25%[30]。同样地,Liu等在大肠杆菌中通过敲除基因sthA和加强pntAB,使脂肪酸β-氧化得到的NADH转变为NADPH,使大肠杆菌用脂肪酸产3-羟基丙酸的产量提高至3.29 g/L,提高了55%[22]。
对于某些消耗还原力的代谢途径,还原力再生与循环成为提高目标化合物产量与转化率的关键。自然界中存在许多厌氧发酵生物可将甘油还原为1, 3-丙二醇,然而每合成1分子的1, 3-丙二醇需要消耗1分子的NADH,在厌氧的生物催化中,只能通过将甘油降解至乙酸来提供还原力(图 6A),一方面产生了大量的副产物,另一方面1, 3-丙二醇的生产强度、效价和转化率均存在瓶颈,再加上高昂的原料价格成本,这种生产方式并不具备市场竞争力[26],因此有人提出外加葡萄糖补充还原力,但是在厌氧发酵条件下这种策略会进一步增加副产物的生成。为了解决1, 3-丙二醇发酵时所面临的还原力困境,杜邦(DuPont)和杰能科(Genencor)在以葡萄糖为原料好氧条件下合成1, 3-丙二醇方面进行了大量的研发投入。研究人员首先对大肠杆菌进行一系列的改造使50%的碳流向1, 3-丙二醇的合成,剩余50%的碳流向TCA循环(图 6B1),以提供更多的还原力。在好氧条件下,他们史无前例地以葡萄糖为碳源合成了高达130 g/L的1, 3-丙二醇,远高于甘油转化路线的78 g/L,在这种tpi阻断的前提下,质量转化率达到了近40% (此途径的理论转化率为42.5%),此后他们进一步优化了糖摄入方式,以便更有效地提供PEP (磷酸烯醇式丙酮酸),并且将部分流向TCA循环的碳引流至1, 3-丙二醇和合成途径,最终在10 L发酵罐中合成了135 g/L的1, 3-丙二醇,转化率达到了51%[9],成功实现了生物制造1, 3-丙二醇的工业化生产。在合成途径中还原力供应不足的情况下,可适量“燃烧”部分碳源来换取足量的还原力供给,以保证代谢通路的顺畅。
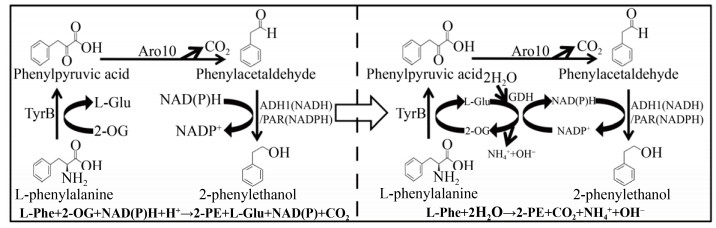
在有些代谢途径中,虽然从等式上来看还原力是不平衡的,但从还原力当量上是平衡的,例如以L-苯基丙氨酸为原料生物催化合成L-苯基乙醇的途径中,既有消耗α-酮戊二酸生成L-谷氨酸的反应,又有消耗NADPH的反应,Wang等将这两步反应偶联起来,构建了代谢途径内的辅因子自平衡系统(图 7),使催化效率提高了3.8倍[37]。
除了上述NAD(P)H的再生影响代谢途径的顺畅进行,诸如维生素B6 (各种转氨酶依赖辅因子)、维生素B12 (甘油脱水酶依赖辅因子)和生物素(羧化酶依赖辅因子)等辅因子对某些关键反应步骤也有较大的影响,在代谢途径限制靶点分析时应给予重视。
5 产物的反馈抑制与毒性自然存在的代谢途径普遍受到负反馈调节的抑制,因为生物要维持胞内各种化合物的相对稳定,防止某一化合物的过度合成而消耗太多资源[34]。例如在辅酶A合成途径中泛酸激酶CoaA的活性受到胞内CoA含量的调控,当胞内CoA含量升高时,泛酸激酶的活性几乎完全丧失,以维持胞内CoA含量的相对稳定[31]。这种现象对生物制造来讲是非常不利的,因为细胞工厂的主要目的就是将原料尽可能地转化为单一目标化合物,因此在途径设计、构建与优化的基础上,为了得到较高的效价,需解除代谢途径中的反馈抑制。一般来讲,反馈抑制往往是终产物或代谢中间体对途径中某个酶的酶活有抑制作用。对于抑制作用较弱的途径,可通过不断地分离终产物来解除抑制作用;而对于产物抑制作用很强的途径,可通过酶的定向进化与筛选来解除抑制,例如泛酸激酶CoaA的突变体F247V的酶活力几乎完全不受CoA浓度的影响[31]。
氨基酸是一大类重要的生物制造目标化学品,由于其代谢途径通常受到严格的调控,在合成氨基酸的细胞工厂构建过程中,调控是首先要解决的问题。比较典型的例子是苏氨酸的生物合成,该途径中不仅天冬氨酸激酶Ⅰ和Ⅲ分别受到苏氨酸和赖氨酸的别构抑制,此外苏氨酸和异亮氨酸还能使操纵子thrABC衰减表达[23]。Lee等在大肠杆菌中对L-苏氨酸合成途径进行了系统性地改造(图 8),它们首先解决了L-苏氨酸反馈抑制的问题,通过在天冬氨酸激酶Ⅰ(ThrA)和Ⅲ (LysC)中引入点突变,解除了氨基酸的别构反馈抑制;将thrABC操纵子的启动子更换为不受调控的tac启动子,以解除该操纵子的衰减效果,同时提高途径中酶的表达量;更进一步地,他们过表达了苏氨酸转运蛋白,尽可能降低了胞内苏氨酸的含量,以削弱反馈抑制的影响。最终他们可以利用葡萄糖合成82.4 g/L的苏氨酸,质量转化率为0.393 g/g葡萄糖[21]。
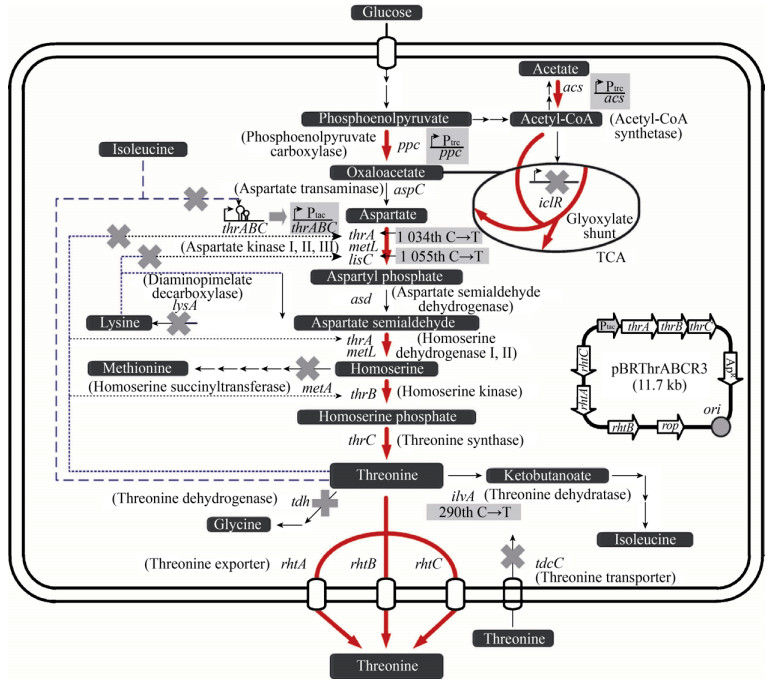
|
| 图 8 产苏氨酸大肠杆菌代谢工程改造策略 Fig. 8 Metabolic engineering strategies employed for the development of Thr-overproducing E. coli strain. |
| |
除了代谢途径终产物会产生反馈抑制,代谢中间体或者副产物有时也存在反馈抑制。前文中我们提到的以甘油为原料合成1, 3-丙二醇的途径中,往往伴随着丙酮醛和甘油-3-磷酸的积累,这些化合物的积累一方面对细胞产生了毒性,另一方面抑制了关键酶活力,Marie等分别阻断了上述两个副产物的合成途径,使1, 3-丙二醇的产量分别提升了50%和250%[41-42]。产物的反馈抑制与毒性问题的解决,对于构建高效价化学品合成的细胞工厂来说尤为重要。
6 总结与展望高效率细胞工厂的构建综合了计量化学、计算机模拟和生物技术等学科,尤其是当前合成生物技术的发展,使改造生命体为人类服务成为可能。在细胞工厂的设计与组装过程中,不仅需要通过计量化学来评估代谢途径的可行性,还需要计算机模拟等工具优化和设计更为高效的合成途径以及合成元件,在此基础上通过生物技术对合成模块进行组装和微调,使代谢途径中的前体得到充足的供应、代谢流顺畅、辅因子平衡和反馈抑制解除,进而得到高效合成目标化学品的细胞工厂(图 9)。随着合成生物技术的进步,将会有许多表达元件与调控手段被开发,这些工具也将逐步被应用于人工合成“细胞工厂”的构建与优化。

|
| 图 9 生物制造“细胞工厂”的设计与组装 Fig. 9 Design and assembly of bio-manufacturing "cell factory". |
| |
| [1] |
Beesch SC. Acetone-butanol fermentation of sugars. Ind Eng Chem, 1952, 44(7): 1677-1682. DOI:10.1021/ie50511a054 |
| [2] |
Gabriel CL. Butanol fermentation process. Ind Eng Chem, 1928, 20(10): 1063-1067. DOI:10.1021/ie50226a020 |
| [3] |
Caspi R, Foerster H, Fulcher CA, et al. MetaCyc: a multiorganism database of metabolic pathways and enzymes. Nucleic Acids Res, 2006, 34(S1): D511-D516. |
| [4] |
Jang YS, Lee JY, Lee J, et al. Enhanced butanol production obtained by reinforcing the direct butanol-forming route in Clostridium acetobutylicum. mBio, 2012, 3(5): e00314-12. |
| [5] |
Jang YS, Woo HM, Im JA, et al. Metabolic engineering of Clostridium acetobutylicum for enhanced production of butyric acid. Appl Microbiol Biotechnol, 2013, 97(21): 9355-9363. DOI:10.1007/s00253-013-5161-x |
| [6] |
Moon HG, Jang YS, Cho C, et al. One hundred years of clostridial butanol fermentation. FEMS Microbiol Lett, 2016, 363(3): fnw001. |
| [7] |
de Graef MR, Alexeeva S, Snoep JL, et al. The steady-state internal redox state (NADH/NAD) reflects the external redox state and is correlated with catabolic adaptation in Escherichia coli. J Bacteriol, 1999, 181(8): 2351-2357. |
| [8] |
Dürre P. Fermentative butanol production: bulk chemical and biofuel. Ann N Y Acad Sci, 2008, 1125(1): 353-362. DOI:10.1196/annals.1419.009 |
| [9] |
Emptage M, Haynie SL, Laffend LA, et al. Process for the biological production of 1, 3-propanediol with high titer: US, 6514733. 2003-02-04.
|
| [10] |
Finley SD, Broadbelt LJ, Hatzimanikatis V. Computational framework for predictive biodegradation. Biotechnol Bioeng, 2009, 104(6): 1086-1097. DOI:10.1002/bit.22489 |
| [11] |
Flamholz A, Noor E, Bar-Even A, et al. eQuilibrator—the biochemical thermodynamics calculator. Nucleic Acids Res, 2012, 40(D1): D770-D775. DOI:10.1093/nar/gkr874 |
| [12] |
Anthony JR, Anthony LC, Nowroozi F, et al. Optimization of the mevalonate-based isoprenoid biosynthetic pathway in Escherichia coli for production of the anti-malarial drug precursor amorpha-4, 11-diene. Metab Eng, 2009, 11(1): 13-19. |
| [13] |
Hadadi N, Hafner J, Shajkofci A, et al. ATLAS of biochemistry: a repository of all possible biochemical reactions for synthetic biology and metabolic engineering studies. ACS Synth Biol, 2016, 5(10): 1155-1166. DOI:10.1021/acssynbio.6b00054 |
| [14] |
Harcum SW, Bentley WE. Heat-shock and stringent responses have overlapping protease activity in Escherichia coli. Appl Biochem Biotechnol, 1999, 80(1): 23-37. |
| [15] |
Henry CS, Broadbelt LJ, Hatzimanikatis V. Discovery and analysis of novel metabolic pathways for the biosynthesis of industrial chemicals: 3-hydroxypropanoate. Biotechnol Bioeng, 2010, 106(3): 462-473. |
| [16] |
Heux S, Cachon R, Dequin S. Cofactor engineering in Saccharomyces cerevisiae: expression of a H2O-forming NADH oxidase and impact on redox metabolism. Metab Eng, 2006, 8(4): 303-314. |
| [17] |
Hou BK, Ellis LBM, Wackett LP. Encoding microbial metabolic logic: predicting biodegradation. J Ind Microbiol Biotechnol, 2004, 31(6): 261-272. DOI:10.1007/s10295-004-0144-7 |
| [18] |
Chen XL, Li SB, Liu LM. Engineering redox balance through cofactor systems. Trends Biotechnol, 2014, 32(6): 337-343. DOI:10.1016/j.tibtech.2014.04.003 |
| [19] |
Cui QQ, Zhou FL, Liu WF, et al. Avermectin biosynthesis: stable functional expression of branched chain α-keto acid dehydrogenase complex from Streptomyces avermitilis in Escherichia coli by selectively regulating individual subunit gene expression. Biotechnol Lett, 2017, 39(10): 1567-1574. DOI:10.1007/s10529-017-2389-z |
| [20] |
Kanehisa M, Goto S, Kawashima S, et al. The KEGG databases at GenomeNet. Nucleic Acids Res, 2002, 30(1): 42-46. |
| [21] |
Lee KH, Park JH, Kim TY, et al. Systems metabolic engineering of Escherichia coli for L-threonine production. Mol Syst Biol, 2007, 3(1): 149. |
| [22] |
Liu B, Xiang SM, Zhao G, et al. Efficient production of 3-hydroxypropionate from fatty acids feedstock in Escherichia coli. Metab Eng, 2019, 51: 121-130. DOI:10.1016/j.ymben.2018.10.003 |
| [23] |
Lynn SP, Gardner JF, Reznikoff WS. Attenuation regulation in the thr operon of Escherichia coli K-12: molecular cloning and transcription of the controlling region. J Bacteriol, 1982, 152(1): 363-371. |
| [24] |
Martin VJJ, Pitera DJ, Withers ST, et al. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat Biotechnol, 2003, 21(7): 796-802. DOI:10.1038/nbt833 |
| [25] |
Lopez de Felipe F, Kleerebezem M, de Vos WM, et al. Cofactor engineering: a novel approach to metabolic engineering in Lactococcus lactis by controlled expression of NADH oxidase. J Bacteriol, 1998, 180(15): 3804-3808. |
| [26] |
Nakamura CE, Whited GM. Metabolic engineering for the microbial production of 1, 3-propanediol. Curr Opin Biotechnol, 2003, 14(5): 454-459. DOI:10.1016/j.copbio.2003.08.005 |
| [27] |
Ogata H, Goto S, Sato K, et al. KEGG: Kyoto encyclopedia of genes and genomes. Nucleic Acids Res, 1999, 27(1): 29-34. |
| [28] |
Oh M, Yamada T, Hattori M, et al. Systematic analysis of enzyme-catalyzed reaction patterns and prediction of microbial biodegradation pathways. J Chem Inf Model, 2007, 47(4): 1702-1712. DOI:10.1021/ci700006f |
| [29] |
Pitera DJ, Paddon CJ, Newman JD, et al. Balancing a heterologous mevalonate pathway for improved isoprenoid production in Escherichia coli. Metab Eng, 2007, 9(2): 193-207. |
| [30] |
Qiao KJ, Wasylenko TM, Zhou K, et al. Lipid production in Yarrowia lipolytica is maximized by engineering cytosolic redox metabolism. Nat Biotechnol, 2017, 35(2): 173-177. |
| [31] |
Rock CO, Park HW, Jackowski S. Role of feedback regulation of pantothenate kinase (CoaA) in control of coenzyme A levels in Escherichia coli. J Bacteriol, 2003, 185(11): 3410-3415. DOI:10.1128/JB.185.11.3410-3415.2003 |
| [32] |
Schomburg I, Chang A, Hofmann O, et al. BRENDA: a resource for enzyme data and metabolic information. Trends Biochem Sci, 2002, 27(1): 54-56. DOI:10.1016/S0968-0004(01)02027-8 |
| [33] |
Song CW, Lee J, Ko YS, et al. Metabolic engineering of Escherichia coli for the production of 3-aminopropionic acid. Metab Eng, 2015, 30: 121-129. DOI:10.1016/j.ymben.2015.05.005 |
| [34] |
Stephanopoulos G, Vallino JJ. Network rigidity and metabolic engineering in metabolite overproduction. Science, 1991, 252(5013): 1675-1681. DOI:10.1126/science.1904627 |
| [35] |
Sun SJ, Zhang HY, Lu SY, et al. The metabolic flux regulation of Klebsiella pneumoniae based on quorum sensing system. Sci Rep, 2016, 6: 38725. DOI:10.1038/srep38725 |
| [36] |
Takamura Y, Nomura G. Changes in the intracellular concentration of acetyl-CoA and malonyl-CoA in relation to the carbon and energy metabolism of Escherichia coli K12. Microbiology, 1988, 134(8): 2249-2253. DOI:10.1099/00221287-134-8-2249 |
| [37] |
Wang PC, Yang XW, Lin BX, et al. Cofactor self-sufficient whole-cell biocatalysts for the production of 2-phenylethanol. Metab Eng, 2017, 44: 143-149. DOI:10.1016/j.ymben.2017.09.013 |
| [38] |
Xu P. Production of chemicals using dynamic control of metabolic fluxes. Curr Opin Biotechnol, 2018, 53: 12-19. DOI:10.1016/j.copbio.2017.10.009 |
| [39] |
Yoon YJ, Kim ES, Hwang YS, et al. Avermectin: biochemical and molecular basis of its biosynthesis and regulation. Appl Microbiol Biotechnol, 2004, 63(6): 626-634. DOI:10.1007/s00253-003-1491-4 |
| [40] |
Zha WJ, Rubin-Pitel SB, Shao ZY, et al. Improving cellular malonyl-CoA level in Escherichia coli via metabolic engineering. Metab Eng, 2009, 11(3): 192-198. |
| [41] |
Zhu MM, Lawman PD, Cameron DC. Improving 1, 3-propanediol production from glycerol in a metabolically engineered Escherichia coli by reducing accumulation of sn-glycerol-3-phosphate. Biotechnol Prog, 2002, 18(4): 694-699. DOI:10.1021/bp020281 |
| [42] |
Zhu MM, Skraly FA, Cameron DC. Accumulation of methylglyoxal in anaerobically grown Escherichia coli and its detoxification by expression of the Pseudomonas putida glyoxalase I gene. Metab Eng, 2001, 3(3): 218-225. DOI:10.1006/mben.2001.0186 |
 2019, Vol. 35
2019, Vol. 35