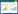中国科学院微生物研究所、中国微生物学会主办
文章信息
- 于航, 高冬妮, 申燕, 刘颖, 平文祥, 葛菁萍
- Yu Hang, Gao Dongni, Shen Yan, Liu Ying, Ping Wenxiang, Ge Jingping
- 鸡GM-CSF和IL-2增强表达新城疫病毒F蛋白的重组杆状病毒疫苗的免疫效果
- Efficacy enhancement of a Baculovirus-vectored Newcastle Disease Virus F protein vaccine by chicken GM-CSF and IL-2
- 生物工程学报, 2018, 34(9): 1442-1452
- Chinese Journal of Biotechnology, 2018, 34(9): 1442-1452
- 10.13345/j.cjb.170505
-
文章历史
- Received: December 21, 2017
- Accepted: May 28, 2018
新城疫(Newcastle disease, ND)是由新城疫病毒(Newcastle disease virus, NDV)引起的高度接触性传染病,由于该病的暴发及抗原变异等情况相继出现,使得传统疫苗免疫效果日趋下降而濒临于历史舞台“边缘”[1]。针对这种情况,开发基因工程亚单位疫苗成为解决该疫病的方法之一。杆状病毒表达系统是一种操作简便、收益高、表达产物稳定的高效的真核表达载体系统,可用于制备新型疫苗以对抗禽类传染病的暴发[2-3]。并且各类疫苗在添加免疫佐剂后其免疫效果得到提高[4-5]。研究表明,F蛋白是NDV感染所必需的蛋白,其在病毒颗粒与宿主细胞融合过程中发挥重要作用[6]。本课题组前期采用DNAMAN、DNAStar和ABCpred等预测软件对NDV-F蛋白抗原表位指数、亲水性、疏水性和二级结构进行了综合预测,我们根据预测结果选取第1-196位氨基酸与第331-554位氨基酸片段作为抗原片段来研究F基因的抗原性并分别构建重组杆状病毒疫苗。鸡体免疫结果显示,含有F全基因的杆状病毒疫苗可获得最佳的免疫保护效果[7],因此本研究以F全基因为目的基因构建重组杆状病毒疫苗,以保护鸡体免受病毒攻击。
但基因工程亚单位疫苗通常因分子量小等因素而不能完全发挥其免疫效果,因此需要通过添加一定的免疫佐剂提高其免疫效果[8]。在众多类型免疫佐剂中,GM-CSF和IL-2对各类免疫细胞具有较强的免疫刺激作用。且具有较为广泛的应用前景而逐渐进入研究者们的视线。其中,GM-CSF是一种重要的造血生长因子和免疫调节因子[9],不仅能够促进粒细胞和单核/巨噬细胞形成集落,还可诱导抗原呈递细胞到达抗原入侵部位对抗原进行呈递,同时也在树突状细胞前体细胞分化中起关键作用[10]。IL-2作为细胞因子可增强单核细胞及NK细胞的杀伤活性[11],同时促进T、B淋巴细胞的增殖和分化,从而发挥抗病毒作用[12]。并且研究者们已经证实重组IL-2具有较强的免疫刺激作用和免疫协同作用[13]。
此外,人们为增强杆状病毒疫苗的保护效率,筛选高效的免疫佐剂亦为重中之重。因此,人们将研究重点逐渐转向对免疫佐剂的研究。本文自主构建重组杆状病毒疫苗(rBV-LMI-F),并联合免疫刺激剂CSF及IL-2进行鸡体免疫。通过对比各组鸡只的抗体水平及细胞因子含量,从GM-CSF和IL-2中筛选出最佳免疫刺激剂,为NDV疫苗免疫刺激剂的应用提供理论依据。
1 材料与方法 1.1 供试材料SPF鸡:80只1日龄白来航鸡均由哈尔滨兽医研究所提供,饲养于隔离器中用于鸡体免疫试验;国家标准速发型NDV强毒株F48E9购自中国兽医微生物菌种保藏管理中心,用于攻毒试验;Sf9昆虫细胞由本实验室冻存,用于重组杆状病毒滴度测定。
1.2 供试质粒本研究所用的杆状病毒骨架质粒pLMI及携带目的基因的原始质粒pT-F和pT-IL-2由本实验室前期自主构建,pUC-GM-CSF购自哈尔滨金凯瑞公司,上述质粒用于构建重组杆状病毒rBV-LMI-F、rBV-LMI-GM-CSF与rBV-LMI-IL-2。
1.3 试剂盒CellTiter 96®Aqueous One Solution Cell Proliferation Assay购自Promega公司;鸡新城疫病毒IgG抗体ELISA检测试剂盒、IFN-γ ELISA检测试剂盒、IL-2 ELISA检测试剂盒和鸡IL-4 ELISA检测试剂盒购自Abcam公司。
1.4 方法 1.4.1 引物设计根据F、GM-CSF及IL-2基因序列设计PCR引物,引物见表 1。
| Primer name | Primer sequence (5′-3′) |
Size (bp) |
Cleavage site (Underlined) |
| F-up | ATCCTCGAGATGGGCTCCAGACCTTCTACC | 30 | XhoⅠ |
| F-down | GGCGTCGACTCAATGATGATGATGATGATGCATTTTTGTAGTGGCTCTCATC | 52 | SalⅠ |
| GM-CSF-up | ATCTCGAGATGCTGGCCCAGCTCACTATT | 29 | XhoⅠ |
| GM-CSF-down | AATGAATTCTTAATGATGATGATGATGATGGATGCAGTCTTTCTCCTCTGGG | 52 | EcoRⅠ |
| IL-2-up | CGGAATTCTGGGACACTGCCATGATG | 26 | EcoRⅠ |
| IL-2-down | CGCGTCGACAATATGATGATGATGATGATGTTATTAAATGTCATCTAGAAG | 51 | SalⅠ |
| M13-47 | CGCCAGGGTTTTCCCAGTCACGAC | 24 | - |
| Enzyme restriction sites are underlined. | |||
将载体pLMI与pT-F/pUC-GM-CSF/pT-IL-2分别进行XhoⅠ/SalⅠ、XhoⅠ/EcoRⅠ和EcoRⅠ/SalⅠ双酶切,并与pLMI载体相连接,构建重组转移质粒pLMI-F、pLMI-GM-CSF与pLMI-IL-2。将获得的重组质粒转入E. coli DH5α感受态细胞中,挑取白色单菌落,提取质粒DNA,并对其进行双酶切验证。验证正确后将重组转移质粒转入E. coli DH10 Bac感受态细胞中,筛选阳性重组子提取Bacmid DNA,并命名为rBac-LMI-F、rBac-LMI-GM-CSF与rBac-LMI-IL-2。最后分别以rBac-LMI-F、rBac-LMI-GM-CSF与rBac-LMI-IL-2为模板,以F-up/F-down、GM-CSF-up/GM-CSF-down、IL-2-up/IL-2-down和M13-47为上下游引物进行PCR,鉴定杆状病毒转移载体是否构建成功。
1.4.3 重组杆状病毒的制备本研究通过脂质体培养法制备重组杆状病毒,首先将上述3种杆状病毒转移载体rBac-LMI-F、rBac-LMI-GM-CSF与rBac-LMI-IL-2转染Sf9昆虫细胞,当80%细胞病变时收集共转染上清液,如此重复3次,以获得高效价P3代重组杆状病毒,并分别命名为rBV-LMI-F、rBV-LMI-GM-CSF和rBV-LMI-IL-2。最后以构建完成的杆状病毒为模板,以F-up/F-down、GM-CSF-up/GM-CSF-down、IL-2-up/IL-2-down为上下游引物进行PCR,验证目的基因是否整合至重组杆状病毒中。
1.4.4 重组杆状病毒的滴度测定本研究通过测定重组杆状病毒滴度确定免疫剂量,将Sf9昆虫细胞接种至6孔板中,并向其分别加入经10倍连续稀释的rBV-LMI-GM-CSF和rBV-LMI-IL-2病毒液,1 h后弃去病毒液,加入含0.9%低熔点琼脂的Sf900 Ⅱ SFM培养液,27 ℃孵育8 d,最后使用中性红染色,通过试验所得蚀斑数量测定重组杆状病毒rBV-LMI-GM-CSF和rBV-LMI-IL-2滴度,并以此滴度进行鸡体免疫。
1.4.5 免疫及攻毒程序将14日龄SPF鸡随机分为4组,每组20只,免疫分组、剂量、接种途径见表 2。当免疫鸡只日龄为14日龄时,对各免疫组鸡只进行第一次免疫;隔7 d进行第二次免疫(0.2 mL/只);42日龄时采用NDV标准强毒株F48E9以皮下注射方式对各免疫组鸡只攻毒,攻毒剂量为200 μL/只。攻毒后观察鸡采食量、饮水量、粪便和精神状况等生理变化。
| Group | Vaccine | Antigen gene | Inoculation dose | Inoculation route |
| A | PBS | - | 200 μL | Intramuscular injection |
| B | rBV-LMI-F | F | 200 μL | Intramuscular injection |
| C | rBV-LMI-F+rBV-LMI-GM-CSF | GM-CSF | 200 μL each | Intramuscular injection |
| D | rBV-LMI-F+rBV-LMI-IL-2 | IL-2 | 200 μL each | Intramuscular injection |
攻毒后7 d,各免疫组随机选取一只SPF鸡进行麻醉并断头处死,提取免疫鸡只心脏及十二指肠组织,混于多聚甲醛溶液过夜,然后使用EDTA脱钙液体脱钙1周。包埋后通过切片机将组织切成8 μm厚的截面,用于病理组织切片分析。
1.4.7 免疫鸡血清中和试验分离免疫鸡血清,梯度稀释NDV强毒株及血清,然后使病毒与血清中和反应1 h,接种至鸡胚成纤维细胞,37 ℃、5% CO2培养96 h,每12 h记录细胞病变情况,按Reed-Muench法计算出每个血清样品的中和保护价(Protective dose,PD50),用SSPS软件计算每组血清PD50的几何平均数,即为该日龄血清的中和抗体效价(Geometric mean titer,GMT)。
1.4.8 免疫鸡血清IgG抗体水平的检测在免疫0、14、28、42、56 d后每组随机选取6只采取翅静脉血,每只0.5-1.0 mL,4 000 r/min离心15 min分离血清,应用新城疫IgG抗体ELISA试剂盒检测免疫后各组血清样本中IgG抗体滴度,具体方法按照ELISA检测试剂盒说明书进行。
1.4.9 免疫鸡血清细胞因子的检测所有免疫鸡在免疫后0、14、28、42、56 d后随机翅静脉采血6只,每只0.5-1.0 mL,离心分离血清,应用IFN-γ、IL-2和IL-4 ELISA试剂盒检测各免疫组鸡只血清样本中IFN-γ、IL-2和IL-4浓度,具体方法按照ELISA检测试剂盒说明书进行。
1.4.10 统计学分析运用SPSS Statistics19软件对有样本重复的试验数据进行统计学分析,试验数据均以x±s表示,均数间的比较采用差异显著性分析,P<0.05为差异显著。
2 结果与分析 2.1 重组转移载体pLMI-F、pLMI-GM-CSF和pLMI-IL-2的构建与鉴定将载体pLMI、pT-F、pUC-GM-CSF和pT-IL-2分别进行酶切后,将载体片段与目的片段连接,转化E. coli DH5α感受态细胞,提取质粒进行酶切验证,凝胶电泳检测结果表明重组转移载体pLMI-F、pLMI-GM-CSF和pLMI-IL-2构建成功。
2.2 重组穿梭转移载体rBac-LMI-F、rBac-LMI-GM-CSF和rBac-LMI-IL-2的鉴定将构建成功的重组转移载体转化E. coli DH10 Bac感受态细胞,提取Bacmid DNA,进行PCR验证,凝胶电泳结果显示在预期处均有明显条带(4 000、2 800、2 800 bp),表明重组穿梭转移载体rBac-LMI-F、rBac-LMI-GM-CSF和rBac-LMI-IL-2构建成功。
2.3 重组杆状病毒rBV-LMI-F、rBV-LMI-GM-CSF和rBV-LMI-IL-2的PCR鉴定将构建完成的重组穿梭载体rBac-LMI-F、rBac-LMI-GM-CSF和rBac-LMI-IL-2转染Sf9昆虫细胞,收集上清液制备P1代重组杆状病毒,并进行PCR鉴定,电泳结果显示在预期处均有明显条带(1 662、435、430 bp),表明目的基因已成功整合到重组杆状病毒基因组中,重组杆状病毒rBV-LMI-F、rBV-LMI-GM-CSF和rBV-LMI-IL-2构建成功。
2.4 重组杆状病毒滴度测定利用空斑分析法测定P3代重组杆状病毒滴度,观察至空斑数不变后计数,计数前用中性红溶液染色2 h,观察空斑形态并计数,得到rBV-X P3代的重组病毒滴度(表 3和图 1)。
| Group-P3 | Titer (PFU/mL) | Dilution factor | Number of plaques |
| rBV-LMI-F | 1.00×109 | 10-7 | 100 |
| rBV-LMI-GM-CSF | 5.30×108 | 10-7 | 32 |
| rBV-LMI-IL-2 | 1.00×109 | 10-7 | 100 |
|
| 图 1 免疫鸡只攻毒保护结果 Figure 1 Results of chicken challenge experiments. |
| |
各免疫组鸡只在初次免疫和加强免疫后均表现正常。在攻毒2 d后开始出现死亡,空白对照组鸡只发病率为71.4%,同时本课题组在剖检鸡只后发现各免疫组鸡只的心脏及十二指肠均有不同程度的出血和充血现象,说明NDV对免疫鸡只具有较强的毒性,并可致其死亡。而rBV-LMI-F单独免疫组和rBV-LMI-F+rBV-LMI-IL-2联合免疫组在攻毒4 d后才陆续有少量鸡只死亡,而rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组的免疫鸡只则全部存活。同时在攻毒后第8天剖检GM-CSF和IL-2联合免疫组鸡只,未发现其心脏与十二指肠出现大规模出血与充血现象。并且在GM-CSF和IL-2的免疫协同作用下,rBV-LMI-F+ rBV-LMI-GM-CSF/IL-2联合免疫组攻毒保护率分别达到100%和85.7%,与rBV-LMI-F单独免疫组(80%)相比,差异显著(P<0.05),同时rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组攻毒保护率较rBV-LMI-F+rBV-LMI-IL-2联合免疫组提高了14.3%,且差异显著(P<0.05)。表明GM-CSF与IL-2虽均具有较强的免疫协同作用,但相比于IL-2来说,GM-CSF具有更强的免疫刺激效果(图 1)。同时排毒情况显示,PBS对照组病毒分离为阳性,而rBV-LMI-F单独免疫组和rBV-LMI-F+rBV-LMI-GM-CSF/IL-2联合免疫组病毒分离均为阴性,且盲传1代后亦为阴性。
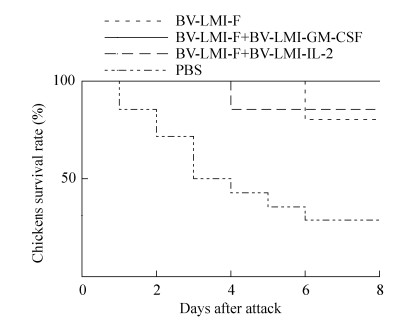
2.6 病理学分析 2.6.1 免疫鸡只病理组织定性分析根据病理组织切片结果显示,GM-CSF联合免疫组鸡只的十二指肠则无明显病理变化;且IL-2联合免疫组鸡只的十二指肠的肠黏膜部分有少量脱落,而PBS及rBV-LMI-F对照组免疫鸡只的十二指肠的肠粘膜表面上皮脱落且多处呈枣核状紫红色出血点,大部分组织结构被破坏。另外在心肌纤维方面,GM-CSF联合免疫组鸡只的心肌纤维完好无损,无明显病理变化;同时IL-2联合免疫组鸡只的心肌纤维局部有轻微的小灶状出血,而PBS及rBV-LMI-F对照组免疫鸡只的心肌纤维明显断裂,存在大量出血点及出血斑(图 2、图 3)。表明相对于IL-2来说,GM-CSF具有较强的免疫协同作用,可有效增强重组杆状病毒对鸡体的保护能力。
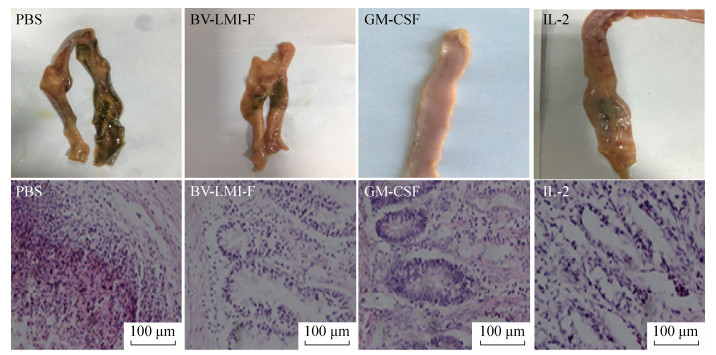
|
| 图 2 各免疫组鸡只的十二指肠病变情况(200×) Figure 2 Duodenum lesions in the immunized chickens of each group (200×). |
| |
|
| 图 3 各免疫组鸡只的心肌病变情况(200×) Figure 3 Myocardial lesions in the immunized chickens of each group (200×). |
| |
为深入分析GM-CSF与IL-2在协助重组杆状病毒疫苗对鸡体器官组织保护方面的能力强弱,本研究通过Image J软件测定免疫鸡组织内肠上皮脱落与心肌纤维断裂部分面积的大小,对病理组织切片进行定量分析,以评价GM-CSF与IL-2的免疫协同作用。
结果表明,PBS空白对照组、rBV-LMI-F、GM-CSF共免疫组及IL-2共免疫组免疫鸡只十二指肠内场上皮脱落面积分别为25 830、11 541、2 079、5 086 μm2,其中GM-CSF共免疫组十二指肠内肠上皮脱落面积最小,且与其余各免疫组相比均差异显著(P<0.05)。同时,PBS空白对照组、rBV-LMI-F、GM-CSF共免疫组及IL-2共免疫组免疫鸡只心肌纤维断裂部分面积分别为13 227、9 248、1 058、2 865 μm2,其中GM-CSF共免疫组十二指肠内肠上皮脱落面积最小,且与其余各免疫组相比均差异显著(P<0.05),表明相对于IL-2,GM-CSF可协助重组杆状病毒疫苗对鸡体组织提供更好的保护。
2.7 免疫鸡血清中和抗体效价测定各免疫组鸡只免疫血清中中和抗体效价均呈现先升高后降低的趋势,且在第一次免疫后28 d达到最高(图 4),rBV-LMI-F+rBV-LMI-GM-CSF及rBV-LMI-F+rBV-LMI-IL-2联合免疫组免疫鸡血清中中和抗体效价分别为1 575.84及1 457.83,与rBV-LMI-F单独免疫组(1 329.78)相比,差异极显著(P<0.01),表明GM-CSF与IL-2均能对重组杆状病毒疫苗起到免疫增强的协同作用。同时,rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组免疫鸡血清中中和抗体效价较rBV-LMI-F+rBV-LMI-IL-2联合免疫组高8.1%,且差异极显著(P<0.01),表明与IL-2相比,GM-CSF能够对重组杆状病毒疫苗起到更强的免疫增强的协同作用。
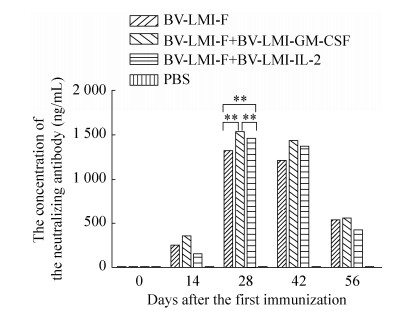
|
| 图 4 各免疫组鸡血清中中和抗体效价 Figure 4 The titer of serum neutralizing antibody in each group. *P < 0.05; **P < 0.01. |
| |
自首免后,各免疫组鸡血清中IgG水平均呈现先升高后降低的趋势,且于第一次免疫后42 d达到最高,其中rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组鸡血清中IgG抗体水平较BV-LMI-F单独免疫组提高了25.7%,差异显著(P<0.05),而rBV-LMI-F+rBV-LMI-IL-2联合免疫组较rBV-LMI-F单独免疫组仅提高了13.8%。同时GM-CSF联合免疫组鸡血清中IgG抗体水平较IL-2联合免疫组提高了10.49%,且差异显著(P<0.05),表明相对于IL-2而言,GM-CSF能够刺激鸡体产生较高水平体液免疫应答,此结果与攻毒保护率相符(图 5)。
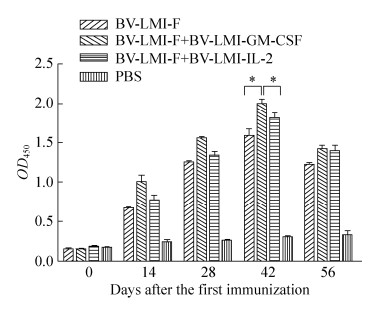
|
| 图 5 各免疫组鸡血清中特异性IgG抗体水平 Figure 5 The titer of serum specific IgG in each group. *P < 0.05; **P < 0.01. |
| |
首免后,各免疫组鸡只血清中IFN-γ含量随时间延长而逐渐升高,至第一次免疫后42 d,各组IFN-γ含量达到最大(图 6)。其中rBV-LMI-F+rBV-LMI-GM-CSF/IL-2联合免疫组鸡只血清中IFN-γ含量(78.10、73.01 ng/mL)与rBV-LMI-F单独免疫组(59.53 ng/mL)相比差异极显著(P<0.01)。而rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组鸡只血清中IFN-γ含量较rBV-LMI-F+ rBV-LMI-IL-2联合免疫组提高了7.0%,且差异极显著(P<0.01),表明GM-CSF与IL-2均能刺激鸡体产生较强的细胞免疫应答。
|
| 图 6 各免疫组鸡血清中IFN-γ含量 Figure 6 The serum concentration of IFN-γ in each group. *P < 0.05; **P < 0.01. |
| |
各免疫组鸡只血清中IL-2及IL-4含量均呈现先升高后降低的趋势,至第一次免疫后56 d时达到最高,且rBV-LMI-F+rBV-LMI-GM-CSF/IL-2联合免疫组与rBV-LMI-F单独免疫组相比,差异极显著(P<0.01)。其中,rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组血清中IL-2及IL-4含量较rBV-LMI-F+rBV-LMI-IL-2联合免疫组分别提高了10.74%和21.4%,且均差异极显著(P<0.01)。结果表明,相对于IL-2来说,GM-CSF能够诱导鸡体产生更强的系统性免疫应答,对鸡体提供更好的保护(图 7、图 8)。
|
| 图 7 各免疫组鸡血清中IL-2含量 Figure 7 The serum concentration of IL-2 in each group. *P < 0.05; **P < 0.01. |
| |
|
| 图 8 各免疫组鸡血清中IL-4含量 Figure 8 The serum concentration of IL-4 in each group. *P < 0.05; **P < 0.01. |
| |
目前人们对于NDV的防控主要以传统疫苗为主,虽然也开始利用基因工程亚单位疫苗进行尝试,但是也或多或少出现了一些弊病,例如重组杆状病毒疫苗的免疫效果会受外源基因表达时间的限制[14-15],并且变异株的出现使疫苗免疫效果下降[16-18],而单一使用疫苗也很难将病毒根除[19-20]。因此,联合免疫刺激剂来增强重组杆状病毒疫苗的免疫效果成为有益的选择[21-22]。
目前,在众多免疫刺激剂中,GM-CSF和IL-2对各类免疫细胞具有较强的免疫刺激作用。王兴龙等[23]在探究GM-CSF作用效果时发现,其可刺激鸡骨髓细胞快速形成集落。姜永厚等[24]在构建重组质粒并联合F基因疫苗进行鸡体免疫研究IL-2的免疫效果作用时亦得到相似结论。
虽然鸡GM-CSF和IL-2具有作为免疫刺激剂的应用前景,但对于两者免疫增强效果的比较方面的研究还鲜有报道,且两者对于NDV的响应水平及对杆状病毒疫苗的免疫协同效果还不为人所知[25]。因此本研究以此为切入点,以GM-CSF和IL-2为免疫刺激剂进行鸡体免疫,对比分析两者的免疫增强效果。
免疫鸡只攻毒保护率结果表明,rBV-LMI-F+ rBV-LMI-GM-CSF联合免疫组攻毒保护率和中和抗体含量较IL-2联合免疫组提高了14.3%,差异显著(P<0.05),且Sedegah等[26]在探究GM-CSF与pPyCSP免疫协同作用时得出相似结果,即两者混合免疫后机体内pPyCSP特异性抗体水平提高了8倍,表明GM-CSF可提高多类基因工程疫苗的免疫效果,且不仅局限于禽类疫苗中,其可突破种属限制并发挥较强的免疫刺激作用,同时本研究也为GM-CSF在其余病例中的应用提供新思路。
此外,rBV-LMI-F+rBV-LMI-GM-CSF联合免疫组鸡只器官并无明显病变,而rBV-LMI-F+rBV-LMI-IL-2联合免疫组鸡只器官有明显出血点和血斑出现,表明GM-CSF可增强杆状病毒疫苗对鸡体的保护效果,GM-CSF可能通过激活某种信号转导通路以修复受损组织避免鸡体死亡,从侧面提高疫苗的免疫保护效率。另一方面,本研究发现GM-CSF联合免疫组鸡只免疫血清中中和抗体及特异性IgG抗体水平较IL-2联合免疫组分别提高了5.5%和11.8%,且均差异显著(P<0.05),表明GM-CSF能够刺激鸡体产生较强的体液免疫应答,进而协助重组杆状病毒疫苗提高对鸡体的保护效率。同时,GM-CSF联合免疫鸡血清中IFN-γ、IL-2及IL-4含量均高于IL-2联合免疫组,且均差异显著(P<0.05)。Du等[27]在探究GM-CSF的免疫协同作用时亦发现,GM-CSF可协助重组疫苗提高机体内IL-2、IL-4和IFN-γ等细胞因子的含量,另外谭兵等[28]亦得到相似结果,表明GM-CSF不仅对免疫细胞具有较强刺激作用,对机体的体液及细胞免疫亦具有较强的刺激作用,至于其是否可激活某种信号转导通路还需进一步探究。
综上所述,本研究在尝试构建杆状病毒载体疫苗并进行鸡体免疫后,明确了GM-CSF作为免疫刺激剂的免疫协同效果,发现GM-CSF可不受种属限制,GM-CSF亦可协助疫苗突破机体组织屏障,保护机体组织不受病毒侵害以发挥其较强的免疫协同作用。本研究不仅为NVD的制备奠定基础,同时也为GM-CSF的应用领域及免疫增强机制方面的探究提供新的研究思路。
| [1] | Cuadrado-Castano S, Sanchez-Aparicio MT, García-Sastre A, et al. The therapeutic effect of death: newcastle disease virus and its antitumor potential. Virus Res, 2015, 209: 56–66. DOI: 10.1016/j.virusres.2015.07.001 |
| [2] | Li BQ, Ye JX, Lin Y, et al. Selection and characterization of single-chain recombinant antibodies against phosphoprotein of newcastle disease virus. Biologicals, 2014, 42(5): 285–289. DOI: 10.1016/j.biologicals.2014.05.006 |
| [3] | Shittu I, Zhu ZY, Lu YQ, et al. Development, characterization and optimization of a new suspension chicken-induced pluripotent cell line for the production of Newcastle disease vaccine. Biologicals, 2016, 44(1): 24–32. DOI: 10.1016/j.biologicals.2015.09.002 |
| [4] | Loudon PT, Yager EJ, Lynch DT, et al. GM-CSF increases mucosal and systemic immunogenicity of an H1N1 influenza DNA vaccine administered into the epidermis of non-human primates. PLoS ONE, 2010, 5(6): e11021. DOI: 10.1371/journal.pone.0011021 |
| [5] | Panousis C, Dhagat U, Edwards KM, et al. CSL311, a novel, potent, therapeutic monoclonal antibody for the treatment of diseases mediated by the common β chain of the IL-3, GM-CSF and IL-5 receptors. MAbs, 2016, 8(3): 436–453. DOI: 10.1080/19420862.2015.1119352 |
| [6] | Jiang NY, Tian ZQ, Tang J, et al. Granulocyte macrophage-colony stimulating factor (GM-CSF) downregulates the expression of protumor factors cyclooxygenase-2 and inducible nitric oxide synthase in a GM-CSF receptor-independent manner in cervical cancer cells. Mediat Inflamm, 2015, 2015(5): 601–604. |
| [7] | Tan B, Wang HN, Shang LQ, et al. Coadministration of chicken GM-CSF with a DNA vaccine expressing infectious bronchitis virus (IBV) S1 glycoprotein enhances the specific immune response and protects against IBV infection. Arch Virol, 2009, 154(7): 1117–1124. DOI: 10.1007/s00705-009-0424-7 |
| [8] | Lawson DH, Lee S, Zhao FM, et al. Randomized, placebo-controlled, phase Ⅲ trial of yeast-derived Granulocyte-Macrophage Colony-Stimulating Factor (GM-CSF) versus peptide vaccination versus gm-csf plus peptide vaccination versus placebo in patients with no evidence of disease after complete surgical resection of locally advanced and/or stage Ⅳ melanoma: a trial of the eastern cooperative oncology group-American College of Radiology Imaging Network Cancer Research Group (E4697). J Clin Oncol, 2015, 33(34): 4066–4076. DOI: 10.1200/JCO.2015.62.0500 |
| [9] | Cheng H, Wang AD, Meng J, et al. Enhanced metastasis in RNF13 knockout mice is mediated by a reduction in GM-CSF levels. Protein Cell, 2015, 6(10): 746–756. DOI: 10.1007/s13238-015-0188-7 |
| [10] | Zhang HW, Qian P, Peng B, et al. A novel subunit vaccine co-expressing GM-CSF and PCV2b Cap protein enhances protective immunity against porcine circovirus type 2 in piglets. Vaccine, 2015, 33(21): 2449–2456. DOI: 10.1016/j.vaccine.2015.03.090 |
| [11] | Martinović KMM, Vuletić AM, Lj Babović N, et al. Attenuated in vitro effects of IFN-α, IL-2 and IL-12 on functional and receptor characteristics of peripheral blood lymphocytes in metastatic melanoma patients. Cytokine, 2017, 96: 30–40. DOI: 10.1016/j.cyto.2017.02.024 |
| [12] | Li XG, Lu P, Li B, et al. Interleukin 2 and interleukin 10 function synergistically to promote CD8+ T cell cytotoxicity, which is suppressed by regulatory T cells in breast cancer. Int J Biochem Cell Biol, 2017, 87: 1–7. DOI: 10.1016/j.biocel.2017.03.003 |
| [13] |
Wu YG, Ding GY, Song CP, et al. The epidemic characteristics and control strategy of Newcastle disease.
Chin Poultry, 2012, 34(5): 5–7.
(in Chinese). 吴延功, 丁国义, 宋翠平, 等. 新城疫的流行特点与防控措施. 中国家禽, 2012, 34(5): 5-7. DOI:10.3969/j.issn.1004-6364.2012.05.002 |
| [14] | Kitagawa Y, Tani H, Limn CK, et al. Ligand-directed gene targeting to mammalian cells by pseudotype baculovirurses. J Virol, 2005, 79(6): 3639–3652. DOI: 10.1128/JVI.79.6.3639-3652.2005 |
| [15] |
Qin ZF, He DS, Liu FA. Immunogenicity of three subunit vaccine of ND.
Chin J Vet Sci, 2003, 23(1): 22–25.
(in Chinese). 秦智锋, 贺东生, 刘福安. 新城疫3组基因亚单位疫苗的免疫原性试验. 中国兽医学报, 2003, 23(1): 22-25. DOI:10.3969/j.issn.1005-4545.2003.01.007 |
| [16] |
Ding Z, Yin RF, Xue C, et al. The new epidemiological features of Newcastle disease and the control strategy of Newcastle Disease.
Chin J Vet Sci, 2015, 35(1): 159–168.
(in Chinese). 丁壮, 尹仁福, 薛聪, 等. 新城疫流行病学新特点及鹅新城疫防控策略. 中国兽医学报, 2015, 35(1): 159-168. |
| [17] |
Li N, Sun YM, Zhao BH. Cloning of F gene of Newcastle disease virus HeB02 isolate and the study of its DNA vaccine.
Chin J Biotech, 2006, 22(3): 445–450.
(in Chinese). 李楠, 孙一敏, 赵宝华. 鸡新城疫病毒HeB02分离株F基因的克隆及其DNA疫苗的研究. 生物工程学报, 2006, 22(3): 445-450. DOI:10.3321/j.issn:1000-3061.2006.03.016 |
| [18] |
Xu HY, Qin ZM, Qi LH, et al. Evolution of non-coding nucleotide sequences in Newcastle disease virus genomes.
Acta Microbiol Sin, 2014, 54(9): 1073–1081.
(in Chinese). 徐怀英, 秦卓明, 亓丽红, 等. 新城疫病毒非编码序列的遗传演化趋势. 微生物学报, 2014, 54(9): 1073-1081. |
| [19] |
Zhang JH. The production, application and development of chicken Newcastle disease vaccines.
Chin Poultry, 2000, 22(2): 41–42.
(in Chinese). 张俊红. 鸡新城疫疫苗的产生、应用及发展. 中国家禽, 2000, 22(2): 41-42. DOI:10.3969/j.issn.1004-6364.2000.02.028 |
| [20] |
Yang BL, Lü HQ. The detection of hiantibodies to Newcastle disease of serum from chickens inoculated with different strains of vaccine.
Chin Anim Husb Vet Med, 2006, 33(5): 53–55.
(in Chinese). 杨百亮, 吕慧强. 不同鸡新城疫疫苗免疫鸡血清HI抗体的测定. 中国畜牧兽医, 2006, 33(5): 53-55. DOI:10.3969/j.issn.1671-7236.2006.05.019 |
| [21] |
Duan L, Li XZ, Tian QH. Screening of immunostimulants for Newcastle disease vaccine.
Chin Poultry, 2015, 37(14): 65–66.
(in Chinese). 段龙, 李学钊, 田启会. 常用新城疫疫苗免疫佐剂的筛选. 中国家禽, 2015, 37(14): 65-66. |
| [22] |
Tang C, Huang X, Yang FL, et al. Effects of aluminum hydroxide nanoparticles on chicken Newcastle disease antimicrobial antimicrobial agents.
Vet Sci Chin, 2008, 38(12): 1060–1064.
(in Chinese). 汤承, 黄兴, 杨发龙, 等. 氢氧化铝纳米颗粒对鸡新城疫抗原的免疫佐剂效应. 中国兽医科学, 2008, 38(12): 1060-1064. |
| [23] |
Wang XL, Hao HF, Du EQ, et al. Adenovirus expression and activity test of chicken GM-CSF.
Chin J Vet Sci, 2012, 32(4): 509–512.
(in Chinese). 王兴龙, 郝华芳, 杜恩岐, 等. 腺病毒表达鸡GM-CSF及其对鸡骨髓细胞增殖活性的检测. 中国兽医学报, 2012, 32(4): 509-512. |
| [24] |
Jiang YH, Chen JL, Song XL, et al. Construction of the recombinant plasmid coexpressing NDV F gene and chicken IL-2.
Chin J Prev Vet Med, 2001, 23(2): 81–84.
(in Chinese). 姜永厚, 陈奖励, 宋秀龙, 等. 鸡新城疫病毒F基因和鸡IL-2重组DNA疫苗的构建. 中国预防兽医学报, 2001, 23(2): 81-84. DOI:10.3969/j.issn.1008-0589.2001.02.001 |
| [25] |
Jiang YH, Liu ZG, Chen JL, et al. Effect of chicken IL-2 on Newcastle disease virus F gene vaccination.
Chin J Vet Sci, 2002, 22(1): 22–24.
(in Chinese). 姜永厚, 刘忠贵, 陈奖励, 等. 鸡IL-2在新城疫病毒F基因疫苗免疫中的作用. 中国兽医学报, 2002, 22(1): 22-24. DOI:10.3969/j.issn.1005-4545.2002.01.007 |
| [26] | Sedegah M, Weiss W, Sacci JB Jr, et al. Improving protective immunity induced by DNA-based immunization: priming with antigen and GM-CSF-encoding plasmid DNA and boosting with antigen-expressing recombinant poxvirus. J Immunol, 2000, 164(11): 5905–5912. DOI: 10.4049/jimmunol.164.11.5905 |
| [27] | Du YJ, Jiang P, Li YF, et al. Immune responses of two recombinant adenoviruses expressing VP1 antigens of FMDV fused with porcine granulocyte macrophage colony-stimulating factor. Vaccine, 2007, 25(49): 8209–8219. DOI: 10.1016/j.vaccine.2007.09.062 |
| [28] |
Tan B, Wang HN, Zhang Y, et al. Cloning and eukaryotic expression of chicken granulocyte macrophage colony stimulating factor gene.
J Zhejiang Univ: Agric Life Sci, 2009, 35(5): 516–522.
(in Chinese). 谭兵, 王红宁, 张毅, 等. 鸡粒细胞-巨噬细胞集落刺激因子的克隆与真核表达. 浙江大学学报:农业与生命科学版, 2009, 35(5): 516-522. |
 2018, Vol. 34
2018, Vol. 34