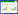中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李远锋, 靳珅, 王登刚, 梁书利, 郑穗平, 林影
- Li Yuanfeng, Jin Shen, Wang Denggang, Liang Shuli, Zheng Suiping, Lin Ying
- 黑曲霉组成型表面展示南极假丝酵母脂肪酶B及其发酵调控
- Constitutive display of Candida antarctica lipase B on the cell surface of Aspergillus niger and regulation of its fermentation
- 生物工程学报, 2018, 34(7): 1189-1196
- Chinese Journal of Biotechnology, 2018, 34(7): 1189-1196
-
文章历史
- Received: December 4, 2017
- Accepted: March 19, 2018
脂肪酶不但催化脂肪水解,而且在非水相中能高效催化转酯和酯化等反应,具有反应条件温和等特性[1-2],由此脂肪酶被广泛应用于化学、食品、化妆品、医药等行业。南极假丝酵母脂肪酶B (Candida antarctica lipase B, CALB)因具有与其他脂肪酶不同的性质和特殊的结构,如对水溶性以及非水溶性底物都有很强的催化活性,可用于催化合成反应、油脂转化等[3-4],同时还具有很显著的手性选择性和区域选择性,可以在有机相中催化不对称的水解、胺解、酯化和酯交换等反应[5-6],使其成为研究热点。
丝状真菌具有较强的蛋白质分泌能力和较完备的蛋白质装配加工运输途径,并具有蛋白质胞外分泌量大、表达蛋白有天然活性的优点[7-8]。其中黑曲霉Aspergllus niger作为一种通用的蛋白表达系统,特别适合于食品和药品的生产,并被美国食品药品监督管理局(Food and Drug Administration, FDA)定义为通常认为安全(Generally regarded as safe, GRAS)的微生物[9]。食品加工行业已经认可通过黑曲霉生产的酶制剂[10]。细胞表面展示技术通过外源蛋白与锚定蛋白融合表达在细胞表面上,简化了蛋白纯化和固定化步骤,具有较大的工业应用价值[11]。目前仅有少数关于丝状真菌表面展示系统的报道,如米曲霉细胞表面展示系统[12-13]和笔者实验室从头构建的黑曲霉细胞表面展示系统[14],在黑曲霉糖化酶基因启动子(pGlaA)操控下,将带有FLAG标签的CALB与A. niger内源的壁蛋白CwpA[15]融合,实现了CALB在黑曲霉菌丝表面的活性展示。尽管pGlaA已被应用于外源蛋白表达中,但其作为一种诱导型启动子,在淀粉或其衍生物的培养基中可以诱导产酶,在木糖培养基中不能诱导产酶[16]。在利用葡萄糖及其类似物等碳源时,仅在较低浓度时有强诱导作用,而在高浓度诱导的作用受到抑制[17-18],使得工业化发酵生产控制困难。
甘油醛3-磷酸脱氢酶是糖酵解第6步的酶,该基因启动子(pGpdA)为组成型启动子,无需添加任何诱导物,可自发调控结构基因进行表达[19]。已有许多成功利用该启动子表达外源蛋白的报道,例如在酱油曲霉中使用pGpdA克隆表达来自烟曲霉菌的α-半乳糖苷酶[20];在黑曲霉中表达大肠杆菌来源的β-半乳糖苷酶、β-葡萄糖醛酸酶[21]以及葡萄糖氧化酶[22]等。
本研究基于实验室已有的黑曲霉表面展示CALB (AN-GlaA)菌株的基础上进行改造[14],将诱导型启动子pGlaA替换为组成型启动子pGpdA (AN-GpdA),通过对所构建菌株的发酵控制研究,拟解决发酵过程中高浓度葡萄糖、木糖等抑制产酶、发酵后期菌丝裂解造成展示酶活力严重下降等问题,初步探讨了甘蔗渣水解液为碳源发酵产品的条件,为甘蔗渣的综合利用提供了新途径。
1 材料与方法 1.1 材料与试剂 1.1.1 菌种实验中所用的菌株和质粒见表 1。
KOD FX聚合酶购自东洋纺(上海)生物技术有限公司。CloneEZ重组克隆试剂盒购自南京金斯瑞生物科技有限公司。各种限制性内切酶(如Not Ⅰ、Sal Ⅰ)购自NEB公司。鼠抗FLAG单抗Mouse anti-FLAG购自美国Agilent公司。Alexa Fluor488标记羊抗鼠IgG购自美国Invitrogen公司。酵母提取物和胰蛋白胨购自Oxoid公司。对硝基苯酚丁酸酯(pNPB)和聚乙烯醇(PVA-124)购自Sigma-Aldrich公司。牛血清白蛋白(BSA)购自北京普博欣生物公司。其余分析纯试剂均购自天津市大茂化学试剂厂。
对硝基苯酚丁酸酯(pNPB)底物配制:25 mmol/L pNPB与1%曲拉通-100溶解于50 mmol/L Tris-HCl缓冲液(pH 8.0),使用均质机乳化至均匀,于–20 ℃保存。
1.1.3 培养基Luria-Bertani (LB):1%胰蛋白胨,0.5%酵母抽提物,1% NaCl。乙酰胺CD种子培养基:2%蔗糖,0.2% KCl,0.05% MgSO4,0.1% K2HPO4,0.001% FeSO4·7H2O,0.05%琼脂,85% H3PO4调节pH至5.5,使用前加入经0.22 μm滤膜过滤除菌后的乙酰胺至10 mmol/L。乙酰胺蔗糖CD高渗固体培养基:乙酰胺CD种子培养基的基础上,更换琼脂为2%,并加入1.5 mmol/L CsCl。
三丁酸甘油酯固体培养基:0.2% PVA-124,0.5%三丁酸甘油酯,0.3% NaNO3,0.1% K2HPO4,0.05% KCl,0.05% MgSO4,1%葡萄糖,2%琼脂,0.25%曲拉通,调节pH至5.5。APY:1%酵母提取物,0.75%蛋白胨,1.5% (NH4)2SO4,0.84% KH2PO4,0.18% Na2HPO4·12H2O。GAPY:在APY添加葡萄糖至终浓度为6%。XAPY:在APY添加木糖母液至终浓度为6%。AN-GlaA发酵在APY诱导产酶,每12 h添加葡萄糖至终浓度为0.25%。
甘蔗渣水解液发酵培养基:称取适量甘蔗渣用4.5%氢氧化钠(S/L=1:25)在80 ℃预处理4 h,水洗至中性,再加入柠檬酸-柠檬酸钠缓冲液(pH 4.8, S/L=1:20)和纤维素酶(20 FPU/g底物),48 ℃酶解反应80 h。过滤后,旋转蒸发,得到终浓度为6%甘蔗渣水解液,再添加APY中的各成分。
1.2 黑曲霉细胞表面展示载体的构建从A. niger SH-1细胞中提取全基因组,设计引物gpdA1261F/SsglaAF (表 2)。PCR扩增出pGpdA的编码基因。以pCALB-C质粒为模板,设计引物gpdARnew/SSglaAR (表 2)。PCR扩增出信号肽SSglaA的编码基因。PCR反应体系与PCR扩增pGpdA的编码基因相同。上述两种产物经PCR产物纯化试剂盒纯化后,共同作为模板,以gpdA1261F/SSglaAR为引物,进行融合PCR,得到pGpdA-SSgla的编码基因。PCR反应体系与PCR扩增pGpdA的编码基因相同。利用限制性内切酶(NotⅠ、SalⅠ)处理pCALB-C,切除pGlaA-SSGla片段,得到产物回收纯化后与上述融合PCR的产物用CloneEZ重组克隆试剂盒连接。随后转化E. coli TOP 10,得到构建的质粒pCALB-D (图 1)。
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| gpdARnew | AGATCGGAACGACATTG TTTAGATGTGTCTATGTG GCG |
38 |
| SSglaAF | TAGACACATCTAAACAA TGTCGTTCCGATCTCTAC TCGC |
39 |
| SSglaAR | CACCAAAGGAGTGGCG TCGACGCGCTTGGAAAT CACATTTGC |
42 |
| gpdA1261F | CAATAGACATCAGTAGC GGCCGCACAGAGGCCA GAGCATCACC |
43 |

|
| 图 1 pCALB-D质粒图谱 Figure 1 Map of the plasmid pCALB-D. |
| |
提取pCALB-D质粒,进行A. niger SH-1原生质体转化,涂布于乙酰胺蔗糖CD高渗平板获得菌落,再转移至三丁酸甘油酯平板筛选转化子。挑取水解圈明显的转化子接至乙酰胺蔗糖CD液体培养基扩大培养,将乙酰胺CD液体培养基培养的菌液离心,弃去上清,菌体用生理盐水洗涤2次,然后接种到50 mL GAPY中,用500 mL摇瓶发酵,装液量10%,30 ℃,250 r/min。从第48 h开始取样,每24 h取样1次,检测相关发酵产酶指标。
1.4 分析方法 1.4.1 生物量测定发酵液经过适当稀释后,于595 nm波长下测定吸光度,该数值反应菌体生物量。在一定的范围内,随着生物量的积累,OD595线性增加。
1.4.2 酶活力测定采用吸光光度法测定展示脂肪酶活力[14]。发酵菌液用Tris-HCl缓冲液(pH 8.0)洗涤2次,再用等体积Tris-HCl缓冲液(pH 8.0)重悬,用于检测菌丝展示脂肪酶活性。菌液稀释至合适的倍数后,以对硝基苯酚丁酸酯(pNPB)作为底物,在pH 8.0、45 ℃条件下反应5 min,酶标仪测定吸光度(OD405)。空白使用Tris-HCl缓冲液(pH 8.0)替代样品,在相同条件下反应检测。展示脂肪酶活力测定体系:900 μL Tris-HCl缓冲液(pH 8.0),50 μL稀释合适倍数的菌液,50 μL pNPB底物,反应体系共计1 mL,反应后取200 μL检测吸光度(OD405)。展示脂肪酶活力单位(1 U)定义为:在pH 8.0、45 ℃条件下,每1 min水解pNPB生成1 μmol对硝基苯酚所需的酶量。
计算公式:酶活力(U/g)=(OD405−ODblank)×M×K×1 000/(W×OD595×T)。
其中OD405:待测样品在405 nm波长的吸光值;ODblank:空白对照品在405 nm波长的吸光值;M:样品的稀释倍数;K:水解生成对硝基苯酚的标准曲线系数,数值上等于标准曲线方程x=1时的y值(μmol/L),实验室测得该系数的值为0.12;T:反应时间,5 min;W:1 L发酵液1 OD595对应的菌体干重(g/L),本实验所用的系数值为0.33;OD595:待测样品的生物量。
1.4.3 表面展示脂肪酶黑曲霉细胞免疫荧光分析构建的质粒pCALB-D带有FLAG标签,所以可以通过激光扫描共聚焦显微镜检测经荧光染色的表面展示脂肪酶黑曲霉细胞[23]。菌体用冰冷的磷酸盐缓冲液洗(pH 7.4) 2次后,用含1% BSA的磷酸盐缓冲液(pH 7.4)重悬菌体,加入适量鼠抗FLAG单抗Mouse anti-FLAG,轻敲混匀,孵育2 h。再用含1% BSA的磷酸盐缓冲液(pH 7.4)洗涤并重悬菌体,加入适量Alexa Fluor488标记羊抗鼠IgG抗体,轻敲混匀,避光孵育1 h。然后用含1% BSA的磷酸盐缓冲液(pH 7.4)洗涤并重悬菌体,用Carl Zeiss LSM710激光共聚焦显微镜对黑曲霉菌体进行荧光显微镜检测。
2 结果与分析 2.1 表面展示脂肪酶黑曲霉细胞免疫荧光分析表面展示CALB黑曲霉菌株AN-GpdA利用葡萄糖为碳源培养后洗涤菌体,用免疫荧光染色处理,宿主菌A. niger SH-1作为对照,在激光共聚焦显微镜下观察(图 2)。在488 nm光源的激发下,重组菌细胞表面呈现明显的特异性绿色荧光。因为FLAG标签被设计在CALB和细胞壁锚定蛋白之间,这一结果可以从蛋白质水平表明外源蛋白CALB已经成功地展示在细胞表面。
|
| 图 2 A. niger菌丝激光扫描共聚焦显微镜免疫荧光分析 Figure 2 Immunofluorescence microscopy assay of labeled A. niger mycelium by laser scanning confocal microscope. (A, B) Fluorescence and differential interference contrast micrographs of control host strain A. niger SH-1 respectively. (C, D) Fluorescence and differential interference contrast micrographs of recombinant AN-GpdA respectively. |
| |
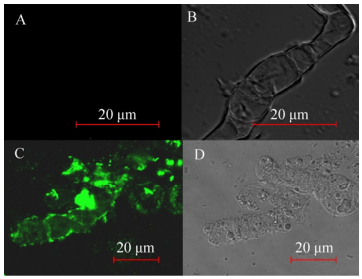
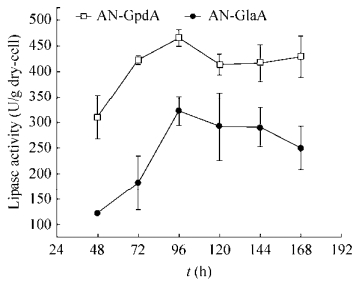
分别研究了黑曲霉AN-GlaA菌株(诱导型表达)和AN-GpdA菌株(组成型表达)在APY发酵培养基培养168 h的展示酶产酶情况,其发酵展示酶活力曲线如图 3所示。在96 h前随着培养时间的增加,两株菌展示的CALB活力均在升高,其中在96 h AN-GpdA的展示CALB酶活力达466.40 U/g,比同时期的AN-GlaA展示CALB酶活力(322.35 U/g)提高了约45%,且AN-GpdA继续培养发酵到168 h展示CALB酶活力较为稳定,而AN-GlaA展示酶活力在168 h下降22%。说明AN-GpdA展示CALB产酶效果较AN-GlaA更具优势,在发酵后期(96–168 h) AN-GlaA展示的酶活力明显下降,推测其与碳源限制和菌丝形态相关。本研究使用的宿主菌A. niger SH-1为无孢黑曲霉,在液体发酵中呈现出菌丝较短、多分支的现象。在葡萄糖限制(0.3–0.6 mmol/L)发酵后期(168 h) AN-GlaA菌株出现了菌丝断裂并裂解(图 4A和4B)致使展示酶活力下降。AN-GpdA菌株在发酵过程中含有充足的葡萄糖,缓解AN-GlaA在发酵过程中碳源匮乏的问题,维持菌丝较为良好的形态(图 4C和4D)大部分菌丝体健壮,轮廓清晰。
|
| 图 3 AN-GlaA和AN-GpdA利用葡萄糖为碳源发酵展示CALB酶活力 Figure 3 Displaying CALB activity on the cell surface of AN-GlaA and AN-GpdA both using glucose as carbon source. |
| |

|
| 图 4 AN-GlaA和AN-GpdA利用葡萄糖为碳源发酵168 h的细胞形态 Figure 4 The mycelial morphology of AN-GlaA and AN-GpdA fermentation using glucose as carbon source at 168 h. (A, B) AN-GlaA magnified 400 and 1 000 times, respectively. (C, D) AN-GpdaA magnified 400 and 1 000 times, respectively. |
| |
AN-GlaA菌株可利用木糖生长,但不能诱导生产展示CALB酶,只有当洗去木糖后,转入APY培养基并添加适量葡萄糖才恢复诱导产酶(数据未显示);而AN-GpdA菌株不仅可以利用葡萄糖产酶,也可以在木糖为唯一碳源时进行产酶。AN-GpdA菌株利用木糖为碳源发酵展示CALB酶活力生产曲线如图 5所示,发酵到144 h时展示CALB活力最高,达到1 100.28 U/g,其展示酶活力明显高于其利用葡萄糖为碳源发酵产酶。推测可能原因是无孢黑曲霉在利用木糖和葡萄糖代谢存在差异,利用前者为碳源时,糖转化率、胞内还原力(NADH/NAD+)和ATP含量均比后者高,且有机酸积累量少,有利于产物积累[24];同时木糖作为唯一碳源对细胞壁的结构产生明显影响,从而改变菌丝的形态、长度、区室多少和结团等,如图 6所示,相比于利用葡萄糖为碳源的细胞培养(图 6A、6B),利用木糖为碳源(图 6C、6D)培养发酵,形成的菌丝体更纤细、更长,区室也更多,且部分区室膨大、更粗壮,这对展示CALB活力影响至关重要。对于黑曲霉来说,其生长形态与蛋白产量受到能量输入的较大影响,随着能量输入的增大,菌体形态由球状向丝状转变,继而带来了较高的蛋白产量[25-26]。

|
| 图 5 AN-GpdA利用木糖为碳源展示CALB酶活力 Figure 5 Displaying CALB activity on the cell surface of AN-GpdA using xylose as carbon source. |
| |
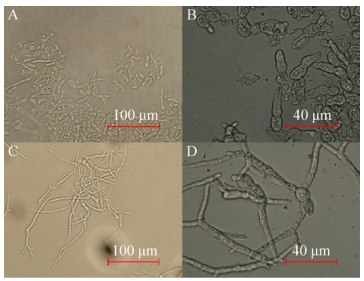
|
| 图 6 AN-GpdA发酵144 h的菌丝形态 Figure 6 The mycelial morphology of AN-GpdA fermentation at 144 h. (A, B) AN-GdpA using glucose as carbon source magnified 400 and 1 000 times, respectively. (C, D) AN-GdpA using glucose as carbon source magnified 400 and 1 000 times, respectively. |
| |
葡萄糖和木糖作为木质纤维素中主要的单糖成分,本研究利用木质纤维素甘蔗渣的水解液作为碳源,添加相应营养成分用于研究AN-GpdA菌株的发酵产酶,其发酵展示CALB酶活力曲线如图 7所示,168 h时展示CALB活力达到600.42 U/g。相比利用葡萄糖或木糖等单一碳源,利用甘蔗渣水解液达到最高展示酶活力的时间较晚,可能是纤维素水解物中存在着乙酸、羟甲基糠醛、糠醛、甲酸等有害物质,影响了细胞的生长与产酶,因此延长了菌体产酶时间[27]。

|
| 图 7 AN-GpdA利用甘蔗渣水解液为碳源展示CALB酶活力 Figure 7 Displaying CALB activity on the cell surface of AN-GpdA using bagasse hydrolysate as carbon source. |
| |
本研究通过替换黑曲霉表面展示CALB菌株(AN-GlaA)的诱导型启动子pGlaA为组成型启动子pGpdA,所构建黑曲霉表面展示CALB菌株AN-GpdA,有效改善了其展示CALB的发酵性能,使其在发酵过程中生长的同时进行产酶,无需添加诱导剂,操作简便。利用葡萄糖为碳源发酵至96 h其展示脂肪酶活力达到466.40 U/g,与同时期的AN-GlaA相比提高了接近45%,而且酶活力更加稳定。AN-GpdA还可利用木糖产酶,因木糖具有较高的代谢效率以及菌体形态发生变化,达到较高的展示酶活力(1 100.28 U/g)。最后以水解制备的甘蔗渣水解液为碳源发酵,获得了良好的产酶性能。利用高效分泌蛋白的无孢黑曲霉作为宿主构建蛋白展示细胞具有表达量高及丝状真菌表面疏水性对脂肪酶酯化催化的促进作用,本研究采用组成型启动子,有利于改善无孢黑曲霉的生长稳定和酶的展示表达效率,拓展了黑曲霉木糖及木质纤维素水解物等碳源的利用,在华南地区利用废弃甘蔗渣水解物为发酵原料,符合地方绿色工业发展需求。
| [1] | Divakar S, Manohar B. Use of lipases in the industrial production of esters//Polaina J, MacCabe AP, eds. Industrial Enzymes. Dordrecht: Springer, 2007: 283–300. |
| [2] | Hasan F, Shah AA, Hameed A. Industrial applications of microbial lipases. Enzyme Microb Technol, 2006, 39(2): 235–251. DOI: 10.1016/j.enzmictec.2005.10.016 |
| [3] | Anthonsen T, Hoff BH. Resolution of derivatives of 1, 2-propanediol with lipase B from Candida antarctica: effect of substrate structure, medium, water activity and acyl donor on enantiomeric ratio. Chem Phys Lipids, 1998, 93(1/2): 199–207. |
| [4] | Anderson EM, Larsson KM, Kirk O. One biocatalyst-many applications: the use of Candida antarctica B-lipase in organic synthesis. Biocatal Biotransform, 1998, 16(3): 181–204. DOI: 10.3109/10242429809003198 |
| [5] | Jin Z, Ntwali J, Han SY, et al. Production of flavor esters catalyzed by CALB-displaying Pichia pastoris whole-cells in a batch reactor. J biotechnol, 2012, 159(1/2): 108–114. |
| [6] | Park CG, Kwon MA, Song JK, et al. Cell-free synthesis and multifold screening of Candida antarctica lipase B (CalB) variants after combinatorial mutagenesis of hot spots. Biotechnol Progr, 2011, 27(1): 47–53. DOI: 10.1002/btpr.v27.1 |
| [7] | Kwon MJ, Jørgensen TR, Nitsche BM, et al. The transcriptomic fingerprint of glucoamylase over-expression in Aspergillus niger. BMC Genomics, 2012, 13: 701. DOI: 10.1186/1471-2164-13-701 |
| [8] | Punt PJ, van Biezen N, Conesa A, et al. Filamentous fungi as cell factories for heterologous protein production. Trends Biotechnol, 2002, 20(5): 200–206. DOI: 10.1016/S0167-7799(02)01933-9 |
| [9] | Schuster E, Dunn-Coleman N, Frisvad JC, et al. On the safety of Aspergillus niger-a review. Appl Microbiol Biotechnol, 2002, 59(4/5): 426–435. |
| [10] | Fleiβner A, Dersch P. Expression and export: recombinant protein production systems for Aspergillus. Appl Microbiol Biotechnol, 2010, 87(4): 1255–1270. DOI: 10.1007/s00253-010-2672-6 |
| [11] | Liu Y, Zhang R, Lian ZS, et al. Yeast cell surface display for lipase whole cell catalyst and its applications. J Mol Catal B Enzym, 2014, 106: 17–25. DOI: 10.1016/j.molcatb.2014.04.011 |
| [12] | Adachi T, Ito J, Kawata K, et al. Construction of an Aspergillus oryzae cell-surface display system using a putative GPI-anchored protein. Appl Microbiol Biotechnol, 2008, 81(4): 711–719. DOI: 10.1007/s00253-008-1687-8 |
| [13] | Tabuchi S, Ito J, Adachi T, et al. Display of both N- and C-terminal target fusion proteins on the Aspergillus oryzae cell surface using a chitin-binding module. Appl Microbiol Biotechnol, 2010, 87(5): 1783–1789. DOI: 10.1007/s00253-010-2664-6 |
| [14] | Pan ZY, Yang ZM, Pan L, et al. Displaying Candida antarctica lipase B on the cell surface of Aspergillus niger as a potential food-grade whole-cell catalyst. J Ind Microbiol Biotechnol, 2014, 41(4): 711–720. DOI: 10.1007/s10295-014-1410-y |
| [15] | Damveld RA, Arentshorst M, VanKuyk PA, et al. Characterisation of CwpA, a putative glycosylphosphatidylinositol-anchored cell wall mannoprotein in the filamentous fungus Aspergillus niger. Fungal Genet Biol, 2005, 42(10): 873–885. DOI: 10.1016/j.fgb.2005.06.006 |
| [16] | Hata Y, Kitamoto K, Gomi K, et al. Functional elements of the promoter region of the Aspergillus oryzae glaA gene encoding glucoamylase. Curr Genet, 1992, 22(2): 85–91. DOI: 10.1007/BF00351466 |
| [17] | Ganzlin M, Rinas U. In-depth analysis of the Aspergillus niger glucoamylase (glaA) promoter performance using high-throughput screening and controlled bioreactor cultivation techniques. J Biotechnol, 2008, 135(3): 266–271. DOI: 10.1016/j.jbiotec.2008.04.005 |
| [18] | Zhu XG, Wang HM, Qiu RX, et al. The synergetic effects of two CCAAT boxes in Aspergillus niger glaA gene promoter on activation of PglaA transcription. Sci China Ser C: Life Sci, 2004, 47(2): 139–147. DOI: 10.1360/03yc0097 |
| [19] | Punt PJ, Dingemanse MA, Kuyvenhoven A, et al. Functional elements in the promoter region of the Aspergillus nidulans gpdA gene encoding glyceraldehyde-3-phosphate dehydrogenase. Gene, 1990, 93(1): 101–109. DOI: 10.1016/0378-1119(90)90142-E |
| [20] | Gürkök S, Söyler B, Biely P, et al. Cloning and heterologous expression of the extracellular alpha-galactosidase from Aspergillus fumigatus in Aspergillus sojae under the control of gpdA promoter. J Mol Catal B Enzym, 2010, 64(3/4): 146–149. |
| [21] | Redkar RJ, Herzog RW, Singh NK. Transcriptional activation of the Aspergillus nidulans gpdA promoter by osmotic signals. Appl Environ Microbiol, 1998, 64(6): 2229–2231. |
| [22] | El-Enshasy H, Hellmuth K, Rinas U. GpdA-promoter-controlled production of glucose oxidase by recombinant Aspergillus niger using nonglucose carbon sources. Appl Biochem Biotechnol, 2001, 90(1): 57–66. DOI: 10.1385/ABAB:90:1 |
| [23] | Su GD, Huang DF, Han SY, et al. Display of Candida antarctica lipase B on Pichia pastoris and its application to flavor ester synthesis. Appl Microbiol Biotechnol, 2010, 86(5): 1493–1501. DOI: 10.1007/s00253-009-2382-0 |
| [24] |
Dou C, Xu Q, Song P, et al. Metabolism of Rhizopus oryzae with xylose or glucose as carbon resource.
Acta Microbiol Sin, 2011, 51(4): 468–473.
(in Chinese). 窦畅, 徐晴, 宋萍, 等. 米根霉利用木糖与葡萄糖的代谢差异. 微生物学报, 2011, 51(4): 468-473. |
| [25] | Ibrahim D, Weloosamy H, Lim SH. Effect of agitation speed on the morphology of Aspergillus niger HFD5A-1 hyphae and its pectinase production in submerged fermentation. World J Biol Chem, 2015, 6(3): 265–271. DOI: 10.4331/wjbc.v6.i3.265 |
| [26] | Colin VL, Baigorí MD, Pera LM. Tailoring fungal morphology of Aspergillus niger MYA 135 by altering the hyphal morphology and the conidia adhesion capacity: biotechnological applications. AMB Express, 2013, 3: 27. DOI: 10.1186/2191-0855-3-27 |
| [27] | Zhang HS, Zhang J, Bao J. High titer gluconic acid fermentation by Aspergillus niger from dry dilute acid pretreated corn stover without detoxification. Bioresour Technol, 2016, 203: 211–219. DOI: 10.1016/j.biortech.2015.12.042 |
 2018, Vol. 34
2018, Vol. 34