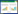中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王思乐, 王宁, 蔡元星, 王华岩
- Wang Sile, Wang Ning, Cai Yuanxing, Wang Huayan
- 人多能干细胞向红细胞的诱导分化
- Differentiation of human pluripotent stem cells into red blood cells
- 生物工程学报, 2018, 34(6): 983-992
- Chinese Journal of Biotechnology, 2018, 34(6): 983-992
- 10.13345/j.cjb.170483
-
文章历史
- Received: December 6, 2017
- Accepted: March 19, 2018
人诱导性多能干细胞(hiPS细胞)具有多向分化和自我更新的潜能,它是将外源多能转录因子Oct4、Sox2、Klf4、cMyc导入成体细胞,经过体细胞重编程获得的[1-2]。iPS细胞具有分化为内、中、外三个胚层细胞和各种组织、器官的能力,可以用于构建临床疾病的体外细胞模型,研究相关病理损伤细胞的发病机制和治疗方法[3-5]。基于hiPS细胞的扩繁增殖潜能和体外分化能力,可以利用hiPS经体外诱导分化为造血干细胞,然后再进一步向红细胞系方向特异诱导分化,最终获得成熟红细胞,为血液病的临床治疗提供了基本原理和技术手段。另外,人间充质干细胞(hMSC细胞)除了具有体外增殖和多向分化能力外,还具有免疫原性低的特点[6-7],因此,常被用于再生医学的研究,例如将hMSC作为实验材料,使其特异分化为软骨等组织中的细胞,来修复机体损伤的部分[8-10]。
红细胞的体内发育起始于胚胎时期的卵黄囊血岛组织,最初产生内皮细胞。随后在主动脉-性腺-中肾区(AGM)产生造血祖细胞,随着胎儿肝脏的形成,卵黄囊和AGM区的血细胞转移至胎儿肝脏,造血祖细胞(HSC细胞)在此产生和发育。胎儿出生后,只在骨髓产生的造血祖细胞和造血干细胞继续分化为成熟的红细胞、白细胞等多种细胞系[11]。体外诱导红细胞也是利用hiPS模拟体内发育阶段将其先诱导为造血祖细胞,再使其分化为红细胞[12-14];或直接利用HSC细胞诱导分化为成熟红细胞[15-16]。目前,体外诱导产生红细胞的方法主要有类胚体(EB)法和共培养法两种方式。采用类胚体诱导分化的技术方法,是利用人胚胎干细胞(hES细胞)或hiPS,通过悬浮培养形成EB,然后EB再在特异诱导因子或与基质细胞(如鼠源BM细胞S17和OP9,内皮细胞C166等)共培养的条件下[17-19],使其分化为成熟红细胞。但是,这种EB法的诱导体系通常涉及3–4个诱导阶段,操作步骤过于繁琐,且所需成本较高。而产生的红细胞不能确保完全脱核,带核的红细胞可能存在基因突变等危险,并且诱导体系中含有胎牛血清、基质细胞等动物源性物质的干扰,所以还不能用于临床输血[17-26]。共培养方法首先利用hES或hiPS与基质细胞贴壁培养,形成造血细胞和内皮细胞的前体细胞(即hemangioblasts),然后将诱导获得的hemangioblasts向红细胞方向诱导,最后将获得的红细胞收集,与基质细胞共培养从而提升红细胞的脱核率[17, 26]。由于这些体外红细胞的诱导技术在不同程度上使用了胎牛血清FBS和饲养层共培养细胞等动物源性物质,因此,临床应用价值有限。另外,最终获得的红细胞只有极少部分能够成为完全成熟的红细胞,产量低。与上述方法不同,本研究采用两步诱导法,先利用多能干细胞诱导得到CD31和CD34阳性表达的细胞群,再将获得的CD31+和CD34+的细胞群通过半悬浮培养的方式诱导分化为成熟红细胞。
本研究中特别选用了hUCMSCRh-A细胞进行两步法诱导,其目的在于最终诱导获得的红细胞将不携带Rh抗原,为体外大量制造Rh阴性的“万能血”提供技术探索。本研究采用独特的红细胞两步诱导法,与之前报道的方法相比,操作更为简便,成本较低,不涉及胎牛血清和饲养层细胞等动物源物质的干扰,可以大量制备成熟红细胞,且产出效率较以往的体系有明显提升。这一新的技术方法有助于推进人红细胞的体外诱导研究和体外大量制备及其临床应用。
1 材料与方法 1.1 材料人iPS细胞(hiPSCs)购自斯丹赛有限公司,Rh阴性A型人脐带间充质干细胞(hUCMSCRh-A)由西安市九州医药科技园有限公司提供,人全血细胞由西北农林科技大学校医院提供。
1.2 试剂和耗材总RNA提取试剂盒购自天根生化科技公司;DNA marker来自BioLabs公司(美国);反转录试剂盒、细胞消化液(Cell Dissociation Buffer, CDB,13151014)、AlbuMAX®Ⅰ富脂牛血清白蛋白(BSA,1116392)、胰酶(Trypsin,1809364)、非必需氨基酸(Nonessential amino acid,NEAA,1703183)和L-谷氨酸(GlutaMAX,L-Gln,1848033)均购自Gibco公司(美国);DMEM (Dulbecco’s modified eagle medium,AB10101516)、α-MEM (Alpha Minimum essential medium,AB212879)、胎牛血清(Fetal bovine serum,FBS,1P1506)购自Hyclone公司;人bFGF (Fibroblast growth factor,FGF,100-18B)、BMP4 (Bone morphogenetic protein 4,120-05)、VEGF (Vascular endothelial growth factor,100-20)、Flt3 ligand (Fms-related tyrosine kinase 3 ligand,300-19)、EPO (Erythropoietin,100-64)购自PeproTech公司;SCF (Recombinant human stem cell factor,255-SC-010/CF)购自R & D system公司;Y27632 (ROCK抑制剂,562822)、Matrigel胶(354234)、CD31 (5090933)、CD34 (28476)、CD44 (37383)、CD45 (28444)、CD71 (05021207)流式抗体均购自BD公司(美国);mTeSRTM1培养基(85850)和造血干细胞培养基(09600)购自Stemcell公司(加拿大);Stemline Ⅱ造血培养基(S0192)、β-巯基乙醇(2-Mercaptoethanol,β-ME,SHBD0359V)、甲基纤维素(Methyl cellulose,MC,V900506)购自Sigma (美国);IMDM (Iscove’s Modified Dulbecco’s Medium,1732829)等购自Invitrogen (美国);PCR Mix购自西安Tsingke公司;PCR引物由西安Tsingke公司合成(表 1)。
| Name | Sequence (5'–3') | Size (bp) |
| CD29 | F: CTGCAAGAACGGGGTGAATG | 302 |
| R: CACAATGTCTACCAACACGCCC | ||
| CD31 | F: GTGCTGCAATGTGCTGTGAA | 370 |
| R: GTACTGCTGGCCTGGACATT | ||
| CD34 | F: CCCAGCCAACGTTTCAACTC | 619 |
| R: ATAAGGGTCTTCGCCCAGC | ||
| CD45 | F: TGACTACAGCAAAGATGCCCAG | 224 |
| R: AAGGTGAGGCGTCTGTACTG | ||
| CD90 | F: ATGAACCTGGCCATCAGCATCGC | 486 |
| R: TCACAGGGACATGAAATCCGTGG | ||
| CD117 | F: TCTGACGTCAATGCTGCCAT | 609 |
| R: AACCTTCCCGAAAGCTCCAG | ||
| qε-globin | F: TGGCAAGGAGTTCACCCCT | 63 |
| R: AATGGCGACAGCAGACACC | ||
| qγ-globin | F: GGCAACCTGTCCTCTGCCTC | 219 |
| R: GAAATGGATTGCCAAAACGG | ||
| qβ-globin | F: CTCATGGCAAGAAAGTGCTCG | 181 |
| R: AATTCTTTGCCAAAGTGATGGG |
诱导实验中涉及如下培养液:BVF培养液(Stemline Ⅱ造血培养基,50 ng/mL BMP4,50 ng/mL VEGF,50 ng/mL bFGF)、BGM培养液(造血干细胞培养基,50 μg/mL VEGF,25 μg/mL Flt3 ligand,8 μg/mL bFGF)、BGME培养液(BGM培养液,3 units/mL EPO)、SSE培养液(Stemline Ⅱ造血培养基,50 ng/mL SCF,3 unit/mL EPO)、SSEMC培养液(SSE培养液,0.5% MC)、SSE34培养液(StemPro-34 SCF培养基,50 ng/mL SCF,3 unit/mL EPO)、SE34培养液(StemPro-34 SCF培养基,3 unit/mL EPO)。
1.3 细胞培养将冻存的hUCMSCRh-A细胞培养在α-MEM中,并添加15% FBS、1% NEAA、1% GlutaMAX和0.1 mmol/L β-ME。待细胞密度长至80%左右,用0.05%胰酶消化传代,将扩增的细胞采用细胞冻存技术冷冻保存。hiPSC细胞采用mTeSRTM1培养基培养,培养皿用Matrigel胶预先处理好,培养6–7 d用细胞消化液消化传代。hUCMSCRh-A和hiPSC细胞均培养在37 ℃、5% CO2的恒温箱中。
1.4 总RNA提取、PCR和荧光定量RT-PCR当细胞密度达到90%左右,将细胞消化离心,并向收集的沉淀中加入RZ细胞裂解液。随后按照总RNA提取试剂盒提取RNA,并检测OD值。然后按照反转录试剂盒说明书,将RNA反转录获得cDNA。用CD29、CD31、CD34、CD45、CD90等特异引物(表 1),按照PCR Mix说明书进行PCR,程序为:96 ℃ 2 min;96 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。PCR产物通过琼脂糖凝胶电泳检测目的条带大小。荧光定量RT-PCR根据设计的qβ-globin、qγ-globin、qε-globin引物,按照荧光定量试剂盒说明书进行RT-PCR扩增程序,并用2–ΔΔCt法计算表达变化倍数。
1.5 hUCMSCRh-A和hiPSC细胞的诱导分化将干细胞诱导分化为BRC细胞主要经过两个阶段的诱导分化过程(图 1)。第一阶段的诱导实验采用BVF培养液,将人多能干细胞诱导分化为CD31+和CD34+的阳性细胞群。采用hUCMSCRh-A细胞进行诱导时,选取培养至第5代的细胞并调整其密度为8×104–10×104个/mL,将其接入直径35 mm的细胞培养皿。然后第2天换BVF培养液,记为诱导第0天。诱导期间2 d换液1次,当细胞长到80%左右,用Accutase消化传代。此阶段持续诱导至第10天。采用hiPSC细胞进行诱导时,调整细胞密度为3×104–4×104个/mL。接入预先铺好四型胶原直径为100 mm的细胞培养皿中,并添加终浓度为10 μmol/L的Y27632。第2天换BVF培养液,记为诱导第0天。2 d换液1次,并持续诱导至第6天。通过上述方法,诱导hUCMSCRh-A和hiPSC细胞分化,可获得CD31+和CD34+的细胞群。
|
| 图 1 诱导分化流程图 Figure 1 Scheme of two stages of cell differentiation. |
| |
第二阶段的诱导过程为将含有CD31+和CD34+阳性细胞的细胞群通过半悬浮培养,诱导分化为成熟红细胞。首先,将第一步诱导获得的CD31+和CD34+的细胞群用Accutase消化后收集,细胞计数后用Stemline Ⅱ培养基重悬,每1×105–1.5×105个细胞(< 0.1 mL)与2.5–3 mL BGM培养液混匀。使用16号针头的注射器将细胞混合物加入到低吸附的6孔板培养皿中,培养在37 ℃、5% CO2的恒温箱中,记为第二阶段诱导的第0天。诱导至第6天,添加2 mL BGME培养液。并持续诱导至第9天,添加与培养皿中液体等体积的BGME培养液。当诱导至第14天,将培养皿内液体转移至直径100 mm的低吸附培养皿中,加入与现有培养基液体积等量的SSE培养液。随后诱导至第17天,加入现有体积一半的SSEMC培养液,每2–3 d加液1次,再继续孵育7 d。接下来,使用含0.5% BSA的IMDM培养液,在诱导第24天用IMDM培养液稀释培养皿中的液体。用5倍于培养皿液体的IMDM培养液,在2 000 r/min、15 min的条件下离心并收集细胞。随后用IMDM培养液重悬细胞,接入组织培养瓶中过夜培养。然后在诱导的第25天离心并收集组织培养瓶中的细胞,使用SSE34培养液重悬细胞,2 d换液1次并持续诱导至第31天。最后换为SE34培养液,持续诱导至第36天,可获得成熟红细胞。将获得的成熟红细胞转移至细胞离心管,自然沉降后有肉眼可见的细胞红色沉淀。
1.7 流式细胞仪检测当培养皿中的细胞长至90%-100%,使用Accutase消化细胞,并进行细胞计数。用FACS缓冲液(3% FBS,97% PBS)重悬细胞沉淀,并清洗2次。随后调整细胞密度为2×105–3×105个/管,并向每管加入20 μL抗体和80 μL FACS缓冲液,遮光置于冰上染色30 min。之后每管加入1 mL FACS缓冲液,离心洗去抗体。最后用500 μL FACS缓冲液重悬,准备上机检测。
1.8 吉姆萨染色用移液管吸取10–20 μL待检溶液滴在载玻片上,均匀涂布。室温下阴干后,用固定液固定涂片10 min。随后将涂片置姬姆萨工作液中,染色30 min。染色完成后,涂片立即用蒸馏水洗脱。最后用甘油压片,指甲油封固,置于显微镜下观察。
1.9 统计学分析吉姆萨染色后的诱导红细胞和人红细胞,分别统计其红细胞和脱核红细胞的总数,并经过t-test检验差异是否具有统计学意义。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 人UCMSCRh-A细胞的培养和鉴定hUCMSCRh-A细胞体外培养,细胞传代至第10代后,通过显微镜观察发现,细胞形态没有明显改变,呈现较短的梭状形态,大小为十几微米,体外培养期间并没有出现细胞衰老和分化的现象(图 2A)。待hUCMSCRh-A长满时收样做PCR检测。利用RCR检测hUCMSCRh-A相关标记基因的表达,通过琼脂糖凝胶电泳结果显示,hUCMSCRh-A细胞表达CD29、CD90和CD117基因,不表达造血相关的基因,如基因CD31、CD34和CD45 (图 2B)。随后,采用细胞流式仪检测hUCMSCRh-A蛋白水平的表达。收取hUCMSCRh-A细胞,制备成单细胞悬液用于细胞流式仪的检测。结果发现,CD44阳性的hUCMSCRh-A细胞占98%,CD71阳性的hUCMSCRh-A细胞占81.4%;而CD31、CD34和CD45阳性的hUCMSCRh-A细胞最高只有0.2% (图 2C)。上述结果表明hUCMSCRh-A细胞表达间充质干细胞的相关标记CD29、CD44、CD90等,不表达CD31、CD34等造血干细胞相关标记。

|
| 图 2 hUCMSCRh-A细胞的培养和鉴定 Figure 2 Culture and evaluation of hUCMSCRh-A. (A) Morphology of hUCMSCRh-A. (B) PCR analysis of cell surface markers in hUCMSCRh-A. (C) Flow cytometry analysis of cell surface markers in hUCMSCRh-A. |
| |
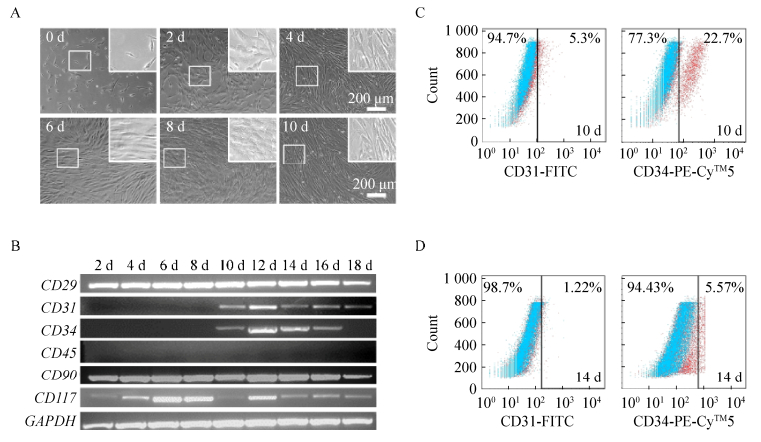
采用体外培养至第5代的hUCMSCRh-A细胞,进行第一阶段的诱导分化实验。细胞在分化过程中,第2天诱导的形态无明显差异;第4天时,细胞已基本长满,需要进行细胞传代。到第6天时,可发现部分细胞变为伸长的梭形;继续诱导至第8天时,细胞长满。传代后长至第10天,可以清楚地观察到细胞的大小较第0天有明显的改变,细胞全部变为较长的梭形(图 3A)。在诱导过程中,每2 d取样1次,持续至第18天。通过RT-PCR检测,可以看出hUCMSCRh-A细胞分化后,细胞在第8天开始有CD31和CD34基因的表达,且表达量在第10天达到最大值,而之后这些基因的表达水平逐渐降低。并且,hUCMSCRh-A细胞持续表达CD29、CD90、CD117,不表达CD45 (图 3B)。因此,我们采用诱导至第10天和第14天的细胞,流式细胞仪检测CD31和CD34的表达水平。结果发现,诱导第10天时,带CD31标记的细胞比率为5.3%,CD34标记的细胞比率为22.7% (图 3C)。而第14天时,带CD31标记的细胞比率下降至1.22%,CD34标记的细胞比率降至5.57% (图 3D)。上述结果显示,经过第一阶段的诱导,hUCMSCRh-A细胞能够分化成为CD31+和CD34+的细胞群,并表达造血干细胞相关的标记。
|
| 图 3 hUCMSCRh-A细胞诱导分化为CD31+和CD34+的细胞群 Figure 3 Differentiation of hUCMSCRh-A into CD31+ and CD34+ cells. (A) Morphology of induced hUCMSCRh-A cells in different time points. (B) RT-PCR analysis of cell surface markers from induced hUCMSCRh-A cells. (C, D) Flow cytometry analysis of CD31+ and CD34+ cells derived from hUCMSCRh-A cells. |
| |
人iPS细胞进行第一阶段的诱导分化实验,在诱导过程中,细胞的形态变化非常明显。从诱导的第0–2天,细胞克隆逐渐长大,且克隆数目明显增多。至第4天时细胞克隆已长成片状,细胞边缘开始分化为多边形的上皮样。第6天时克隆已扁平,细胞大部分都成为上皮样形态,且更为致密(图 4A)。将诱导至第6天的细胞收样,制备单细胞悬液并用流式细胞仪检测。结果显示,带有CD31标记的细胞比率为31.2%,带有CD34标记的细胞比率为8.2% (图 4B)。通过体外贴壁诱导阶段,人iPS细胞可分化为CD31+和CD34+的细胞群。

|
| 图 4 hiPS细胞诱导分化为CD31+和CD34+的细胞群 Figure 4 Differentiation of hiPS into CD31+ and CD34+ cells. (A) Morphology of induced hiPS in different time points. (B) Flow cytometry analysis of CD31+ and CD34+ cells. |
| |
将第一阶段贴壁诱导获得的CD31+和CD34+的阳性细胞群消化离心,再经过36 d的半悬浮诱导培养,使其分化为成熟红细胞。首先,将获得的成熟红细胞取样,利用吉姆萨染色的方法,通过显微镜观察,可以发现细胞呈现红色,且有完全粉红色无细胞核的红细胞。而诱导分化所获得的红细胞,通过计数统计,直径在7–8 μm之间的脱核红细胞比例可达87.09% (P < 0.05),说明其形态与正常人红细胞相比差异较小,大小也与正常人红细胞相近(图 5A)。为了检测红细胞中成熟β-globin的表达水平,我们采用荧光定量RT-PCR进行检测。结果显示,诱导的红细胞中3种球蛋白(成熟期的β-globin、胎儿期的γ-globin和胚胎期的ε-globin)的表达比例分别是20%、74%和6% (图 5B),其中β-globin的表达量占整体globin的20%,说明诱导的成熟红细胞具备携氧能力。最后,将诱导的红细胞收集到细胞离心管中,自然静置沉降2 h后,肉眼可看见红细胞沉淀,且与人全血静置后的沉淀颜色相似。细胞计数得到4.2×107 hiPSC/mL,与起始时3×104–4×104 hiPSC/mL的细胞数相比,诱导产生的红细胞数量是起始iPS细胞量的1 050–1 400倍,同时也是第一阶段CD31+和CD34+细胞群(1×105–1.5×105个)的280–420倍(图 5C,5D)。

|
| 图 5 CD31+和CD34+的细胞群分化为红细胞 Figure 5 Differentiation of CD31+ and CD34+ cells into RBC. (A) Giemsa staining of induced RBC. NC: negative control. (B) qRT-PCR analysis of globin expression in induced RBCs. (C) Static settlement of induced RBCs. (D) Static settlement of human whole blood. |
| |
目前,急性白血病、慢性白血病、骨髓增生异常综合症等各种血液疾病的治疗方法主要依赖于临床输血,而当务之急是体外大量制备成熟的红细胞[20-21]。人iPS因其强大的分化和增殖能力,我们选取其作为研究模型,可按照我们优化的诱导体系将其向红细胞分化。而这种方法的实现,提供了脐带间充质干细胞向红细胞分化的一种手段,我们采用Rh阴性的脐带间充质干细胞为研究对象,其诱导出的细胞是不含Rh抗体的,为实现Rh阴性的O型“万能血”提供了可能。以往体外红细胞诱导通过EB或共培养的体系,但是这两种方法的操作复杂,诱导效率低,且由于体系中含有动物源性物质,所以制备的红细胞无法用于临床的输血应急。本文的两步法诱导红细胞(图 1),将人iPS细胞和人UCMSCRh-A细胞,在无动物源性物质干扰的条件下,省去了第一阶段的EB悬浮和与基质细胞共培养步骤,经过贴壁诱导,使其分化为CD31+和CD34+的细胞群;然后利用收集的CD31+和CD34+的细胞群,经第二步半悬浮体系的诱导,在不与基质细胞共培养的条件下使其最终分化为成熟的红细胞。这种方法相比以往的红细胞诱导体系,省去了多阶段培养的繁琐步骤,还降低了实验成本。其中采用的无血清、无饲养层细胞等无动物源性物质的培养体系,排除了其他物质的干扰,产生的成熟红细胞可用于临床输血研究。在第一阶段的诱导过程中,与人iPS细胞相比,人UCMSCRh-A细胞的诱导时间更长。人iPS细胞的第一阶段诱导需要6 d的持续诱导,而人UCMSCRh-A细胞则需要至少10 d的持续诱导,才能获得较理想的CD31+和CD34+的细胞群。除此之外,由人iPS细胞分化的细胞,更倾向于表达CD31;相反,人UCMSCRh-A分化的细胞更倾向于表达CD34。并且,两种细胞在BVF培养液中的增殖速度都较分化前更快。然而,CD31+和CD34+的细胞群的诱导效率还有待提高,可通过磁珠分选的方法富集CD31+和CD34+的细胞群,从而为后续诱导提供更多的种子细胞。在第二阶段血红蛋白的检测中,由于血红蛋白是由4条球蛋白链组成的四级结构,每一条链中均有一个疏水结构,可结合一个血红素并携带一分子氧。在胚胎期血红蛋白主要由两条α链和两条γ链组成(α2γ2),在胎儿期主要由α2ε2组成,在成熟期主要由α2β2组成[14, 27]。我们分别检测了胚胎期的ε-globin、胎儿期的γ-globin和成熟期的β-globin来验证诱导的红细胞是否进入了成熟阶段。人iPS细胞来源广泛,增殖能力强,是体外诱导成熟红细胞重要的细胞来源;而人UCMSCRh-A细胞,由于其不携带Rh抗原,所以诱导获得的成熟红细胞也是Rh阴性。若将本实验的诱导体系应用到人UCMSCRh-O细胞,则可大量诱导出不含Rh-O抗体的红细胞,实现体外制备“万能血”的技术方法,这对于临床输血的研究有着重大的意义。
本研究在无动物源性物质干扰的前提下,以独特的两步法,成功将人iPS细胞和人UCMSCRh-A细胞特异诱导为成熟红细胞。本方法的诱导效率相比EB法和共培养法的效率有所提高[12, 16-22, 24-26],由人iPS细胞诱导的红细胞中成熟红细胞标志性的β-globin表达由之前的16%提升至20%[16, 26],但由人MSC细胞诱导获得的红细胞效率并不高,说明本方法的第二阶段并不适用于人MSC细胞。通过吉姆萨染色法可以观察到,诱导的成熟红细胞形态及大小与正常人红细胞相似,并有红细胞去核的现象。但诱导的成熟红细胞,相比人全血的红细胞数量较少,并且诱导红细胞的脱核效率可通过与人间充质细胞等基质细胞共培养来提高[17, 25-26]。综上所述,我们的研究成果为优化人体外诱导红细胞提供了技术改进,为进一步研究临床输血的应用打下了基础。
| [1] | Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 2007, 131(5): 861–872. DOI: 10.1016/j.cell.2007.11.019 |
| [2] | Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 2006, 126(4): 663–676. DOI: 10.1016/j.cell.2006.07.024 |
| [3] | Li L, Chao JF, Shi YH. Modeling neurological diseases using iPSC-derived neural cells: iPSC modeling of neurological diseases. Cell Tissue Res, 2018, 371(1): 143–151. DOI: 10.1007/s00441-017-2713-x |
| [4] | Ghiroldi A, Piccoli M, Ciconte G, et al. Regenerating the human heart: direct reprogramming strategies and their current limitations. Basic Res Cardiol, 2017, 112(6): 68. DOI: 10.1007/s00395-017-0655-9 |
| [5] | Csaszar E, Kirouac DC, Yu M, et al. Rapid expansion of human hematopoietic stem cells by automated control of inhibitory feedback signaling. Cell Stem Cell, 2012, 10(2): 218–229. DOI: 10.1016/j.stem.2012.01.003 |
| [6] | Macias MI, Grande J, Moreno A, et al. Isolation and characterization of true mesenchymal stem cells derived from human term decidua capable of multilineage differentiation into all 3 embryonic layers. Am J Obstet Gynecol, 2010, 203(5): 495. |
| [7] | Li CD, Zhang WY, Jiang X. Human-placenta-derived mesenchymal stem cells inhibit proliferation and function of allogeneic immune cells. Cell Tissue Res, 2007, 330(3): 437–446. DOI: 10.1007/s00441-007-0504-5 |
| [8] | Wang YF, Yu DS, Liu ZM, et al. Exosomes from embryonic mesenchymal stem cells alleviate osteoarthritis through balancing synthesis and degradation of cartilage extracellular matrix. Stem Cell Res Ther, 2017, 8(1): 189. DOI: 10.1186/s13287-017-0632-0 |
| [9] | Wu HW, Lei FP, Liu GY, et al. Reconstruction of large-scale defects with a novel hybrid scaffold made from poly (L-lactic acid)/Nanohydroxyapatite/ Alendronate-loaded chitosan microsphere: in vitro and in vivo studies. Sci Rep, 2017, 7(1): 359. DOI: 10.1038/s41598-017-00506-z |
| [10] | Dai J, Yu DS, Wang YF, et al. Kdm6b regulates cartilage development and homeostasis through anabolic metabolism. Ann Rheum Dis, 2017, 76(7): 1295–1303. DOI: 10.1136/annrheumdis-2016-210407 |
| [11] | Costa G, Kouskoff V, Lacaud G. Origin of blood cells and HSC production in the embryo. Trends Immunol, 2012, 33(5): 215–223. DOI: 10.1016/j.it.2012.01.012 |
| [12] | Chang KH, Nelson AM, Cao H, et al. Definitive-like erythroid cells derived from human embryonic stem cells coexpress high levels of embryonic and fetal globins with little or no adult globin. Blood, 2006, 108(5): 1515–1523. DOI: 10.1182/blood-2005-11-011874 |
| [13] | Garba A, Acar DD, Roukaerts IDM, et al. Long-term culture and differentiation of porcine red bone marrow hematopoietic cells co-cultured with immortalized mesenchymal cells. Vet Immunol Immunopathol, 2017, 191(9): 44–50. |
| [14] | Sugimura R, Jha DK, Han A, et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature, 2017, 545(7655): 432–438. DOI: 10.1038/nature22370 |
| [15] | Alonso-Ferrero ME, van Til NP, Bartolovic K, et al. Enhancement of mouse hematopoietic stem/progenitor cell function via transient gene delivery using integration-deficient lentiviral vectors. Exp Hematol, 2018, 57(1): 21–29. |
| [16] | Lapillonne H, Kobari L, Mazurier C, et al. Red blood cell generation from human induced pluripotent stem cells: perspectives for transfusion medicine. Haematologica, 2010, 95(10): 1651–1659. DOI: 10.3324/haematol.2010.023556 |
| [17] | Kaufman DS, Hanson ET, Lewis RL, et al. Hematopoietic colony-forming cells derived from human embryonic stem cells. Proc Natl Acad Sci USA, 2001, 98(18): 10716–10721. |
| [18] | Ledran MH, Krassowska A, Armstrong L, et al. Efficient hematopoietic differentiation of human embryonic stem cells on stromal cells derived from hematopoietic niches. Cell Stem Cell, 2008, 3(1): 85–98. DOI: 10.1016/j.stem.2008.06.001 |
| [19] | Vodyanik MA, Bork JA, Thomson JA, et al. Human embryonic stem cell-derived CD34+ cells: efficient production in the coculture with OP9 stromal cells and analysis of lymphohematopoietic potential. Blood, 2005, 105(2): 617–626. DOI: 10.1182/blood-2004-04-1649 |
| [20] | Zonari E, Desantis G, Petrillo C, et al. Efficient ex vivo engineering and expansion of highly purified human hematopoietic stem and progenitor cell populations for gene therapy. Stem Cell Rep, 2017, 8(4): 977–990. DOI: 10.1016/j.stemcr.2017.02.010 |
| [21] | Kaufman DS. Toward clinical therapies using hematopoietic cells derived from human pluripotent stem cells. Blood, 2009, 114(17): 3513–3523. DOI: 10.1182/blood-2009-03-191304 |
| [22] | Umeda K, Heike T, Yoshimoto M, et al. Development of primitive and definitive hematopoiesis from nonhuman primate embryonic stem cells in vitro. Development, 2004, 131(8): 1869–1879. DOI: 10.1242/dev.01065 |
| [23] | Wang CY, Tang XM, Sun XM, et al. TGFβ inhibition enhances the generation of hematopoietic progenitors from human ES cell-derived hemogenic endothelial cells using a stepwise strategy. Cell Res, 2012, 22(1): 194–207. DOI: 10.1038/cr.2011.138 |
| [24] | Feng Q, Lu SJ, Klimanskaya I, et al. Hemangioblastic derivatives from human induced pluripotent stem cells exhibit limited expansion and early senescence. Stem Cells, 2010, 28(4): 704–712. DOI: 10.1002/stem.321 |
| [25] | Qiu CH, Olivier EN, Velho M, et al. Globin switches in yolk sac-like primitive and fetal-like definitive red blood cells produced from human embryonic stem cells. Blood, 2008, 111(4): 2400–2408. DOI: 10.1182/blood-2007-07-102087 |
| [26] | Lu SJ, Feng Q, Park JS, et al. Biologic properties and enucleation of red blood cells from human embryonic stem cells. Blood, 2008, 112(12): 4475–4484. DOI: 10.1182/blood-2008-05-157198 |
| [27] | Jorge SE, Bringas M, Petruk AA, et al. Understanding the molecular basis of the high oxygen affinity variant human hemoglobin Coimbra. Arch Biochem Biophys, 2018, 637(1): 73–78. |
 2018, Vol. 34
2018, Vol. 34